川党参的化学成分及其与磷酸二酯酶4D2的分子对接研究
2024-03-05刘新桥胡贝袁桥玉宋炜杨中正吴娅
刘新桥,胡贝,袁桥玉,宋炜,杨中正,吴娅
(1 中南民族大学 a. 药学院, b. 湖北省中药活性物质合作基地 武汉430074;2 武汉职业技术学院 生物工程学院,武汉 430074;3 三峡大学 a. 第三临床医学院,b. 国药葛洲坝中心医院药学部,湖北 宜昌 443002;4 武汉生物技术研究院 a. 技术平台部,b. 武汉生物样本库有限公司, 武汉 430075)
川党参(Codonopsis tangshenOliv.,C. tangshen)为常用中药党参的来源植物之一,是多年生草本植物,生长于海拔800~2300 m 处,主要分布于四川、湖北、贵州、陕西和湖南等地[1].具有补中益气、生津和胃之功效,用于治疗内热消渴、食少便溏、气短心悸等症.目前,国内相关文献报道已经从川党参中分离得到了炔烯类、三萜类、生物碱及含氮类、木脂素类及黄酮类等多种化合物.现代药理研究表明川党参具有较好的抗炎活性,可用于治疗胃溃疡、肠道炎症等疾病[2].
磷酸二酯酶(phosphodiesterase 4,PDE4)为细胞内介导炎症反应的环磷酸腺苷(cAMP)的降解酶,由4 种亚型(PDE4A~PDE4D)组成.PDE4 抑制剂选择性抑制PDE4后,可增加细胞内cAMP 的含量而激活蛋白激酶A(protein kinase A,PKA),从而加强PKA下游蛋白的磷酸化来抑制炎症反应的发生.但由于4 种亚型的催化结构域具有较高的序列同源性,因此大多数PDE4抑制剂常被设计为占据PDE4D的催化结构域,尤其是PDE4D2.PDE4抑制剂药物可用于治疗多种炎症性疾病,如特异性皮炎、牛皮癣、慢性阻塞性肺病、炎症性肠病等.目前已上市的PDE4抑制剂药物如罗氟司特(roflumilast)、阿普司特(apremilast)等虽疗效较好,但具有腹泻、恶心、头痛等副作用. 因此,从植物中寻找抗炎活性好且副作用小的PDE4抑制剂具有良好的研究前景[3-4].
为了进一步阐明川党参中具有抗炎活性的物质基础,本实验对川党参的乙酸乙酯和石油醚部分进行系统的化学成分研究,从中分离并鉴定了12个化合物(图1),并对主要特征化合物与炎症相关的靶点PDE4 进行分子对接研究,为后续研究提供理论参考依据.

图1 化合物1~12的结构式Fig.1 Structures of compounds 1-12
1 实验部分
1.1 仪器与材料
川党参采自湖北神农架,由中南民族大学药学院刘新桥教授鉴定为川党参(C. tangshen)的干燥根. 柱色谱硅胶(200~300目)和薄层色谱硅胶(青岛海洋化工);Sephadex LH-20(GE,美国);50 μm 反相硅胶(YMC,日本);分析纯二氯甲烷、乙酸乙酯、甲醇、石油醚、正丁醇(国药集团);色谱纯乙腈(赛默飞,美国);色谱纯甲醇(弗顿生化);核磁共振波谱仪(600 MHz 和500 MHz,Bruker,瑞士);高效液相色谱仪(Dionex UltiMate 3000,美国);C18半制备型色谱柱(250 mm×20 mm,YMC,日本);旋转蒸发仪(RE2000A型,上海亚荣).
PDB 数据库(http://www.rcsb.org/);PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/);SYBYL X 2.1.1(Tripos,美国);Discovery Studio 2017 R2 Client(Accelrys,美国);Pymol;Chemoffice 2014(PerkinElmer,美国).
1.2 提取和分离
干燥的川党参根(16 kg)粉碎后,用95%和60%乙醇进行渗漉提取,将合并的总提取液浓缩后得总浸膏6 kg,用水混悬分散均匀后,依次用石油醚、乙酸乙酯和水饱和的正丁醇溶液进行萃取,得到石油醚萃取物169 g,乙酸乙酯萃取物98 g,正丁醇萃取物691 g.
取石油醚和乙酸乙酯合并部位267g,通过硅胶柱色谱技术,采用石油醚-乙酸乙酯-甲醇(20∶1∶0,10∶1∶0,8∶1∶0,6∶1∶0,4∶1∶0,3∶1∶0,2∶1∶0,1∶1∶0,1∶2∶0,1∶3∶0,0∶1∶0,0∶95∶5,0∶9∶1,0∶8∶2)进行梯度洗脱,共得到11 个组分(Fr.1~Fr.11). Fr.7 经硅胶柱色谱分离,用二氯甲烷-甲醇(500∶1~9∶1)洗脱,得到6个组分(Fr.7.1~7.6). Fr.7.2经Sephadex LH-20分离,用氯仿-甲醇(1∶1)洗脱,得到5个组分(Fr.7.2.1~Fr.7.2.5).Fr.7.2.1 用ODS-HPLC 纯化(30%甲醇)得到化合物3(5.2 mg,tR=36.6 min). Fr.7.2.4 用ODS-HPLC 纯化(45%甲醇)得到化合物2(2.3 mg,tR=27.2 min);(37%乙腈)得到化合物1(24.8 mg,tR=7.5 min)和化合物4(6.3 mg,tR=10.1 min). Fr.7.4 经Sephadex LH-20 分离,用氯仿-甲醇(1∶1)洗脱,得到5 个组分(Fr.7.4.1~Fr.7.4.5). Fr.7.4.3 经反相硅胶柱分离,依次用30%、50%、70%以及90%甲醇洗脱得到4 个部分(Fr.7.4.3.1~Fr.7.4.3.4). Fr.7.4.3.2 用ODS-HPLC 纯化(48%甲醇)得到化合物7(6.7 mg,tR=33.7 min);(44%甲醇)得到化合物8(6.7 mg,tR=40.3 min);(35%甲醇)得到化合物5(2.5 mg,tR=59.9 min). Fr.7.4.5 用ODS-HPLC 纯化(30%甲醇)得到化合物6(17.6 mg,tR=25.2 min);Fr.6经硅胶柱柱色谱法分离,用二氯甲烷-甲醇(200∶1~95∶5)洗脱,得到6 个组分(Fr.6.1~6.6). Fr.6.3经Sephadex LH-20分离,用氯仿-甲醇(1∶1)洗脱,得到4个组分(Fr.6.3.1~Fr.6.3.4). Fr.6.3.3用ODS-HPLC 纯化(90%甲醇)得到化合物9(75.8 mg,tR=19.9 min)和化合物10(42.5 mg,tR=15.8 min). Fr.4经硅胶柱色谱分离,用二氯甲烷-乙酸乙酯(500∶1~6∶1)洗脱,得到7 个组分(Fr.4.1~4.7). Fr.4.4 经Sephadex LH-20 分离,用氯仿-甲醇(1∶1)洗脱,得到3 个组分(Fr.4.4.1~Fr.4.4.3). Fr.4.4.2 用ODS-HPLC纯化(48%甲醇)得到化合物11(2 mg,tR=14.8 min).Fr.4.3 经Sephadex LH-20 分离,用氯仿-甲醇(1∶1)洗脱,得到3 个组分(Fr.4.3.1~Fr.4.3.3). Fr.4.3.3 用ODS-HPLC 纯化(40%甲醇)得到化合物12(2.1 mg,tR=24.3 min).
1.3 分子对接
在PubChem 数据库中根据化合物名称下载3D结构,对于搜索不到的化合物则用ChemDraw 软件画出结构式,用Chem 3D 转换为3D 结构;在PDB 数据库中下载PDE4D2 的晶体结构(1XOQ);将靶蛋白和化合物导入到SYBYL X 2.1.1 中进行结构优化和处理后,在Surflex-dock模式下进行对接.
靶蛋白与配体之间的相互作用力用Total score值来表示,一般认为Total score 值越大,表明小分子配体与受体之间结合越好,相互作用力越强. 当Total score≥7时,表明小分子与配体结合较好[5].
2 实验结果
2.1 结构鉴定
化合物1:淡黄色胶状固体;1H NMR (500 MHz,CDCl3)δH:6.86 (2H, m, H-2′, 5′), 6.84 (1H, d,J=8.5 Hz, H-5), 6.80 (1H, dd,J=8.0, 2.1 Hz, H-6′),6.69 (2H, m, H-2, 6), 4.79 (1H, d,J=6.6 Hz, H-7′),4.05 (1H, dd,J=8.6, 6.6 Hz, H-9a), 3.91 (1H, dd,J=10.7, 3.6 Hz, H-9a′), 3.88 (3H, s, 3-OCH3), 3.87 (3H,s, 3′-OCH3), 3.77(1H, m, H-9b′), 3.75(1H, m,H-9b), 2.91 (1H, dd,J=13.6, 5.2 Hz, H-7a), 2.73(1H, m, H-8), 2.55 (1H, dd,J=13.6, 10.7 Hz, H-7b), 2.41 (1H, m, H-8′);13C NMR (125 MHz, CDCl3)δC: 146.6 (C-3), 146.5 (C-3′), 145.0 (C-4′), 144.0(C-4), 134.8 (C-1′), 132.3 (C-1), 121.2 (C-6), 118.7(C-6′), 114.4 (C-5), 114.2 (C-5′), 111.2 (C-2), 108.3(C-2′), 82.8 (C-7′), 72.9 (C-9), 60.9 (C-9′), 55.9(3′-OCH3), 55.9 (3-OCH3), 52.6 (C-8′), 42.4 (C-8), 33.3 (C-7). 以上波谱数据与文献[6]基本一致,因此鉴定化合物1为mangnostellin D.
化合物2:淡黄色胶状固体;1H NMR (500 MHz,CDCl3)δH: 6.95 (2H, m, H-5, 6), 6.93 (1H, d,J=2.6 Hz, H-2), 6.89 (1H, d,J=8.2 Hz, H-5′), 6.82(1H, d,J=2.0 Hz, H-2′), 6.73 (1H, dd,J=8.2, 2.0 Hz,H-6′), 4.92 (1H, d,J=8.3 Hz, H-7), 4.01 (1H, m, H-8), 3.92(3H, s, 3-OCH3), 3.77(1H, dd,J=12.4,2.8 Hz, H-9a), 3.68 (2H, t,J=6.4 Hz, H-9′), 3.54(1H, dd,J=12.4, 4.1 Hz, H-9b), 2.63 (2H, t,J=7.6 Hz, H-7′), 1.87 (2H, m, H-8′);13C NMR (125 MHz,CDCl3)δC: 146.9 (C-3), 146.3 (C-4), 143.6 (C-3′),141.3 (C-4′), 135.3 (C-1′), 128.1 (C-1), 121.5 (C-6′),120.8 (C-6), 117.0 (C-2′), 116.8 (C-5′), 114.6 (C-5),109.5 (C-2), 78.1 (C-8), 76.4 (C-7), 62.3 (C-9′), 61.8(C-9), 56.0 (3-OCH3), 34.2 (C-8′), 31.3 (C-7′). 以上波谱数据与文献[7]基本一致,因此鉴定化合物2为(7S,8S)-3-methoxy-3′,7-epoxy-8,4′-oxyneoligna-4,9,9′-triol.
化合物3:淡黄色胶状固体;1H NMR (500 MHz,CDCl3)δH: 6.84 (1H, d,J=8.0 Hz, H-5′), 6.65 (1H,dd,J=8.0, 2.0 Hz, H-6′), 6.59(1H, d,J=2.0 Hz,H-2′), 6.57 (1H, s, H-6), 6.28 (1H, s, H-3), 3.88(1H, m, H-9b), 3.85 (3H, s, 3′-OCH3), 3.82 (3H,s, 5-OCH3), 3.77 (1H, dd,J=11.1, 2.7 Hz, H-9a),3. 73 (1H, m, H-7′), 3.71 (1H, m, H-9b′), 3.51(1H, dd,J=11.2, 5.5 Hz, H-9a′), 2.82 (1H, dd,J=15.8, 11.6 Hz, H-7a), 2.72(1H, dd,J=15.9, 4.7 Hz,H-7b), 2.02 (1H, m, H-8), 1.85 (1H, m, H-8′);13C NMR (125 MHz, CDCl3)δC: 146.7 (C-5), 144.8 (C-3′), 144.2 (C-4), 143.5 (C-4′), 137.0 (C-1′), 132.8(C-2), 127.5 (C-1), 122.3 (C-6′), 115.5 (C-3), 114.2(C-5′), 111.4 (C-2′), 110.1 (C-6), 66.4 (C-9), 63.0(C-9′), 56.0(3′-OCH3), 55.9(5-OCH3), 48.0 (C-8′), 47.9 (C-7′), 40.1 (C-8), 33.3 (C-7). 以上波谱数据与文献[8]基本一致,因此鉴定化合物3 为isolariciresinol.
化合物4:淡黄色胶状固体;1H NMR (500 MHz,CDCl3)δH: 9.85 (1H, s, H-7′), 7.44 (1H, s, H-6′),7.41 (1H, d,J=1.5 Hz, H-2′), 6.90 (3H, s, H-2, 4,6), 5.70 (1H, d,J=7.1 Hz, H-7), 4.01 (2H, m, H-9),3.96 (3H, s, 3′-OCH3), 3.88 (3H, s, 3-OCH3), 3.72(1H, q,J=6.1 Hz, H-8);13C NMR (125 MHz, CDCl3)δC: 190.5 (C-7′), 154.1 (C-4′), 146.8 (C-3), 146.0 (C-5), 145.1 (C-3′), 131.9 (C-1), 131.4 (C-1′), 128.6 (C-5′), 120.9 (C-6′), 119.5 (C-2), 114.5 (C-4), 112.1(C-2′), 108.7 (C-6), 89.5 (C-7), 63.9 (C-9), 56.1(3′-OCH3), 56.0 (3-OCH3), 52.7(C-8). 以上波谱数据与文献[9]基本一致,因此鉴定化合物4 为curcasinlignan B.
化合物5:无色油状液体;1H NMR (500 MHz,CD3OD)δH: 6.39 (1H, dt,J=16.0, 4.7 Hz, H-13), 5.80(1H, m, H-4), 5.77 (1H, m, H-12), 5.55 (1H, ddt,J=15.4, 7.0, 1.5 Hz, H-5), 4.21 (1H, dd,J=6.7,0.9 Hz, H-7), 4.12 (2H, dd,J=4.7, 2.1Hz, H-14),3.97 (1H, td,J=6.8, 1.0 Hz, H-6), 3.56 (2H, t,J=6.5 Hz, H-1), 2.14(2H, q,J=7.6 Hz, H-3), 1.63(2H, m, H-2);13C NMR (125 MHz, CD3OD)δC:148.3 (C-13), 135.2 (C-4), 129.7 (C-5), 108.5 (C-12),82.3 (C-8), 77.4 (C-11), 76.6 (C-6), 74.3 (C-10),71.0 (C-9), 67.8(C-7), 62.7(C-14), 62.3(C-1),33.1 (C-2), 29.8 (C-3). 以上波谱数据与文献[10]基本一致,因此鉴定化合物5 为(4E,12Z)-threotetradeca-4,12-diene-8,10-diyne-1,6,7,14-tetraol.
化合物6:淡黄色胶状固体;1H NMR (500 MHz,CD3OD)δH: 7.01 (1H, d,J=1.9 Hz, H-2), 6.88 (1H,d,J=1.9 Hz, H-2′), 6.84 (1H, dd,J=8.1, 1.9 Hz, H-6′), 6.74 (3H, m, H-5, 5′, 6), 6.45 (1H, m, H-7′),6.18 (1H, m, H-8′), 4.21 (1H, m, H-8), 4.18 (1H,d,J=1.5 Hz, H-9b), 4.17 (1H, d,J=1.5 Hz, H-9a),3.85 (1H, dd,J=11.8, 6.5 Hz, H-9b′), 3.80 (3H, s,3-OCH3), 3.75 (1H, m, H-9a′);13C NMR (125 MHz,CD3OD)δC: 149.0 (C-4), 147.5 (C-3), 147.3 (C-3′),133.9 (C-4′), 133.8 (C-1), 131.7 (C-1′), 131.7 (C-7′),128.5 (C-8′), 120.9 (C-6), 119.6 (C-6′), 116.0 (C-5), 114.8 (C-5′), 114.8 (C-2′), 111.8 (C-2), 87.4(C-8), 74.1(C-7), 63.9(C-9), 62.1(C-9′), 56.5(3-OCH3). 以上波谱数据与文献[11]基本一致,因此鉴定化合物6 为(-)-(7R,8S,7′E)-3′,4-dihydroxy-3-methoxy-8,4′-oxyneoligna-7′-ene-7,9,9′-triol.
化合物7:无色油状液体;1H NMR (600 MHz,CD3OD)δH: 6.09 (1H, dq,J=15.8, 6.8 Hz, H-13),6.04 (1H, dd,J=15.9, 5.9 Hz, H-8), 5.81 (1H, m, H-4), 5.72 (1H, m, H-9), 5.61 (1H, dp,J=15.8, 1.9 Hz,H-12), 5.48(1H, m, H-5), 3.98 (1H, td,J=6.1,1.5 Hz, H-6), 3.89 (1H, m, H-7), 3.56 (2H, t,J=6.5 Hz, H-1), 2.13 (2H, m, H-3), 1.78 (3H, dd,J=6.8, 1.9 Hz, H-14), 1.62(2H, m, H-2);13C NMR(150 MHz, CD3OD)δC: 142.7 (C-8), 140.3 (C-13),134.5 (C-5), 130.6 (C-4), 112.4 (C-12), 112.1 (C-9),89.7 (C-10), 86.9 (C-11), 76.8 (C-6), 76.3 (C-7),62.3 (C-1), 33.1 (C-2), 29.8 (C-3), 18.7 (C-14).以上波谱数据与文献[12]基本一致,因此鉴定化合物7 为tetradeca-4E,8E,12E-triene-10-yne-1,6,7-triol.
化合物8:无色油状液体;1H NMR (600 MHz,CD3OD)δH: 6.32 (1H, dq,J=15.8, 6.9 Hz, H-2), 5.80(1H, dtd,J=15.0, 6.8, 1.0 Hz, H-11), 5.58(1H,m, H-10), 5.55(1H, m, H-3), 4.20 (1H, dd,J=6.7, 0.8 Hz, H-8), 3.97 (1H,td,J=6.8, 1.0 Hz, H-9), 3.57 (2H, t,J=6.5 Hz, H-14), 2.14 (2H, m, H-12), 1.80 (3H, dd,J=6.9, 1.9 Hz, H-1), 1.63 (2H,m, H-13);13C NMR (150 MHz, CD3OD)δC: 145.2(C-2), 135.2(C-11), 129.7(C-10), 110.5(C-3),81.6 (C-4), 78.0 (C-5), 76.6 (C-9), 72.5 (C-7),71.2 (C-6), 67.7 (C-8), 62.3 (C-14), 33.1 (C-13),29.8 (C-12), 18.9 (C-1). 以上波谱数据与文献[12]基本一致,因此鉴定化合物8为lobetyol.
化合物9:淡黄色油状液体;1H NMR (600 MHz,CDCl3)δH: 5.36 (4H, m, H-9′, 10′, 12′, 13′), 4.14(2H, m, H-1′), 3.92 (1H, m, H-2′), 3.68 (1H, dd,J=11.6, 3.7 Hz, H-3a′), 3.58 (1H, dd,J=11.6, 6.1 Hz,H-3b′), 2.77 (2H, t,J=6.9 Hz, H-11′), 2.35 (2H, t,J=6.9 Hz, H-2), 2.05 (4H, q,J=7.7 Hz, H-8′, 14′),1.62 (2H, m, H-3), 1.32 (14H, m, H-4′, 5′, 6′, 7′,15′, 16′, 17′), 0.89 (3H, t,J=6.9 Hz, H-18′);13C NMR (150 MHz, CDCl3)δC: 174.4 (C-1′), 130.2 (C-10′), 130.0 (C-12′), 128.1 (C-13′), 127.9 (C-9′),70.2(C-2), 65.1 (C-1), 63.4(C-3), 34.2(C-2′),31.5 (C-16′), 29.6 (C-6′), 29.4 (C-7′), 29.2 (C-15′), 29.1 (C-4′), 29.1(C-5′),27.2 (C-8′), 27.2(C-14′), 25.6 (C-11′), 24.9 (C-3′), 22.6 (C-17′),14.1 (C-18′). 以上波谱数据与文献[13]基本一致,因此鉴定化合物9为1-α-linoleoylglycerol.
化合物10:淡黄色油状液体;1H NMR (600 MHz,CDCl3)δH: 5.37 (6H, m, H-9′, 10′, 12′, 13′, 15′, 16′),4.16 (2H, m, H-3), 3.92 (1H, m, H-2), 3.69 (1H,dd,J=11.5, 3.9 Hz, H-1a), 3.59 (1H, dd,J=11.5,6.0 Hz, H-1b), 2.80 (4H, m, H-11′, 14′), 2.35 (2H,t,J=7.6 Hz, H-2′), 2.06 (4H, m, H-8′, 17′), 1.63(2H, m, H-3′), 1.29 (8H, m, H-4′, 5′, 6′, 7′), 0.98(3H, t,J=7.3 Hz, H-18);13C NMR (150 MHz, CDCl3)δC: 174.4 (C-1′), 132.0 (C-9′), 130.3 (C-16′), 128.3(C-12′), 128.2 (C-13′), 127.8 (C-15′), 127.1 (C-10′),70.2(C-2), 65.1(C-3), 63.3(C-1), 34.1(C-2′),29.6 (C-7′), 29.2 (C-5′), 29.1 (C-4′), 27.2 (C-8′),25.6(C-14′), 25.5 (C-11′), 24.9(C-3′), 20.6(C-17′), 14.3 (C-18′). 以上波谱数据与文献[14]基本一致,因此鉴定化合物10 为glycerol 1-(9,12,15-octadecatrienoate).
化合物11:淡黄色粉末;1H NMR (500 MHz,CD3OD)δH: 7.26 (2H, s, H-2′, 6′), 3.91 (6H, s, 3,5-OCH3), 2.96 (2H, q,J=7.3 Hz, H-2), 1.22 (3H, t,J=7.3 Hz, H-3);13C NMR (125 MHz, CD3OD)δC:199.3 (C-1), 146.7 (C-3′, 5′), 139.4 (C-4′), 128.6 (C-1′), 105.3 (C-2′, 6′), 56.5 (3, 5-OCH3), 31.4 (C-2), 8.5 (C-3). 以上波谱数据与文献[15]基本一致,因此鉴定化合物11 为3,5-二甲氧基-4-羟基-苯丙酮.
化合物12:淡黄色粉末;1H NMR (500 MHz,CDCl3)δH: 7.33 (2H, s, H-2, 6), 4.37 (2H, q,J=7.1 Hz, H-8), 3.95 (6H, s, 3, 5-OCH3), 1.40 (3H, t,J=7.1 Hz, H-9);13C NMR (125 MHz, CD3OD)δC:168.3 (C-7), 149.0 (C-3, 5), 141.2 (C-4), 122.2 (C-1), 108.1 (C-2, 6), 62.0 (C-8), 56.8 (3, 5-OCH3),14.7 (C-9). 以上波谱数据与文献[16]进行基本一致,因此鉴定化合物12为syringic acid ethyl ester.
2.2 分子对接结果及作用分析
根据分子对接结果可知(表1),有4个化合物的total score≥7,分别为:mangnostellin D、(7S,8S)-3-methoxy-3′,7-epoxy-8,4′-oxyneoligna-4,9,9,′-triol、(-)-(7R,8S,7′E)-3′,4-dihydroxy-3-meth-oxy-8,4′-oxyneoligna-7′-ene-7,9,9′-triol、(4E,12Z)-threotetradeca-4,12-diene-8,10-diyne-1,6,7,14-tetraol. 选取得分最高的化合物mangnostellin D,用DS 软件和Pymol 软件分析二者之间的相互作用力.根据相互作用力图可知,mangnostellin D 与氨基酸HIS160、MET273、GLN369 形成氢键,与氨基酸HIS164、ILE336、PHE372 形成了疏水相互作用;其中氢键和疏水作用为主要作用力(图2-3).

表1 川党参化学成分与磷酸二酯酶4D2对接结果Tab. 1 Docking results of chemical constituents from C. tangshen and PDE4D2
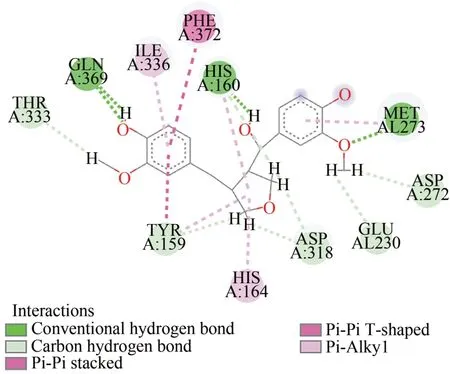
图2 化合物1与PDE4D2相互作用的2D图Fig.2 2D diagram of the interaction between compound 1 and PDE4D2

图3 化合物1与PDE4D2相互作用的3D图Fig.3 3D diagram of the interaction between compound 1 and PDE4D2
3 结语
(1)分离得到了12 个化合物,其中化合物1、4、10、11和12为首次从该植物中分离得到.
(2)将川党参中的主要特征化合物1~8 与PDE4D2 对接发现,mangnostellin D、(7S,8S)-3-methoxy-3′,7-epoxy-8,4′-oxyneoligna-4,9,9,′-triol、(-)-(7R,8S,7′E)-3′,4-dihydroxy-3-methoxy-8,4′-oxyneoligna-7′-ene-7,9,9′-triol、(4E,12Z)-threotetradeca-4,12-diene-8,10-diyne-1,6,7,14-tetraol 与PDE4D2 有较好的结合活性. 本研究为寻找新型磷酸二酯酶PDE4D2抑制剂提供了参考.
