Cu基催化剂电化学还原CO2合成乙醇的研究进展
2024-03-05吕昭锦赵俊虎程菲张嘉文吕康乐张甜
吕昭锦,赵俊虎,程菲,张嘉文,吕康乐,张甜*
(1 武汉理工大学 a.化学化工与生命科学学院; b.资源与环境工程学院,武汉 430070; c.三亚科教创新园,海南 三亚 572000; d.艾克斯马赛学院,武汉 430070;2 中南民族大学 a.资源与环境学院;b.资源转化与污染控制国家民委重点实验室,武汉 430074)
随着工业迅速发展,化石燃料成为维持社会和经济的主要能源,过量的CO2排放将对全球造成无法估量的损害,从而推动了对CO2捕获、储存和利用的系统研发[1].将CO2转化为高附加值燃料或化学品,从而实现碳循环是很有吸引力的一种方法.但由于CO2特殊的分子结构的特点(稳定的热力学结构和化学惰性)导致其反应动力学迟缓,需要利用大型设备和复杂工艺进行CO2转化.近年来许多研究者着力于利用光催化[2]、热催化[3]、酶催化[4]和电化学[5]等方式实现CO2转换,以减少CO2能量屏障,实现可持续的碳循环.其中,利用电催化剂进行电化学还原CO2的方法受到越来越多的关注,不同于其他催化方法需要苛刻的条件(如高压和高温),电化学还原反应不仅可以在环境温度和压力下进行,且目标产物可以通过调整电催化剂、电极电势、电解质、电解池和电解液浓度等进行控制,可以在“绿色”条件下进行大规模生产[6-7].
目前,研究已经发现电化学还原二氧化碳(ERCO2)有多种可能的产物,包括甲酸、一氧化碳在内的C1产物和乙烯、乙醇等多碳(C2+)产物.其中C2产物乙醇,其用途广泛,具有高能量密度(26.8 MJ·kg-1),常用于制造醋酸、酒类、燃料等,在工业、医疗卫生、食品业等生产中都有广泛的用途,特别是随着乙醇燃料汽车的推广和国内外疫情影响之下使用体积分数为70%~75%的乙醇作为日常常用消毒剂,使得乙醇需求量极大提升.乙醇通常的合成方法为乙烯水化法,该方法使用乙烯来进行合成,生产过程需要消耗大量能源[8].通过选择性ERCO2来生产乙醇,不仅可以降低CO2排放对环境造成的影响,还可以产生很大的经济效益,因此受到广泛关注[9-11].
迄今为止,研究者们通过调节应用电位、pH、反应器配置和电解质类型等方式来控制产物的选择性,提高目标产物产率,并了解潜在的机制途径.目前已有许多电催化剂可以实现电化学还原CO2合成乙醇[12-13],且电催化剂种类直接影响其催化活性和选择性[14].在众多电催化剂中,Cu 基催化剂因其独特的活性和选择性而受到广泛关注,其具有良好的中间体CO 结合能,能极大地促进电子/质子转移,是目前唯一能够在水性溶剂中将CO2电化学还原为大量多碳化合物的金属催化剂,被认为是最有前途的电化学还原CO2合成乙醇的催化剂.但目前仍存在众多问题,如过电势太高(-1.0 V vs. RHE 以上)、稳定性不理想、产物选择性难以控制等问题,因此开发高效电催化剂具有重要意义.本文介绍了ERCO2合成乙醇的反应机理和典型的电解池,综述了以乙醇为目标产物的Cu 基催化剂和部分非Cu 基催化剂,提出了几种可能的策略,为设计高性能的ERCO2催化剂提供指导,最后展望了以ERCO2生产乙醇的现状和未来.
1 ERCO2反应概述
1.1 ERCO2反应原理
ERCO2是一个多步骤的过程,通过施加电流使CO2在阴极表面进行还原反应,该过程主要有三个步骤:(1) CO2在电催化剂上进行化学吸附;(2) 在催化剂作用下,发生电子转移以及质子的迁移,形成C—H 或者断裂C—O;(3) 中间产物重新排列,生成的产物从催化剂表面解吸脱离,转移至电解液中[15].
在电化学反应过程中,施加的电极电位对还原产物有重要影响.从热力学角度看,CO2电化学还原反应和析氢反应的平衡电位相近,其产物反应活性很强,种类难以控制,且还原过程相当复杂,包括2、4、6、8、12电子等过程,其还原产物有一氧化碳(CO)、甲酸(HCOOH)、甲醛(HCOH)、乙烯(C2H4)、甲醇(CH3OH)、甲烷(CH4)、乙醇(CH3CH2OH)等,表1 列举了CO2还原反应和析氢反应的标准电极电位[16-18].由表1 可见:所施加的电极电势对还原产物有显著影响,析氢反应(HRE)的平衡电极电势相对其他反应较低,是ERCO2过程中主要的竞争反应,且由于CO2分子中较高的键能(1598 kJ·mol-1),使活化CO2成为该反应的速率控制步骤,在通常情况下CO2还原反应所需的实际电极电位比平衡电极电位负得更多,因此ERCO2还原需要考虑经济上的可行性,注重提高能量效率.

表1 电催化还原二氧化碳的电极电势Tab.1 Electrode potential for electrocatalytic reduction of carbon dioxide
1.2 ERCO2合成乙醇机制
目前在ERCO2合成乙醇过程中被普遍接受的机理为:电解质中的CO2分子在催化剂表面被吸附,在质子耦合电子转移之后,吸附的CO2分子转化为*COOH或*OCHO,它们分别形成CO和HCOOH的重要中间体.另一方面,当催化剂对*CO具有很强的结合能时,则*CO 与*CO 相互偶联形成的*OCCO 将继续反应,但与*CO形成*HCOO—或*CHO相比,碳碳耦合通常需要更高的能垒[19],这一步骤也被认为与生产乙烯共享的途径,也可以继续被氢化成*CH2CHO,因此这个中间体*CH2CHO 的下一步反应将控制着反应向生成乙烯、乙醇的方向进行,其可能的反应机理详见图1.在ERCO2过程中,中间体CO2*的形成被认为是生产C2产物决定速率的步骤[20],活性位点对C1产物有较强吸附能力时,则会促进碳碳耦合,加快生成C2产物.因此,稳定中间体CO2*和控制中间体*CH2CHO 向乙醇生成的方向进行是实现高效生产乙醇的关键.

图1 水溶液中电极上ERCO2主要产物的形成途径Fig.1 Pathway of ERCO2 main products formation on electrodes in aqueous solution
2 ERCO2反应器
电解池类型是影响ERCO2的重要因素[21],设计合适的电化学反应器是提高ERCO2效率的有效方法之一,目前用于ERCO2的反应器主要有四种类型,即一室型电解池、H 型电解池、液体流动电解池(flow cell)和膜电极组件反应器(membrane electrode assembly, MEA).
2.1 一室型电解池
一室型电解池[22]如图2(a)所示,由工作电极、参比电极、对电极组成,三个电极与电化学工作站相连,进行CO2电化学还原反应后收集出气管中气相产物和电解池中液相产物来研究电极反应,但由于阴极CO2还原反应和阳极氧化反应发生在同一电解室内,阴极还原产物可能会通过溶液混合到达阳极附近再次被氧化,因此该类电解池在应用中较少.
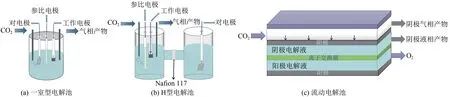
图2 常见的三类电解池示意图Fig.2 Diagram of the three common types of electrolytic cells
2.2 H型电解池
H型三电极电解池[23]是较为常见的电化学反应系统,如图2(b)所示,由ERCO2的阴极室和OER 的阳极室组成,阴阳两室由离子交换膜(Nafion 膜)隔开.CO2以鼓泡方式通入阴极腔,还原电压下进行CO2的还原反应,为防止阴极还原产物转移到阳极又被氧化,两极之间用Nafion 膜隔开.H 型电解池结构简单低成本且易操作,可以快速测试电解质和电催化剂,常常被用于实验室研究电催化ERCO2.但CO2在水溶液中的溶解度有限(<0.034 mol·L-1),且当电化学反应电流较大时,而溶液中CO2浓度太小,电极表面将会出现严重的传质极化,竞争性析氢副反应强烈,另一方面在使用强碱性电解液时,OH-会与CO2反应生成碳酸盐,导致目标产物选择性降低等[24].因此,H 型电解池仅用于实验研究阶段初期筛选催化剂.
2.3 液相流动电解池和膜电极组件反应器
现流动电解池已取得较大研究进展[25-28],用于ERCO2的流动电解池主要为液相流动电解池和膜电极组件反应器.这两种电解池的工作电极通常使用气体扩散电极(gas diffusion electrode,GDE),由多孔催化剂固定在密集排列的碳纤维(通常是碳纸或碳布)和更密集的碳微孔层制备而成,分别作为电催化剂、气体扩散层来输送CO2且对催化剂层起支撑作用,以及作为集流体来维持体系电子传输效率,减小电阻损耗.一方面延长了反应物和催化位点之间的接触时间,另一方面可以将CO2分子直接传输到阴极附近,CO2分子再快速通过气体扩散电极到达电催化剂表面进行电化学还原反应,有效地克服了CO2传质限制的问题,为实现高电流密度提供了方向.图2(c)为常见的液相流动电解池[29],由三个隔间组成,分别为CO2流动的气体阴极室、阴极电解液流动的液体阴极室和阳极电解液流动的阳极室,GDE 将气体和液体阴极室分离,CO2从阴极一侧进入系统,消除了溶解度限制,ERCO2发生在GDE 的三相边界上.常见的MEA 则是将阴极疏水GDE 和阳极催化剂直接压在离子交换膜的两侧,极大减少了传质限制,也是ERCO2的另一种有前途的反应器.
BURDYNY 等[30]研究对比了H 型电解池,液相流动电解池、无液相流动电解池中CO2还原过程中的物质传递过程,如图3(a)所示,H 型电解池中CO2通过气-液界面边界层扩散到催化剂层,再生成产物脱离催化剂层,而流动电解池(包括液体流动电解池和无液体流动电解池)中使用的气体扩散电极含有疏水多孔的气体传输通道,可以将CO2直接输送到阴极,无需溶解在液体电解质中,极大减少了流动边界层对ERCO2传质速率的控制.如图3(b)所示,流动电解池(~50 nm)中CO2扩散到催化剂表面的路径相对于H型电解池(~50 μm)大约减少了3个数量级,有效地解决了CO2在水溶液体系中传质差的问题.总之,电化学反应电解池很大程度影响了电化学反应,在未来可以合理设计流动电解池,电流密度可以达到H型电解池的十倍甚至以上.
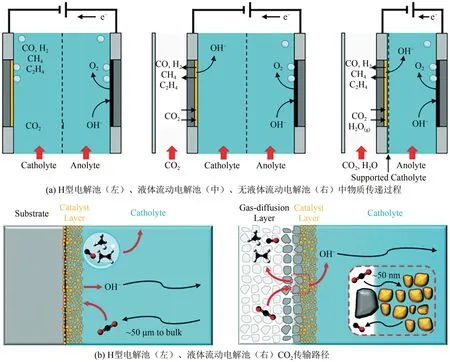
图3 常用电化学CO2还原装置中的质量传递现象对比[30]Fig.3 Comparison of mass transport phenomena in commonly-used electrochemical CO2 reduction configurations[30]
3 ERCO2合成乙醇的催化剂
ERCO2合成乙醇的关键是催化剂材料的选择和制备[31],Cu 基催化剂对中间体*CO 具有较好的结合能,有利于C—C 耦合过程,是唯一对CO2转化为醇和烃类具有显著催化性能的催化剂,因此已被广泛研究用于ERCO2中[32-38].近年来研究者们对Cu 基催化剂进行了一系列修饰和改性,此外非Cu基催化剂也受到了广泛的关注.本节中分析了Cu基和部分非Cu 基催化剂的设计和催化剂在ERCO2生产乙醇中的性能.表2 总结了ERCO2生产乙醇的代表性催化剂及其性能.
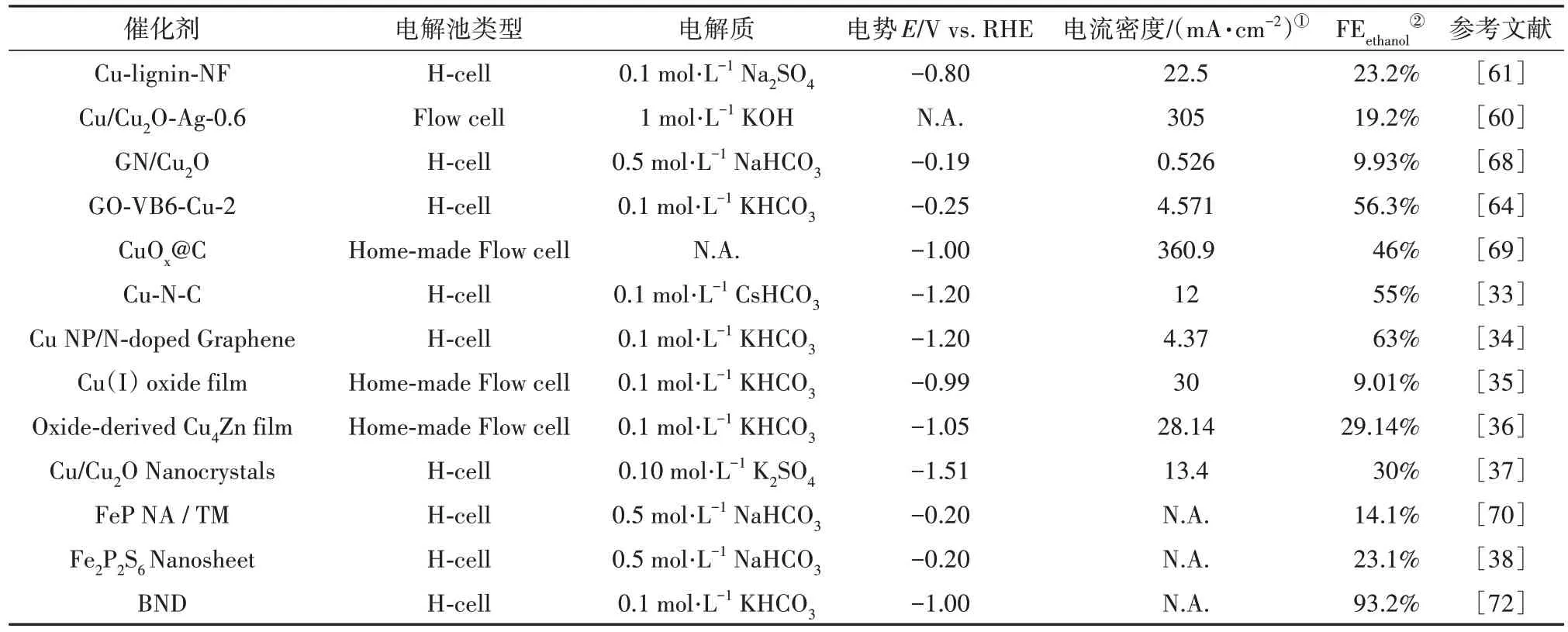
表2 水溶液电解质中ERCO2为乙醇的电催化剂及其性能Tab.2 Performance of an ERCO2 to ethanol electrocatalyst in an aqueous electrolyte
3.1 Cu基催化剂
3.1.1 单金属催化剂
对于单金属Cu,其形貌、尺寸、晶型等是影响其电催化性能的主要原因.此外,金属团簇和金属纳米颗粒具有较高表面积和低配位数,低配位的原子有丰富的悬挂键,易于反应物相互作用,可以提供丰富的催化活性中心,提高活性面积,提高原子利用率.YANG 等[39]研究了Cu 纳米催化剂电还原生命周期的原位电子结构,发现Cu纳米团簇在电解过程中表面的氧化物被还原,配体被解吸后内部Cu纳米颗粒逐渐聚集,形成活性Cu 纳米颗粒,其具有丰富晶界,提供高密度的活性欠配位,增强了C2+产物选择性.KIM等[40]制备了Cu纳米颗粒(Cu NPs)电催化剂,在电解过程中催化剂由致密堆积的Cu NPs 转变为立方体状颗粒,催化性能进一步加强,对C2+产物表现出较高法拉第效率.产物的选择性高度依赖于晶体取向,REYHANEH 等[41]以电沉积的方式制备了纳米泡沫铜,含较多低指数晶面铜单晶[如单晶Cu(111)],使其具有更低的表面能,极大地促进ERCO2为乙醇,在-1.6 V(vs. Ag/AgCl)条件下,乙醇的法拉第效率(FE)为49%.GAO 等[42]通过低压等离子体处理制备了具有可调Cu(100)面、缺陷含量和氧含量的Cu纳米立方催化剂,表现出较高的乙醇和正丙醇选择性(其中乙醇的FE为22%),表明不同铜晶面暴露程度和表面结构会极大影响催化剂性能.因此,开发尺寸可调、形貌可控的Cu 基催化剂至关重要,且不规则的非晶体材料相对于晶体材料具有更大比表面积,对CO2吸附更加充分,也是一种有效的调控手段.
3.1.2 氧化物衍生的Cu基催化剂
与未经处理的金属Cu 相比,氧化物衍生的Cu基催化剂[43]表现出更好的催化效率.研究表明[44]金属Cu在-1.05 V(vs. RHE)时,C2H5OH的FE为9.7%,而金属Cu氧化物衍生的催化剂,在-1.0 V(vs. RHE)时,电流密度达到11.8 mA·cm-2,C2H5OH 的FE 为35%.CHI 等[45]利用水热合成法制备了不同形貌、尺寸的CuO 催化剂,最佳时乙醇的电流效率达到34.2%. ZAHID 等[46]通过水热法制备了CuO 负载在Cu 电极上的催化剂,其在ERCO2过程中CuO 被还原成为Cu(111)纳米颗粒,电流密度得到提高,过电位显著降低.Cu+或Cu2+的存在在ERCO2过程中起重要作用,但在有些ERCO2过程中,还原电位作用下会使氧化物Cu 基催化剂迅速转化为金属Cu[47],影响氧化物Cu 基催化剂的活性、选择性和稳定性.LU 等[48]采用电沉积法制备了不同Cu0/Cu+浓度比的催化剂,在比例最优时,可实现在-0.6 V(vs. RHE)时,乙醇的FE 达48%.研究表明Cu+及其相邻金属Cu 位点之间的界面有利于C—C 偶联,使乙醇更容易形成.因此对Cu 基金属催化剂进行价态和形貌控制,调节表面还原诱导位点以促进C—C 偶联是进行ERCO2为乙醇的重要方向.
3.1.3 Cu基金属有机框架催化剂
金属有机框架(MOFs)具有较高比表面积,可调节的孔隙率,CO2吸附量大是ERCO2良好的催化剂.ALBO等[49]制备了Cu和Bi基MOFs材料,乙醇的FE为28.3%,结果表明了Cu 和Bi基MOFs 的协同作用,较单金属有着显著优势,且Cu/Bi比例可以控制反应生成乙醇.PERFECTO-IRIGARAY 等[50]通过在HKUST-1(Cu)MOF 中掺杂不同金属(如Zn、Pd 和Ru),得到金属-有机异质金属框架MOFs,表明金属掺杂显著提高了催化CO2还原活性.可见,利用Cu 和其他金属掺杂的MOFs可以促进乙醇的生成,这为MOFs作为催化剂用于ERCO2提供了新的思路.
大多数MOFs 相对于金属来说其导电性差,通常只能达到较低的电流密度和能量转换效率.与常见MOFs 相比,2D MOFs 允许在平面内有效地离域载流子[51],表现出更好的导电性,加速反应中的电荷转移过程,在ERCO2方面表现出显著的性能.Yi等[52]制备的2D 酞菁基MOF(NiPc-NiO4)具有良好的导电性,电流密度达到34.5 mA·cm-2,优于已有的MOF催化剂.因此,制备具有快速电子转移能力的MOF催化剂是重要的研究方向.
3.1.4 Cu基合金催化剂
通过向Cu中引入第二金属来构建双金属体系,具有不同组成和原子排列的双金属催化剂可改变Cu 的电子结构和配位,调整中间体的结合强度,提高反应动力学和Cu 基催化剂稳定性,以及改变ERCO2反应路径[53-55].MA 等[56]设计双金属CuPd 催化剂可提高碳氢化合物和氧化物的选择性(如图4),与无序CuPd 和有序CuPd 相比,相分离CuPd 催化剂对乙醇具有更高的选择性,表明几何效应和Cu 与Pd 混合后产生的电子效应在决定中间体*CO 的后续反应途径中起重要作用.

图4 不同原子排列的CuPd NPs的产物分布[56]Fig.4 Product distribution of CuPd NPs with different atomic arrangements[56]
已有研究表明[57-59]:CuAg 双金属催化剂ERCO2比纯Cu 更有选择性地形成多碳产物,Cu-Ag 边界上丰富的CO促进了Cu上的C—C偶联(CO与CHx),使其主要产物是乙醇而不是乙烯.SU 等[60]制备了微量银修饰的Cu/Cu2O 复合材料(Cu/Cu2O-Ag-0.6),微量Ag修饰后是无Ag修饰催化剂活性的2~3倍,乙醇的FE为19.2%,部分电流密度达到305 mA·cm-2.
CHANDA 等[61]通过电化学沉积法制备了Cu-木质素-Ni 泡沫,木质素使Cu 和NF 价态发生变化,在-0.80 V(vs. RHE)时,乙醇的FE 为23.2%,电流密度为22.5 mA·cm-2.YANG等[62]制备了与氧化钒结合的多孔Cu催化剂,-0.62 V(vs. RHE)时乙醇的FE可达到30.1%,部分电流密度为16 mA·cm-2.密度泛函理论表明:催化剂表面关键*HCCHOH 中间物种的形成,显著提高了乙醇的FE. ZHU 等[63]制备了Au-Cu异质结双金属催化剂,Au位点的添加促进CO形成,加快了C—C的耦合,先在Au上高选择性地将CO2转化为CO,再在Cu上进行C—C偶联过程,生成C2产物.因此通过双金属串联可有效地促进碳碳偶联过程,使产物向着有利于乙醇生成的方向进行.由此可见:在Cu 基催化剂上引入第二种金属可以改变催化剂表面与中间体结合能,特别是引入易发生ERCO2为CO 的金属(如Ag、Au、Zn 等),提高活性中心附近的CO浓度,促进C—C耦合,进一步提升ERCO2为乙醇的催化性能.
3.1.5 非金属修饰的Cu基催化剂
金属与碳、氮等非金属结合可以减少金属含量,有助于在反应过程中稳定纳米粒子,防止纳米粒子聚集,促进电荷转移.YUAN等[64]成功地设计了由Cu纳米颗粒修饰的N 掺杂氧化石墨烯(GO-VB6-Cu),在-0.25 V(vs. RHE)下,乙醇的最大FE为56.3%,且表现出卓越的稳定性.ZHUANG 等[65]在Cu NPs 中加入硫原子制备的催化剂(图5),可以显著提升乙醇选择性,密度泛函理论(DFT)计算表明在NP 壳层中产生的Cu 空位和纳米颗粒核心中的S 原子是导致较高的乙醇产量的原因.
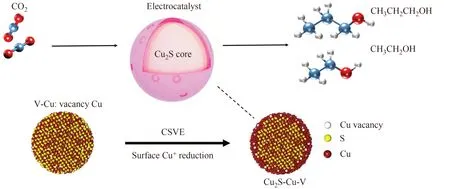
图5 用于CO2还原生产多碳醇的Cu2S-Cu-V CSVE电催化剂设计示意图[65]Fig.5 Schematic design of Cu2S-Cu-V CSVE electrocatalyst for CO2 reduction to produce polycarbonate alcohols[65]
BARHÁCS 等[66]将小Cu 团簇(Cun,n=3~8)固定在掺硼石墨烯上,Cu7对乙醇产物显示出较高的选择性.KIM 等[67]利用化学气相沉积生长石墨烯,制备出一种以石墨烯晶界(gGB)为氧化掩蔽材料的Cu+位点和高晶面共存的电催化剂(Cu+/hf-Cu),Cu+中心具有较强的CO 键合作用,Cu0的高晶面提供了有利的C—C 偶联中心,在-0.8 V(vs. RHE)时,乙醇的FE 为53%.GEIOUSHY等[68]合成了平均粒径为20~50 nm的石墨烯(GN)/Cu2O涂覆在铜箔上作为工作电极,该复合材料表现出ERCO2为乙醇更优异的性能,由于石墨烯增强了Cu2O 表面的电子迁移率,更容易使中间体*C2HxO2还原为乙醇.这些结果表明石墨烯是一种ERCO2有前途的非金属载体.
ZANG 等[69]制备了碳包裹的CuOx@C,表面碳涂层在反应中可以稳定Cu+,加速CO 的吸附,在-1.0 V(vs. RHE)时,乙醇的法拉第效率达到46%,部分电流密度达到166 mA·cm-2.因此,引入非金属原子(B、N、I等)是提高Cu+长期运行稳定性的一种可行方法,且通过不同的策略如修饰上掺杂N的碳材料,增大了催化剂比表面积,促进电子转移及活性位点上反应中间体的生成,是一种有效提高ERCO2为乙醇性能的策略.
3.2 非Cu基催化剂
3.2.1 非Cu基金属催化剂
Cu 基电催化剂是目前最有希望用于ERCO2生产乙醇的材料,但它们在稳定性、选择性、高过电位和可重复使用性方面面临重大障碍.因此引入了一些非Cu基电催化剂,为研究新型电催化剂开辟了新方向.JI等[70]制备了FeP 纳米阵列(FeP NA/TM),在-0.20 V(vs. RHE)时,CH3OH的FE高达80.2%.在他们的另一项研究[38]中,将Fe2P2S6纳米片可作为一种高选择性CO2电催化为醇类的催化剂,-0.20 V(vs. RHE)时,甲醇和乙醇总计FE 达到88.3%.此外,密度泛函理论计算表明,可以将Fe2P2S6表面的Fe原子重新用作形成醇的活性位点.ADEGOKE 等[71]用纳米氧化铟和少量的聚四氟乙烯(PTFE)结合作为阴极,结果得到甲醇、乙醇和异丙醇的混合物,醇类产物的最大法拉第效率为82.5%.虽然这些非Cu 基金属催化剂对产物乙醇表现出了较好的电化学性能,但选择性仍然不够,因此探索非Cu基催化剂ERCO2合成乙醇也具有重要意义.
3.2.2 非金属催化剂
非金属催化剂中如掺硼金刚石(BDD)、氮掺杂碳纳米管(N-CNTs)等是一类有前途的ERCO2催化剂.LIU 等[72]制备了B 和N 共掺杂纳米金刚石材料,表现出优异电化学性能,在-1.0 V(vs. RHE)时,CO2还原乙醇法拉第效率达到93%,其优异的性能主要源于硼氮共掺杂,高氮含量和氢释放超电势的协同效应.SONG等[73]通过自组装法制备了N掺杂的有序圆柱形介孔碳材料,表明氮原子和圆柱形孔道构型的协同作用促进了关键中间体CO*的二聚作用,从而促进质子-电子转移,在-1.0 V(vs. RHE)时,乙醇的选择性接近100%.对于非金属催化剂,将杂原子与碳基底结合可以诱导CO2RR 活性中心的形成,如N和其他非金属掺杂的碳材料,电化学比表面积大,还原电流密度较高,值得进一步探究.
4 总结及展望
综上所述,本文分析了电化学还原CO2合成乙醇的电催化过程与反应机理的关系,列举了典型的几类电解池和ERCO2合成乙醇中优异的Cu 基和部分非Cu 基催化剂,提出了电催化剂的设计策略.虽然目前对于ERCO2合成乙醇的研究已取得较好的进展,但就电化学还原的实际应用而言,该方法生产乙醇仍存在巨大挑战,为了使乙醇进一步接近工业应用水平,还需要解决催化剂选择性差、活性低和稳定性差等问题,今后的研究重点可从以下几个方面展开:
(1)设计合理的新型反应器,使CO2以气体的形式参与反应,而不是先溶解在溶液中,避免溶解度极限,例如使用流动电解池、气体扩散电极作为催化电极或离子液体作为电解液来解决溶解度低的问题.
(2)对电催化剂进行合理设计,在已有的ERCO2合成乙醇机理的基础上,合理创新对催化剂的设计,比如氧化处理、形貌控制、纳米结构控制、合金化、表面改性等策略创造更多C—C 偶联活性位点,促进形成乙醇的中间体,进一步增加电化学反应活性表面积.
(3)为了设计更高效的电催化剂,ERCO2为乙醇的机制还需要进一步探究,可以采用先进的表征技术和计算方法检测ERCO2为乙醇的路线中所涉及的中间体,确定活性位点在反应过程中的变化机制,更有利于未来合理设计催化剂.
(4)目前,大多数催化剂只能稳定运行十几个小时或几十个小时,这与ERCO2的实际应用相差甚远,因此需要对催化剂的降解原因和机理进行探究,提高催化剂的稳定性,如使用石墨烯负载金属催化剂、合理设计壳/核结构等方法.
(5)要考虑催化剂的成本和经济性,目前采用电沉积法来制备催化剂较为快捷、简便,通过改变电沉积基底和在电沉积液中添加适当助剂可实现催化剂的设计.
(6)最后,ERCO2过程需要耗费大量电能,从实际生产角度看并不经济,可以考虑使用以光能、太阳能等自然能源来驱动ERCO2过程,进一步推动ERCO2为乙醇的发展.
