军事航空噪声引起的隐匿性听力损失小鼠存在耳蜗核神经元过度激活
2024-03-05姜一弘郑泽宇张卓儒王昊天王小成
朱 靖,姜一弘,吴 侃,郑泽宇,张 鹏,畅 通,张卓儒,王 菲,王昊天,张 敏,王小成
(空军军医大学:1航空航天医学系航空航天临床医学中心,航空航天医学教育部重点实验室,2西京医院空勤科,3基础医学院学员三大队,4基础医学院学员四大队,陕西 西安 710032)
随着航空兵部队高性能战机的全面列装,战机发动机功率增加、座舱内各类电子设备换代,这导致了飞机内外噪声强度、功率、频谱发生明显变化,由此引发的飞行人员听力障碍问题也更加突出[1-2]。持续暴露于高强度噪声,飞行人员会发生永久性听阈下降,导致噪声性听力损失(noise-induced hearing loss,NIHL)[1]。为解决这一问题,航空兵部队普遍采用听力保护装置如耳塞、声音衰减耳罩等措施进行防护,但上述措施仅能够降低20~45 dB噪声,部队官兵仍长期处于中等强度的噪声环境。长期中强度噪声暴露,虽不会引起听阈下降,但会出现噪声环境下言语识别障碍、耳鸣和听觉敏感等症状,临床上称作隐匿性听力损失(hidden hearing loss,HHL)[3]。研究表明,临床听觉障碍的患者群体中,约19%听阈正常,仅表现为噪声环境言语识别障碍[4]。在飞行时间5年以上的飞行人员群体中,超过47.5%人群体验过噪声环境下无线电用语识别障碍[5]。因此,噪声引起的HHL是威胁飞行安全、降低飞行人员作战效能的重要航空医学问题,探索HHL言语认知障碍的原因对于做好噪声防护和提升战斗力具有重要意义。
前期在以小鼠为模型的HHL研究中,探索了噪声暴露后引起的耳蜗带状突触损伤、毛细胞功能障碍、耳蜗传入神经纤维损伤以及听神经纤维暂时性脱髓鞘等变化,这些研究主要集中在外周听觉感受器的病理变化[6-7],但HHL患者出现的噪声环境下言语识别障碍、耳鸣和听觉敏感等临床症状的直接原因尚不明确。事实上,言语认知主要依赖于听觉中枢对声信号的准确编码,耳蜗核是听觉中枢初级核团,耳蜗核内的信息处理是中枢听觉处理的第一环节,主要接收螺旋神经节的传入信号,负责收集由内耳毛细胞传导的听觉信息,同时收集整合传入的体感信号以及前庭信号,在听觉信息的编码传导以及听觉定位中有着重要的作用[8]。本研究中,我们成功构建了小鼠HHL模型,通过听觉暂时性阈移、阈上刺激ABR Ⅰ波幅值降低水平来评估小鼠听力水平,并利用c-Fos蛋白免疫荧光染色方法分析军事航空噪声暴露对小鼠耳蜗核神经元激活状态的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 4周龄雄性C57BL/6J小鼠,由空军军医大学实验动物中心提供,体质量约15~17 g,无噪声暴露史,听性脑干反应(auditory brainstem response,ABR)测试筛选听阈正常的小鼠用于实验研究。所有小鼠于洁净动物房进行常规饲养,提供充足饮食饮水,控制温度22~24 ℃,12 h/12 h明暗循环光照,实验前适应性喂养1周。实验操作经空军军医大学实验动物福利与伦理委员会批准(许可证号:20230375)。
1.1.2 实验仪器和试剂 戊巴比妥钠(Sigma,美国);速眠新Ⅱ注射液(华牧动物保健品有限公司,中国);TritonX-100(MP Biomedicals,美国);PBS(Biosharp,中国);即用型山羊血清(BOSTER,中国);Anti-Fos B抗体(1∶500,Abcam,英国);山羊抗鼠二抗(1∶250,Proteintech,美国);BSA(BioFroxx,德国);含DAPI抗荧光淬灭封片液(Beyotime,中国);注射泵(广州汇特医疗科技有限公司);OCT(Sakura,美国);冰冻切片机(Leica,德国);共聚焦显微镜(Zeiss,德国);音箱(广州声霸智能科技有限公司);功放(广州声霸智能科技有限公司);声级计(广州宏诚集业电子科技有限公司);脑干诱发电位仪(Otometrics ICS chapter EP,丹麦);共聚焦显微镜(Zeiss,德国)。
1.2 方法
1.2.1 实验分组 实验前对所有C57小鼠进行ABR测量,将听力正常的小鼠随机分为3组,按照课题组前期造模条件给予噪声暴露,其中HHL组小鼠给予110 dB SPL 2 h噪声暴露,NIHL组小鼠给予115 dB SPL 4 h噪声暴露,未给予噪声暴露的作为对照组(CON组)。按照噪声暴露后时间再进行分组,分别为噪声暴露后1 d、噪声暴露后7 d、噪声暴露后14 d、噪声暴露后28 d,每组6只。
1.2.2 噪声暴露 实验噪声为我国某航空兵部队军用直升机采集声音,经存储介质导入功放后循环播放。将小鼠置于鼠笼后,放于扬声器正下方。给予噪声刺激前,用声级计测试噪声强度,确保小鼠活动范围内声压级相差<3 dB。实验组小鼠按照分组接受相应强度和时间的噪声刺激,对照组不给予噪声刺激,其他条件与实验组相同。
1.2.3 ABR测试 按照时间节点,在噪声暴露前后进行ABR测量,采用10 g/L戊巴比妥钠(0.3 mL/100 g)联合10 mL/L速眠新Ⅱ(0.04 mL)腹腔注射小鼠进行麻醉。麻醉成功后,将记录电极插于小鼠颅顶正中双耳连线中点皮下,两个参考电极分别插于双耳耳后皮下,接地电极插于尾部正中。实验采用短声(click)作为刺激声,刺激强度从80 dB开始,以10 dB SPL为间隔递减,以能分辨出Ⅲ波的最低刺激声强度为听力阈值,同时记录click 80 dB SPL刺激下Ⅰ波波幅和Ⅰ波潜伏期。测量方法使用仪器配套软件工具,以波型基线到Ⅰ波峰值顶点测量值作为Ⅰ波波幅,以Ⅰ波峰值出现时间作为Ⅰ波潜伏期。
1.2.4 耳蜗核冰冻切片 采用10 g/L戊巴比妥钠(0.3 mL/100 g)联合10 mL/L速眠新Ⅱ(0.04 mL)腹腔注射小鼠进行麻醉。麻醉成功后,在小鼠剑突下剪一“V”字形开口,使小鼠心脏完全暴露后,灌注的尖针插入动物的左心室,使用注射泵将约20 mL的0.01 mol/L PBS(pH=7.4)冲去体内血液,而后用40 g/L多聚甲醛溶液40 mL进行灌注固定。去除颅骨后将小鼠全脑完整取出,放入40 g/L多聚甲醛固定液中4 ℃固定24 h,而后将脑组织浸泡300 g/L蔗糖溶液中4 ℃至组织沉底。脑组织用OCT包埋后,恒冷箱切片机冠状切片,切片厚度为35 μm,分别收入0.01 mol/L PBS中,漂洗3次后进行后续的免疫荧光染色。
1.2.5 免疫荧光染色 取出切好的冰冻切片,加入适量自配封闭液(9.5 mL 0.01 mol/L PBS,30 μL Triton X-100,500 μL即用型山羊血清)室温封闭1 h,而后用0.01 mol/L PBS漂洗3次,每次10 min。向样本加入Anti-Fos B抗体(ab11959,Abcam,英国),并于4 ℃冰箱孵育72 h,0.01 mol/L PBS漂洗3次,每次10 min。向每个样本内加入适量山羊抗鼠二抗(488,SA00013-1,Proteintech,美国),避光4 ℃冰箱孵育24 h,0.01 mol/L PBS漂洗3次,每次10 min。将样本移至载玻片上铺平,滴上适量含DAPI的抗荧光淬灭封片液,盖上盖玻片。将封好的玻片置于黑盒内,于-20 ℃冰箱内暂存。
1.2.6 共聚焦和c-Fos蛋白阳性神经元计数 使用共聚焦显微镜对耳蜗核进行观察,选用放大倍数为10倍的镜头,激发光波长分别为488 nm和340 nm,对耳蜗核区域进行观察并拍照,用ImageJ软件对视野内c-Fos蛋白阳性的神经元进行计数。

2 结果
2.1 ABR测试结果比较
2.1.1 ABR阈值 各组噪声暴露前后ABR click处听阈变化结果如图1所示,HHL组在110 dB SPL 2 h军事航空噪声暴露后1、7 d测得听阈明显升高(P<0.01),随着时间推移听阈逐渐恢复,14、28 d与对照组听阈差异无统计学意义;NIHL组在115 dB SPL 4 h军事航空噪声暴露后1 d测得听阈明显升高(P<0.01),虽然随着时间推移在7、14、28 d测得听阈有所恢复,但仍然明显高于对照组听阈(P<0.01)。

CON组:对照组;HHL组:隐匿性听力损失组;NIHL组:噪声性听力损失组。n=12。bP<0.01。
2.1.2 ABR Ⅰ波波幅 各组噪声暴露前后ABR click 80 dB SPL处Ⅰ波波幅结果如图2所示,HHL组和NIHL组在噪声暴露后Ⅰ波波幅明显下降(P<0.01)。HHL组Ⅰ波波幅随着时间推移有较明显恢复,但在噪声暴露后28 d仍然低于对照组(P<0.01);NIHL组Ⅰ波波幅随着时间推移无明显恢复,在各时间段都明显低于对照组(P<0.01)。
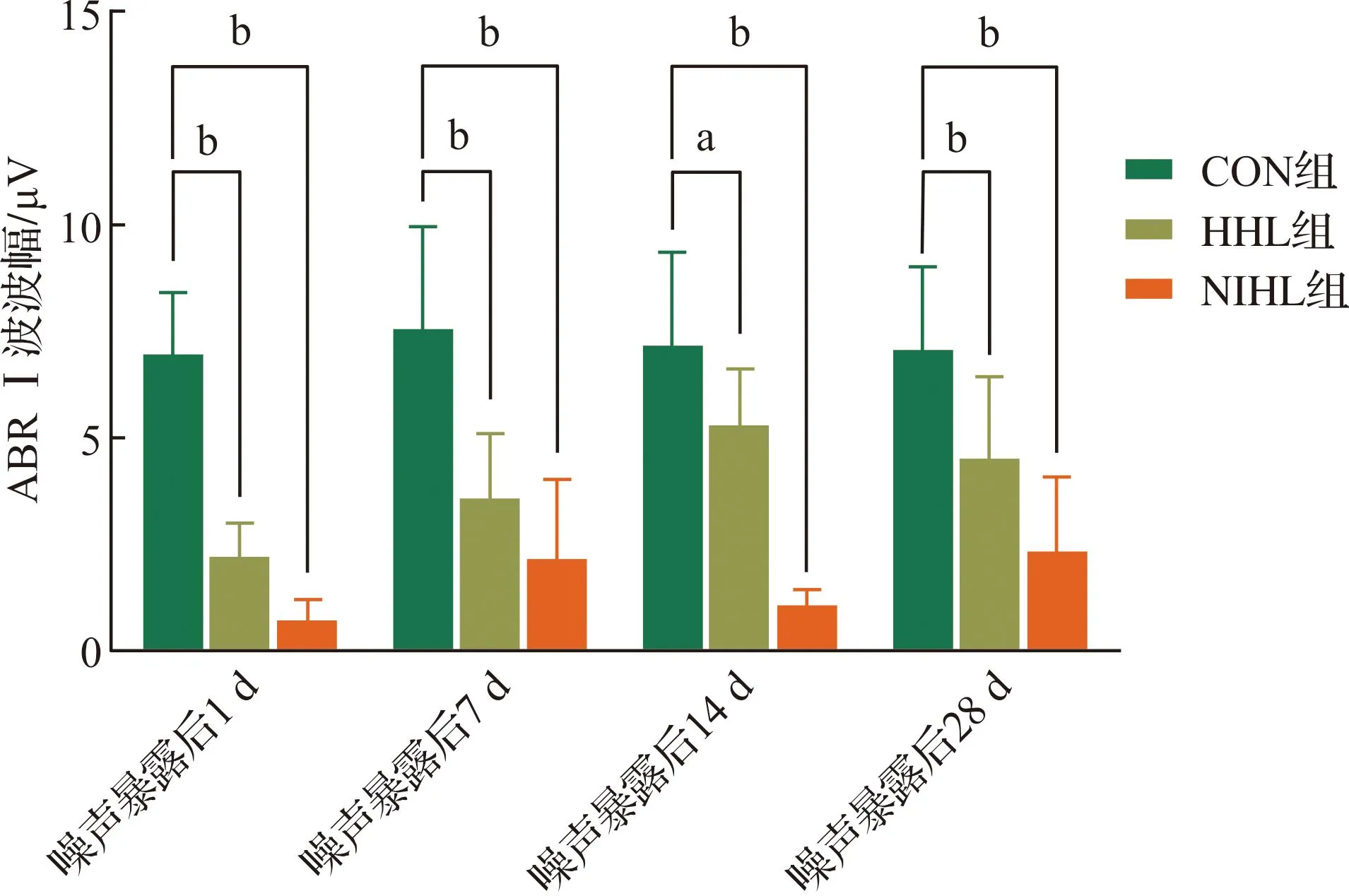
CON组:对照组;HHL组:隐匿性听力损失组;NIHL组:噪声性听力损失组。n=12。aP<0.05,bP<0.01。
2.1.3 ABR Ⅰ波潜伏期 各组噪声暴露前后ABR click 80 dB SPL处Ⅰ波潜伏期结果如图3所示,HHL组在噪声暴露后各时间段潜伏期变化幅度较小,差异无统计学意义;NIHL组在噪声暴露后1、7 d潜伏期明显延长(P<0.01),14、28 d时潜伏期基本恢复,与CON组相比差异无统计学意义。
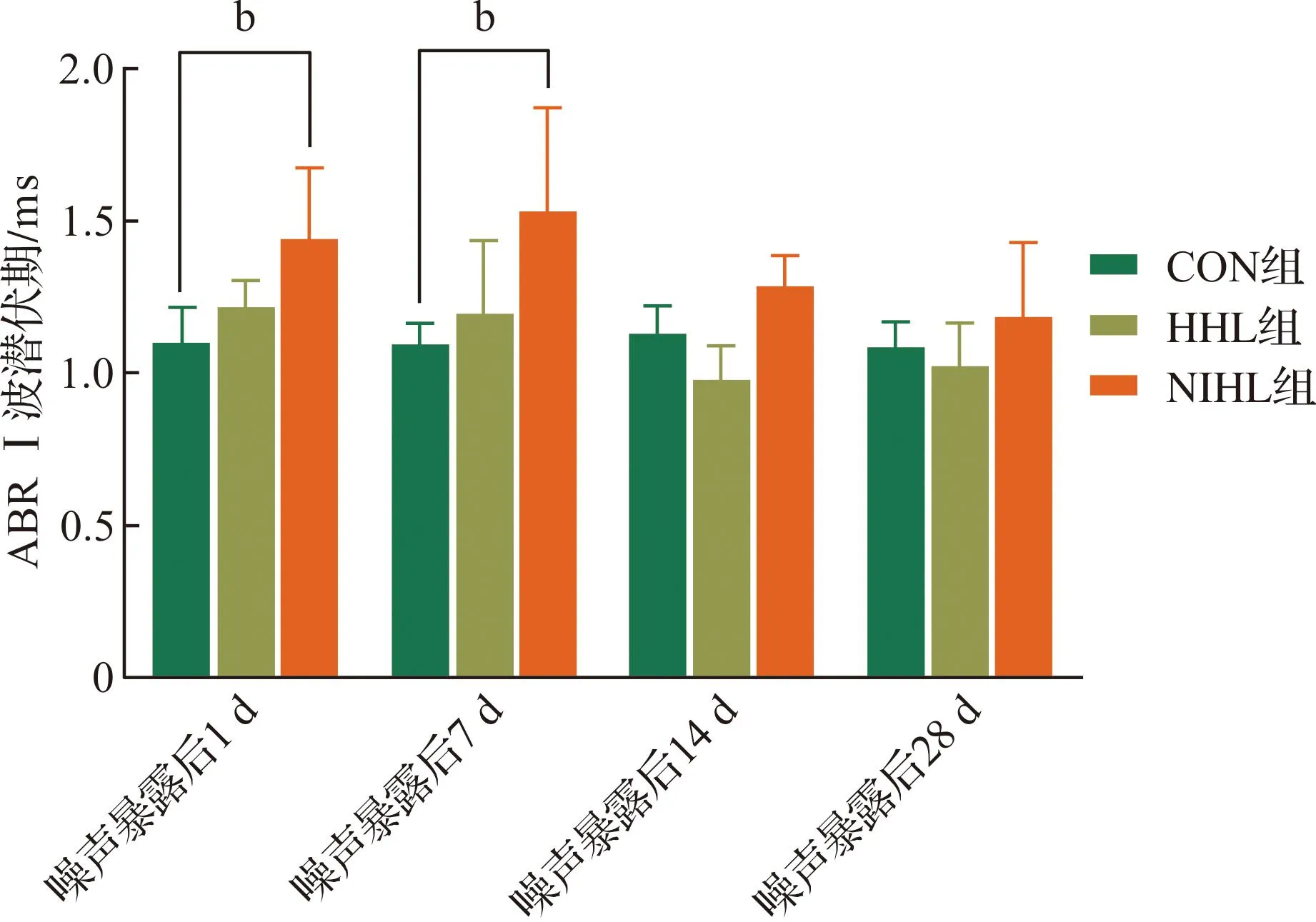
CON组:对照组;HHL组:隐匿性听力损失组;NIHL组:噪声性听力损失组。n=12。bP<0.01。
2.2 噪声暴露后耳蜗核神经元c-Fos蛋白表达的改变
为了探究噪声暴露对于小鼠耳蜗核神经元激活水平的影响,我们分别观察了在有无声音刺激条件下,耳蜗核神经元c-Fos表达的改变。结果发现,噪声暴露后,在无声音刺激情况下(图4),与对照组相比,HHL组耳蜗核c-Fos阳性神经元显著增多(P<0.01),随时间推移数量下降,但在噪声暴露后28 d c-Fos蛋白表达阳性神经元数量仍然高于对照组(P<0.05);NIHL组耳蜗核c-Fos蛋白表达阳性神经元仅在噪声暴露后1 d增多(P<0.01),随时间推移数量下降,噪声暴露后7 d和14 d明显低于对照组(P<0.05),28 d时的数量和对照组差异无统计学意义;对比HHL组与NIHL组耳蜗核c-Fos蛋白表达阳性神经元数量,噪声暴露后各时间段NIHL组明显低于HHL组(P<0.01)。
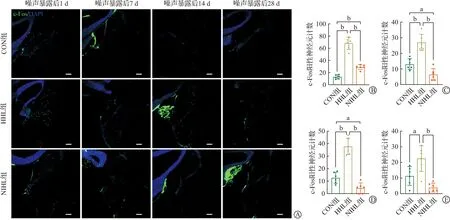
A:噪声暴露后不同时间无声音刺激各组耳蜗核c-Fos阳性神经元免疫荧光染色图;B~E:噪声暴露后1 d(B)、7 d(C)、14 d(D)、28 d(E)无声音刺激各组耳蜗核c-Fos阳性神经元计数统计图。CON组:对照组;HHL组:隐匿性听力损失组;NIHL组:噪声性听力损失组。标尺为100 μm。n=6。aP<0.05,bP<0.01。
噪声暴露后,取材前给予80 dB SPL 2 h声音刺激情况下(图5),相较于对照组,在噪声暴露后1 d,HHL组耳蜗核c-Fos阳性神经元数量增加(P<0.01),噪声暴露后7 d持续增多(P<0.01),噪声暴露后14 d和28 d与对照组差异减小,但仍有统计学意义(P<0.05);NIHL组耳蜗核c-Fos蛋白表达阳性神经元在噪声暴露后1 d和7 d高于对照组(P<0.01),14 d差异无统计学意义,噪声暴露后28 d数量小于对照组(P<0.05);噪声暴露后1 d,HHL组和NIHL组耳蜗核c-Fos蛋白表达阳性神经元数量差异无统计学意义,7 d和14 d NIHL组数量明显低于HHL组(P<0.01),28 d差异更加显著(P<0.01)。

A:噪声暴露后不同时间有声音刺激各组耳蜗核c-Fos阳性神经元免疫荧光染色图;B~E:噪声暴露后1 d(B)、7 d(C)、14 d(D)、28 d(E)有声音刺激各组耳蜗核c-Fos阳性神经元计数统计图。CON+STIM组:对照组(80 dB SPL 2 h声音刺激);HHL+STIM组:隐匿性听力损失组(80 dB SPL 2 h声音刺激);NIHL+STIM组:噪声性听力损失组(80 dB SPL 2 h声音刺激)。标尺为100 μm。n=6。aP<0.05,bP<0.01。
3 讨论
HHL以中等强度噪声刺激后,纯音听阈正常,而噪声环境下言语识别障碍为典型临床表现。在军事飞行活动中,飞行人员经常处在高于80 dB的噪声环境中[9],一旦无法有效识别飞行指令,将对飞行作战任务产生严重不良影响[10]。但噪声环境下言语识别障碍的发生机制尚不明确,以往研究认为,耳蜗毛细胞低自发放电率、高阈值的带状突触是完成背景噪声条件下声信号识别及编码等功能的重要结构[11-12],而中等强度噪声刺激将首先造成这类带状突触丢失[13]。但是听觉形成过程中存在着复杂的传递、编码和调节过程,由声信号感觉到言语认知的形成过程主要依赖于各级听觉中枢及高级认知脑区对声信号的准确编码和调控来完成。因此,从听觉中枢可塑性变化角度切入是探索噪声环境言语识别障碍发生机制的重要方向。本研究初步观察了HHL小鼠耳蜗核神经元存在过度激活,可能导致了噪声条件下言语识别障碍。
本研究中,我们首先以听觉暂时性阈移、ABRⅠ波幅值降低作为指标,并依据本课题组前期的实验基础[14],分别将C57小鼠暴露于110 dB SPL军事航空噪声中2 h和115 dB SPL军事航空噪声中4 h,分别建立HHL小鼠模型和NIHL小鼠模型。在噪声暴露后,HHL组及NIHL组小鼠ABR的Ⅰ波波幅都有明显下降,而ABR的Ⅰ波波幅与耳蜗带状突触数量和功能密切相关[15-16],说明噪声刺激导致了带状突触损伤。而Ⅰ波潜伏期仅在NIHL组噪声暴露后1 d和7 d延长,随时间推移又恢复,这与以往研究结论相同[17]。通过比较各组噪声暴露前后ABR阈值发现,110 dB SPL 2 h噪声暴露后,小鼠听阈出现暂时性阈移;115 dB SPL 4 h噪声暴露后,小鼠听阈出现永久性阈移,因此两种噪声暴露条件分别达到建立军事航空噪声性HHL和NIHL小鼠模型条件。
以往的研究发现,中等强度的噪声暴露会损伤特定频率的听神经纤维亚群的完整性,导致听觉中枢下丘核团发生适应性编码改变[18],而下丘核团的听觉信息输入主要来源于耳蜗核的上行投射。另有研究表明,强噪声暴露后耳蜗核的突触发生了重组反应[19]。因此,我们首先关注了不同强度噪声刺激后耳蜗核神经元激活情况,通过在取材前给予安静条件或80 dB SPL 2 h背景声音刺激处理,分别评估各组小鼠耳蜗核在有无声信号输入条件下的神经元激活情况。结果发现,取材前不给予背景声音刺激,HHL组小鼠耳蜗核神经元在噪声暴露后的不同时间点始终存在过度激活,这种过度激活的状态并未随着听阈恢复而降至正常水平(图4),与之伴随的是以ABR Ⅰ波波幅明显下降为特征的带状突触损伤持续存在(图2)。我们认为这是由于带状突触损伤导致的声信号传入减弱和信号传递方式发生改变,耳蜗核神经元通过增强自发性电活动以实现功能性代偿,以往研究表明,这种代偿性的兴奋性增高会降低各级听觉中枢对声信号编码的准确性[20-21]。与之相对的则是NIHL组小鼠耳蜗核神经元激活水平先升高,后逐渐降低(图4),这可能是由于NIHL组在噪声暴露后的早期代偿较为充分,耳蜗核神经元保持较高的兴奋性,随着大量毛细胞永久性丢失[22],导致外周信号输入大幅度降低,长期缺乏来自外周的信号输入刺激,这种代偿反应逐渐减弱,直至神经元兴奋性低于对照组和HHL组。而这一现象在取材前给予背景声音刺激的实验研究中也得到了印证,在给予80 dB SPL 2 h声音刺激后,对照组小鼠耳蜗核神经元激活数量增多,而HHL组小鼠耳蜗核神经元依然在噪声暴露后持续存在过度激活(图5)。NIHL组小鼠则由于听阈升高,在噪声暴露后初期通过代偿来弥补,而随着代偿反应的消失,即使给予阈上刺激,传入的声音信号不足以激活耳蜗核编码正常的听觉信息,因此神经元激活数量减少,明显低于对照组和HHL组(图5)。此外,本实验发现有声音刺激时,耳蜗核神经元过度激活在噪声暴露后第7日达到峰值(图5),而无声音刺激时,这种过度激活的峰值是在暴露后第1日(图4),我们分析这可能是由于耳蜗核神经元同时接受来自上级听觉中枢的下行调控,而上级听觉中枢发生显著代偿性可塑性变化的时间较之耳蜗核延后,因此,出现了给予声音刺激后耳蜗核神经元激活数量峰值出现的时间较之于安静条件时有所延迟。
本研究存在一定局限性:①耳蜗核存在不同类型的神经元,分别发挥着不同编码功能,而过度激活的神经元属于哪种类型依然需要进行免疫荧光共染、神经元形态学分析等研究;②耳蜗核神经元接受外周听觉信息传入,同时也受到上级听觉中枢发出下行投射神经元的调控,而下行调控神经元异常是否在耳蜗核神经元过度激活发挥更重要的作用依然不清楚,后续需通过调控投射神经元等方法进行深入的机制研究。
综上所述,本研究结果表明,110 dB SPL 2 h军事航空噪声暴露引起小鼠HHL表现为听觉暂时性阈移、ABR Ⅰ波幅值降低,HHL组小鼠耳蜗核神经元出现了过度激活,可能引起噪声暴露后的声信号编码异常,导致噪声环境下言语识别障碍。探明噪声暴露后各级听觉中枢神经可塑性变化的规律及机制,对未来探索噪声的有效防治措施具有重要意义。
