急性缺氧致小鼠脑血管平滑肌功能改变的转录组学分析
2024-03-05李亚娟臧克海李少华刘美杰刘峰舟薛军辉
常 玮,李亚娟,臧克海,李少华,刘美杰,刘峰舟,4,薛军辉,4
(空军军医大学:1航空航天医学系航空航天临床医学中心,2航空航天医学系航空航天生理学教研室,3航空航天医学系飞行人员疗养与康复教研室,4西京医院空勤科,陕西 西安 710032)
随着经济的发展,我国每年出于生活、援建以及执行军事任务等目的进入高原的人员超过3 000万[1]。急进高原(海拔超过1 000 m)并进行相关作业对于长期生活在平原地区的人员来说是一项巨大挑战[2]。因为发病机制尚不明确,所以不同程度的低气压缺氧脑损伤在急进高原人群中的发生率很高且尚无很好的防治措施。目前已有研究证实血管屏障破坏以及脑血流增加所引起的血管源性水肿是低气压缺氧脑损伤发生发展的主要原因[3]。脑血管平滑肌作为脑血管壁的重要组成部分,在维持大脑血管的正常功能中发挥着至关重要的作用[4]。然而,在急性低气压缺氧环境下,脑血管平滑肌细胞(cerebrovascular smooth muscle cells,CVSMCs)会发生怎样的功能改变进而影响低气压缺氧脑损伤的发生发展还有待进一步研究。本研究观察了低气压缺氧条件下的脑损伤以及脑血管平滑肌功能结构的变化,并对小鼠脑血管平滑肌原代细胞进行转录组学分析,为阐明低气压缺氧脑损伤的发生机制提供了新的思路,对于寻找有效的防治策略、降低低气压缺氧脑损伤的发生率具有一定的意义。
1 材料与方法
1.1 材料
1.1.1 实验动物 本实验采用6周龄左右雄性C57BL/6J小鼠,体质量18~22 g,由空军军医大学实验动物中心提供。领取小鼠后,将动物饲养温度控制在20~25 ℃,实验室明暗交替时间为12 h∶12 h,自由进食与饮水。所有动物实验均经空军军医大学实验动物福利与伦理委员会批准[许可证号:SCXK(军)2017-0021]。小鼠适应性喂养1周后,将其中20只小鼠随机分为平原组(Sham组)以及高原组(HA组),每组10只。另取20只C57BL/6J小鼠进行原代细胞的分离培养。
1.1.2 主要试剂 Ham’s F-12培养基(#31765035,GbicoTM,美国),胎牛血清(#10099-141,GbicoTM,美国),α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)抗体(YT5797,Immunoway,美国),通用型抗体稀释液(WB500D,新赛美,中国),杜氏磷酸盐缓冲液(Dulbecco’s phosphate-buffered saline,DPBS)(#14190144,GibcoTM,美国),Ⅱ型胶原酶(#9001-12-1,Sigma-Aldrich,美国),2.5 g/L胰蛋白酶(#C0208-100 mL,碧云天,中国),TRIzol试剂(#15596026,Invitrogen,美国),RIPA裂解液(#P0013B,碧云天,中国),10×TBST缓冲液(#T1081,索莱宝,中国),Calponin 1抗体(#bs-0095R,博奥森,中国),β-tubulin抗体(#10094-1-AP,武汉三鹰),血管平滑肌22α(smooth muscle 22α,SM22α)抗体(#60213-1-Ig,武汉三鹰),QubitTM RNA检测试剂盒(#Q10210,Life Technologies,美国),KCTM Stranded mRNA Library Prep Kit for Illumina®建库试剂盒(#DR08402,南宁核利科技),TRIzol(#B610409,上海生工),反转录试剂盒(#B639277,上海生工),SYBR Green染料法Mix(#B110031,上海生工)。
1.2 方法
1.2.1 动物模型制备 根据JING等[5]关于高原脑水肿造模研究,我们将HA组小鼠放入小型动物实验用环境模拟舱(由空军军医大学航空航天医学系与宏远氧业股份有限公司联合研制),以5~10 m/s速度升至模拟海拔6 000 m,并在该条件下连续暴露5 d后,以10~15 m/s速度降至地面高度。Sham组小鼠置于当地(西安)海拔约400 m进行饲养。两组动物均给予充足的食物与水。
1.2.2 HE染色 模型制备完成后对所有小鼠进行小鼠脱颈处死,在冰上迅速分离小鼠大脑,并将其放入用0.1 mol/L PBS配制的含40 g/L多聚甲醛溶液中固定1周,按常规处理制备石蜡切片,常温保存备用。染色前将石蜡切片常规脱蜡至水,然后依次进行苏木素染色(10 min)、盐酸乙醇分化(2 s)、自来水洗返蓝(3 min)、伊红染色(3 min)、流水冲洗(1 min)、分化液分化(10 s)、梯度乙醇脱水、二甲苯透明以及中性树胶封片,最后将切片放置显微镜下观察染色情况。
1.2.3 免疫组织化学技术 ①取石蜡切片,60 ℃烤片1 h,脱蜡复水;②热修复法修复抗原;③山羊血清封闭室温60 min;④滴加α-SMA抗体(1∶200稀释),4 ℃过夜;⑤PBS冲洗3次;⑥滴加HRP标记的羊抗兔二抗(1∶200稀释)室温孵育1 h;⑦DAB镜下显色、苏木素复染;⑧切片经梯度乙醇脱水干燥;⑨中性树胶封固,晾干后显微镜观察。
1.2.4 Western blotting检测 ①颈椎脱臼法处死小鼠后将其放入预先配好的750 mL/L乙醇中浸泡5 min;②快速断头取脑放入含有100 mg/L青霉素和100 mg/L链霉素的预冷DPBS溶液中;③在体视显微镜直视下迅速分离大脑底部动脉(包括Willis环及其分支);④加入RIPA裂解液,冰上孵育20 min,在4 ℃下12 500 r/min离心20 min,取上清液;⑤采用BCA蛋白定量试剂盒测定蛋白浓度;⑥加入蛋白上样缓冲液,100 ℃煮沸10 min;⑥按每孔50 μg上样,SDS-PAGE电泳后将蛋白转移至PVDF膜,在50 g/L脱脂奶粉中室温封闭1 h;⑦按说明书配置并加入一抗,4 ℃孵育过夜;⑧加相应二抗,室温孵育1 h,TBST洗膜3次;⑨采用Vilber Fusion FX Spectra设备进行条带显影以及灰度值分析。
1.2.5 小鼠脑血管平滑肌原代细胞提取 ①分离小鼠大脑底部动脉,方法同上;②将分离的动脉放于含100 mg/L青霉素和100 mg/L链霉素的PBS中漂洗数次;③将动脉移入1 g/L的Ⅱ型胶原酶溶液中,用滴管轻轻吹打1 min左右;④置于CO2培养箱中,消化15 min,每5 min取出并用滴管轻轻吹打30 s左右;⑤待动脉消化成絮状物,加入含100 mL/L胎牛血清的Ham’s F-12培养基终止酶解反应,并将其放入离心机,按1 500 r/min离心5 min,弃上清;⑥重新加入DPBS溶液吹打,离心,弃上清,洗掉残余胶原酶;⑦加入含200 mL/L胎牛血清、100 mg/L青霉素以及100 mg/L链霉素的Ham’s F-12培养基,吹打混匀后,转移至培养瓶中,置于CO2培养箱中继续培养;⑧1周左右时间细胞融合生长,约长满培养瓶80%,即可传代培养。
1.2.6 细胞的传代及纯化 当细胞生长密度达到80%~90%时,用胰蛋白酶分离消化细胞,进行传代。由于脑血管直径小,内膜和纤维外层不易去除。因此,在细胞传代过程中,可以根据成纤维细胞和平滑肌细胞的不同消化时间对细胞进行纯化。在细胞消化过程中,成纤维细胞在平滑肌细胞之前从细胞壁上分离出来,因此,这种差异可以用于纯化。在传代过程中,在显微镜下观察细胞的消化过程,20~30 s后,将消化下分离出来的细胞(主要是成纤维细胞)和消化液在20~30 s内丢弃,然后再加入胰蛋白酶完成传代过程。此外,血管平滑肌细胞的数量明显多于成纤维细胞和内皮细胞。因此,平滑肌细胞在培养过程中具有增殖优势,这种优势可以抑制其他细胞的增殖。
1.2.7 细胞缺氧模型建立 ①将处于对数生长期的第三代小鼠脑血管平滑肌原代细胞置于缺氧培养箱中(10 mL/L O2、50 mL/L CO2、940 mL/L N2,37 ℃)缺氧处理24 h,建立细胞缺氧模型组(Hypoxia组);②常氧培养的细胞作为对照组(Control组)。
1.2.8 RNA提取及文库构建与高通量测序 按照CHOMCZYNSKI等[6]的方法,使用TRIzol试剂从Control和Hypoxia组的小鼠脑血管平滑肌原代细胞中分别提取总RNA。RNA质量通过使用NanoDropTMOne C分光光度计(赛默飞有限公司)检测A260 nm/A280 nm来确定。通过15 g/L琼脂糖凝胶电泳确认RNA完整性。最终通过Qubit 3.0荧光定量仪和相应的QubitTMRNA检测试剂盒对合格的RNA(A260 nm/A280 nm:1.8~2.2,RQN值>7.0)进行定量。使用RNA链特异性建库试剂盒将2 μg的总RNA用于建库。将构建好的文库在DNBSEQ-T7测序平台(华大基因)进行转录测序。
1.2.9 生物信息学分析 以RPKM值作为基因表达量的衡量指标。以∣log2(fold change)∣>1且P<0.05作为标准,表示该基因为差异表达基因(differentially expressed genes,DEGs)。通过DAVID平台对筛选出的样品间DEGs进行GO富集分析和KEGG通路显著性富集分析。
1.2.10 qRT-PCR验证 用TRIzol提取总RNA,然后通过反转录试剂盒逆转录获得cDNA。使用SYBR Green染料法Mix进行qRT-PCR。用β-actin来归一化这些基因的表达,用2-△△Ct方法计算相对基因表达值。从PrimerBank40中检索到引物序列(表1),引物特异性用国家生物技术信息中心引物BLAST工具进一步验证。

表1 qRT-PCR的引物序列
1.2.11 统计学分析 原始测序数据首先由Trimmomatic(版本0.36)过滤,低质量的读取被丢弃,被适配器序列污染的读取被修剪。使用带有默认参数的STRA软件(版本2.5.3a)将干净的数据映射到Mus_musculus的参考基因组[参考基因组版本Mus_musculus. GRCm38(NCBI)]。通过featureCounts(Bioconductor)计算映射到每个基因外显子区域的读数,然后计算RPKMs。使用edgeR包(版本3.12.1)鉴定各组间DEGs。以∣log2(fold change)∣>1且P<0.05作为标准来判断DEGs的统计学意义。通过KOBAS软件(版本2.1.1)进行DEGs的GO分析和KEGG富集分析,P<0.05表示显著富集。对实验数据以Graghpad软件进行统计学处理,至少取3次独立实验结果。计量资料的两组间比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 模拟高原环境导致小鼠脑血管收缩功能改变
通过HE染色发现,与Sham组相比,HA组小鼠大脑细胞的组织间隙明显变宽且皮层血管扩张明显,可见神经元萎缩以及核深染。脑组织免疫组化以及免疫荧光检测小鼠脑组织中平滑肌细胞收缩功能标记分子α-SMA的表达[7],发现HA组α-SMA的表达较Sham组下降。分离两组小鼠大脑底部动脉(包括Willis环及其分支)并进行Western blotting检测,发现缺氧暴露下,小鼠脑血管平滑肌与收缩功能相关蛋白α-SMA、Calponin 1、SM22α表达下降。提示低气压缺氧环境下,小鼠脑血管平滑肌收缩功能发生改变(图1)。
2.2 小鼠原代CVSMCs鉴定
小鼠原代CVSMCs由组织块缓慢爬出,约14 d后观察到细胞呈典型的峰谷状生长模式。用血管平滑肌特异性标记蛋白α-SMA进行免疫荧光染色,此外,细胞核用DAPI复染,图像合并。荧光显微镜下可见血管平滑肌细胞的胞质呈红色,胞核呈蓝色(图2)。

A:小鼠CVSMCs(×100);B:小鼠CVSMCs α-SMA免疫荧光染色(×200);C:小鼠CVSMCs DAPI染色(×200);D:小鼠CVSMCs染色混合图(×200)。CVSMCs:脑血管平滑肌细胞;α-SMA:α-平滑肌肌动蛋白。
2.3 基因表达差异分析
聚类热图显示了Hypoxia组和Control组之间基因表达谱的差异。为了确定这些基因在缺氧环境中的差异表达,我们使用火山图分析了两组之间的变化。通过比较Hypoxia组和Control组之间的DEGs,以∣log2(fold change)∣>1、P<0.05筛选显著的DEGs,随后获得511个DEGs,其中298个基因表达上调,213个基因表达下调(图3)。
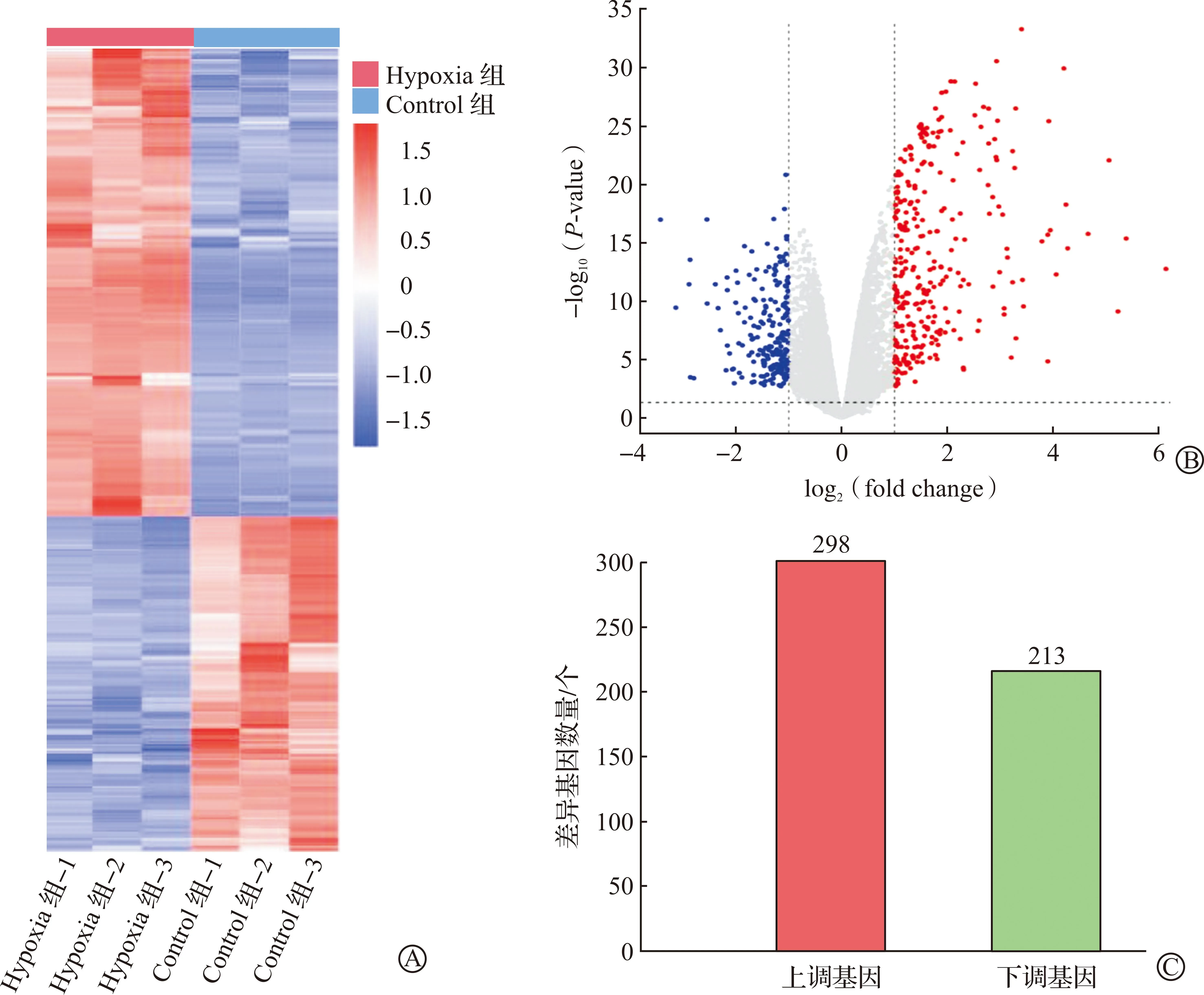
A:Hypoxia组和Control组DEGs的热图,以RPKM值进行聚类,红色表示高表达基因,蓝色表示低表达基因;B:Hypoxia组和Control组基因表达的火山图,灰色点代表未发生差异表达的基因,蓝色点代表差异下调的基因,红色点代表差异上调的基因;C:Hypoxia组和Control组DEGs上、下调数目统计。Hypoxia组:缺氧模型组;Control组:对照组。DEGs:差异表达基因;log2(fold change):差异倍数以2为底的对数;-log10(P-value):P值以10为底的负对数。
2.4 DEGs的GO富集分析
对Hypoxia组与Control组筛选出来的显著性DEGs进行GO富集分析,以P<0.05作为筛选标准。GO富集分析主要包括3个部分,分别是生物过程、细胞组分和分子功能。通过GO富集分析结果可以看出,DEGs中的上调基因在生物学过程模块中,主要富集在线粒体蛋白质分解代谢过程、糖酵解过程、线粒体外膜通透性等;分子功能模块中,上调的DEGs主要富集在磷酸丙酮酸水合酶活性和脱氢抗坏血酸跨膜转运蛋白活性等;下调的DEGs在生物学过程中表达量显著性差异较大的基因主要富集在共生体对宿主的黏附、核糖核酸酶活性的调节以及对Ⅰ型干扰素的应答;分子功能模块中,下调基因主要富集在2′-5′-寡腺苷酸合成酶活性以及CCR5趋化因子受体结合等方面。我们按P值排序选择最显著的前20个GO Terms作图(图4)。

A:Hypoxia组和Control组上调DEGs的GO富集图;B:Hypoxia组和Control组下调DEGs的GO富集图。横轴表示富集的显著性[用-log10(P-value)表示,该值越大富集得越显著],纵轴表示富集的GO Terms,圆点大小表示该GO Terms包含的差异基因数目,圆点深浅表示rich factor富集的程度。Hypoxia组:缺氧模型组;Control组:对照组。DEGs:差异表达基因。
2.5 DEGs的KEGG通路分析
对Hypoxia组和Control组筛选出来的显著性DEGs进行KEGG通路富集分析,判断基因富集的阈值为P<0.05。在KEGG富集分析中,上调的DEGs基因富集最多的类别为糖酵解/糖异生,其次为新霉素、卡那霉素和庆大霉素生物合成、氨基酸的生物合成以及淀粉和蔗糖代谢。与此同时,对于下调的DEGs而言,RIG-I样受体信号通路、丙型肝炎、甲型流感以及麻疹均富集显著。我们按P值排序选择最显著的前20个KEGG Pathways作图(图5)。

A:Hypoxia组和Control组上调DEGs的KEGG代谢通路图;B:Hypoxia组和Control组下调DEGs的KEGG代谢通路图。横轴表示富集的显著性[用-log10(P-value)表示,该值越大富集得越显著],纵轴表示富集的KEGG Pathways,圆点大小表示该KEGG通路包含的差异基因数目,圆点深浅表示rich factor富集的程度。Hypoxia组:缺氧模型组;Control组:对照组。DEGs:差异表达基因。
2.6 利用qRT-PCR验证RNA-Seq数据
为了验证我们研究中获得的转录组测序数据的可靠性,我们选择了4个表达差异较大的DEGs进行验证,包括Aire、Ndufa4l2、Gpr35以及Tnfrsf9(图6)。结果提示RNA-seq数据可靠。
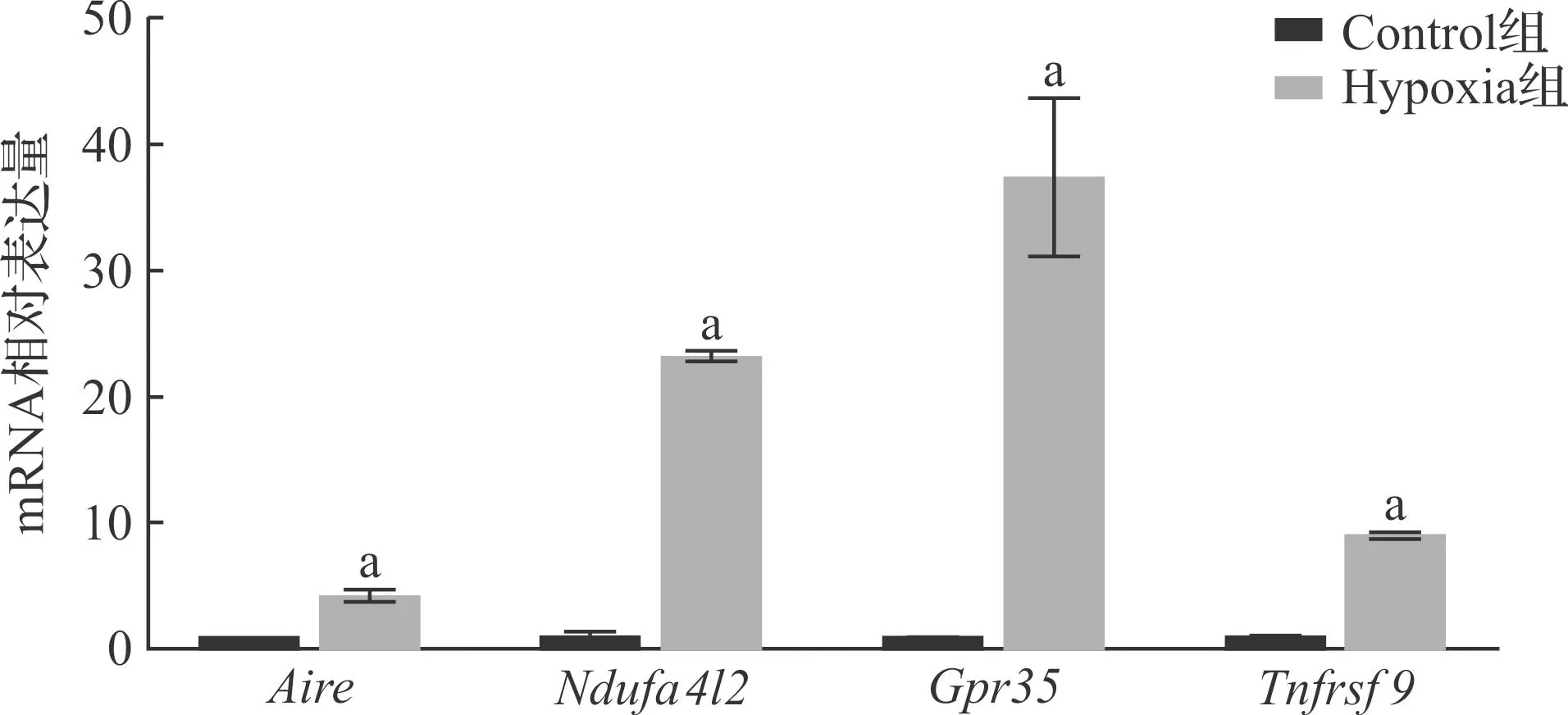
Control组:对照组;Hypoxia组:缺氧模型组。DEGs:差异表达基因。条形代表组。
3 讨论
本研究通过构建低气压缺氧动物模型,发现小鼠脑血管平滑肌在低气压缺氧暴露下的功能结构变化。然后分离小鼠脑血管平滑肌原代细胞构建缺氧模型进行高通量转录组测序,筛选出DEGs后进行GO富集分析和KEGG通路富集分析,并使用qRT-PCR进行相关验证。发现小鼠CVSMCs可通过改变能量代谢、物质代谢、信号传导等多个途径在低气压缺氧脑损伤中发挥作用。
通过HA组以及Sham组的比较,发现HA组小鼠的脑细胞间隙明显变宽且出现脑神经元损伤。免疫组化以及免疫荧光检测小鼠脑组织中平滑肌细胞收缩功能标记分子α-SMA的表达,提示低气压缺氧可能导致血管平滑肌收缩功能改变。我们进一步分离两组小鼠脑血管并进行Western blotting检测,发现平滑肌特异性收缩功能相关蛋白α-SMA,Calponin 1以及SM22α在缺氧暴露后表达下降。以上实验均提示低气压缺氧环境下,小鼠脑神经元的损伤伴随着脑血管平滑肌收缩功能的改变。因为主要由血管平滑肌细胞承担的脑血管收缩舒张功能在缺氧脑损伤中发挥重要作用,并且相关机制尚不明确[8]。因此,缺氧导致CVSMCs功能改变的机制值得进一步的研究及探讨。
通过对Hypoxia组和Control组小鼠原代CVSMCs进行高通量转录组测序分析,共发现511个DEGs,其中298个上调基因,213个下调基因。对DEGs进行GO和KEGG的功能分类分析。其中GO功能分析结果显示,DEGs主要参与线粒体蛋白质分解代谢过程、糖酵解过程、磷酸丙酮酸水合酶活性以及核糖核酸酶活性的调节等方面。通过KEGG富集分析,DEGs主要参与糖酵解/糖异生、氨基酸生物合成、RIG-I样受体信号通路等。为了验证测序结果的准确性,我们在所有DEGs中筛选出表达差异较大的4个分子进行qRT-PCR验证,分别是Aire、Ndufa4l2、Gpr35以及Tnfrsf9。Aire与免疫调节密切相关,它可以促进胸腺中各种组织特异性抗原的表达[9]。AIRE可与多种蛋白合作发挥核转运、染色质结合/结构、转录和前体mRNA加工等功能[10]。缺氧条件下,Aire的表达改变可能从以上几个方面影响血管平滑肌细胞的功能。NDUFA4L2作为线粒体复合物Ⅰ的负性调节因子,缺氧条件下的过表达可以减少因细胞活性氧增多而导致的细胞凋亡,这一过程在肿瘤细胞上得到了印证[11]。GPR35可通过调节细胞微环境刺激新鲜血管的生成[12]。目前,有研究表明GPR35是Na/K-ATPase离子泵功能和Src信号活性的关键启动子,在肿瘤细胞的发生发展以及炎症和能量代谢方面都发挥重要作用[13]。TNFRSF9又称为4-1BB或CD137,是一种在多种细胞上表达的共刺激受体。目前研究认为,TNFRSF9是肿瘤反应性调节性T细胞的激活标志物[14]。TNFRSF9的激活可刺激T细胞和抗原提呈细胞的增殖,并促进相关细胞因子的分泌,进而提高机体抗肿瘤免疫应答水平[14]。此外有研究表明,对于血管平滑肌细胞而言,TNFRSF9的激活可通过降低抗凋亡调节因子Bcl-2并随后上调凋亡相关蛋白酶cleaved caspase-3来增加细胞的凋亡[15]。作为靶向抗肿瘤药物研发的“明星分子”,与之相关的研究大都围绕肿瘤细胞进行。对于非肿瘤细胞,TNFRSF9的研究并不多见。但值得注意的是,Tnfrsf9与炎症、细胞信号传导等方面均密切相关,这些作用在非肿瘤细胞上的研究还有待开展[16]。
通过本项目,我们发现缺氧暴露对小鼠CVSMCs的线粒体相关功能影响显著。线粒体对于真核细胞的能量代谢、物质代谢以及信号传导等方面均发挥着重要作用[17];并且线粒体的结构和功能改变与许多疾病密切相关(如阿尔茨海默病、颅脑创伤、癫痫)[18]。最近的功能蛋白质组学研究揭示了线粒体蛋白质组成的复杂性[19-20]。承担线粒体呼吸作用、代谢物运输、膜结构调控等功能的蛋白质之间存在相互联系,并在一个动态网络中相互作用[20]。缺氧对线粒体蛋白质分解代谢过程的改变可能会从以上多个方面对小鼠CVSMCs线粒体功能产生影响。糖酵解是所有生物体进行葡萄糖分解代谢所必须经过的共同阶段,其全部反应过程均在细胞质中进行[21]。已有大量研究发现,肿瘤细胞可通过糖酵解和氧化磷酸化之间的转换来适应代谢环境的改变[22-24]。我们的研究发现,对于小鼠CVSMCs而言,微环境的变化同样会造成细胞糖代谢相关途径的变化。磷酸丙酮酸水合酶是糖代谢途径中的关键酶,在各个组织器官中的表达丰富,其作用是使2-磷酸甘油酸转变为磷酸烯醇式丙酮酸。缺氧情况下,磷酸丙酮酸水合酶活性的改变会大大影响细胞的糖代谢[25]。细胞核糖核酸酶活性在缺氧暴露下的改变意味着小鼠CVSMCs的能量代谢、物质代谢以及对有害物质的防御机制发生了变化[26-27]。小鼠CVSMCs参与糖酵解/糖异生、氨基酸生物合成、RIG-I样受体信号通路的基因在缺氧条件下会发生改变,提示缺氧对细胞结构和功能均产生显著影响,尤其是涉及能量代谢、物质代谢和信号传导方面。以上这些变化都将进一步影响细胞的增殖和凋亡。
综上所述,我们发现急性低气压缺氧暴露会导致脑血管平滑肌功能结构的改变;同时,这种改变可能不同程度上参与了低气压缺氧脑损伤的发生发展。通过对小鼠CVSMCs缺氧处理并进行高通量转录组测序,我们发现缺氧会导致小鼠CVSMCs糖代谢相关途径发生明显改变。这种能量代谢途径的变化对于低气压缺氧脑损伤而言是一种保护机制还是损害机制还有待进一步研究。不论是能量代谢、物质代谢还是信号传导,线粒体都在其中发挥着重要作用,血管平滑肌细胞线粒体结构是否在缺氧暴露下发生改变还有待进一步证明。不可否认的是,该研究存在一定的局限性。首先,因实验条件有限,实验室无法同时满足低温低压的模拟高原环境。对于低气压缺氧脑损伤而言,高海拔导致的低气压缺氧虽在其中发挥重要作用,但不能忽视高海拔温度变化对机体带来的影响。优化实验条件,更加准确地模拟高原环境将更有利于对低气压缺氧脑损伤的研究。其次,未对实验动物进行更详细的大脑功能检测以及施加相应的干预措施,这将在今后更深入的研究中进行。
