川陈皮素对单纯性肥胖症大鼠肠道菌群和短链脂肪酸的影响*
2024-03-05郑近园庹余兴张梦苹
呙 燕, 郑近园▲, 张 佳, 庹余兴, 张梦苹, 刘 霞△
(1重庆三峡医药高等专科学校,重庆 404120;2长江师范学院,重庆 408100)
近年来,由于人们饮食习惯的改变以及缺乏锻炼等因素,全球肥胖患病率显著上升[1]。肥胖是诱发高血压、糖尿病、脂肪肝和脑卒中等疾病的重要原因[2]。目前,治疗肥胖症的方式主要包括饮食控制[3]、药物治疗[4]及手术治疗[5]等,但由于饮食控制难以坚持、药物副作用以及手术风险大等因素,其长期效应难以维持。
川陈皮素(nobiletin,NOB)又称蜜桔黄素,是从中药陈皮中提取的一类黄酮类化合物[6],具有降血脂、降血糖等作用[7],其在治疗肥胖症方面的效果已被证实[8],但其具体机制尚不明确。肠道菌群及其代谢产物,如短链脂肪酸(short chain fatty acids,SCFAs)与肥胖症及相关代谢性疾病的发生发展关系密切[9]。SCFAs 在因肥胖引起的肠道菌群紊乱的情况下会发生相应改变[10-11],是预防和治疗肥胖及相关代谢紊乱的关键环节[12]。本项工作以单纯性肥胖症大鼠模型为研究对象,分析NOB 对肥胖症大鼠肠道菌群、SCFAs及脂质代谢的影响,为NOB 的抗肥胖研究提供参考。
材 料 和 方 法
1 动物
22 只SPF 级SD 雄性大鼠,4 周龄,体质量(150±20)g,购于湖南斯莱克景达实验动物有限公司 [许可证号为SCXK(湘)2019-0004]。本课题动物实验经重庆三峡医药高等专科学校生物医学伦理委员会批准,伦理审查批号为:SYYZ-A-2211-0001。实验动物饲养于重庆三峡医药高等专科学校实验动物中心,温度24~26 ℃,相对湿度50%~60%,光暗周期为12 h,适应性喂养1周后开始实验。
2 主要试剂及仪器
川陈皮素(成都德思特生物技术有限公司);低脂饲料及高脂饲料(Research Diet)。全自动生化分析仪(山东博科生物产业有限公司);PCR 仪(Biorad);凝胶成像仪(Tanon);全自动样品快速研磨仪(上海万柏生物科技有限公司);高灵敏质谱仪(AB Sciex);超高效液相色谱仪(日本岛津公司)。
3 造模、分组及给药
22 只SD 大鼠适应性喂养1 周后,随机分为对照组(6 只)和模型组(16 只),对照组予以低脂饲料喂养,模型组予以高脂饲料喂养。以高脂饲料组大鼠体质量超过低脂饲料组大鼠平均体质量的20%为成模标准[13]。将造模成功的12 只大鼠随机分为模型组和川陈皮素组,每组各6 只。对照组、模型组给予同体积生理盐水,川陈皮素组给予100 mg/kg NOB 悬浮液灌胃[14],每天1次,连续给药21 d,隔天记录各组大鼠体质量。
4 标本采集与检测方法
4.1 各组大鼠血脂水平检测 禁食不禁水12 h 后用2%戊巴比妥钠(2 mL/kg)进行麻醉,腹主动脉采血,954 ×g离心15 min,取血清。采取临床全自动生化分析仪检测血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)水平。
4.2 肝脏、脂肪组织病理学检查 腹主动脉取血后,迅速分离出肝脏和肾周脂肪组织,用PBS 冲洗后滤纸吸干水分,置于4%多聚甲醛溶液中固定,常规包埋、切片后进行苏木精-伊红(hematoxylin-Eosin,HE)染色,用光学显微镜观察并拍照记录。
4.3 肠道菌群16s rRNA 高通量测序 末次给药后采用逼迫法令其应激排便,采集1 粒粪便样本于无菌冻存管中后置于液氮中猝灭。检测由上海欧易生物医学实验室完成。测序分析过程如下:(1)DNA 抽提和PCR 扩增:采用MagPure Soil DNA LQ Kit(Magan)试剂盒,按照其说明书提取粪便菌群总基因组DNA。以提取的基因组 DNA 为模板,使用带 Barcode 的特异引物和Takara Ex Taq 高保真酶进行细菌16S rRNA基因的PCR扩增。采用通用引物343F (5’-TACGGRAGGCAGCAG-3’)和798R(5’-AGGGTATCTAATCCT-3’)扩增16S rRNA 基因的V3-V4 可变区,用于细菌多样性分析;(2)文库构建和测序:PCR 扩增产物使用琼脂糖凝胶电泳检测。然后使用AMPure XP beads 磁珠纯化,纯化后作为二轮PCR 模板,并进行二轮 PCR 扩增。并再次使用磁珠纯化,取纯化过的二轮产物进行Qubit定量,然后调整浓度进行测序。使用Illumina NovaSeq 6000 测序平台进行测序,并生成250 bp双端reads;(3)生物信息学分析:使用Cutadapt 软件,将raw data 序列剪切掉引物序列。然后使用DADA2,将合格的双端raw data 按照QIIME 2默认参数进行质控分析,得到代表序列及ASV丰度表格。使用QIIME 2 软件包挑选出各个ASV 的代表序列后,并将所有代表序列与Silva(version138)数据库进行比对注释。物种比对注释使用q2-feature-classifier 软件默认参数进行分析。采用QIIME2软件进行α 和β 多样性分析。基于R 包,采用ANOVA统计算法,进行差异分析。
4.4 短链脂肪酸含量检测 以同上方法采集大鼠粪便1 粒,大鼠粪便经过研磨、提纯、富集、纯化等样本预处理后,采用LC-MS分析方法,对目标代谢物进行定性定量检测,色谱条件:进样量:1μL;流速:0.4 mL/min;流动相:A(0.1%甲酸-水溶液),B(乙腈/甲醇=2:1);梯度洗脱方法(Gradient Elution Procedures):0 min A/B(80:20,V/V),2 min A/B(80:20,V/V),8min A/B(60:40,V/V),8.1min A/B(5:95,V/V),9.5 min A/B(5:95,V/V),9.6 min A/B(80:20,V/V),10 min A/B(80:20,V/V)。质谱条件:气帘气:35(psi);碰撞诱导电离(collision-activated dissociation,CAD)参数:medium;负离子喷雾电压:-4500V;离子源温度:450 ℃;柱温:40 ℃;喷雾气(Gas1):50(psi);辅助加热气(Gas2):50(psi)。代谢物定量利用三重四极杆质谱的多反应检测(MRM)模式进行分析。获得不同样本的质谱分析数据,对所有的色谱峰进行峰面积积分,并对其中同一物质在不同样本中的色谱峰进行积分校正。
5 统计学处理
采用SPSS 27.0软件进行统计学分析,数据均以均数±标准差(mean±SD)表示,多组间比较进行单因素方差分析;方差齐用LSD 分析,方差不齐用Dunnet T3分析,以P<0.05定义为差异有显著性。
结 果
1 各组大鼠体质量和摄食量比较
如图1A 所示,给药前,与对照组比较,模型组和川陈皮素组体质量均显著升高(P<0.01),模型组与川陈皮素组间体质量无统计学差异;给药后,与模型组比较,川陈皮素组体质量显著降低(P<0.05)。图1B 可见与模型组比较,川陈皮素组大鼠摄食量减少。
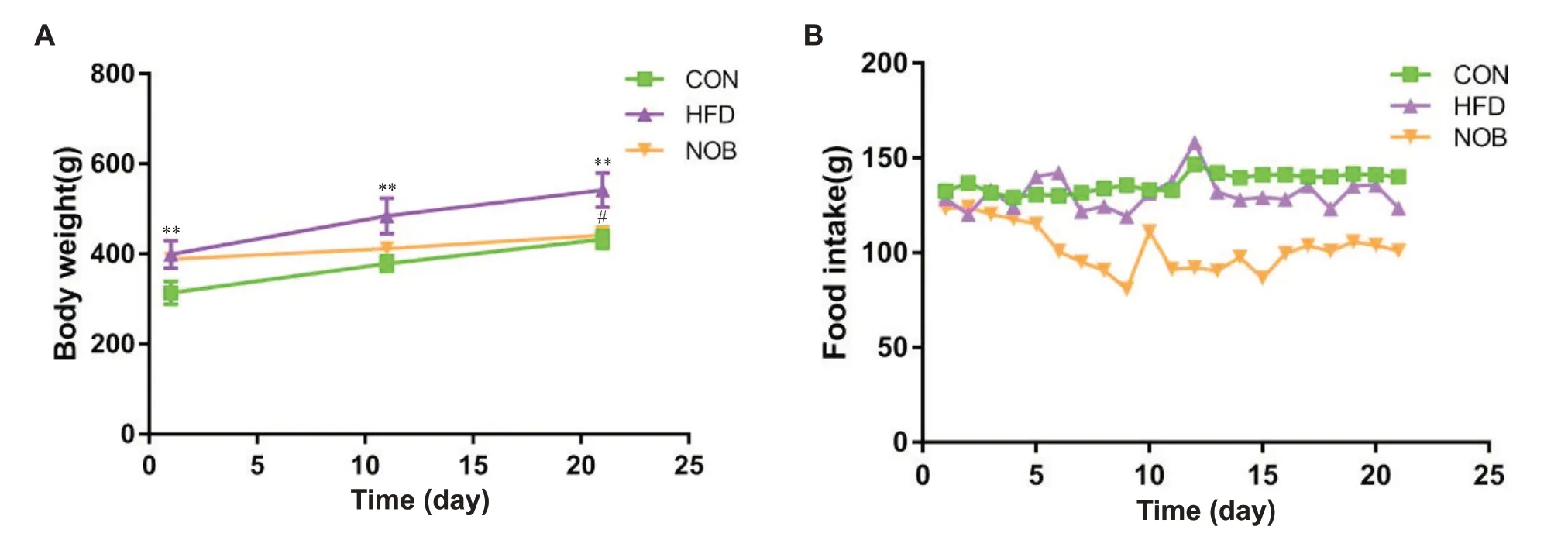
Figure 1. Comparison of body weight (A) and food intake (B) before and after intervention among groups. Mean±SD. n=6. **P<0.01 vsCON group; #P<0.05 vs HFD group.图1 各组大鼠干预前后体质量和摄食量比较
2 各组大鼠脂肪组织病理学分析
对照组大鼠脂肪组织细胞在单个视野下呈现细胞直径小、数量多并且形态正常;与对照组比较,模型组脂肪组织细胞直径增大。干预后,与模型组比较,川陈皮素组脂肪细胞直径显著变小(图2)。

Figure 2. Comparison of histopathology of adipose tissue in each group. Compared with the control group, the diameter of adipocytes in the model group was significantly increased. After the treatment, the diameter of adipocytes in the NOB group was significantly decreased.图2 各组大鼠脂肪组织病理形态学比较
3 各组大鼠肝脏组织病理形态学分析
与对照组相比,模型组大鼠可见明显的肝细胞空泡化现象,空泡面积较大且数量较多,伴有细胞脂肪变性和炎症反应。经NOB 干预后,肝细胞空泡化现象较少,炎症浸润现象得到显著改善(图3)。
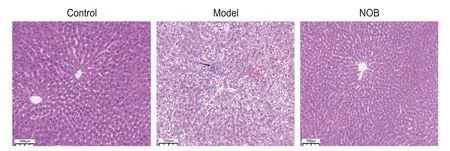
Figure 3. Comparison of histopathology of liver tissue in each group. Black arrow: inflammatory infiltration; Red arrow: lipid droplets. Scale bar=100 μm. Compared with the control group, there were a large number of lipid droplets in the liver of the model group rats, accompanied by inflammatory infiltration. Compared with the model group, there were only a small amount of lipid droplets in the liver of the NOB group, and the inflammatory infiltration was significantly improved.图3 各组大鼠肝脏组织病理形态学比较
4 NOB对肥胖症大鼠血清血脂的影响
如表1所示,与对照组相比,模型组大鼠的TG和TC 水平显著升高(P<0.05);与模型组相比,经NOB干预后,大鼠的TG 和TC 水平显著降低(P<0.05)。各组间HDL-C和LDL-C无显著差异。

表1 NOB对肥胖症大鼠血清血脂的影响Table 1. Effects of NOB on serum lipid in obese rats (mmol/L. Mean±SD. n=6)
5 各组大鼠肠道菌群变化
5.1 各组大鼠肠道菌群的物种注释 花瓣图用于分析各样品之间所特有、共有的ASVs 个数,如图4A所示,通过高通量测序共得到890个ASVs,样本间共有ASVs 28 个。Venn 图可用于直观表现样本的ASVs 数目及各组重叠情况,如图4B 所示,对照组独有277个ASVs,模型组独有174个ASVs,川陈皮素组独有211 个ASVs。经鉴定分别属于16 个门和168 个属。该结果表明各组大鼠肠道菌群结构存在一定的差异,但又有一定的相似。

Figure 4. Petal diagram (A) and Venn diagram (B) of ASV distribution of gut microbiota. CON: control group; HFD: model group;NOB: NOB group. n=6.图4 肠道菌群ASV分布花瓣图和Venn图
5.2 各组大鼠肠道菌群α 多样性分析 稀释曲线随着抽取序列数的增加而趋于平缓,说明样本测序量合理(图5A)。通过Simpson 指数分析,对照组、模型组和川陈皮素组之间的物种丰富度和多样性无显著差异(P>0.05)(图5B)。
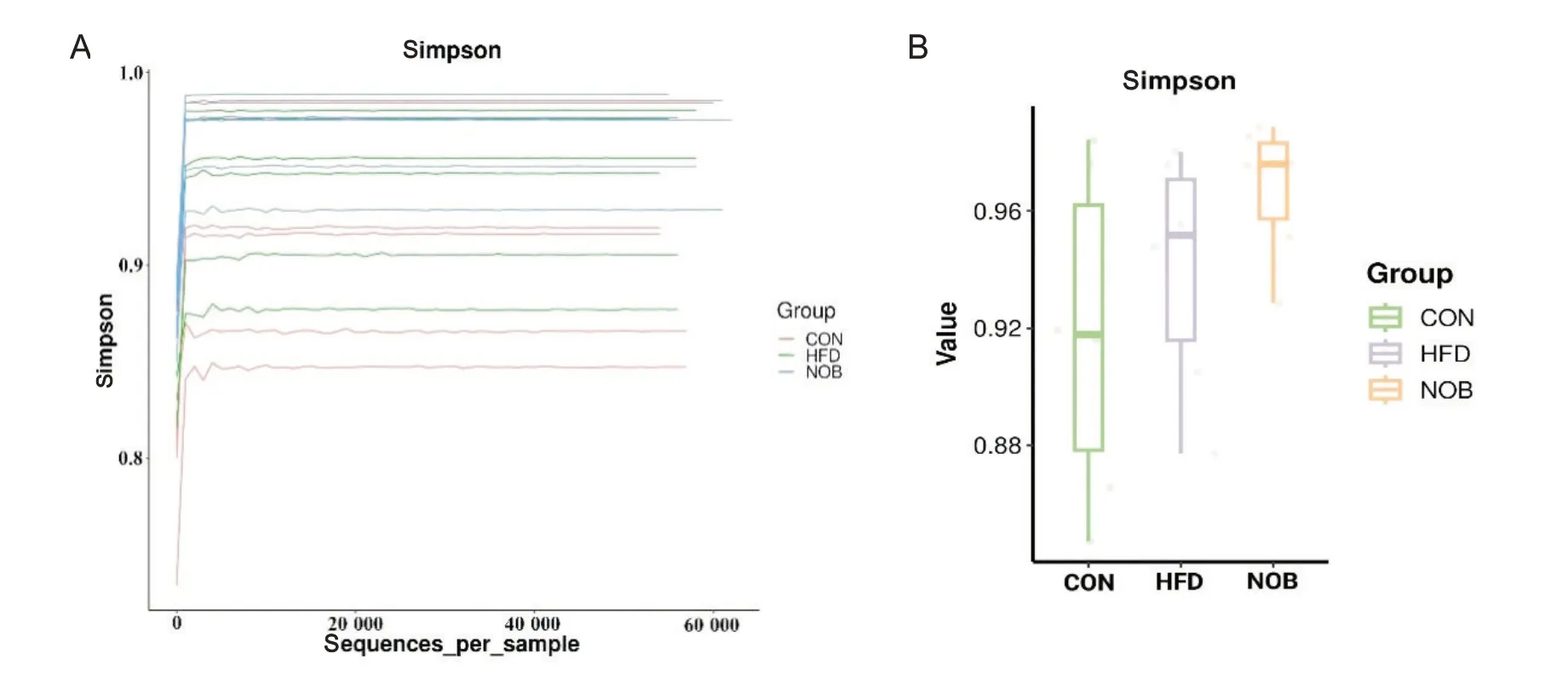
Figure 5. α diversity analysis of gut microbiota in each group. A: rarefaction curve; B: simpson index. CON: control group; HFD:model group; NOB: NOB group. Mean±SD. n=6.图5 各组大鼠肠道菌群α多样性分析
5.3 各组大鼠肠道菌群β 多样性分析 主坐标分析(principal coordinates analysis,PCoA)可观察出不同样品间群落组成的差异和距离。对照组明显区别于模型组和川陈皮素组,模型组与川陈皮素组虽有重合,但也有部分区域分开(图6)。
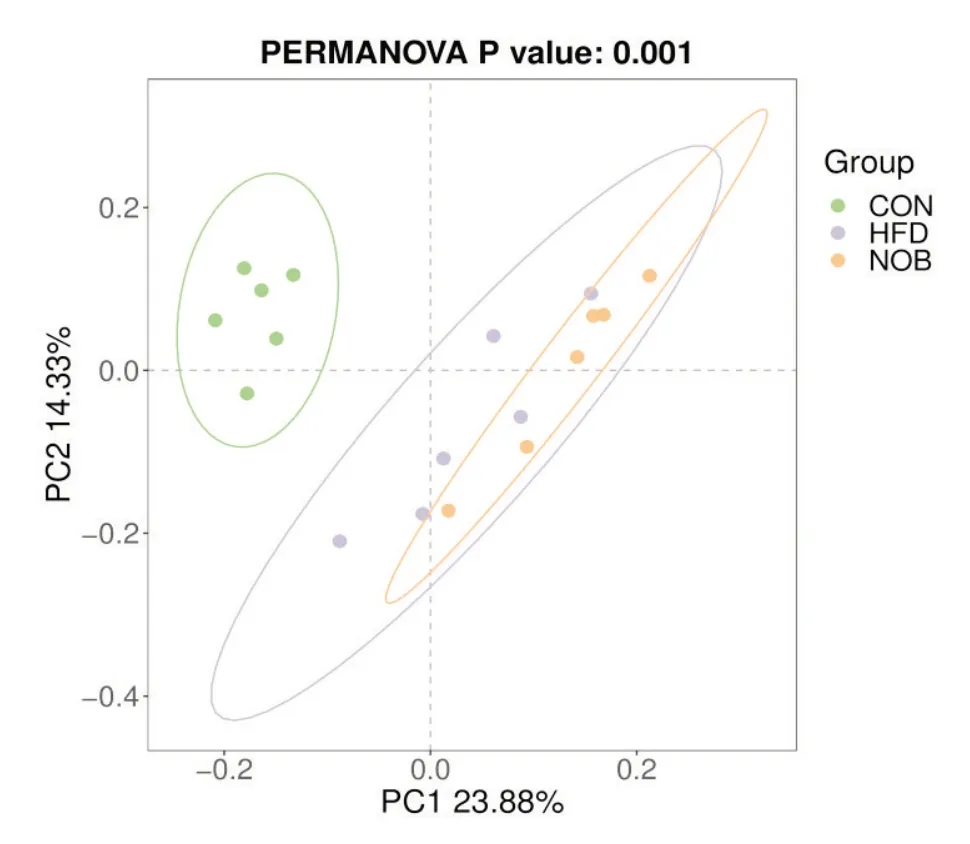
Figure 6. PCoA analysis of gut microbiota in each group. CON:control group; HFD: model group; NOB: NOB group. n=6.图6 各组大鼠肠道菌群PCoA分析
5.4 各组大鼠肠道菌群物种组成及差异分析
5.4.1 门水平物种组成及差异分析 在门水平上,各组大鼠肠道菌群的优势物种主要为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、脱硫杆菌门(Desulfobacterota)、弯曲杆菌门(Campilobacterota)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)和螺旋体菌门(Spirochaetota)等。其中厚壁菌门和拟杆菌门的相对丰度占比95%以上,脱硫杆菌门次之。与对照组比较,模型组厚壁菌门相对丰度显著上升,拟杆菌门显著下降(P<0.05);相对于模型组,川陈皮素组厚壁菌门相对丰度减小,而拟杆菌门增加(P<0.05)(图7)。
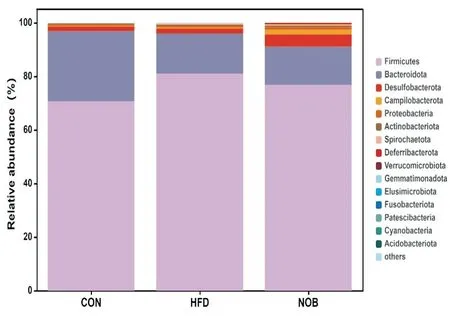
Figure 7. Relative abundance of gut microbiota at the level of phylum. CON: control group; HFD: model group; NOB: NOB group.n=6.图7 门水平物种组成及差异分析
5.4.2 属水平物种组成及差异分析 在属水平上,各组大鼠主要的优势菌种有:瘤胃球菌属(Ruminococcus)、Muribaculaceae属、Lachnospiraceae-NK4A136-group属、拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)、经黏液真杆菌属(Blautia)、罗氏菌属(Roseburia)、大肠杆菌属(Colidextribacter)、Clostridia-UGG-014属、丁酸弧菌属(Butyrivibrio)、粪球菌属(Coprococcus)等。与对照组相比,模型组拟杆菌属、乳杆菌属、经黏液真杆菌属显著下降(P<0.05),大肠杆菌属显著升高(P<0.05)。与模型组比较,川陈皮素组以上菌属均出现回调(图8)。
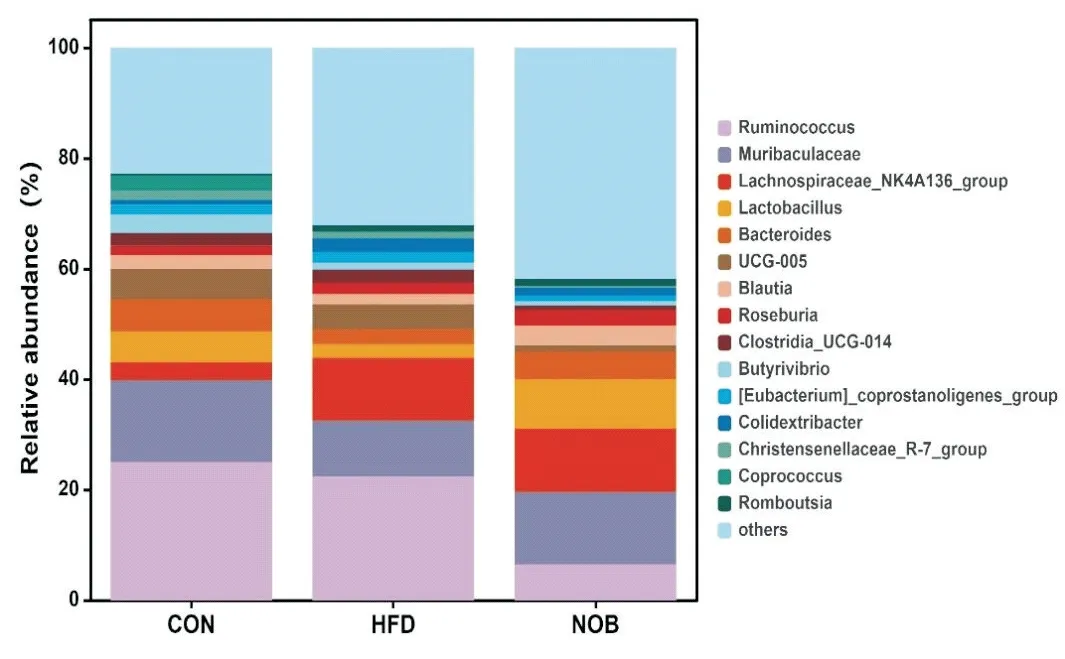
Figure 8. Relative abundance of gut microbiota at the level of genus. CON: control group; HFD: model group; NOB: NOB group. n=6.图8 属水平物种组成及差异分析
5.5 各组大鼠粪便SCFAs 的变化 与对照组相比,模型组中的丙酸和丁酸水平出现下降;与模型组比较,川陈皮素组的丙酸和丁酸出现显著上升(P<0.05),见图9。

Figure 9. Alterations in SCFAs in each group. CON: control group; HFD: model group; NOB: NOB group. Mean±SD. n=6. *P<0.05 vs CON group; #P<0.05, ##P<0.01 vs HFD group.图9 各组大鼠粪便SCFAs的变化
讨 论
肥胖是由于脂肪细胞体积增大和数量增多引起脂肪组织异常或过度的堆积而导致的一种慢性代谢性疾病,对健康造成严重威胁[12,15]。近年来,许多研究结果表明,肠道菌群的结构、功能和多样性的改变在肥胖的发生和进展中起着关键作用[16-17],肥胖者和非肥胖者肠道菌群的结构组成存在着明显差异[18]。本研究主要探讨NOB对单纯性肥胖症大鼠肠道菌群及其产物SCFAs和脂质代谢的影响。
目前对于肥胖症肠道菌群α 多样性分析的结果不完全一致,有研究显示肥胖小鼠肠道菌群α 多样性指数显著下降[19-20],也有研究表明肥胖个体肠道菌群与健康个体无显著差异[21-22]。在本研究中,各组大鼠的α 多样性指数无显著性差异,但在门和属水平上是存在差异的,经过NOB 的干预后又可将紊乱的肠道菌群进行回调。在门水平上,人体肠道菌群中最丰富的两个菌门为厚壁菌门和拟杆菌门。厚壁菌门与拟杆菌门比值变化可作为肥胖诊断的生物标记物[23],肥胖人群其比值增加。本研究中,与对照组相比,模型组厚壁菌门相对丰度显著上升,拟杆菌门显著下降,厚壁菌门与拟杆菌门比值增加,这与孙程远等[12]研究结果一致。经过NOB 的干预后,厚壁菌门丰度显著下降,拟杆菌门显著上升,厚壁菌与拟杆菌比值下降。在属水平上,拟杆菌属是有益菌,参与三羧酸循环产生丙酸[24]。研究表明,拟杆菌属可增强棕色脂肪中的支链氨基酸分解代谢,从而防止肥胖[25]。在正常饮食的情况下补充乳酸杆菌可以降低TC和TG,参与脂质代谢[26]。经黏液真杆菌属则可通过产生细菌素来防止病原体的定植,并通过上调调节性T 细胞和SCFAs 而表现出抗炎特性[27]。在本研究中,与对照组相比,模型组拟杆菌属、乳杆菌属、经黏液真杆菌属显著下降,而大肠杆菌属则出现显著升高。经NOB 干预后,以上菌属均有一定的回调。由此推断,NOB 可能通过提高有益菌、降低有害菌的丰度改善肥胖症大鼠的肠道菌群紊乱。
SCFAs 是肠道菌群的代谢产物,主要由乙酸、丙酸和丁酸组成[28],其中拟杆菌主要产生乙酸和丙酸,而厚壁菌主要产生丁酸[29]。SCFAs 不仅能为菌群提供能量,还可以调控脂质代谢。丙酸可通过多种途径来促进能量消耗和抑制食欲,从而影响肥胖的发生发展[11];丁酸通过激活G 蛋白偶联受体(G proteincoupled receptor, GPR)43 和41 的表达,进而改善肝脏脂肪变性、脂质代谢异常从而延缓肥胖的进程[30]。在本研究中,模型组中的丙酸和丁酸水平显著下降,经NOB 干预后丙酸和丁酸水平显著增加,且血液中TC 和TG 含量以及肝脏的脂肪变性在NOB 干预后得到改善,由此推测NOB 治疗肥胖症的机制可能与回调肠道菌群产物SCFAs的含量,改善脂质代谢有关。
综上所述,经NOB 干预可降低肥胖症大鼠体质量,其发挥抗肥胖的作用可能与调节大鼠肠道菌群的结构和SCFAs 的含量,从而调节脂质代谢紊乱有关,为临床应用提供了实验依据。
