m6A修饰调控酶及其结合蛋白在细胞自噬中作用的研究进展*
2024-03-05陈思琪郭帅杰周明学
陈思琪, 郭帅杰, 周明学
(首都医科大学附属北京中医医院,北京市中医药研究所,北京 100010)
自噬可消除细胞内错误折叠或聚集的蛋白质、清除受损的细胞器以及降解不必要的细胞成分,对于维持细胞功能和新陈代谢十分重要[1]。自噬水平的异常在癌症、心血管、呼吸系统和神经退行性病变等疾病的发病机制中起到重要作用[2]。在过去几十年,对自噬的研究主要集中在自噬的调控机制及自噬基因的生物学功能[3-4]。近年来研究表明,N6-甲基腺苷(N6-methyladenosine, m6A) RNA 甲基化作为真核生物中最普遍和最保守的转录后RNA 修饰,可通过介导多种自噬相关基因的转录和转录后调控,从而影响多种疾病的进展[5]。m6A 修饰过程是动态且可逆的,其调控主要依赖于m6A甲基转移酶、m6A去甲基化酶和m6A 结合蛋白[6]。为此,本综述主要对m6A 修饰调控酶及其结合蛋白调控自噬的研究进展进行文献梳理和总结分析,以期对相关领域研究者提供参考。
1 m6A修饰简介
表观遗传学是研究非核苷酸序列改变的情况下,基因表达可遗传变化的一门遗传学学科。RNA甲基化修饰是转录后水平的表观遗传调控方式的一种,m6A 修饰是其中具有代表性的。m6A 修饰指腺嘌呤碱基(A)的第6 位氮原子发生甲基化,存在于几乎所有类型的RNA 中,是真核生物中最丰富的RNA 甲基化修饰。此外,甲基化修饰可通过影响RNA 的剪接、输出、亚细胞定位、翻译、稳定性和衰变来调节真核转录组[7]。
2 m6A 修饰调控酶及其结合蛋白在细胞自噬中的作用
2.1 m6A 甲基转移酶对自噬的调节作用 甲基转移酶包括甲基转移酶样蛋白3(methyltransferase-like protein 3, METTL3)、METTL14、Wilms 瘤蛋白1 相关蛋 白(Wilms tumor 1-associated protein, WTAP)、KIAA1429 等,主要作用是催化mRNA 上的碱基发生m6A 修饰[6]。METTL3 是具有催化活性的亚基,含有S-腺苷甲硫氨酸(S-adenosylmethionine, SAM)结合结构域,该结构域可将甲基从m6A-甲基化底物转移到腺苷的第6 位氮原子[8]。METTL3 和METTL14 形成稳定的异二聚体复合物,而WTAP 与异二聚体复合物相互作用,确保其位于富含剪接因子的核斑点中并触发催化活性[9]。总之,这些蛋白并不是各自孤立的,而是会形成复合物共同行使催化功能。
2.1.1 METTL3 METTL3作为m6A 甲基转移酶,直接参与调节m6A 水平的改变[10]。在非小细胞肺癌细胞中,METTL3通过促进自噬途径的关键蛋白自噬相关蛋白5(autophagy-related protein 5, ATG5)和ATG7的表达来增强自噬[11]。同样的,在人主动脉平滑肌细胞中,通过慢病毒转染过表达METTL3可增强ATG5和ATG7的蛋白表达,促进自噬体形成,从而抑制细胞的增殖、迁移和从收缩表型向合成表型的转换[12]。但是,在成纤维细胞样滑膜细胞中,随着骨关节炎的进展,由METTL3 介导的m6A 修饰水平上升,ATG7 的表达水平却降低,从而抑制自噬的发生[13]。在小鼠胚胎成纤维细胞中,METTL3的下调减弱了m6A修饰水平,从而抑制了YT521-B同源结构域家族蛋白3(YT521-B homology domain family protein 3,YTHDF3)招募真核起始因子3A(eukaryotic initiation factor 3A, eIF3A)和eIF4B 来促进叉头框蛋白O3(forkhead box protein O3, FOXO3)翻译介导的自噬流[14]。在肺泡上皮细胞中,激活METTL3 介导的NAD 依赖性组蛋白脱乙酰酶sirtuin 1 (Sirt1) mRNA的甲基化,促进了Sirt1 mRNA 的稳定性,降低了Sirt1蛋白表达水平,进而导致自噬通量受损[15]。在非酒精脂肪性肝病小鼠模型中,METTL3介导的m6A 甲基化修饰通过靶向Rubicon(RUN domain beclin-1 interacting and cysteine-rich containing protein) mRNA,调节Rubicon 的蛋白表达水平,从而参与调节肝脏自噬和脂质代谢[16]。在缺氧/复氧诱导的心肌细胞中,METTL3过表达可以催化转录因子EB(transcription factor EB, TFEB) mRNA在3'端的残基处发生m6A修饰,降低了TFEB 的蛋白表达水平,从而抑制自噬通量[17]。综上所述,METTL3 可通过介导m6A 修饰,调节自噬相关蛋白的表达水平,从而影响自噬。
2.1.2 METTL14 METTL14 是m6A 甲基转移酶复合体的另一亚基,含有催化m6A 形成的SAM 结合位点,METTL14 与METTL3 可结合形成异二聚体,从而增强催化m6A 生成的能力[18]。在用人绒毛膜促性腺激素刺激的睾丸间质细胞(Leydig cells, LCs)中,METTL14表达降低引起的m6A 修饰水平下降可影响Mg2+/Mn2+依赖性蛋白磷酸酶1A(protein phosphatase Mg2+/Mn2+dependent 1A, PPM1A)转录本的稳定性和翻译效率,降低钙/钙调素依赖性蛋白激酶激酶2(calcium/calmodulin-dependent protein kinase kinase 2, CAMKK2)的蛋白表达,进而增强自噬水平,促进LCs从睾丸间质干细胞分化为成熟睾丸间质细胞,从而减少睾酮的合成[19]。骨髓间充质干细胞产生新的成骨细胞缺陷是骨质疏松症发展的一个重要病理过程,在骨髓间充质干细胞中,METTL14对破骨细胞分化具有负调控作用,METTL14过表达可通过调节beclin-1 表达从而诱导自噬水平的上升[20]。在口腔鳞状细胞癌细胞中,自噬被激活时,METTL14 表达上调,并影响细胞的增殖、迁移和侵袭能力,其机制可能是通过METTL14 降低eIF4G1 mRNA 稳定性来实现的[21]。上述研究表明,METTL14 介导的m6A 修饰可调控自噬水平,并与疾病进展密切联系。
2.1.3 WTAP WTAP 与METTL3 和METTL14 形成蛋白复合物,其缺失会导致甲基转移酶复合物的RNA 结合能力降低[22]。WTAP 调节自噬的报道还尚少。在肝癌细胞中,WTAP 蛋白表达水平降低可激活自噬,通过降低肝激酶B1(liver kinase B1, LKB1)mRNA 的m6A 修饰水平,导致LKB1 稳定性增加而促进其表达,降低了下游AMPK 的磷酸化水平,从而上调自噬水平并抑制细胞增殖[23]。在人结肠癌细胞中,WTAP 的表达水平升高,其潜在的下游靶点是细丝蛋白A(filamin A, FLNA)。WTAP 通过调节FLNA mRNA 3'端非翻译区的m6A 修饰来抑制FLNA 的表达;沉默WTAP基因对自噬的抑制可被沉默FLNA基因逆转,因而WTAP 通过m6A 依赖性调节FLNA mRNA 的稳定性来阻碍自噬[24]。上述研究表明,WTAP 介导的m6A 修饰主要通过调控自噬上游信号蛋白发挥调节自噬的作用。
m6A 甲基转移酶自噬调节作用及其机制的总结见表1。
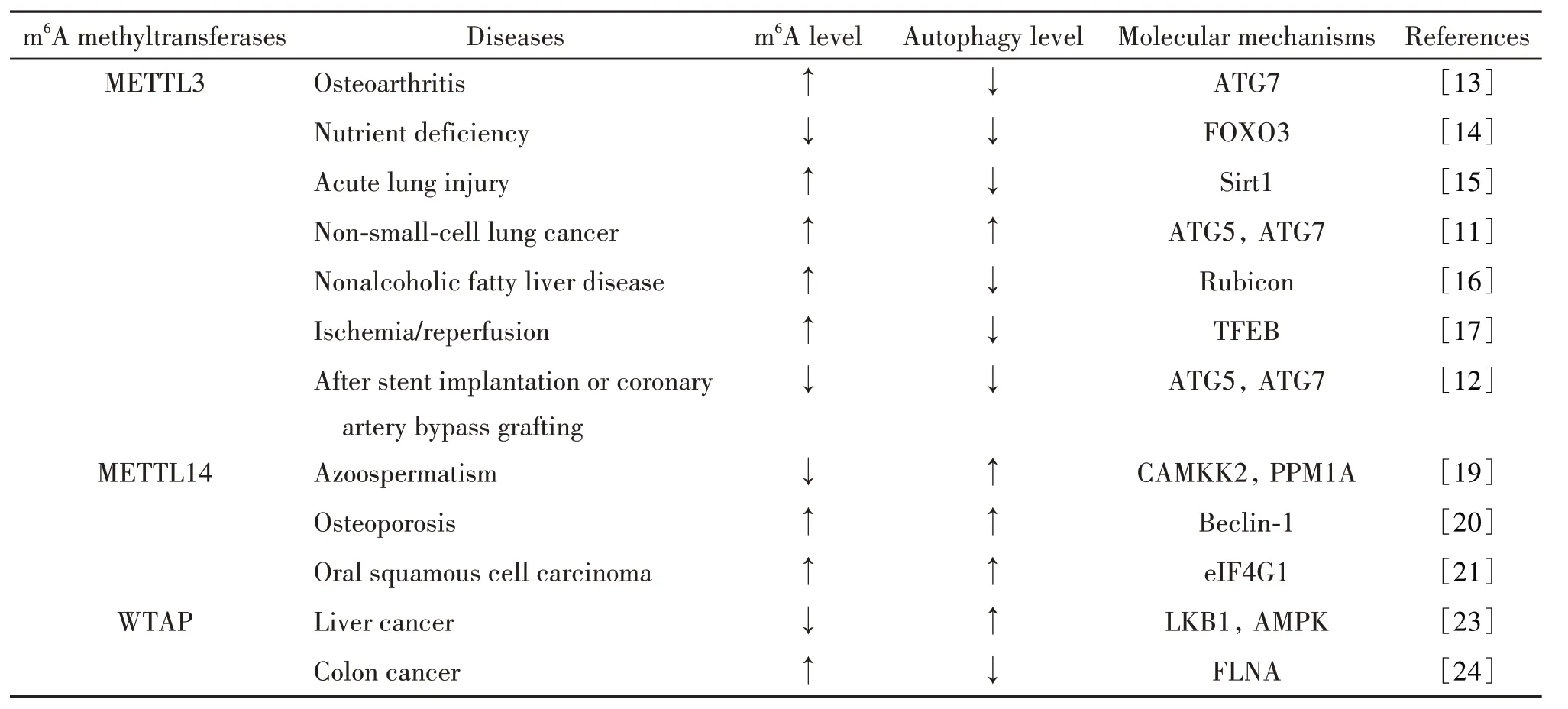
表1 m6A甲基转移酶对自噬的调节作用及其分子机制Table 1. Regulatory effects of m6A methyltransferases on autophagy and their molecular mechanisms
2.2 m6A 去甲基化酶对自噬的调节作用 在真核生物中,m6A 去甲基化酶主要包括脂肪量及肥胖相关蛋白(fat mass and obesity-associated protein, FTO)和ALKB 同源物5(ALKB homolog 5, ALKBH5)等。FTO 和ALKBH5 的主要作用是对已发生m6A 修饰的碱基进行去甲基化,这两种去甲基化酶的发现表明了m6A修饰是一个动态和可逆的过程[25]。
2.2.1 FTO FTO 是首个被证实的m6A 去甲基化酶,是非血红素Fe(Ⅱ)/α-酮戊二酸依赖的ALKB 家族双加氧酶的同源物,可以催化RNA 去甲基化,在转录后发挥功能[26]。FTO 蛋白部分定位于核斑点,核RNA 分子上的m6A 是FTO 的生理底物[27]。FTO 在核心结构域上与ALKB 蛋白家族相似,但是C段独有的长loop结构使得FTO可以对发生甲基化的RNA进行去甲基化修饰[28]。在最近的一项研究中,FTO基因沉默后的脂肪细胞中ATG5 和ATG7 mRNA 的m6A修饰水平上升,从而激活YTHDF2 介导的mRNA 衰变,导致蛋白表达降低,最终抑制了自噬和脂肪生成[29]。而另一项研究显示,在肾透明细胞癌细胞中,抑制FTO基因表达可靶向ATG5 和ATG7 而增强自噬流,其发挥作用的中间环节为FTO 通过m6A-胰岛素样生长因子2 mRNA 结合蛋白2(insulin-like growth factor 2 mRNA-binding protein 2, IGF2BP2)依赖性途径降低了盐诱导激酶2(salt-inducible kinase 2, SIK2)mRNA 的稳定性[30]。在角质细胞中,慢性低水平砷暴露抑制了自噬水平,促进FTO 蛋白的稳定性,从而上调了FTO 的表达水平并降低了m6A 修饰水平,这是诱导恶性转化和肿瘤发生的重要条件[31]。在人髓系白血病细胞中,肿瘤蛋白p53 诱导型核蛋白2(tumor protein p53-inducible nuclear protein 2,TP53INP2)通过FTO 介导的m6A 修饰上调并通过核磷蛋白1(nucleophosmin 1, NPM1)易位到细胞质中,在细胞质内TP53INP2 通过LC3-ATG7 的相互作用增强了自噬活性,并进一步促进白血病细胞的存活[32]。上述研究表明,FTO 作为m6A 去甲基化酶,在疾病中发挥重要作用,并可通过调节自噬相关蛋白发挥调控自噬水平的效应。
2.2.2 ALKBH5 ALKBH5 是ALKB 家族中第二个被发现具有m6A 去甲基化酶活性的成员。ALKBH5定位在细胞核内亚细胞器核小斑,可通过对m6A 去甲基化来调控mRNA 的出核和代谢,且ALKBH5 在精子细胞中表达最多[33]。ALKBH5 对细胞增殖、侵袭、转移等生物过程都有影响[34]。在缺血/再灌注心肌细胞中,ALKBH5过表达可逆转METTL3 抑制自噬的作用,并且ALKBH5 受TFEB 的反向调节,可以与其启动子结合从而激活转录[17]。人绒毛膜促性腺激素刺激的LCs 激活了自噬导致睾酮的合成减少与ALKBH5 的上调有关,并且依赖转录因子CCAAT/增强子结合蛋白ε(CCAAT/enhancer-binding protein epsilon, CEBPE)和TFEB 与其基因启动子的结合而增强[19]。在上皮性卵巢癌中,ALKBH5 的表达上升降低了自噬水平,可能是通过激活mTOR 信号通路和促进Bcl-2 和beclin-1 的相互作用来发挥抑制自噬的功能[35]。在压力诱导的髓核细胞中,ALKBH5 水平的下调导致FAK 家族激酶200 kD 相互作用蛋白(FAK family kinase 200 kD interacting protein, FIP200)mRNA 的甲基化水平上升,从而减弱自噬,最后致使细胞凋亡[36]。上述研究表明,ALKBH5介导的m6A修饰可调控自噬水平的改变,并且TFEB 的转录调节很可能是其中的关键环节。
m6A 去甲基化酶自噬调节作用及其机制的总结见表2。

表2 m6A去甲基化酶对自噬的调控作用及其分子机制Table 2. Regulatory effects of m6A demethylases on autophagy and their molecular mechanisms
2.3 m6A 结合蛋白对自噬的调节作用 m6A 结合蛋白可识别并结合到m6A 位点,结合蛋白的有效识别可以调控mRNA 加工和代谢功能。RNA pull-down实验已经鉴定了多种阅读蛋白,包括YTH 结构域的蛋白、核不均一核糖核蛋白、真核起始因子等。这些结合蛋白的功能主要包括特异性结合m6A 甲基化区域,削弱与RNA 结合蛋白同源结合以及改变RNA 二级结构从而改变蛋白与RNA的互作[37]。
2.3.1 YTHDF1 YTHDF1 可通过与翻译起始因子相互作用和促进核糖体负载从而提高mRNA 的翻译效率作用[37]。YTHDF1 可通过与m6A 修饰的ATG2A和ATG14 mRNA 结 合,促 进ATG2A 和ATG14 的 翻译,从而促进自噬,加重肝细胞癌的进展[38]。在非酒精脂肪性肝病小鼠模型中,虽然METTL3 直接与Rubicon mRNA 结合并介导m6A 修饰,从而抑制自噬的作用,但是YTHDF1 在其中扮演着与Rubicon mRNA相互作用并促进其稳定性关键的作用[16]。在肝纤维化的发生发展中,YTHDF1 通过识别beclin-1 编码区内的m6A 结合位点来促进beclin-1 mRNA 的稳定性,从而激活自噬[39]。并且已有研究指出,双氢青蒿素可以靶向这一途径而缓解肝纤维化[40]。上述研究表明,YTHDF1 可通过调节自噬相关基因的翻译与稳定性来影响自噬水平。
2.3.2 YTHDF2 相较于YTHDF1,YTHDF2 对m6A有更强的结合能力,可以通过识别m6A 使所在的mRNA和非编码RNA降解[41]。在脂肪细胞FTO基因沉默后,具有较高m6A 水平的ATG5 和ATG7 转录物被YTHDF2 捕获,这导致mRNA 降解和蛋白表达减少,从而减少自噬和脂肪生成[29]。抑制谷氨酰胺代谢会导致自噬的激活,减弱了抗肿瘤作用。在一项研究中,抑制结直肠癌细胞谷氨酰胺代谢通过减弱m6A 修饰和YTHDF2 介导的mRNA 衰变来促进转录激活因子4(activating transcription factor 4, ATF4)mRNA 的表达,进而导致ATF4 诱导的自噬增强[42]。上述研究表明,YTHDF2 通过与自噬相关基因的结合并影响mRNA的降解而实现调控自噬的作用。
2.3.3 YTHDF3 YTHDF3 可调节mRNA 的翻译和降解[43]。在饥饿诱导的自噬中,YTHDF3 通过识别FOXO3 mRNA 终止密码子周围的m6A 修饰位点并招募eIF3A 和eIF4B,从而促进FOXO3的蛋白翻译。大量翻译产生的FOXO3 蛋白随后进入细胞核,促进一系列目的基因的转录,从而促进自噬[14]。上述研究表明,YTHDF3 可通过影响自噬相关基因的翻译来调节自噬水平。然而,对YTHDF3 调控自噬的相关研究目前还较少。
2.3.4 YTHDC1 YTHDC1 可促进RNA 的剪切和翻译[44]。在高糖刺激的角质细胞中,YTHDC1 的下调驱动了细胞核中泛素结合蛋白p62 mRNA的降解,从而抑制自噬,导致细胞凋亡增加和愈合能力受损[45]。上皮膜蛋白3(epithelial membrane protein 3,EMP3)是一种肿瘤抑制因子,其下调可能是乳腺癌化疗耐药的原因。在乳腺癌细胞中,EMP3可以阻断Akt-mTOR 信号激活从而诱导自噬,同时EMP3 还可下调YTHDC1 的表达[46]。上述研究表明,YTHDC1可能具有影响自噬水平的作用,但目前还尚未有研究证明其可直接与自噬相关基因结合并发挥调节作用。
m6A 结合蛋白自噬调节作用及其机制的总结见表3。
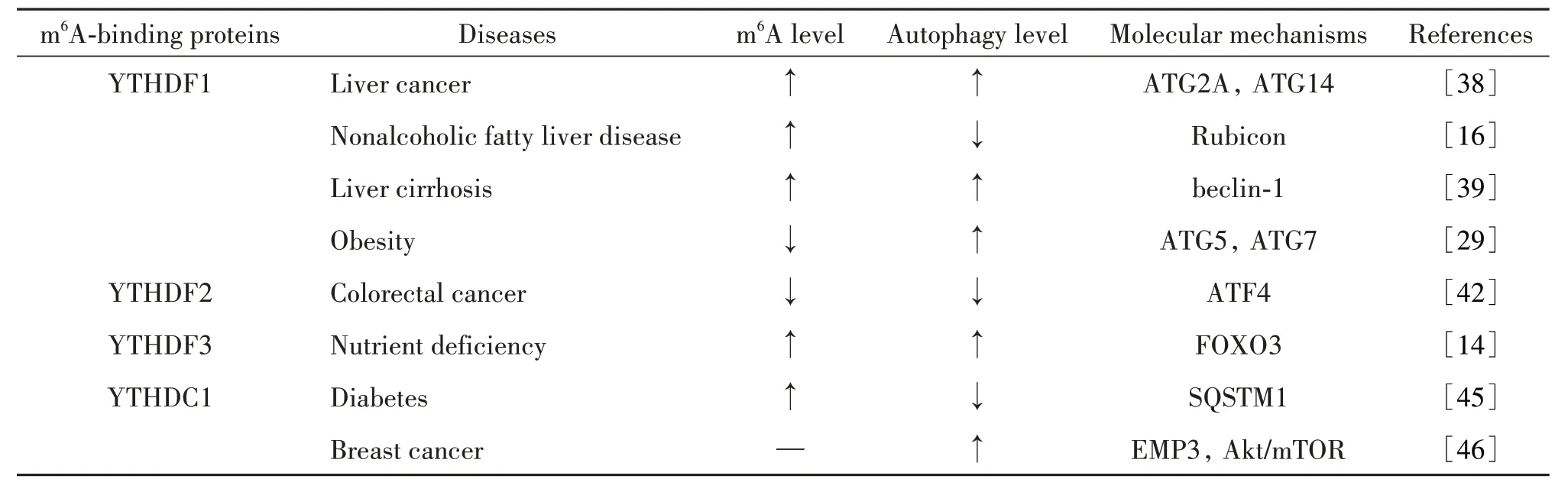
表3 m6A结合蛋白对自噬的调控作用及其分子机制Table 3. Regulatory effects of m6A-binding proteins on autophagy and their molecular mechanisms
3 总结与展望
自噬和m6A 修饰水平的改变会干预细胞的生命活动,改变人类疾病的发生发展,对疾病的诊断和治疗有着重要的意义。随着研究的深入,m6A 修饰与自噬之间的相互作用逐渐引起关注。m6A 修饰调控酶主要靶向调节自噬基因的m6A 修饰从而影响自噬水平(图1)。
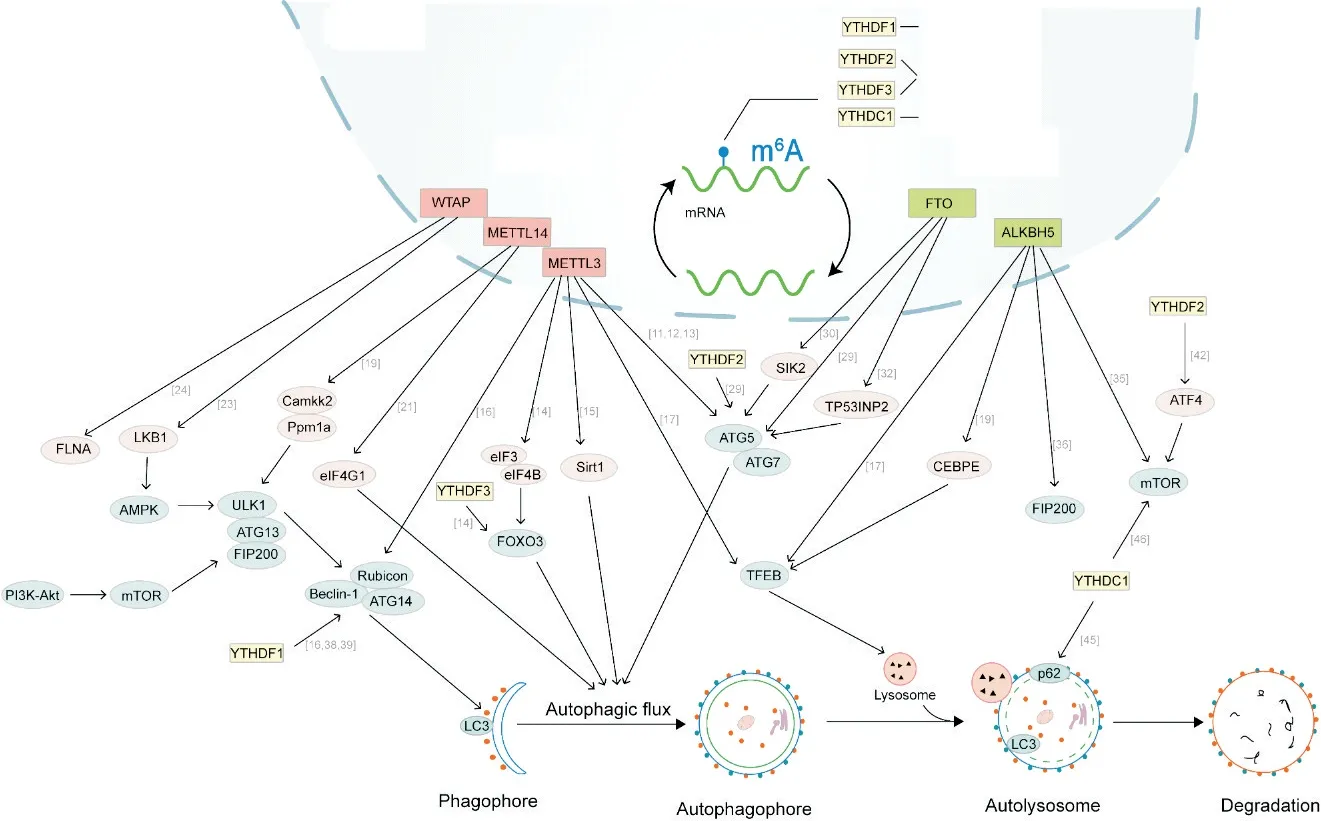
Figure 1. Regulatory effects of m6A modification regulatory enzymes and their binding proteins on autophagy. The red squares are m6A methyltransferases, the green squares are m6A demethylases, the yellow squares are m6A-reading proteins, the blue ellipse are autophagy-related genes, and the pink ellipses are autophagy gene upstream regulatory proteins.图1 m6A修饰调控酶及其结合蛋白在自噬中的调控作用
但是,m6A 修饰与自噬之间明确的调控关系还有待讨论。一方面是m6A 修饰水平与自噬水平在既往的研究中尚存争议。如同样是通过影响ATG5 和ATG7甲基化水平介导的自噬水平改变中,一项研究表明沉默FTO介导的m6A 修饰水平升高会导致ATG5 和ATG7 的表达降低进而抑制自噬,而另一项研究则指出敲减FTO后m6A 修饰水平降低导致ATG5 和ATG7 的表达升高而增强自噬。另一方面,m6A 修饰调控酶调节自噬的具体机制同样存在争议,比如METTL3 的上调在骨关节炎、急性肺损伤、脂肪肝和心梗等疾病中可以下调自噬水平,而在肺癌中,这种关系却是相反的。因此,探明m6A 修饰调控酶与自噬之间的调节机制是十分必要的。此外,m6A 甲基化酶KIAA1429 与自噬之间的关系仍是空白。去甲基化酶只报道了FTO 和ALKBH5,仍有更多m6A 去甲基化酶待发现从而补充完善m6A 修饰调控过程。m6A 结合蛋白的研究对于揭示m6A 的生物功能具有不可或缺的作用,然而目前通过结合蛋白与自噬的调控还比较局限于YTH 结构域的蛋白,期待将来能有更为多元的研究。
综上所述,众多的证据证明了m6A 修饰对调节自噬具有重要作用,m6A 修饰对自噬的促进或抑制水平主要取决于甲基转移酶和去甲基化酶所动态调节的m6A 水平,而对靶标基因m6A 修饰和功能的影响,很大一部分还需要甲基化结合蛋白的参与才能完成。尽管目前研究人员在这一方面做出了可喜的进展,但是它仍然是一个新兴的领域。m6A 修饰调控自噬的确切、具体、可控的分子机制亟待挖掘。
