温胃阳汤对功能性消化不良大鼠肥大细胞活化及SCF/c-Kit信号通路的影响*
2024-03-05税典奎黎舒婷黄慧花龙海华罗诗雨覃凌娜
税典奎, 黎舒婷, 黄慧花, 龙海华, 杨 健, 罗诗雨, 覃凌娜
[1柳州市中医医院(柳州市壮医医院),广西 柳州 545001;2柳州市柳铁中心医院,广西 柳州 545007]
功能性消化不良(functional dyspepsia, FD)是临床中常见的功能性胃肠病,严重影响人类工作和生活。目前,FD 的发病机制尚未明确,胃肠动力障碍被认为是基本的病理机制之一,十二指肠异常是对FD发病机制的新认识[1-2]。肥大细胞(mast cell, MC)是机体重要的免疫细胞,可有效调节胃肠神经,MC活性因子可引起胃肠动力障碍及感觉异常。以往研究表明,干细胞因子(stem cell factor, SCF)/受体酪氨酸激酶c-Kit 通路是缓解FD 的有效途径[3]。本课题组一直致力于FD 的发病机制和中医药治疗策略研究,曾研制出的温胃阳汤(Wenweiyang decoction,WWYD)被证明对胃动力低下大鼠具有良好的促胃动力作用[4],然而目前基于该方剂治疗FD 的作用机制尚未明了。本研究将探讨WWYD 对FD 大鼠十二指肠黏膜下肥大细胞及SCF/c-Kit 信号通路的影响,进一步揭示该方改善FD大鼠胃肠动力的作用机制。
材 料 和 方 法
1 实验材料
1.1 动物 5周龄SPF级SD雄性大鼠60只,体质量(206.9±5.8) g,购自长沙市天勤生物技术有限公司,动物生产许可证号为SCXK(湘)2019-0014。大鼠在标准实验室条件[恒温(20~26)℃、12 h 明暗交替]下饲养7 d,所有动物均自由进食水。实验严格遵循柳州市中医医院(柳州市壮医医院)实验动物伦理审查标准,审批号为2020JAN-KY-YN-003-01。
1.2 药物 WWYD 组成:桂枝12 g、红参12 g、法半夏9 g、炮姜10 g、砂仁6 g、茯苓20 g、紫苏梗10 g、厚朴15 g、草豆蔻6 g、益智仁15 g,药材为颗粒剂,用纯净水配成所需浓度的混悬液。盐酸雷尼替丁胶囊ranitidine hydrochloride capsule, RHC)购自广东恒健制药公司(批号H44021173)。
1.3 主要试剂 ELISA 试剂盒(武汉贝茵莱生物科技有限公司);兔抗GAPDH 抗体(江苏凯基生物技术股份有限公司,KGAA002);兔抗c-Kit 抗体(Abclonal,A0357);兔抗SCF 抗体(武汉三鹰生物技术有限公司,26582-1-AP);Western blot 检测试剂盒(江苏凯基生物技术股份有限公司,KGP1201);Trizol(Invitrogen,15596-026);cDNA 第一链合成试剂盒(TaKa-Ra,RR036B)。
2 主要方法
2.1 动物分组及给药 将所有大鼠随机分为6 组,即空白(control)组、模型(model)组、阳性对照RHC组、低剂量WWYD(low-dose WWYD, WWYD-L)组、中剂量WWYD(medium-dose WWYD, WWYD-M)组和高剂量WWYD(high-dose WWYD, WWYD-H)组,每组10 只。除control 组外,其余各组大鼠采用夹尾刺激加不规则喂养复合番泻叶建立FD 模型[5]:不规则饮食法,单日进食,双日禁食不禁水,普通饲料喂养;用蝴蝶夹夹住大鼠尾巴后1/3,每日夹2 次,一次30 min;同时每日灌胃番泻叶,10 mL/kg,连续灌胃7 d 进行造模。control 组和model 组大鼠灌胃生理盐水,WWYD-L、WWYD-M、WWYD-H 和RHC 组大鼠则分别用WWYD(0.743 g/mL、1.485 g/mL、2.970 g/mL)及盐酸雷尼替丁胶囊(3 g/L)灌胃,灌胃量均为10 mL/kg。各组大鼠每日定时灌胃,连续7 d。
2.2 标本采集 十二指肠组织分离肠系膜,剪去组织周边多余脂肪,将幽门至回盲部的肠管取出,轻拉成直线,置于白纸上,拍照记录。十二指肠组织纵剪剖开,清洗干净,一半组织放入-80 ℃保存,一半组织用4%甲醛溶液固定,石蜡包埋。
2.3 小肠推进实验 造模给药结束后,将大鼠断食不断水24 h,每只灌胃3 g 营养糊,30 min 后处死,打开腹腔,剪取整个小肠,分离肠系膜,将幽门至回盲部的肠管取出,轻拉成直线,置于白纸上,此长度即为小肠总长度,幽门到碳墨前端的长度为碳墨在小肠内前行的距离。小肠推进率(%)=碳墨在小肠推进的距离/小肠总长度×100%。
2.4 甲苯胺蓝染色观察FD 大鼠MC 及MC 脱颗粒数目 取十二指肠组织切片,常规脱蜡,放入0.5%甲苯胺蓝溶液中,95%乙醇分化,无水乙醇脱水,二甲苯透明,中性树胶封片。光学显微镜下观察组织切片中MC形态并计数。在100倍视野下采集3个视野,进行肥大细胞计数。
2.5 ELISA 测定肥大细胞类胰蛋白酶(mast cell tryptase, MCT)和组胺(histamine, HA)的含量 腹主动脉采血法取血,取离心后上清液,采用ELISA 试剂盒检测MCT 和HA 含量,读取各孔的吸光度(A)值,以此计算样本浓度。
2.6 RT-qPCR 检测SCF 和c-Kit mRNA 表达 提取十二指肠组织中总RNA,按试剂盒步骤逆转录成cDNA,引物序列见表1。反应条件:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火20 s,40 个循环;监测熔解曲线。记录样本扩增反应的Ct 值,采用2-ΔΔCt法分析mRNA的相对表达水平。
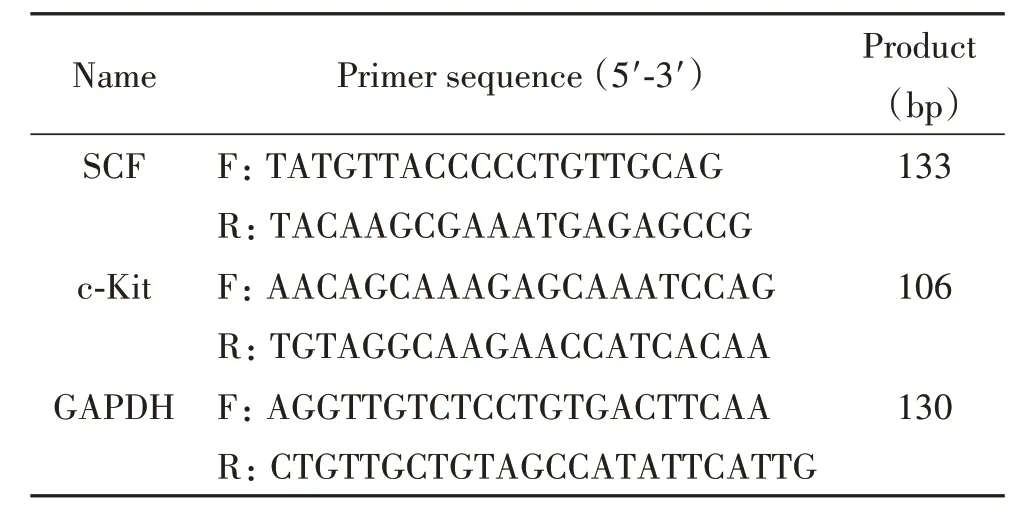
表1 RT-qPCR引物序列Table 1. The sequences of the primers for RT-qPCR
2.7 Western blot 检测SCF 和c-Kit 蛋白表达 取适量十二指肠组织,提取蛋白,采用BCA法检测蛋白浓度。常规制SDS-PAGE 分离胶和5%浓缩胶,上样、电泳,湿法电转将蛋白转移至NC 膜上,5%的脱脂奶粉室温封闭2 h,加入SCF(1∶500)、c-Kit(1∶1 000)和GAPDH(1∶5 000)抗体,4 ℃摇床孵育过夜。取出后,TBST 洗10 min×3 次,室温摇床孵育相应Ⅱ抗(1∶1 000)2 h,洗膜。显色后,使用Gel-Pro32 软件对结果进行分析。
2.8 免疫组化法观察SCF 和c-Kit 蛋白表达 按常规方法进行脱蜡、水合、抗原修复、灭活酶、封闭、滴加Ⅰ抗50~100 μL,4 ℃过夜。PBS 浸洗3 min×3 次,滴加羊抗鼠聚合物50 μL,室温湿盒孵育20 min。PBS 浸洗3 min×3 次,DAB 显色,苏木素染液复染、脱水封片,数字病理切片扫描仪扫片观察SCF 和c-Kit蛋白表达位置。结果判断:显微镜下胞质出现棕黄色片状或颗粒状物为阳性。
3 统计学处理
采用SPSS 26.0 统计软件进行分析。数据均用均数±标准差(mean±SD)表示。多组间比较采用单因素方差分析;如样本资料不符合方差分析的条件,则采用完全随机设计的秩和检验(Kruskal-Wallis 检验)。相关性比较采用Pearson 相关性分析。以P<0.05为差异有统计学意义。
结 果
1 WWYD对大鼠小肠推进率的影响
与control 组比较,model 组大鼠的小肠推进率显著下降(P<0.01);与model 组相比,WWYD-L 组、WWYD-M 组、WWYD-H 组和RHC 组大鼠的小肠推进率均显著提高(P<0.05),见图1。
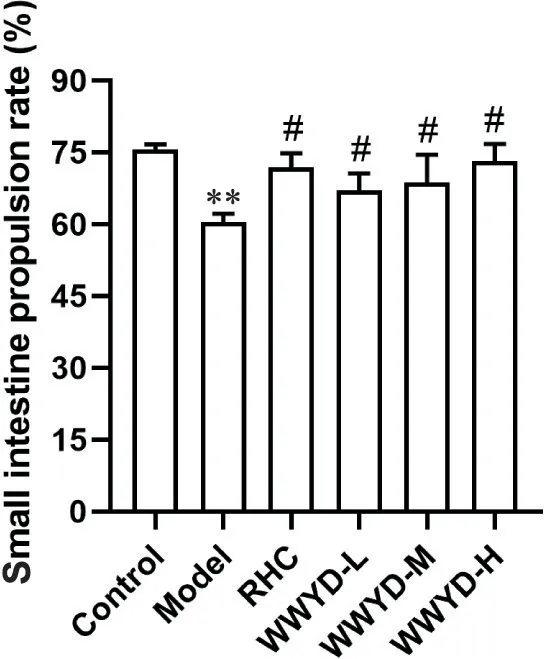
Figure 1. Effect of Wenweiyang decoction (WWYD) on small intestine propulsion rate in rats. RHC: ranitidine hydrochloride capsule. Mean±SD. n=10. **P<0.01 vs control group; #P<0.05 vs model group.图1 温胃阳汤对大鼠的小肠推进率的影响
2 WWYD 对大鼠十二指肠黏膜组织肥大细胞数量及MCT和HA含量的影响
与control 组比较,model 组大鼠十二指肠组织中MC 数量显著增加(P<0.05),MCT 和HA 含量显著升高(P<0.01);与model 组比较,WWYD-L 组、WWYDM 组和WWYD-H 组大鼠十二指肠组织中MC 数量显著减少(P<0.05 或P<0.01),MCT 和HA 含量均显著下调(P<0.05),见图2。

Figure 2. Effects of Wenweiyang decoction (WWYD) on mast cell counts and mast cell tryptase (MCT) and histamine (HA) content in rat duodenal mucosa tissues. A: morphological manifestations of mast cells (toluidine blue staining, scale bar=100 μm)and total number of mast cells; B: MCT content; C: HA content. RHC: ranitidine hydrochloride capsule. Mean±SD. n=10. *P<0.05, **P<0.01 vs control group; #P<0.05, ##P<0.01 vs model group.图2 温胃阳汤对大鼠十二指肠黏膜组织肥大细胞数量及肥大细胞类胰蛋白酶和组胺含量的影响
3 WWYD 对大鼠十二指肠SCF 和c-Kit mRNA 水平的影响
与control 组相比,model 组大鼠十二指肠组织SCF 和c-Kit 的mRNA 表达水平显著降低(P<0.01);与model 组相比,WWYD-M 组、WWYD-H 组和RHC组大鼠十二指肠组织c-Kit和SCF的mRNA 表达水平均显著升高(P<0.01),见图3。

Figure 3. Effects of Wenweiyang decoction(WWYD) on the mRNA expression of SCF(A) and c-Kit (B) in rat duodenum. RHC:ranitidine hydrochloride capsule. Mean±SD. n=10. **P<0.01 vs control group; ##P<0.01 vs model group.图3 温胃阳汤对大鼠十二指肠SCF和c-Kit mRNA表达的影响
4 WWYD 对大鼠十二指肠SCF 和c-Kit 蛋白水平的影响
与control 组比较,model 组大鼠十二指肠组织中c-Kit 和SCF 蛋白表达水平均显著下降(P<0.01);与model 组比较,WWYD-M 组、WWYD-H 组及RHC 组大鼠十二指肠组织c-Kit和SCF蛋白表达水平均显著升高(P<0.05 或P<0.01),WWYD-L 组c-Kit 和SCF蛋白表达升高,但差异不显著(P>0.05),见图4。
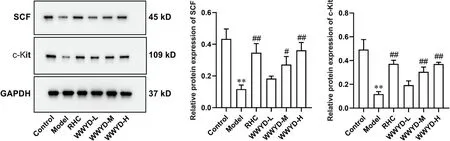
Figure 4. Effects of Wenweiyang decoction(WWYD) on the protein expression of SCF and c-Kit in rat duodenum. RHC: ranitidine hydrochloride capsule. Mean±SD. n=10. **P<0.01 vs control group; #P<0.05, ##P<0.01 vs model group.图4 温胃阳汤对大鼠十二指肠SCF和c-Kit蛋白表达的影响
5 WWYD 对大鼠十二指肠SCF 和c-Kit 阳性细胞数的影响
免疫组化染色结果显示,model组大鼠十二指肠组织中SCF和c-Kit阳性细胞数较control组显著减少[(69±13)vs(101±9)/5 个 高 倍 镜 视 野,(64±8)vs(97±11)/5个高倍镜视野,P<0.05],WWYD-H组SCF和c-Kit 阳性细胞数较model 组显著增加[(91±12)vs(69±13)/5 个高倍镜视野,(80±13)vs(64±8)/5 个高倍镜视野,P<0.05],见图5。
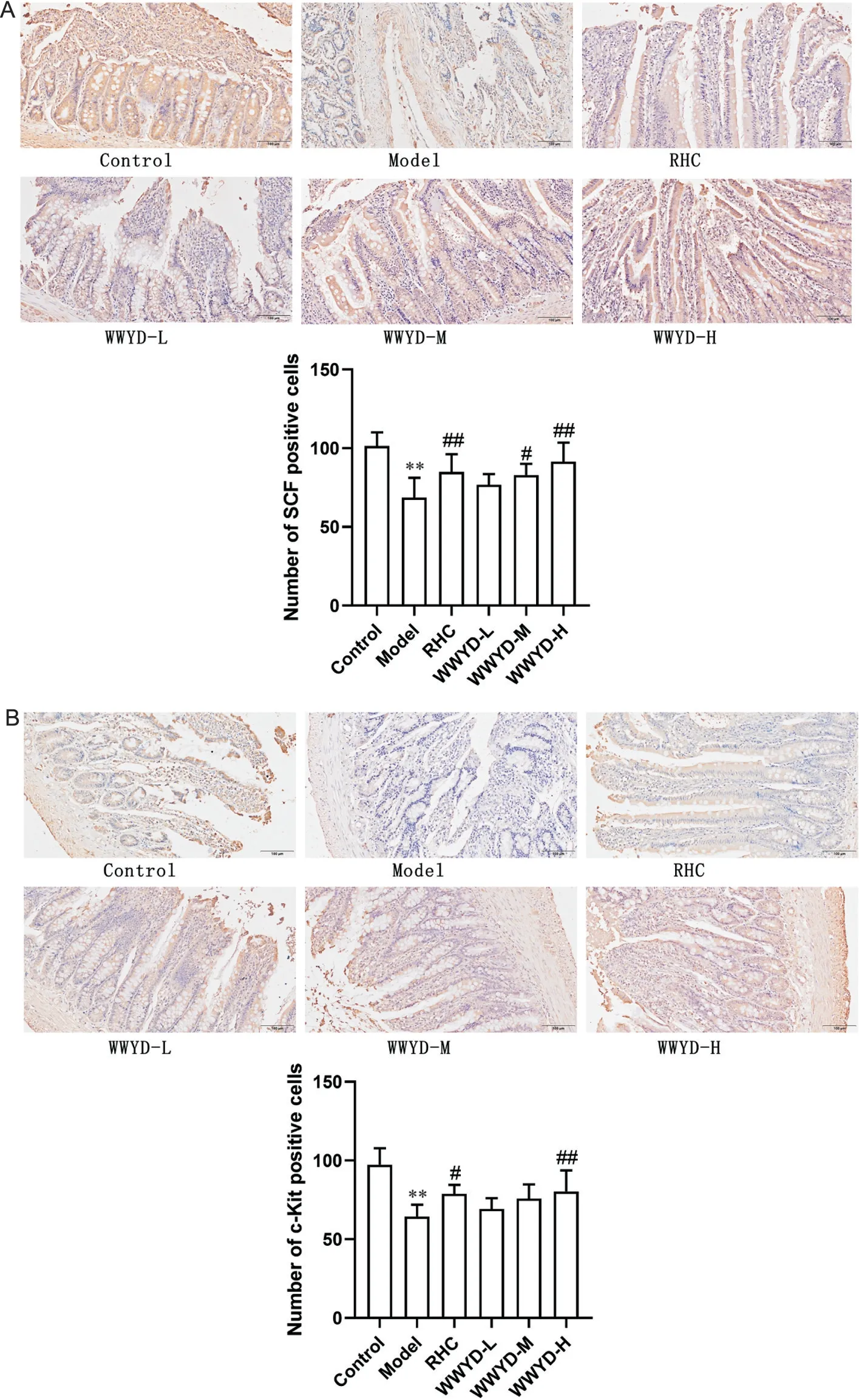
Figure 5. Effects of Wenweiyang decoction (WWYD) on the numbers of SCF (A) and c-Kit (B) positive cells in rat duodenum (immunohistochemical staining, scale bar=100 μm). RHC: ranitidine hydrochloride capsule. Mean±SD. n=10. **P<0.01 vs control group; #P<0.05, ##P<0.01 vs model group.图5 温胃阳汤对大鼠十二指肠SCF和c-Kit蛋白阳性表达细胞数量的影响
6 相关性分析
小肠推进率分别与MCT 和HA 含量呈负相关,与SCF 和c-Kit 的表达呈正相关(r值分别为-0.482、-0.450、0.750 和0.742,P<0.05);SCF 和c-Kit 与MCT和HA不存在相关关系(P>0.05)。
讨 论
FD 症状反复、病情迁延难愈,久病易伤阳。本实验采用夹尾刺激加不规则喂养复合番泻叶法建立大鼠FD 模型,其中夹尾刺激加不规则喂养是经典的FD造模方法[6],《脾胃论·饮食劳倦所伤始为热中论》云:“苦寒之药损其脾胃”,番泻叶性味苦寒,苦寒泻下伤脾阳引起脾胃虚寒。WWYD 集温阳、益气、化湿、祛痰、理气多法于一方,可使中焦脾胃和小肠得以温运,脾胃纳运复常,肠气通畅,诸病证自除。
SCF 又称MC 生长因子,是c-Kit 的配体。c-Kit作为肥大细胞标志性蛋白,参与细胞内信号转导,当c-Kit与SCF 结合时,可被迅速磷酸化,激活下游一系列信号分子,这些信号分子调节MC 的增殖、生长和活化[7]。在十二指肠部位,肥大细胞作为免疫炎症细胞,SCF 促进肠道MC 增生,MC 活化可释放多种介质,如组胺、5-羟色胺和类胰蛋白酶等,引起胃、十二指肠的炎症反应[8-9]。治疗FD 的有效方法包括质子泵抑制剂、H2 受体拮抗剂和促胃肠动力药等,本实验选用雷尼替丁作为阳性对照药,其作为组胺H2 受体拮抗剂,能够直接作用于MC,从而抑制组胺等所致组胺效应,缓解炎症反应。有实验显示通过下调MC 表面受体c-Kit 及其配体SCF 水平使MC 脱颗粒减少,从而抑制HA释放[10]。
SCF/c-Kit 通路可以通过调控Cajal 间质细胞、MC 内相关因子的数量及结构治疗FD[3],SCF 和c-Kit的低表达可能导致Cajal 间质细胞缺失并参与胃肠运动障碍[11]。MC 已被证实参与FD 发病过程,然而经SCF/c-Kit 通路调控MC 治疗FD 的调控机制尚不明确。本研究显示,经高剂量WWYD 给药后,十二指肠组织中SCF 和c-Kit 的阳性细胞数目显著升高,相应的mRNA 水平升高,MCT 和HA 表达显著降低,并且小肠推进率与SCF 和c-Kit 的表达呈正相关,可见WWYD 通过调节FD 大鼠十二指肠SCF、c-Kit 及其受体表达,激活SCF/c-Kit 信号通路,同时抑制MCT和HA的生成,从而恢复大鼠十二指肠动力。
既往关于FD 的研究主要集中于胃的结构功能异常,包括动力障碍、敏感性增高及顺应性下降等,前期研究证明WWYD 在治疗FD 中促胃动力作用显著[12]。最近的研究表明,十二指肠因素(如酸、胆盐、微生物群以及肥大细胞活化)可能与胃肠感觉运动功能障碍有关[8,13],本研究结果显示,给予FD 模型大鼠WWYD 治疗后,大鼠的小肠推进率显著提高,进一步证实WWYD 具有促进大鼠十二指肠动力的作用。十二指肠黏膜伴有轻微的嗜酸性粒细胞和肥大细胞浸润及脱颗粒增加[13-14],十二指肠病理学的识别有望成为治疗FD 新的生物标志物和治疗靶点。本实验初步完成MC 计数以及MCT 和HA 的自发释放水平检测,今后的研究将检测MC 释放炎症因子,如白细胞介素10(interleukin-10, IL-10)、IL-1β、IL-6 等的水平,进一步揭示WWYD 改善十二指肠微炎症的作用机制。
综上所述,本研究首次证实WWYD 能够激活SCF/c-Kit信号通路,抑制肥大细胞活化,促进大鼠十二指肠动力,为FD等相关胃肠动力疾病提供了参考。本实验表明,小肠推进率与MCT 和HA 含量呈负相关,说明肥大细胞活化过程参与大鼠十二指肠运动,而SCF 和c-Kit 与MCT 和HA 不存在相关关系,提示FD大鼠中十二指肠肥大细胞活化可能与其他通路相互影响发挥促十二指肠动力作用,还需进一步研究。
