异叶天南星的化学成分研究
2024-03-04宋孟霜栗嘉琪李虹霞
宋孟霜,张 希,栗嘉琪,李虹霞,许 枬
(辽宁中医药大学药学院•辽宁 大连•116600)
天南星具有燥湿化痰、祛风止痉的作用,用药历史二千余年[1]。现代研究发现,其有良好的抗肿瘤、抗惊厥、抗心律失常、镇静止痛、抗菌、抗炎等活性[2]。除可治疗中风和外伤疼痛外,对肺癌、面神经麻痹也颇有疗效[3,4]。而且,天南星还被用于农业杀虫、杀螺[5]。活性筛查表明,其黄酮碳苷具有杀线虫作用,生物碱类、苯丙素类成分具有对人类白细胞的细胞毒作用,还有一些成分具有抗肿瘤、抗炎作用[5]。正品天南星原植物虽有3 种基源,但因自然分布面积小,对生长环境要求较高,因此天南星的野生资源一直比较稀缺,尤其是异叶天南星,其相关研究报道极少[6]。因市场需求的不断增加,一些科研人员开展了天南星的人工种植研究工作,目前已经取得成功,极大地缓解了天南星的资源问题。为了更好地揭示天南星的活性与成分关系,以及不同品种天南星的成分差异,为临床用药提供依据,本研究对异叶天南星(Arisaema.heterophyllum Blume.)块茎抗炎活性部位的化学成分进行研究,从中分离得到18 个成分,化合物1 为新化合物,化合物1,2,4,9~15 从该种植物中首次分离。
1 仪器与材料
AVANCE 600 超导核磁共振仪(德国布鲁克公司);6550iFunnel Q-TOF LC/MS 质谱仪(美国安捷伦公司);高效液相制备色谱仪(艾杰尔公司);硅胶柱色层析用硅胶(青岛海洋化工有限公司);Sephadex LH-20 凝胶(瑞士法玛西亚公司);MCI CHP-20 树脂(日本三菱公司);半制备柱(ODS,5μm,20×250 nm,艾杰尔公司);TLC 薄层板(德国默克公司);分析纯试剂(天津科密欧试剂有限公司);色谱甲醇(美国天地公司);液相用水(杭州娃哈哈集团有限公司);氘代试剂(北京恒思公司);天南星采自贵州省贵定县,经辽宁中医药大学赵蓉副教授鉴定为异叶天南星(Arisaema.heterophyllum Blume.)的块茎,标本保存于辽宁中医药大学中药化学教研室(编号:20201112)。
2 提取与分离
2.1 活性部位的制备
取异叶天南星块茎4 kg,研碎,加80%乙醇渗漉3 天。提取液经减压回收得稠膏物,加水混悬,用氯仿萃取,得氯仿萃取物54.6 g,剩余水层经大孔吸附树脂柱分离,依次用10%、30%、50%、70%、100%乙醇洗脱,分别得到10%乙醇洗脱部位162.3 g,30%乙醇洗脱部位30.5 g,50%乙醇洗脱部位52.4 g,70%乙醇洗脱部位44.7 g,100%乙醇洗脱部位173.6 g。将上述不同部位样品分别配制成50μg•mL-1、100 μg•mL-1的溶液,加入预先用1μg•mL-1LPS 刺激的5×104个/孔RAW264.7 细胞的48 孔板中,置于二氧化碳培养箱37 °C 恒温培养24 h。平行设置空白对照组、阳性对照组(槲皮素),每组3 个复孔。24 h 后采用CCK-8 法与ELISA 法,考察被测样品对细胞的毒性及抗炎活性。结果表明,大孔吸附树脂的30%、50%洗脱部分均能抑制LPS 刺激后RAW264.7 细胞的IL-6 与TNF-α的分泌,且无明显细胞毒性。由此确定大孔吸附树脂的30%、50%洗脱部分为抗炎活性部位。
2.2 化学成分分离
将上述大孔吸附树脂30%与50%乙醇洗脱物合并,取其中80 g,分次用Sephadex LH-20 色谱柱纯化(30×300 nm,甲醇洗脱),每100 mL 收集一瓶,洗脱液浓缩后用FeCl3显色检查,合并FeCl3显色部分(25.1 g)与FeCl3不显色部分(52.8 g)。上述FeCl3不显色部分(50 g)经硅胶柱分离,以环己烷-乙酸乙酯(100∶0,80∶1,50∶1,10∶1,2∶1)→甲醇梯度洗脱,得6 个流分(Fr.I~Fr.VI)。其中Fr.III(6.2 g)经硅胶柱色谱分离,以正己烷-乙酸乙酯(48∶1)洗脱,经硅胶薄层检识,合并相同斑点洗脱液,再经Sephadex LH-20 凝胶柱色谱纯化(以氯仿-甲醇洗脱,体积比1∶1),得化合物1(9.2 mg)、2(6.4 mg)。Fr.VI(5.4 g)以SephadexLH-20纯化(甲醇洗脱),得化合物17(53.1 mg)、化合物18(185.7 mg);剩余物经硅胶柱分离,以二氯甲烷-甲醇梯度洗脱(20∶1→0∶1),得化合物16(22.8 mg)。取FeCl3显色部分24 g,经MCI 色谱柱纯化,以10%甲醇→100%甲醇梯度洗脱,得到6 个组分(Fr.1~Fr.6)。Fr.5(4.4 g)经硅胶柱色谱分离,以二氯甲烷-丙酮梯度洗脱(体积比60∶120∶1),得到5 个组分(Fr.5-1~Fr.5-5)。其中,Fr.5-4 经MCI 吸附树脂柱纯化,以30%甲醇→80%甲醇梯度洗脱,收集70%甲醇洗脱部分,再用反相半制备色谱分离,以78%甲醇-水为流动相,得化合物3(7.7 mg)。Fr.2(3.6 g)经反相半制备色谱分离,以25%乙腈-0.1%甲酸水为流动相(流速3.0 mL•min-1),得化合物4(6.6 mg)、化合物5(5.7 mg)、化合物6(6.2 mg)。Fr.3(6.7 g)经反相半制备色谱分离,以32%乙腈-0.1%甲酸水为流动相(流速3.0 mL•min-1),得化合物7(8.6 mg)、化合物10(6.2 mg)、化合物11(11.2 mg)、化合物15(9.6 mg)。Fr.4(4.1 g)经MCI 色谱柱纯化,再反相半制备色谱分离,以28%乙腈-0.1%甲酸水为流动相(流速3.0 mL•min-1),得化合物8(8.3 mg)、化合物9(10.5 mg)、化合物12(7.9 mg)、化合物13(10.4 mg)、化合物14(8.2 mg)。依据理化性质与波谱数据鉴定其结构,具体结构见图1。
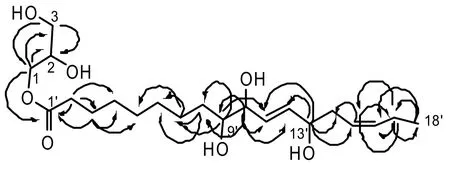
图1 化合物1 的HMBC 主要相关关系
2.3 单体化合物抗炎活性研究
将化合物1,2,7,10 配成1、5、10、25、50 μg/mL浓度梯度的溶液,按照“2.1” 项下方法进行试验,测定其抗炎活性及IC50值。
3 结构鉴定
化合物1:无色粉末。HR-ESI-MS 给出准分子离子m/z 403.2699[M+H]+(403.2701,C21H39O7),提示其分子式为C21H38O7。1H-NMR (600 MHz,CDCl3) 谱中δH4.14(1H,dd,J=9.4,4.2Hz),4.07(1H,dd,J=9.4,6.0Hz),3.83(1H,dd,J=6.0,4.2Hz),3.56(2H,m)的质子信号结合13C-NMR(150MHz,CDCl3)谱中δC65.1,69.7,62.7 的碳信号,提示结构存在甘油链。13C-NMR 谱共出现21个碳信号,除甘油链信号外,剩余的18 个碳信号包括4 个烯碳信号(δC125.0,129.6,133.0,135.1),1 个羰基碳信号δC174.1 和13 个sp3 杂化碳信号,提示结构中有1 个十八碳烯酰基。依据1H-NMR 谱中δH5.71(2H,dd,J=15.7,5.7 Hz),5.47 (2H,ddd,J=11.0,5.6,6.0Hz)的2 组质子信号,确定十八碳烯酰基中有两组双键,取代模式分别为反式与顺式。综上分析,推测该化合物为十八碳烯酸甘油酯。由于文献中未检索到该化合物,为确定碳烯酸与甘油的连接位置测试其2D NMR 谱,并通过HSQC 谱归属碳氢信号。HMBC 谱显示,H-1 分别与C-2,C-3,C-1′相关;H-3 与C-1,C-2相关,证实结构存在甘油酯片段。由于H-2′与C-1′,C-3′,C-4′相关,H-3′与C-1′,C-4′,C-5′相关,H-7′与C-5′,C-6′相关,H-8′与C-6′,C-7′相关,H-9′与C-7′,C-8′,C-10′,C-11′相关,H-10′与C-8′,C-9′,C-11′,C-12′相关,H-11′与C-9′,C-10′,C-11′相关,H-13′与C-11′,C-12′,C-14′,C-15′相关,H-15′与C-14′,C-17′相关,H-16′与C-17′,C18′相关,H-17′与C15′,C16′,C18′相关,H-18′与C-16′,C-17′相关(见图1),进一步证实结构存在十八碳二烯酰基,而且十八碳烯酰基的1D NMR 谱数据与(10E,15Z)-9,12,13-trihydroxyoctadeca-10,15-dienoic acid[7]十分相近。由此,鉴定化合物1 的结构为1-O-(10E,15Z)-9,12,13-trihydroxyoctadeca-10,15-dienoyl glycerol,其光谱数据见表1。

表1 化合物物1 的NMR 数据(in CD3OD)
化合物2:无色油状物,EI-MS m/z:411.3[M+H]+。1H-NMR (400 MHz,CDCl3)δ:5.42 (4H,m,H-5′,6′,9′,10′),5.33(1H,m,H-2),4.30(2H,m,H-3),2.35(2H,m,H-3′),2.11 (4H,m,H-7′,8′),2.83 (2H,m,H-4′),1.6(2H,m,H-2′),1.37(20H,m,H-11′~H-19′),0.95(3H,t,J=7.2 Hz,H-1′);13C-NMR (100 MHz,CDCl3)δ:173.1(C-1) 69.2(C-2),62.2(C-3),14.1(C-1′),25.8(C-2′~C-3′),34.2(C-4′),128.1(C-5′),128.3(C-6′),27.4(C-7′,8′),130.2(H-9′),130.0(C-10′),25.1 (C-11′),29.2 (C-12′~C-19′)。该化合物的光谱数据与文献[8]基本一致,故鉴定该化合物为2-hydroxyethyl carboxylic acid-5,9-eicodien-carboxylate。
化合物3:白色粉末,香草醛-硫酸试液显紫红色。ESI-MS m/z:357.1 [M-H]-。1H-NMR (600MHz,CD3OD)δ:6.89(4H,m,H-2,5,2′,5′),6.82(2H,dd,J=1.9,8.0 Hz,H-6,6′),4.74 (2H,d,J=4.2 Hz,H-7,7′),4.24(2H,dd,J=7.0,9.2 Hz,H -9a,9a′),3.90 (6H,s,-OCH3),3.87 (2H,dd,J=3.8,9.2 Hz,H-9b,9b′),3.10(2H,m,H-8,8′);13C-NMR(150 MHz,CD3OD)δ:133.0(C-1,1′),108.6(C-2,2′),147.1(C-3,3′),145.3(C-4,4′),119.0(C-5,5′),114.3(C-6,6′),85.9(C-7,7′),54.2(C-8,8′),71.7(C-9,9′),56.0(-OCH3)。以上数据与文献[9]基本一致,故鉴定为松脂素。
化合物4:无色粉末,溴甲酚蓝显黄色。ESI-MS m/z:193.1[M-H]-。1H-NMR(600 MHz,CD3OD)δ:7.54(1H,dd,J=8.4,1.8 Hz,H-6),7.53(1H,d,J=1.8Hz,H-2),6.81(1H,J=8.4 Hz,H-5),3.88(3H,s,-OCH3);13CNMR (150 MHz,CD3CD)δ:122.1 (C-1),114.4 (C-2),147.2(C-3),151.1(C-4),112.4(C-5),123.8(C-6),168.9(C-7),55.0(-OCH3)。以上数据与文献[10]报道基本一致,故鉴定为香草酸。
化合物5:无色粉末。ESI-MS m/z:193.1[M-H]-。1H-NMR (600MHz,CD3OD)δ:7.54 (1H,d,J=15.6 Hz,H-7),7.17(1H,br.s,H-2),7.05(1H,br.d,J=8.0Hz,H-6),6.80(1H,d,J=8.0Hz,H-5),6.22(1H,d,J=15.6 Hz,H-8),3.90(6H,s,-OCH3)。13C-NMR (150 MHz,CD3OD)δ:126.4 (C-1),122.6 (C-2),149.1 (C-3),148.0 (C-4),110.3 (C-5),115.0 (C-6),145.5 (C-7),114.5 (C-8),δC169.6(C-9),55.0(OCH3)。以上数据与文献[11]基本一致,故鉴定为阿魏酸。
化合物6:无色粉末,三氯化铁显蓝色。ESI-MS m/z:193.1[M-H]-。1H-NMR (600 MHz,CD3OD)δ:7.59(1H,d,J=15.9 Hz,H-7),7.17 (1H,br.s,H-2),7.05(1H,br.d,J=8.0Hz,H-6),6.80 (1H,d,J=8.0Hz,H-5),6.30(1H,d,J=15.9Hz,H-8);13C-NMR (150 MHz,CD3OD)δ:128.0(C-1),115.2(C-2),146.9(C-3),149.5(C-4),116.3(C-5),123.0(C-6),147.1(C-7),115.9(C-8),171.3(C-9)。以上数据与文献[12]基本一致,故鉴定为咖啡酸。
化合物7:黄色粉末,盐酸镁粉反应呈阳性。ESIMS m/z:563.3[M-H]-。1H-NMR (600 MHz,DMSO-d6)δ:13.67 (1H,brs,5-OH),8.02(2H,brd,J=8.4 Hz,H-2′,6′),6.91(2H,d,J=8.4 Hz,H-3′,5′),6.80(1H,s,H-3),4.71(1H,d,J=9.6 Hz,H-1′′),4.75(1H,d,J=9.0 Hz,H-1″′),3.20~3.91 (11H,sugar-H);13C-NMR (150MHz,DMSO-d6)δ:164.5 (C-2),104.1 (C-3),182.8 (C-4),158.7(C-5),108.6(C-6),161.7(C-7),105.6(C-8),155.7(C-9),103.0(C-10),121.9(C-1′),129.5(C-2′,6′),116.3(C-3′,5′),161.7(C-4′),74.7(C-1″),71.4(C-2′′),74.4(C-3″),68.9(C-4″),70.6(C-5″),73.8(C-1″′),71.0(C-2″′),79.4(C-3″′),70.0(C-4″′),82.4(C-5″′),61.7(C-6″′)。以上数据与文献[13]基本一致,故鉴定为异夏佛托苷。
化合物8:黄色粉末,盐酸镁粉反应呈阳性。ESIMS m/z:563.3[M-H]-。1H-NMR(600 MHz,DMSO-d6)δ:13.82 (1H,s,5-OH),8.03 (2H,d,J=8.0 Hz,H-2′,H-6′),6.92(2H,d,J=8.0 Hz,H-3′,H-5′),6.80(1H,s,H-3),4.72(1H,d,J=9.6 Hz,H-1″),4.76(1H,d,J=9.5 Hz,H-1"′),3.20~3.91(11H,sugar-H);13C-NMR(150 MHz,DMSO-d6)δ:164.8(C-2),102.5(C-3),182.8(C-4),158.7(C-5),108.5(C-6),161.7(C-7),105.6(C-8),155.7(C-9),104.1(C-10),121.5(C-1′),129.2(C-2′),116.4(C-3′),161.7(C-4′),116.4(C-5′),129.2(C-6′),74.3(C-1″),68.7(C-2″),78.3(C-3″),70.6(C-4″),81.1(C-5″),61.7(C-6″),74.6(C-1"′),69.7(C-2"′),74.3 (C-3"′),70.6(C-4"′),68.7(C-5"′)。以上数据与文献[14]基本一致,故鉴定为夏佛托苷。
化合物9:黄色粉末,盐酸镁粉反应呈阳性,ESIMS m/z:563.1[M-H]-。1H-NMR(600 MHz,DMSO-d6)δ:13.68(1H,s,5-OH),7.93(2H,d,J=8.7 Hz,H-2′,6′),6.93(2H,d,J=8.7 Hz,H-3′,5′),6.80(1H,s,H-3),4.75(1H,d,J=9.6 Hz,H-1″),4.70(1H,d,J=9.8 Hz,H-1″′),3.20~3.91(11H,sugar-H);13C-NMR(150 MHz,DMSOd6)δ:164.2(C-2),103.1(C-3),182.6(C-4),161.7(C-5),109.0(C-6),161.7(C-7),105.4(C-8),155.5 (C-9),103.7(C-10),122.0(C-1′),129.0(C-2′,6′),116.4(C-3′,5′),158.8(C-4′),74.2(C-1″),68.9(C-2″),74.9(C-3″),70.1(C-4″),79.5(C-5″),61.3(C-6″),75.1(C-1″′),70.7(C-2″′),74.9(C-3″′,70.6(C-4″′),71.1(C-5″′)。以上数据与文献[15]基本一致,故鉴定为6-C-α-L-arabinosyl-8-C-β-Dgalactosyl apigenin。
化合物10:黄色粉末,盐酸镁粉反应呈阳性,ESI-MS m/z:563.1[M-H]-。1H-NMR(600 MHz,DMSOd6)δ:13.72(1H,brs,5-OH),7.93(2H,brd,J=8.4Hz,H-2′,6′),6.92 (2H,d,J=8.4Hz,H-3′,5′),6.75 (1H,s,H-3),4.74 (1H,d,J=9.6Hz,H-1′′),4.74 (1H,d,J=9.0Hz,H-1″′),3.20~3.91 (11,sugar-H);13C-NMR (150 MHz,DMSO-d6)δ:163.8(C-2),104.1(C-3),182.3(C-4),158.7(C-5),108.6(C-6),159.5(C-7),105.2(C-8),155.5(C-9),103.0(C-10),122.1(C-1′),129.0(C-2′,6′),116.4(C-3′,5′),161.6(C-4′),75.4(C-1″),70.6(C-2″),78.7(C-3″),71.0(C-4″),69.9(C-5″),74.5(C-1″′),71.9(C-2″′),79.4(C-3″′),71.7(C-4″′),81.5(C-5″′),60.7(C-6″′)。以上数据与文献[16]基本一致,故鉴定为维采宁1。
化合物11:黄色粉末,盐酸镁粉反应呈阳性,ESI-MS m/z:563.1 [M-H]-。1H-NMR (400 MHz,DMSO-d6)δ:13.70(1H,s,5-OH),7.94(2H,d,J=8.8 Hz,H-2′,6′),6.94 (2H,d,J=8.8 Hz,H-3′,5′),6.80 (1H,s,H-3),4.77(1H,d,J=10.0 Hz,H-1″),4.75(1H,d,J=10.0 Hz,H-1″′),3.20~3.91 (11,sugar-H);13C-NMR (100 MHz,DMSO-d6)δ:164.2 (C-2),103.1 (C-3),182.6 (C-4),159.4 (C-5),108.4 (C-6),161.7 (C-7),105.2 (C-8),155.3(C-9),103.9(C-10),121.9(C-1′),129.1(C-2′,6′),115.8(C-3′,5′),161.7(C-4′),74.4(C-1″),71.0(C-2″),79.1(C-3″),70.5 (C-4″),81.6(C-5″),60.6(C-6″),75.2(C-1″′),72.0(C-2″′),78.5(C-3″′),71.6(C-4″′),69.8(C-5″′)。以上数据与文献[17]基本一致,故鉴定为维采宁3。
化合物12:黄色粉末,盐酸镁粉反应呈阳性,ESI-MS m/z:595.1577 [M+H]+。1H-NMR (400 MHz,DMSO-d6)δ:13.70(1H,s,5-OH),7.94(2H,d,J=8.8 Hz,H-2′,6′),6.94 (2H,d,J=8.8 Hz,H-3′,5′),6.80 (1H,s,H-3),4.77(1H,d,J=10.0 Hz,H-1″),4.75(1H,d,J=10.0 Hz,H-1″′),3.20~3.91 (12H,sugar-H)。13C-NMR(100 MHz,DMSO-d6)δ:164.2 (C-2),103.2 (C-3),182.6 (C-4),158.9 (C-5),109.0 (C-6),161.7 (C-7),105.2 (C-8),155.5(C-9),103.9(C-10),121.9(C-1′),129.1(C-2′,6′),116.4(C-3′,5′),161.7(C-4′),74.2(C-1″),68.9(C-2″),75.0(C-3″),70.2(C-4″),79.5(C-5″),61.3(C-6″),74.2(C-1″′),68.9(C-2″′),75.0(C-3″′),70.2(C-4″′),79.6(C-5″′),61.3(C-6″′)。以上数据与文献[18]基本一致,故鉴定为6,8-di-C-β-D-galactosyl apigenin。
化合物13:黄色粉末,盐酸镁粉反应呈阳性,ESI-MS m/z:595.1 [M+H]+。1H-NMR (400 MHz,DMSO-d6)δ:13.78(1H,s,5-OH),8.31(2H,d,J=8.8 Hz,H-2′,6′),6.89 (2H,d,J=8.8 Hz,H-3′,5′),6.85 (1H,s,H-3),4.74(1H,d,J=10.0 Hz,H-1″),4.44(1H,d,J=10.0 Hz,H-1″′),3.20~3.91 (11H,sugar-H);13C-NMR(100 MHz,DMSO-d6)δ:164.8 (C-2),102.5 (C-3),182.8 (C-4),158.7 (C-5),108.5 (C-6),161.8 (C-7),105.6 (C-8),155.7(C-9),104.1(C-10),121.4(C-1′),130.2(C-2′,6′),116.4(C-3′,5′),161.8(C-4′),74.6(C-1″),70.6(C-2″),78.2(C-3″),68.9 (C-4″),68.8(C-5″),74.3(C-1″′),70.0(C-2″′),74.6(C-3″′),70.0 (C-4″′),81.1(C-5″′),61.7(C-6″′)。以上数据与文献[15]基本一致,故鉴定为6-C-β-D-xylosyl-8-C-β-D-galactosyl apigenin。
化合物14:黄色粉末,盐酸镁粉反应呈阳性,ESI-MS m/z:595.1 [M+H]+。1H-NMR (400 MHz,DMSO-d6)δ:13.68 (1H,brs,5-OH),7.90 (2H,d,J=8.7Hz,H-2′,6′),6.85 (2H,d,J=8.7Hz,H-3′,5′),6.41(1H,brs,H-3),4.62 (1H,d,J=9.8Hz,H-1″),4.82(1H,brd,J=9.6Hz,H-1″′),3.84~3.20 (12H,sugar-H);13CNMR(100MHz,DMSO-d6)δ:164.7(C-2),102.5 (C-3),182.8(C-4),158.7(C-5),108.85C-6),161.6(C-7),106.4(C-8),155.6(C-9),105.2(C-10),121.4(C-1′),103.6(C-3),129.8(C-2′,6′),116.4 (C-3′,5′),74.2(C-1″),70.7(C-2″),78.8(C-3″),70.3(C-4″),80.5(C-5″),61.0(C-6″),74.4(C-1″′),71.8(C-2″′),79.0(C-3′),70.7(C-4″′),81.3(C-5″′),61.3(C-6″′)。以上数据与文献[14]基本一致,故鉴定为维采宁2。
化合物15:黄色粉末,盐酸镁粉反应呈阳性,ESI-MS m/z:563.1[M-H]-。1H-NMR(600 MHz,DMSOd6)δ:13.80(1H,s,5-OH),7.97(2H,d,J=8.7 Hz,H-2′,6′),6.91 (2H,d,J=8.7Hz,H-3′,5′),6.84 (1H,s,H-3),4.75(1H,d,J=9.6 Hz,H-1″),4.69(1H,d,J=9.8 Hz,H-1″′),3.20~3.91(11H,sugar-H);13C-NMR(150 MHz,DMSOd6)δ:164.7(C-2),103.1(C-3),182.8(C-4),161.7(C-5),109.0(C-6),161.6(C-7),105.3(C-8),155.5(C-9),102.9(C-10),121.5(C-1′),130.0(C-2′,6′),116.5(C-3′,5′),158.8(C-4′),74.2(C-1″),68.7(C-2″),75.1(C-3″),69.5(C-4″),79.6(C-5″),61.3(C-6″),75.5(C-1″′),70.7(C-2″′),74.9(C-3″′),69.0(C-4″′),71.5(C-5″′)。以上数据与文献[16]基本一致,故鉴定为6-C-β-D-galactosyl-8-Cα-L-arabinosyl apigenin。
化合物16:无色粉末,ESI-MS m/z:579.5 [M+H]+。该化合物在氯仿-甲醇(体积比1∶1)的溶剂中溶解度良好,与胡萝卜苷对照品进行TLC 对照,硫酸显色紫红色,Rf 值一致,故鉴定为胡萝卜苷。
化合物17:白色粉末。1H-NMR (600 MHz,D2O)δ:4.20 (1H,d,J=7.5Hz,H-1),3.25~3.89 (12H,m,sugar-H)。13C-NMR(150 MHz,D2O)δ:97.4(C-1),74.1(C-2),76.8(C-3),70.4(C-4),76.7(C-5),61.3(C-6)。以上数据与文献[19]基本一致,故鉴定为葡萄糖。
化合物18:白色粉末。1H-NMR (600 MHz,D2O)δ:5.40(1H,d,J=3.9 Hz,H-1′),4.2(1H,d,J=7.5Hz,H-1),4.30 (1H,t,J=8.4Hz,H-3′),3.45~4.03 (12H,m,sugar-H)。13C-NMR(150 MHz,D2O)δ:92.2(C-1),71.1(C-2),76.3(C-3),69.2(C-4),74.0(C-5),61.3(C-6),60.1(C-1′),103.7(C-2′),81.4(C-3′),72.6(C-4′),72.4(C-5′),62.4(C-6′)。以上数据与文献[20]基本一致,故鉴定为蔗糖。
4 抗炎作用
结果表明,化合物1,2,7,10 均能抑制LPS 诱导巨噬细胞RAW264.7 的IL-6 与TNF-α 的释放,表现出具有抗炎活性,详见表2。

表2 分离化合物的抗LPS 诱导RAW264.7 细胞释放炎症因子的活性
5 讨论
目前已从天南星中发现苯丙素,黄酮,甘油酯,凝集素等成分,因夏佛陀苷含量较高,且具有良好活性,已作为指标性成分用于天南星的鉴定。但现有研究表明,《中国药典》收录的3 种天南星的成分差异较大[5],但相关品种与质量鉴别研究报道较少,主要原因是三种天南星的成分研究还不系统[6]。本课题组利用LCMS 分析发现,3 种天南星的黄酮碳苷差异尤为突出,主要表现为异叶天南星中黄酮碳苷类成分较为丰富。本研究从异叶天南星的抗炎活性部位中鉴定了9 种黄酮碳苷,为天南星的品种鉴定提供参考。同时,抗炎活性成分的研究也为天南星的开发应用提供了依据。但不同基源天南星的成分与活性的系统研究还有待进一步深入。
