血浆致动脉粥样硬化指数对急性心肌梗死发生的预测价值
2024-03-04吕素洁吴寿岭朱辰蕊李金锋黄喆王艳丽季春鹏
吕素洁 吴寿岭 朱辰蕊 李金锋 黄喆 王艳丽 季春鹏
063000 唐山,开滦总医院心内科
随着经济的发展和人民生活水平的提高,一些不良的饮食生活方式,如久坐、缺乏体育锻炼、吸烟、高脂饮食和高糖饮食等出现流行趋势,使心血管疾病患病率不断攀升[1]。根据《中国心血管健康与疾病报告2022》显示,我国冠心病患病人数为1 139万,并呈快速增长趋势[2]。另据《中国卫生健康统计年鉴2021》数据,2020年中国城市居民冠心病死亡率为291.04/10万,农村为336.13/10万[3]。因此,心血管疾病的防治刻不容缓,早期识别并改善心血管危险因素已成为心血管疾病防治的重中之重[4]。
目前,已被识别的常见心血管危险因素包括血脂异常、高血压、高血糖、肥胖、缺乏体育锻炼和吸烟等[5]。其中,血脂异常是动脉粥样硬化性心血管疾病的重要致病因子[6]。而低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)被认为是血脂异常的主要治疗靶点。然而,在LDL-C达标后,仍有50%的心血管残余风险[7]。进一步研究发现,小而密低密度脂蛋白胆固醇(small dense low-density lipoprotein cholesterol,sdLDL-C)比LDL-C具有更显著的致动脉粥样硬化风险[8]。不过,由于sdLDL-C检测方法复杂,成本昂贵,尚不能应用于临床。近年研究证实,血浆致动脉粥样硬化指数(atherogenic index of plasma,AIP),即三酰甘油(trighyceride,TG)与高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)比值的对数转换值[log(TG/HDL-C)],与sdLDL-C颗粒直径密切相关[9-11],并且是动脉粥样硬化性心血管疾病的一个重要预测因子,其预测价值可能优于传统的促动脉粥样硬化脂质参数[12]。但相关研究多为横断面分析,样本量相对较少,且缺乏单独对急性心肌梗死(acute myocardial infarction,AMI)发生影响的研究。为此,本研究利用开滦队列研究数据分析了AIP对新发AMI的影响。
1 对象和方法
1.1 研究对象
2006年7月至2007年10月由开滦总医院、开滦林西医院、开滦赵各庄医院、开滦唐家庄医院、开滦范各庄医院、开滦吕家坨医院、开滦荆各庄医院、开滦林南仓医院、开滦钱家营医院、开滦马家沟医院和开滦医院分院11家医院,对开滦集团在职及退休职工进行了第1次健康体检,共有101 510名职工(男性81 110名,女性20 400名)参加。此后每2年随访1次,体检项目均与第1次相同,2018年7月至2019年10月进行了第6次健康体检。
采用前瞻性队列研究。本研究对象的入选标准:(1)参加了2006—2007年第1次健康体检者;(2)同意参加本研究并签署知情同意书者。排除标准:(1)TG或HDL-C缺失者;(2)体检前已有心肌梗死病史者。本研究通过开滦总医院医学伦理委员会审核批准(批准文号:[2006]医伦字5号)。
1.2 研究方法
流行病学调查内容、人体测量学指标和生化指标检测方法详见本课题组已发表的文献[13]。
1.2.1 流行病学调查 设计流行病学调查表,制定统一的填表指南。将调查表预先交予个人填写,体检当日由经过培训的医护人员采取面对面的方式逐项核实确保准确无误。调查内容包括个人生活习惯、高血压病史、糖尿病病史、脑卒中病史、心肌梗死病史、吸烟史、饮酒史、体育锻炼、睡眠时间及质量、受教育情况、职业、家庭收入和工作环境等。吸烟定义为每天至少吸1支烟,连续吸烟至少1年以上。饮酒定义为平均每日饮白酒(酒精含量38%及以上)至少100 ml,持续1年以上。戒烟或戒酒不足1年者定义为吸烟或饮酒。
1.2.2 人体测量学指标 身高、体重采用经校正的RGZ-120型体重秤测量,受试者脱鞋、脱帽,穿轻单衣,体质指数(body mass index,BMI)=体重/身高2(kg/m2)。腰围测量:将尺水平放在腰最细的部位进行测量,读数精确至0.1 cm。血压测量:受试对象测量血压前30 min内禁止吸烟或饮茶、咖啡,背靠静坐15 min,采用经校正的汞柱式血压计测量右侧肱动脉血压。收缩压读数取柯氏音第1音,舒张压读数取柯氏音第5音。连续测量3次,每次测量间隔1~2 min,取平均值。
1.2.3 生化指标检测 研究对象于体检当日上午7:00-9:00抽取空腹肘静脉血5 ml于EDTA真空管内,在室温下经3 000 r/min离心10 min后取上层血清在4 h内检测TG、总胆固醇(total cholesterol,TC)、LDL-C、HDL-C、空腹血糖(fasting blood glucose,FBG)、C反应蛋白(C-reactive protein,CRP)和尿酸(uric acid,UA)。采用免疫比浊法测定血清CRP水平,所用试剂由日本关东化学株式会社生产。TC和TG采用氧化酶法测量,试剂由上海名典生物工程公司提供。FBG采用己糖激酶法测量,试剂由中生北控生物科技股份公司提供。UA采用酶偶联比色法测定,试剂盒由上海名典生物工程有限公司提供。以上分析均在日立7600全自动生化分析仪上进行,严格按试剂说明书进行操作,随批质控,由专业检验师进行操作。
1.2.4 相关诊断标准 高血压定义为收缩压≥140 mmHg和(或)舒张压≥90 mmHg或正在服用降压药或有高血压病史[14]。糖尿病定义为FBG≥7.0 mmol/L或正在服用降糖药物或有糖尿病病史[15]。心肌梗死的诊断标准采用2007年欧洲心脏病学会/美国心脏病学会基金会/美国心脏协会/世界心脏联盟(ESC/ACCF/AHA/WHF)心肌梗死全球定义[16],即存在心肌损伤标记物的动态变化且存在以下3项中任意1项:(1)缺血性胸痛症状;(2)新发缺血性心电图改变(ST-T改变或新出现左束支传导阻滞)或新发病理性Q波形成;(3)影像学证据。
1.2.5 AIP计算方法及研究分组 AIP为TG与HDL-C比值的对数转换值,即AIP=log(TG/HDL-C)[9-11]。依据AIP四分位数将研究对象分为4组。
1.2.6 随访和终点事件 以2006—2007年健康体检时间为随访起始时间,如研究对象未发生终点事件,随访终止时间为2019年12月31日。如研究对象未发生终点事件而中途死亡,则死亡时间为随访终止时间。终点事件包括致死性和非致死性心肌梗死。自2006年开始,每半年由经过培训的医务人员到上述各医院收集观察对象的终点事件情况。此外,自2010年开始,每半年由开滦医保中心收集1次观察对象在上述医院以外医疗单位就诊的信息,并收集发生终点事件者的住院信息。所有诊断均由专业医师根据住院病历进行确认。
1.3 统计学方法

2 结果
2.1 一般资料
参加2006—2007年健康体检者共101 510人,排除基线TG或HDL-C缺失者1 281人,排除既往心肌梗死病史者1 354人,最终共有98 875名研究对象纳入本研究分析。依据AIP四分位数将研究对象分为4组,即Q1组:AIP<-0.56,Q2组:-0.56≤AIP<-0.16,Q3组:-0.16≤AIP<0.31,Q4组:AIP≥0.31。随AIP四分位数分组递增,年龄、男性、吸烟、脑卒中病史者、服用降压药和降糖药者比例、收缩压、FBG、BMI、TC、TG、LDL-C、UA、CRP均呈递增趋势,而HDL-C、体育锻炼和文化程度初中及以上者比例呈下降趋势,见表1。

表1 研究对象的基线资料
2.2 AMI检出率和累积发病率
在平均随访(12.9±1.0)年后,Q1、Q2、Q3和Q4组发生AMI的例数分别为306、368、519和611例,AMI检出率分别为1.25%、1.48%、2.11%和2.47%(P<0.001);AMI的累积发病率分别为1.23%、1.47%、2.11%和2.47%(P<0.001),见表2;不同AIP水平人群AMI的累积风险函数曲线,见图1。
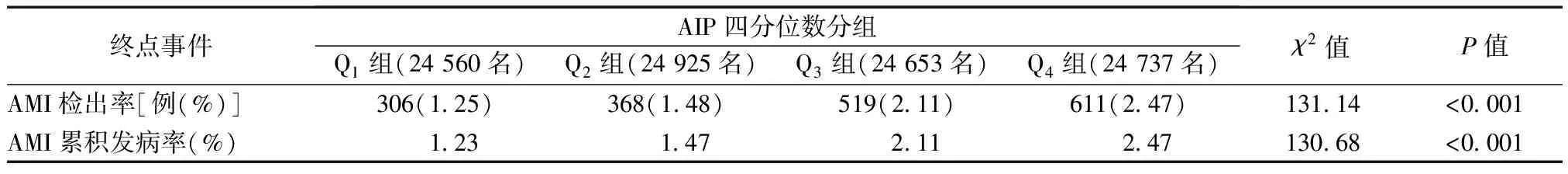
表2 不同AIP分组的AMI检出率和累积发病率
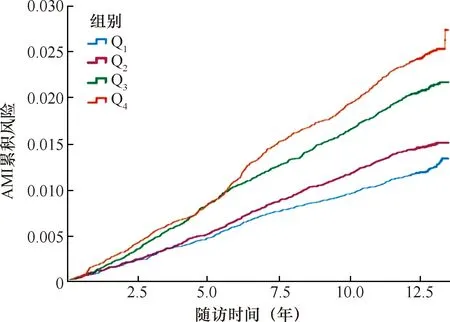
AMI:急性心肌梗死;Q1组:AIP<-0.56;Q2组:-0.56≤AIP<-0.16;Q3组:-0.16≤AIP<0.31;Q4组:AIP≥0.31(AIP:血浆致动脉粥样硬化指数)
2.3 AIP对AMI发生影响的多因素Cox回归分析
在校正年龄、性别、文化程度、体育锻炼、家庭人均月收入、吸烟、饮酒、脑卒中病史、降压药、降糖药、收缩压、BMI、TC、FBG、UA、CRP后,多因素Cox回归分析显示,AIP每增加一个标准差(0.68),AMI发生的风险增加30%(HR=1.30,95%CI:1.21~1.41,P<0.001),见表3。

表3 AIP对AMI发生影响的多因素Cox回归分析
2.4 不同AIP水平对AMI发生影响的多因素Cox回归分析
在校正上述混杂因素后,多因素Cox回归分析结果显示,与Q1组相比,Q3组和Q4组发生AMI的风险分别增加了46%(HR=1.46,95%CI:1.24~1.71,P<0.001)和70%(HR=1.70,95%CI:1.45~1.99,P<0.001),但Q2组发生AMI的风险并未显著增加(HR=1.15,95%CI:0.97~1.35,P=0.11),见表4。
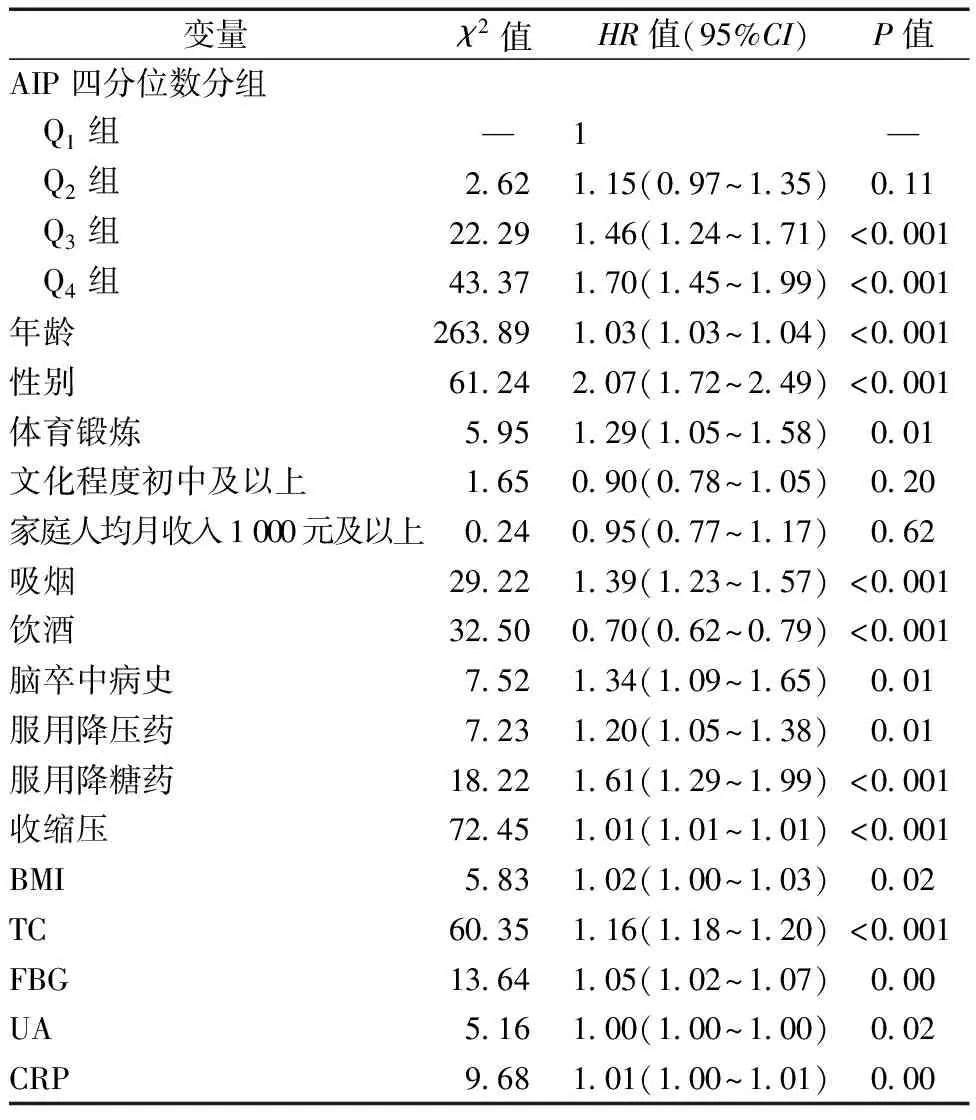
表4 不同AIP水平对AMI发生影响的多因素Cox回归分析
3 讨论
本研究对98 875名开滦人群平均随访12.9年后发现,随着AIP四分位数组递增,AMI发病率呈递增趋势;AIP升高是AMI的独立危险因素。
通过Cox比例风险模型校正年龄、性别等混杂因素后发现,与AIP第一分位数组比较,第三、四分位数组发生AMI的风险分别增加46%和70%。Guo等[7]对4 644例绝经后妇女(50岁及以上)进行横断面研究发现,AIP与冠心病风险存在显著关联(OR=1.548,95%CI:1.239~1.933,P<0.001),因此认为AIP可能是绝经后女性冠心病风险的一个强有力的独立预测因子,可能优于传统的血脂指标。与该研究相比,本研究样本量大且为全人群,能够更好地解释在全人群中AIP升高对AMI发病风险的影响。Cai等[17]在5 387例观察对象中评估了AIP与冠心病(冠状动脉造影证实)的关联,结果显示,AIP每增加一个标准差,冠心病的风险增加66%(HR=1.66,95%CI:1.367~2.016,P<0.001)。而本研究显示,AIP每增加一个标准差(0.68),AMI发生的风险可增加30%。Cai等[5]对1 478名年龄≤35岁的人群进行横断面分析发现,AIP与急性冠脉综合征和AMI均存在独立关联,OR(95%CI)值分别为2.390(1.855~4.627)和3.872(2.280~6.576)。与上述研究相比,本研究为队列研究且随访时间较长。
有研究表明,AIP与心脑血管疾病风险的关系可能比其他单独的HDL-C、LDL-C、TC、TG等有更好的预测能力[18-19]。因此,AIP的升高可能作为一种有效的群体筛查方法来识别AMI事件的高危人群。
本研究还发现,随着AIP水平递增,一些传统的心血管危险因素(吸烟、收缩压、血脂、血糖、UA、CRP)出现聚集。多因素分析也提示,吸烟、收缩压、TC、FBG、BMI、CRP是AMI的独立危险因素,HR(95%CI)值分别为1.39(1.23~1.57)、1.01(1.01~1.01)、1.16(1.16~1.20)、1.05(1.02~1.07)、1.02(1.01~1.03)和1.01(1.00~1.01),这与既往研究结论一致[20-22]。因此,在临床工作中,计算AIP可帮助临床医生迅速区分心血管高危人群,加强高AIP人群危险因素的监测并及时改善,将有助于降低其未来心血管风险。
AIP是TG与HDL-C比值的对数,研究发现AIP与sdLDL-C颗粒直径呈显著负相关[19],因此目前AIP被认为是sdLDL-C颗粒直径的良好替代指标。相较于其他脂蛋白,sdLDL-C具有更强的致动脉粥样硬化作用。一方面,由于颗粒直径较小,sdLDL-C更容易侵入和沉积在动脉壁上,然后被氧化成氧化低密度脂蛋白。氧化低密度脂蛋白被巨噬细胞吞噬后转化为泡沫细胞,泡沫细胞融合并破裂,释放出大量胆固醇,是构成动脉粥样硬化斑块的核心部分[23]。另一方面,sdLDL-C可抑制内皮依赖性血管舒张,促进内皮功能舒缩功能障碍,降低内皮细胞对炎症因子的屏障作用[24]。正是基于上述病理生理学机制,在以往的流行病学研究中,AIP也被证实对心血管事件具有一定的预测价值[25]。
本研究存在一定的局限性。第一,研究对象仅限于开滦集团公司在岗及离退休职工,且以男性为主,限制了结果的外延,但样本量大,仍有一定的参考意义;其次,在评价AIP对终点事件的预测价值时,虽然校正了可能的混杂因素,但限于资料有限,仍有其他因素如种族、饮食、药物、其他生活方式和代谢状态等因素未被校正,可能对结果造成一定影响。
利益冲突:无
