痛风散对急性痛风性关节炎小鼠模型干预作用的机制研究
2024-03-04张奎邓向亮陈佳傅南琳广东药科大学中医学院广州50006南方医科大学中西医结合医院广州5035
★ 张奎 邓向亮 陈佳 傅南琳(.广东药科大学中医学院 广州 50006;.南方医科大学中西医结合医院 广州 5035)
急性痛风性关节炎(acute gouty arthritis,AGA)是一种炎症相关的关节性疾病,是单钠尿酸盐在关节沉积而诱发的关节局部炎性反应,主要表现为患者关节出现红肿疼痛,甚至部分患者可见关节活动障碍以及并发肾脏损伤[1]。最新研究表明,T 细胞在痛风发病中也发挥重要作用,其中Th1/Th2、Th17/Treg 失衡可能参与了痛风性关节炎的发病[2]。
中医认为AGA 是湿热蕴结证,因此采用清热通络、祛风除湿的复方治疗。例如,国医大师朱良春的临床经验方由土茯苓、萆薢等组成,对AGA有显著疗效[3]。中医专家根据自身临床经验自拟的治疗AGA 的方药,也含土茯苓、萆薢、银花(或银花藤)、知母等清热解毒除湿之药[4-7]。可见,现代中医名家对AGA 的认识和治疗颇为一致,为中医药防治痛风的现代研究提供了参考。傅南琳教授采用自拟痛风散治疗AGA 疗效显著,该方包括土茯苓30 g,萆薢15 g,泽泻15 g,赤芍20 g,金银花30 g,连翘15 g,石膏30 g,知母10 g,生地黄15 g,甘草10 g。全方由清热解毒、祛风除湿药物组成,可明显缓解AGA 患者关节红肿热痛的临床症状。为了阐明自拟痛风散治疗AGA 的现代药理机制,进一步促进该方的临床应用,本研究旨在探讨傅教授的经验效方痛风散对小鼠AGA 的治疗作用,并从调节免疫角度探讨该方的作用机制。
1 材料与仪器
36 只Balb/c 雄性小鼠,8 周龄,体质量(20±2)g,由辽宁长生生物技术股份有限公司提供,合格证号为SCXK(辽)2020-0001。土茯苓(批号19120371)、萆薢(批号20020861)、泽泻(批号20060181)、赤芍(批号20041241)、金银花(批号20040571)、连翘(批号20031181)、石膏(批号20041701)、知母(批号20010751)、生地黄(批号19122641)、甘草(批号20041501)均为颗粒剂,由广东一方制药有限公司提供;氧嗪酸钾(potassium oxonate,PO,上海麦克林公司批号C10976408);尿酸钠(南通宇飞生物科技有限公司批号FY28362R1116);秋水仙碱(西双版纳药业有限责任公司批号20010);尿酸(UA)试剂盒(批号20190927)、谷草转氨酶(AST)测试盒(批号20190928)、谷丙转氨酶(ALT)测试盒(批号20191008)、肌酐(CRE)测定试剂盒(批号20191008)、尿素氮(BUN)测试盒(批号20190927)由南京建成生物工程研究所提供。
主要仪器包括BDFACSCanto Ⅱ流式细胞仪(美国BD 公司);EL×800 全自动酶标仪(美国BioTek 公司);GFL-230 烤箱(天津市莱玻瑞仪器设备有限公司);JJ-12J 脱水机(武汉俊杰电子有限公司);RM2016 病理切片机(上海徕卡仪器有限公司);JB-P5 包埋机(武汉俊杰电子有限公司);KD-P 组织摊片机(浙江省金华市科迪仪器设备有限公司);JB-L5 冻台(武汉俊杰电子有限公司)。
2 实验方法
2.1 动物模型复制、分组及给药方法
采用随机数表法,将 36 只Balb/c 雄性小鼠分为6 组,即空白对照组、模型组、秋水仙碱阳性药组、痛风散低剂量组、痛风散中剂量组、痛风散高剂量组。
将Balb/c 雄性小鼠饲养于SPF 级环境中,明暗周期12 h/12 h,温度保持在(23±1.5)℃,相对湿度为(45±15)%,以保证小鼠处在舒适的环境中。用标准饲料将小鼠适应性饲养1 周后,腹腔注射PO 溶液及踝关节腔注射尿酸钠晶体混悬液进行AGA 造模[8]。每只小鼠每日腹腔注射0.25 g/kg 的PO 溶液,连续15 d,第9 d 后每隔2 d 在小鼠右踝关节腔配合注射1 次50 μL 浓度为25 mg/mL 的尿酸钠晶体混悬液[9]。在踝关节注射尿酸钠晶体混悬液后,小鼠关节出现明显肿胀,液体未完全吸收,表明造模成功。因PO 与尿酸钠难溶于水,采用0.5%CMC-Na 进行助溶配制,尿酸钠晶体混悬液则用生理盐水及吐温80(9∶1)配制。
按照体表面积法将正常成人用药量换算成痛风散中剂量,痛风散高剂量设定为中剂量的2 倍量,痛风散低剂量则设定为中剂量的1/2 倍量。每天造模完成后,GPLDG、GPMDG、GPHDG 小鼠分别灌胃12.35、24.70、49.40 g/(kg·d)剂量的痛风散溶液,连续15 d,CG 及MG 小鼠给予药物等量的蒸馏水,CPDG 小鼠灌胃0.40 mg/kg 剂量的秋水仙碱溶液。第16 天处死小鼠,取血检测相关指标。
2.2 检测指标与方法
2.2.1 肿胀度测定 第16 天用游标卡尺测量小鼠双踝关节的最大直径并计算关节肿胀度,每组重复测量3 次,并求取平均值。踝关节肿胀度=(小鼠右踝关节周径-左踝关节周径)/左踝关节周径。
2.2.2 踝关节组织学观察 对小鼠踝关节进行组织学观察(HE 染色法),首先剪取踝关节,用10%福尔马林溶液固定72 h,然后经脱钙处理,再制备石蜡切片,最后按HE 染色试剂盒使用说明书进行染色、封片。在光学显微镜下观察经HE 染色的组织,主要是观察踝关节滑膜上皮细胞结构和炎症细胞浸润数量。
2.2.3 血清代谢指标检测 第16 天早上摘除小鼠眼球取血,全血立即放入离心机中,常规分离血清。分别取各只小鼠的血清,测定血清中尿酸(UA)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、肌酐(CRE)及尿素氮(BUN)的水平。
2.2.4 免疫组化指标检测 取每只实验小鼠右踝关节组织,放入10%福尔马林溶液中固定72 h,经脱钙、包埋、切片后做踝关节免疫组化指标检测。严格按照试剂盒说明书,对得到的切片依次进行石蜡切片脱蜡至水、抗原修复、阻断内源性过氧化物酶、血清封闭、加一抗、加二抗、DAB 显色、复染细胞核、脱水封片、显微镜镜检的操作,检测踝关节组织内IL-6、IL-17A、IFN-γ、IL-4、IL-10、TGF-β、TNF-α、EMR1 的表达。采集图像,采用Image J 测量法进行量化分析[10-11],通过测量出每张图片的累积光密度以及阳性表达的范围大小,计算出平均光密度,即可反映图片中目标蛋白的单位面积浓度,平均光密度越高则说明阳性表达越显著。最后对各组小鼠踝关节免疫组化的结果进行分析比较。
2.2.5 流式细胞术检测Treg 细胞 取小鼠外周血,利用红细胞裂解液处理后(样品经过破除红细胞、离心洗涤)得到淋巴细胞悬液。取淋巴细胞悬液,按照Treg 细胞流式检测试剂盒说明书对细胞进行标记,用于标记的流式抗体包括荧光标记的CD3、CD4 和CD25 单抗,最后采用流式细胞术检测CD3+CD4+CD25+Treg 比例。
2.3 统计学方法
实验结果使用GraphPad prime 8 软件进行处理分析,各组数据以平均值±标准差()表示。2 组间数据采用t检验,多组间数据采用单因素方差分析,以P<0.05 表示差异具有统计学意义。
3 结果
3.1 一般状态比较
造模前各组小鼠的毛发有光泽、精神状态良好、摄食摄水正常,体重增加,造模干预后模型组各组小鼠毛发变黄,摄食量减少,不喜动。
3.2 肿胀度比较
实验结果显示,造模后无论是模型组还是秋水仙碱组或痛风散低、中、高剂量组小鼠踝关节肿胀度明显高于空白对照组(P<0.01)。痛风散低、中、高3 个剂量组以及秋水仙碱组小鼠的踝关节肿胀度均比模型组的低(P<0.01)。见图1。
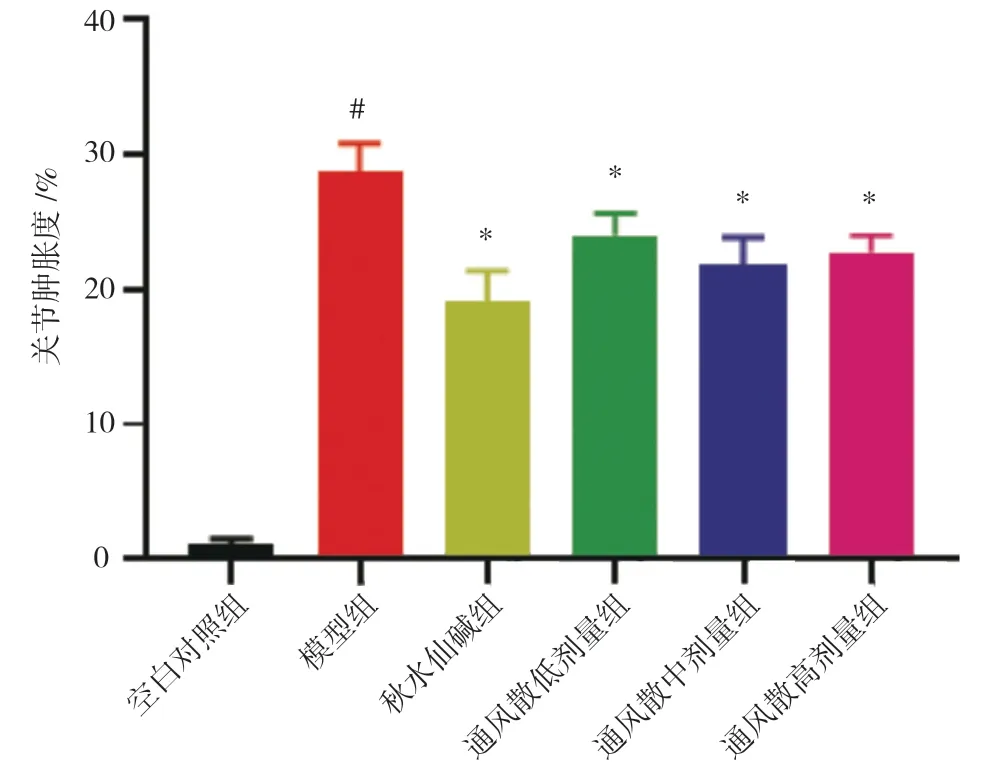
图1 各组小鼠造模踝关节的肿胀度
3.3 踝关节组织病理比较
模型组小鼠造模后踝关节HE 染色结果出现异常,包括组织肿胀、滑膜增生、局部浸润的炎性细胞增加。秋水仙碱组与模型组比较,滑膜增生情况得到改善,局部的炎性细胞数量也减少。痛风散低、中、高剂量组小鼠踝关节局部的炎性细胞数量和滑膜增生情况也较模型组有所改善,其中痛风散中、高剂量组的组织病理改善最为明显。见图2。
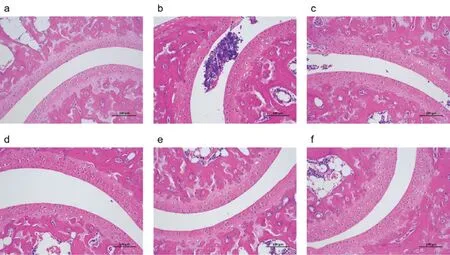
图2 各组小鼠踝关节组织病理(HE×200)
3.4 血清相关指标比较
3.4.1 血清尿酸含量比较 实验结果显示,模型组小鼠经造模后血清尿酸水平明显高于空白对照组(P<0.01)。秋水仙碱组小鼠的血尿酸水平与模型组比较差异无统计学意义。痛风散低、中剂量组小鼠的血尿酸水平与模型组比较有所降低,其中痛风散低剂量组与模型组比较,差异有统计学意义(P<0.05)。见表1。
表1 痛风散对急性痛风性关节炎小鼠血尿酸水平的影响(,n=3)
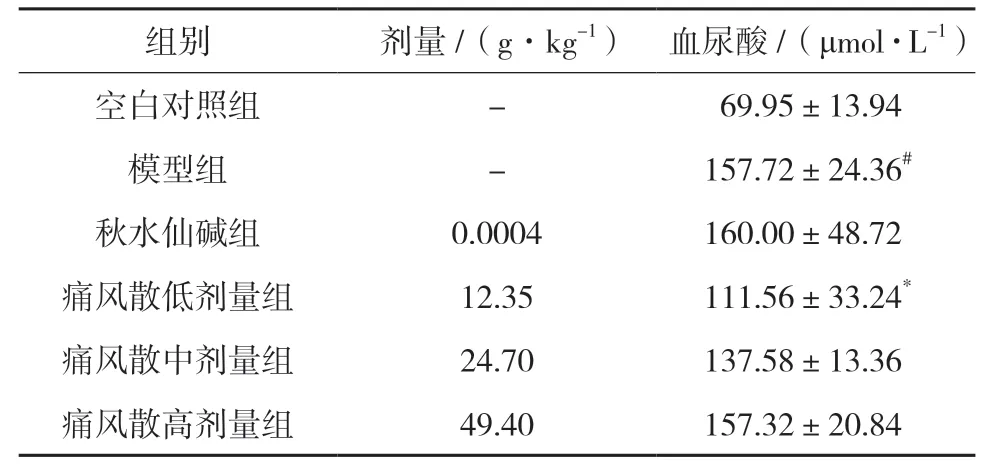
表1 痛风散对急性痛风性关节炎小鼠血尿酸水平的影响(,n=3)
注:与空白对照组比较,#P<0.01;与模型组比较,*P<0.05。
?
3.4.2 血清肌酐、尿素氮含量比较 造模后无论是模型组还是秋水仙碱组小鼠,肌酐、尿素氮含量与空白对照组相比均明显升高(P<0.01)。秋水仙碱组小鼠血清中肌酐和尿素氮含量与模型组比较无明显变化。但是痛风散的低、中、高剂量组小鼠的肌酐和尿素氮含量都低于模型组且都有统计学意义(P<0.01)。见表2。
表2 痛风散对急性痛风性关节炎小鼠肌酐和尿素氮的影响(,n=6)

表2 痛风散对急性痛风性关节炎小鼠肌酐和尿素氮的影响(,n=6)
注:与空白对照组比较,#P<0.01;与模型组比较,*P<0.01。
?
3.4.3 血清AST 和ALT 含量比较 造模后模型组小鼠血清AST 和ALT 含量均高于空白对照组,差异有统计学意义(P<0.01)。秋水仙碱组小鼠血清AST 和ALT 含量均低于模型组,其中2 组小鼠ALT 含量的差异有统计学意义(P<0.05)。痛风散低、中、高剂量组小鼠血清中AST 和ALT 含量与模型组比较都有不同程度的降低(P<0.01),尤其是ALT 含量。见表3。
表3 痛风散对急性痛风性关节炎小鼠血清AST和ALT的影响(,n=6)
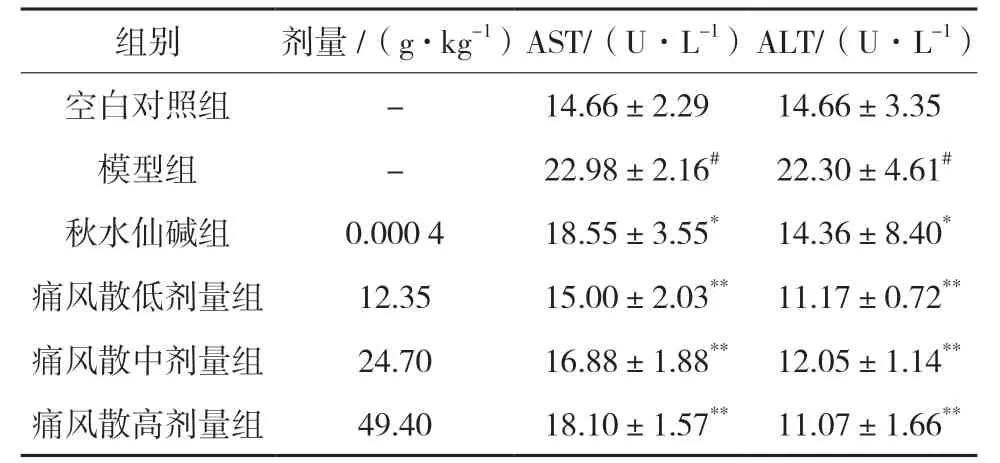
表3 痛风散对急性痛风性关节炎小鼠血清AST和ALT的影响(,n=6)
注:与空白对照组比较,#P<0.01;与模型组比较,*P<0.05,**P<0.01。
?
3.5 免疫组化指标比较
模型组与空白对照组比较,IL-17A 呈上升趋势,秋水仙碱组、痛风散低、中、高剂量组与模型组比较IL-17A 有下降趋势,具有显著性差异。模型组与空白对照组比较,IL-6、IFN-γ 呈上升趋势,秋水仙碱、痛风散低、中、高剂量组与模型组比较,IL-6、IFN-γ 有下降趋势,但没有显著性差异。模型组与空白对照组比较,TNF-α 呈上升趋势,秋水仙碱组、痛风散低、中剂量组与模型组比较,有下降趋势,但没有显著性差异,痛风散高剂量组与模型组比较,TNF-α 有下降趋势,具有显著性差异。模型组与空白对照组比较,EMR1呈上升趋势,秋水仙碱组、痛风散高剂量与模型组比较,EMR1 有下降趋势,但没有显著性差异,痛风散低、中剂量组与模型组比较,EMR1 无明显变化。模型组与空白组比较,IL-4 没有变化,秋水仙碱组、痛风散低、中、高剂量组与模型组比较,IL-4 无明显变化。模型组与空白对照组比较,IL-10 呈上升趋势,秋水仙碱组、痛风散低、中剂量组与模型组比较,IL-10 无明显变化,痛风散高剂量组与模型组比较,IL-10 有下降趋势,但没有显著性差异。模型组与空白对照组比较,TGF-β呈上升趋势,秋水仙碱组与模型组比较,TGF-β有下降趋势,具有显著性差异,痛风散低、中、高剂量组与模型组比较,TGF-β 无明显变化。见图3、图4、图5。
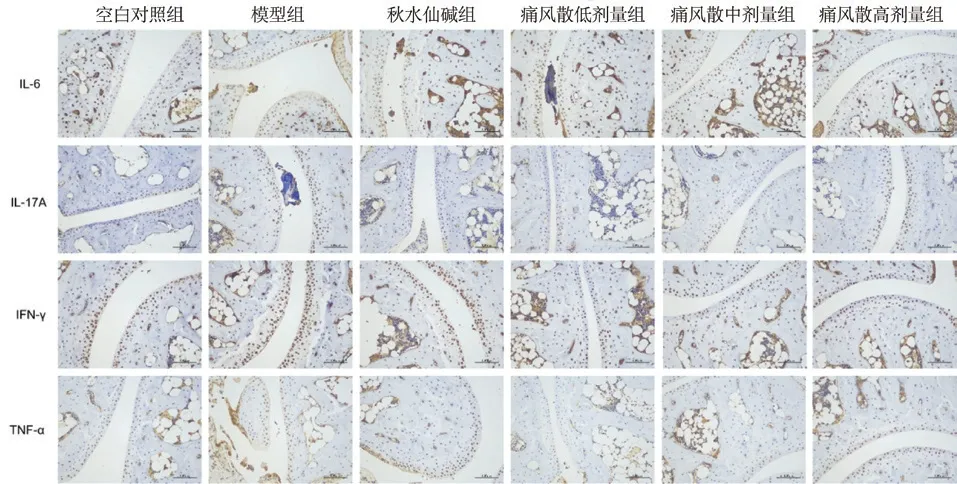
图3 小鼠踝关节IL-6、IL-17A、IFN-γ、TNF-α的表达量
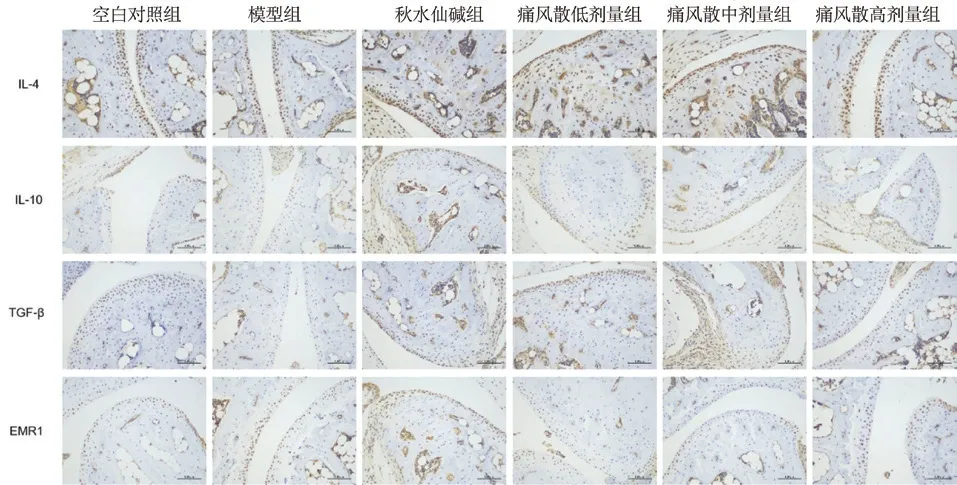
图4 小鼠踝关节IL-4、IL-10、TGF-β、EMR1的表达量

图5 小鼠踝关节的相关炎症因子表达量分析
3.6 Treg 细胞
为了探明痛风小鼠血液细胞 CD3+CD4+CD25+Treg 细胞的变化情况,对其采用流式细胞技术进行了检测。经造模后,模型组小鼠血液细胞中CD3+CD4+CD25+Treg 细胞的比例明显高于正常对照组(P<0.01)。而秋水仙碱组、痛风散各剂量组小鼠的Treg 细胞比例与模型组比较均有不同程度的升高,其中秋水仙碱组、痛风散低剂量组、痛风散中剂量组与模型组比较差异都有统计学意义(P<0.01)。见图6、图7。

图6 流式细胞术检测的各组CD3+CD4+CD25+的表达
4 讨论
经验方痛风散疗效显著且不良反应少,但作用机制尚不清楚。本实验采用尿酸钠混悬液踝关节注射配合腹腔注射氧嗪酸钾溶液,进行急性痛风性关节炎模型造模,然后用痛风散干预,通过观察各组小鼠的一般情况、造模踝关节的肿胀度、踝关节组织病理情况、小鼠血清相关生化指标的变化、踝关节免疫组化指标的检测、小鼠血液Treg 细胞的流式检测,探究经验方痛风散治疗痛风的疗效及可能作用机制。
现代医学普遍认为,高尿酸血症和痛风性关节炎属于痛风疾病的不同阶段,高尿酸血症是痛风性关节炎的前期病理过程,痛风性关节炎患者伴有血尿酸的升高,是尿酸沉积的结果。临床上用秋水仙碱治疗急性痛风性关节炎,主要是抗炎、减轻肿胀,无降尿酸的作用。但是在临床上患者的血尿酸水平升高作为诊断痛风的重要标准,所以本研究采用腹腔注射氧嗪酸钾诱导小鼠高尿酸,给予痛风散干预后,测定小鼠的血清尿酸,根据小鼠的血清尿酸水平判断痛风散的疗效。经过痛风散干预后,小鼠血尿酸明显降低,其中以痛风散低剂量组的效果最佳,表明痛风散对急性痛风性关节炎小鼠有治疗作用。
高尿酸血症和痛风与代谢综合征、脂肪肝、慢性肾病等疾病的发生发展密切相关,临床上也常常注意相关指标的检测,预防痛风的并发症。故研究中检测AST、ALT、CRE、BUN 指标,探讨痛风散对肝肾功能的影响[12]。痛风散干预后,各剂量组小鼠血清中肌酐和尿素氮都有所降低,中剂量的效果相对更明显。小鼠血清AST 和ALT 都明显降低,且以痛风散低剂量为最佳,表明本实验所用的痛风散对肝肾功能无不良影响,且对肝肾功能有较好的保护作用。
经痛风散的干预后,小鼠踝关节炎性细胞渗出浸润明显减少,滑膜增生减少,其中以痛风散中剂量组的效果为最佳。小鼠踝关节的促炎因子IL-6、IL-17A、IFN-γ、TNF-α 的表达有减弱趋势,抑炎因子IL-4、IL-10、TGF-β 表达有增强趋势。结果表明,痛风散对急性痛风性关节炎的治疗,可能是通过抑制促炎因子的IL-6、IL-17A、IFN-γ、TNF-α 表达和促进抑炎因子IL-4、IL-10、TGF-β 的表达实现。研究表明,血尿酸持续增高超过饱和状态,尿酸盐晶体沉积于关节等处诱导炎症反应的发生,炎症因子的释放受到多种信号通路和免疫细胞的调节[13],其中Th17/Treg 细胞失衡在痛风性关节炎中起重要作用,痛风患者中介导炎症的Th17 细胞表达增加而抑制炎症的Treg 表达减少[14]。IL-17A 主要是Th17 细胞分泌的炎症因子,而IL-10、TGF-β 主要由Treg 分泌[15],由此推测痛风散可能具有调节Treg 和Th17 的作用。研究结果发现,经过痛风散的干预后,小鼠Treg 细胞的比例有所升高,为上述推测提供了可靠的证据。
在实验结果中,低剂量比高剂量的实验数据较好,推测可能由于高剂量药物浓度过高,反而不利于药物的吸收,而药物的药理作用不是剂量越高越好,而是在一定范围内呈剂量依赖性,超过一定的剂量反而药效较差。
综上,本研究通过建立急性痛风性关节炎小鼠模型,评价了痛风散的抗痛风作用。结果显示,痛风散可以降尿酸,保护肝肾功能,缓解关节炎症肿胀,可以通过抑制炎症因子的生成发挥抗痛风的作用,其作用机制可能归因于痛风散促进Treg 介导的抑炎作用,进而抑制了促炎因子的表达。研究结果表明,痛风散对动物模型的作用与阳性对照药秋水仙碱相比,具有类似或更强的效果。本实验在动物水平上研究了痛风散作为抗痛风性关节炎的可行性,并初步探讨了其作用机制,为痛风散在临床使用提供一定的实验依据,同时也为新型抗痛风药物的开发提供思路。由于本研究只探讨了痛风散对急性痛风性关节炎的作用,而复方成分复杂,作用具有多成分多靶点的特点,对痛风散作用的有效组分和内在机制研究将是下一步研究的方向。
