固有手性化合物
2024-03-04师自法刘帅楠赵佳琳曹小平
师自法,刘帅楠,赵佳琳,曹小平
兰州大学化学化工学院,功能有机分子化学国家重点实验室,兰州 730000
国际纯粹与应用化学联合会(IUPAC)对手性(chirality)的定义为,如果一个刚性物体和它的镜像不能重叠,就称它具有手性。分子的手性主要有中心手性、轴手性、平面手性和螺旋手性等(图1)。目前无论天然或合成的绝大部分手性分子,都可用以上类型归属它们的手性特征。然而,科学家们在研究大分子和超分子过程中发现,有些分子尽管局部不含以上的手性因素,但分子整体却表现出手性。1994年德国科学家Böhmer综述了杯芳烃分子骨架上引入不同的非手性基团后,形成呈现整体手性的大环化合物,提出了用“固有手性(inherent chirality)”的概念来描述这类新型的手性特征[1]。自此之后固有手性这一术语被化学家广泛接受,常用于描述缺乏常规手性因素的大环分子。

图1 传统的手性化合物
2010年,Szumna在综述固有手性化合物和借鉴Mandolini等[2]描述的基础上提出固有手性的定义:无垂直对称面的曲面引起的手性(“inherent chirality arises from the introduction of a curvature in an ideal planar structure that is devoid of perpendicular symmetry planes in its bidimensional representation”)[3]。如图2所示,分子的各个部分都在同一平面上时,无手性,重心凸凹产生曲面时就产生了手性。尽管分子的局部不含传统的四种手性因素,但分子整体具有手性的特性。整个分子具有明显的曲面,且无垂直于曲面的对称面。
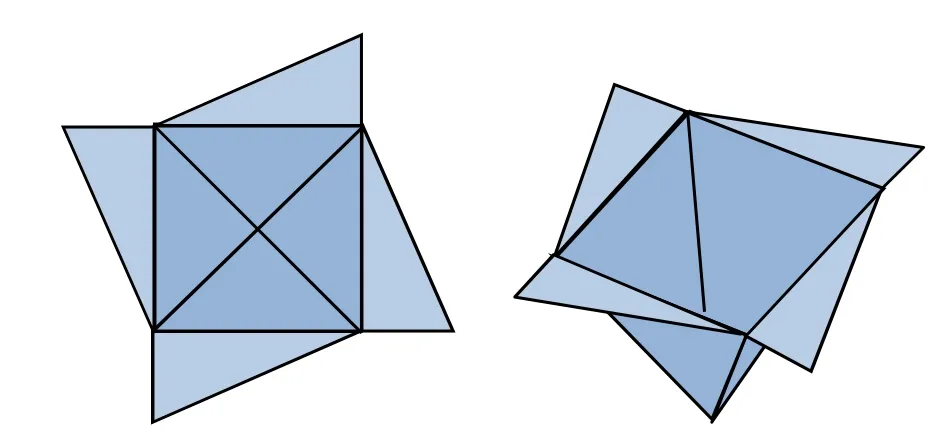
图2 固有手性示意图
本文将从天然固有手性化合物,合成的芳环间位(meta)相连的杯芳烃(calixarenes)、对位(para)相连的柱芳烃(pillararenes)、邻位(ortho)相连的环三藜芦烃(cyclotriveratrylenes,CTVs)、刚性三苯三戊并烯(trebenzotriquinacenes,TBTQs)、马鞍状八元环(saddle-like octatomic rings)、其他连接方式的素馨烯(sumanenes)、笼状化合物(cages)等详细介绍固有手性化合物的结构特点、合成、拆分及应用。
1 天然的固有手性化合物
大多数固有手性化合物都是人工合成的,但自然界也存在具有活性的固有手性化合物。化合物1是视网膜的发色团,由于甲基的空间位阻阻止了共轭双键完全共平面,在溶液中以固有手性的外消旋体存在。固态时的X衍射结构分析证实在蛋白质结合位点化合物1以手性构象存在,这是影响圆偏振吸收谱(CD)的主要因素(图3)[3]。

图3 视网膜发色团1的分子结构(左)和它的晶体结构(右)
2 固有手性的杯芳烃(calixarenes)
杯芳烃是苯环通过亚甲基间位相连形成的大环化合物,是最早被合成和拆分的固有手性化合物。杯[4]芳烃由于空腔较小,构象固定和易于衍生化颇受关注。杯芳烃2由于具有对称面而无手性。当苯环上增加取代基(3和4)、下方烷氧基至少三个不同(5)或四个芳环不同(6)时,分子对称面缺失而具固有手性(图4)[4]。
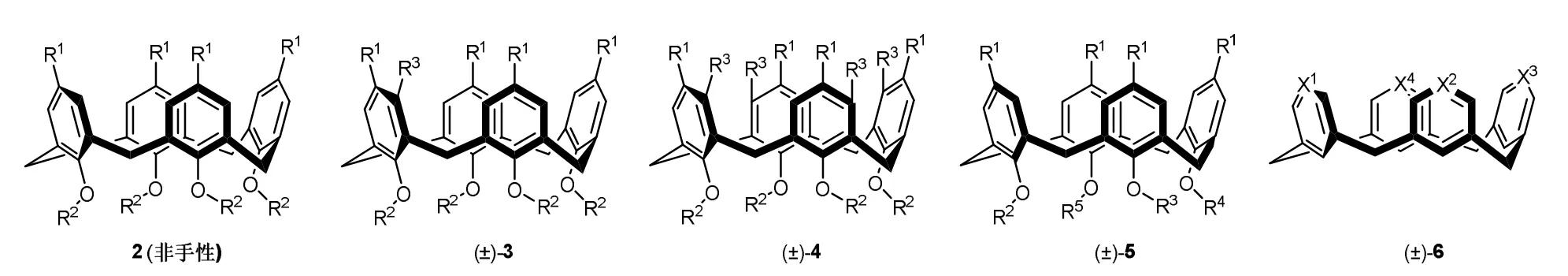
图4 杯芳烃及固有手性杯芳烃的结构
1990年,Shinkai等成功拆分了上沿甲基取代的固有手性杯[4]芳烃(±)-8[5]。他们用片段缩合法合成了杯芳烃(±)-7,上沿的其中一个苯环含有甲基。将(±)-7下沿的酚羟基全醚化后,制备了外消旋固有手性产物(±)-8,利用手性高效液相色谱(HPLC)拆分得到了对映体(–)-8和(+)-8,它们的CD谱表现为镜像对称图形(图5)。
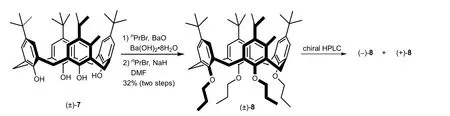
图5 固有手性杯芳烃8的合成与拆分
同年,他们又报道了首例下沿AABH取代固有手性杯[4]芳烃(±)-11的合成[6]。作者将对叔丁基杯[4]芳烃9用2-氯甲基吡啶(7)单醚化得(±)-10,继而与1-溴丙烷继续醚化制备了化合物(±)-11,再用手性HPLC拆分得到了对映体(–)-11和(+)-11 (图6)。

图6 固有手性杯芳烃11的合成与拆分
另一个重要的例子是Swager等报道的首例固有手性金属杯[4]芳烃(±)-13的合成及拆分[7]。他们将Böhmer等曾经报道的苯环上邻二甲基取代杯[4]芳烃(±)-12[8]与六氯化钨反应合成了锥形构象外消旋配合物(±)-13,用手性二苯乙二醇(S,S)-14将(±)-13衍生成非对映异构体15a和15b,经HPLC分离后除去手性助剂即得光学纯对映体(–)-13和(+)-13 (图7)。由于含钨杯芳烃具有路易斯酸性和刚性手性空腔,故在不对称催化和液晶材料等领域具有潜在的用途。
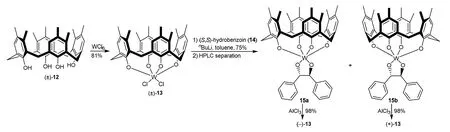
图7 固有手性杯芳烃配合物13的合成与拆分
最近,佟硕、王梅祥等采用金属不对称催化的方法合成了芳环间氮原子连接的杯[4]芳烃(–)-18和(+)-18[9]。他们以Pd2(dba)3为催化剂,分别用手性配体(R,Sp)-17和(S,Rp)-17使链状化合物16环化,高对映选择性地合成了ABCD型固有手性杯芳烃(–)-18和(+)-18 (图8)。它们具有独特的、受pH响应的圆偏振发光(circularly polarized luminescence,CPL)性能。该研究为固有手性化合物的催化不对称合成及开拓其在化学、医药和高技术材料领域的应用提供了新的思路。
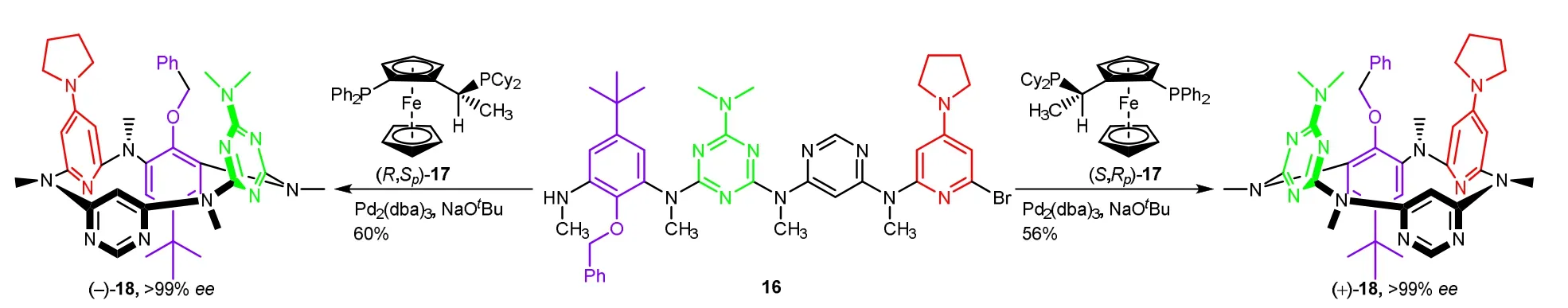
图8 固有手性杯芳烃18的不对称合成
3 固有手性的柱芳烃(pillararenes)
与杯芳烃不同,柱芳烃苯环间在对位通过亚甲基相连形成大环化合物。即使芳环上烷氧基全都相同,也因对称面缺失而具固有手性(图9)。固有手性柱芳烃(19)可以用P/M来定义其手性,根据Cahn-Ingold-Prelog顺序规则确定芳环上(或下)缘取代基的优先顺序,如果组序列按照逆时针排列,则认为该柱芳烃绝对构型为M型(M为minus,逆时针);相反,如果组序列按照顺时针排列,则为P型(P为positive,顺时针)[10]。

图9 固有手性柱芳烃19的结构
手性柱芳烃研究最多的是柱[5]芳烃。M和P构型的柱芳烃可以通过环的翻转相互转化,随着取代基体积增大,翻转能垒增加。Ogoshi等在柱[5]芳烃母环上引入大位阻基团——环己基甲基,得到十环己基甲基柱[5]芳烃外消旋体(±)-20,用手性HPLC分离得到了一对对映体(–)-20和(+)-20[11]。随后,他们使用偶联反应合成了柱[5]芳烃外消旋体(±)-21,同样采用手性HPLC法,拆分得到M型和P型单一构型的异构体(–)-21和(+)-21 (图10)[12]。

图10 固有手性柱芳烃20 (左)和21 (右)的拆分
Al-Azemi等以1-苄氧基-4-环己基甲氧基苯和1,4-二(环己基甲氧基)苯为原料制备了单苄基取代的柱[5]芳烃(±)-22,用钯/碳催化氢解脱去苄基,得到了单羟基的柱[5]芳烃(±)-23。用手性化合物(S)-24将其进行酰化后得到非对映异构体(M,S)-25a和(P,S)-25b混合物,通过柱层析法分离,再去除手性助剂合成了两个单一构型的异构体(M)-23和(P)-23 (图11)[13]。
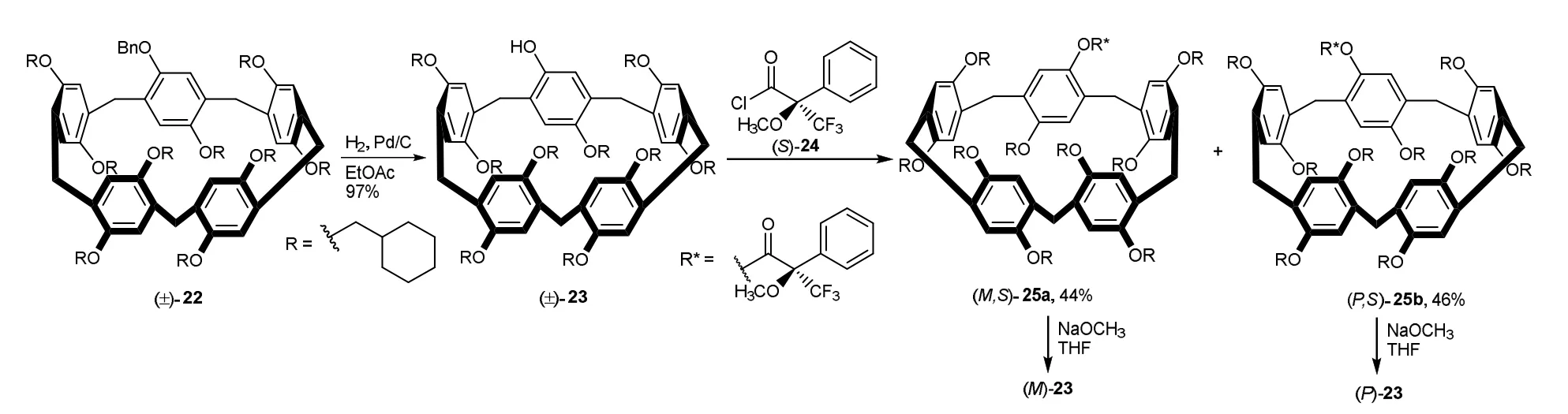
图11 固有手性柱芳烃23的合成与拆分
4 固有手性的环三藜芦烃(cyclotriveratrylenes,CTVs)
环三藜芦烃是三个苯环的邻位经亚甲基相连形成的大环化合物。由于其易获得性、稳定性及可直接修饰性而成为一种方便的凸形骨架。碗状倒置势垒(ΔE= 109.5–114.5 kJ·mol−1)足以使两种对映体在室温下拆分。当每个芳香环具有两个不同的取代基时,即具固有手性。Collet和Gottarelli等用苄醇26在酸性条件下环化一步合成了(±)-27,脱去烯丙基后与(−)-29酯化合成非对映体30a和30b,它们经柱层析分离后脱去手性助剂得到一对对映体(−)-28和(+)-28 (图12)[14]。

图12 固有手性藜芦烃28的合成与拆分
5 固有手性的三苯三戊并烯(tribenzotriquinacenes,TBTQs)
三苯三戊并烯与CTV的结构相似,也是三个苯环邻位通过碳原子连接成的大环化合物(图13,R3> R2)。三苯三戊并烯具有独特的刚性C3对称的凸凹碗状骨架结构,可视为三个茚满单元相互稠合而成,之间的夹角约为90° (31)。当其外围的苯环连有取代基时可形成单翼(32)、双翼(33)、三翼TBTQ(34),均具固有手性,是构筑手性功能分子的优良基元,在主客体化学、材料科学等领域应用广泛。
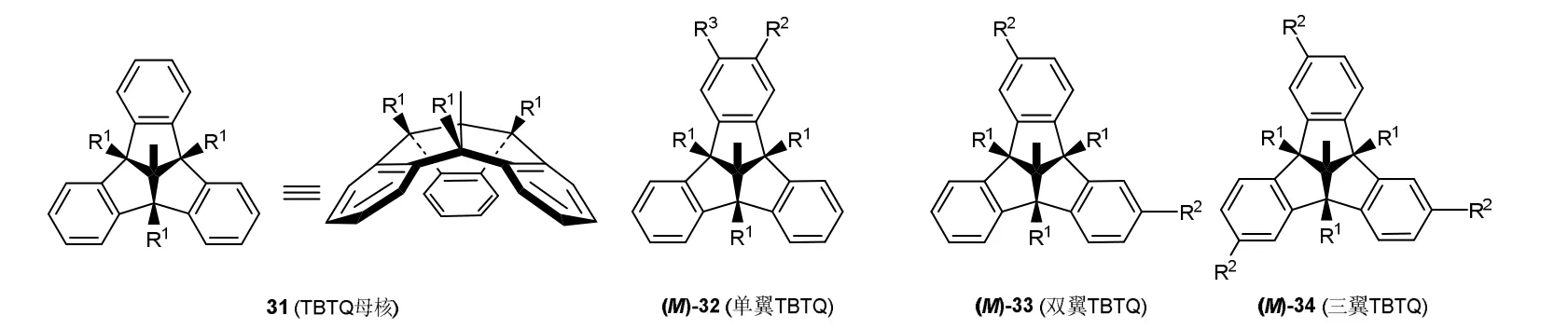
图13 TBTQ母核及固有手性TBTQ的结构
笔者所在课题组在2010年报道了首次用手性联萘酚拆分单翼固有手性TBTQ水杨醛的例子[15]。也通过对TBTQ母体35的硝化、还原制备了36,再溴化后成功的合成了单翼TBTQ (±)-37,并通过醛[(S)-38]与其生成的亚胺非对映体(–)-(M,S)-39a和(+)-(P,S)-39b,实现了(±)-37的光学拆分,得到了(−)-(M)-37和(+)-(P)-37,通过单晶X衍射分析确证了它们的绝对构型[16]。光学纯的(−)-(M)-37或者(+)-(M)-37通过Buchwald-Hartwig胺化反应,都可立体选择性合成吡嗪连接的syn-构型双-TBTQ衍生物(syn-40) (图14),单晶X衍射分析证实它的TBTQ部分相互为双凸构型,并保留了它们各自内部单翼的正交取向。
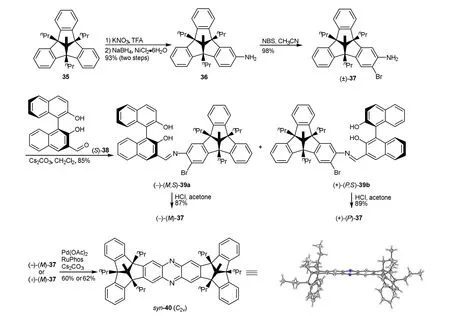
图14 单翼固有手性TBTQ衍生物的合成及在制备二聚体中的应用
我们也完成了双翼固有手性TBTQ的拆分[17]。用CH3OCHCl2/TiCl4对全甲基化TBTQ母体41进行区域选择性双酰化反应,再经还原和柱层析后得到了C1对称的2,6-双(羟甲基)-TBTQ (±)-42,及内消旋体meso-43和meso-44。将TBTQ双醇(±)-42转化为TBTQ双溴(±)-45后,用(R)-BINOL醚化制备了非对映体(R)-1,1’-双-2-萘酚醚(–)-47a和(+)-47b,再经柱层析分离后与PBr3反应实现了外消旋(±)-45的拆分。并由CD激子模型分析确定了(–)-45和(+)-45的绝对构型,它们的电子圆二色(ECD)谱和比旋度与DFT计算结果一致(图15)。

图15 双翼固有手性TBTQ衍生物的合成与拆分
2021年,我们报道了三翼固有手性TBTQ三胺的拆分[18]。用TBTQ母体35硝化后再还原的方法制备了C3对称三氨基取代的TBTQ (±)-48,并用Boc-D-苯甘氨酸(50)将其进行三酰化后,通过非对映异构体(+)-(M,R)-51a和(–)-(M,R)-51b的柱层析分离,除去手性助剂后得到了光学纯固有手性TBTQ三胺对映体(+)-(M)-48和(−)-(P)-48。随后以(+)-(M)-48和(−)-(P)-48为原料有效拓展为末端炔基元,并以此构筑了首例光学纯的TBTQ烃分子笼(+)-(M,M)-52和(−)-(P,P)-52,它们可能具有对映选择性主–客体化学识别作用(图16)。
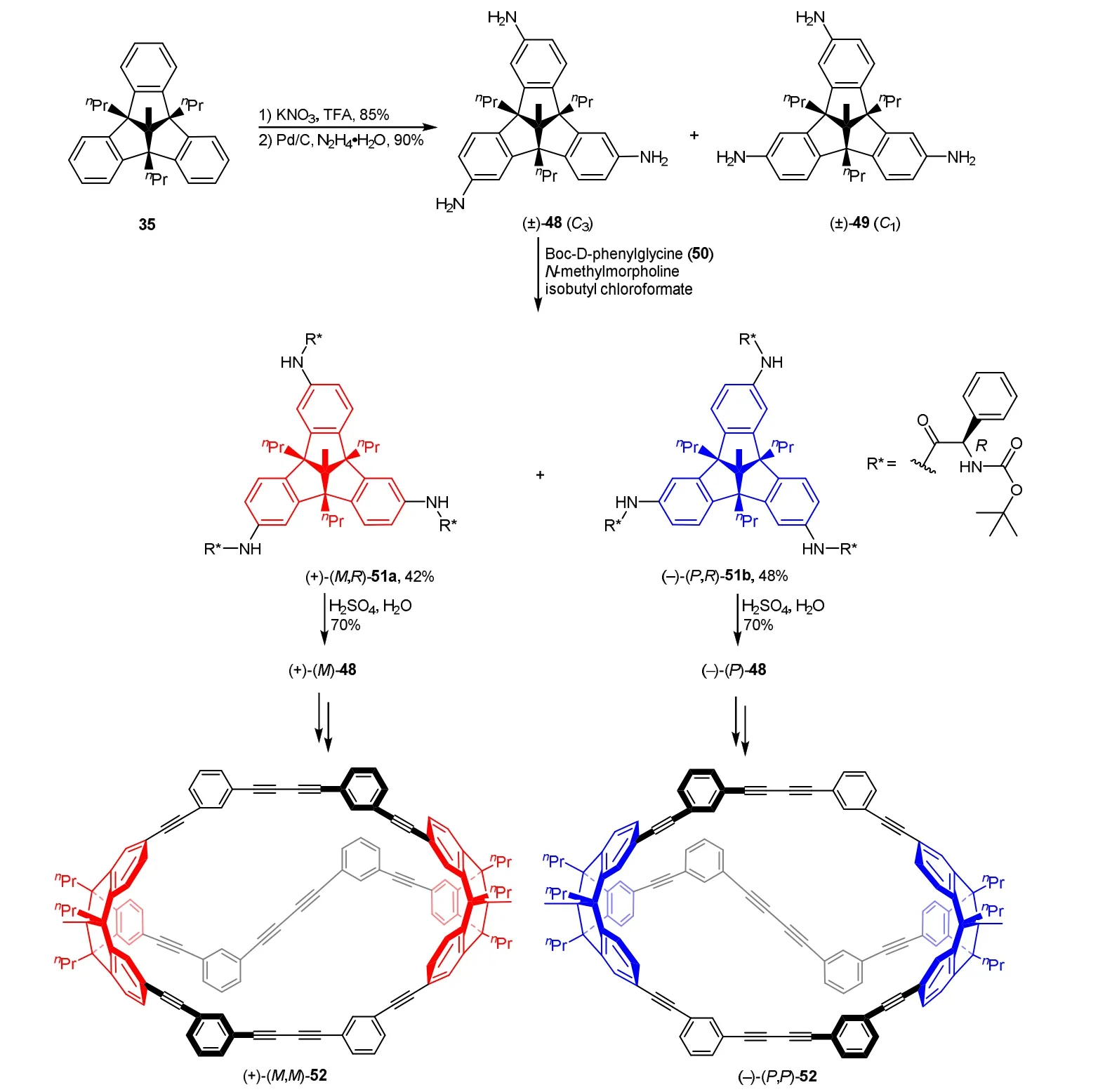
图16 三翼固有手性TBTQ衍生物的合成及在制备手性分子笼中的应用
6 固有手性的马鞍状八元环(saddle-like octatomic rings)
四个苯环的邻位通过单键相连形成马鞍状八元环化合物本无手性,但若其中的一个芳环上含有取代基时便具固有手性(53),而氮杂八元环类似物由于环内含杂原子(54–57)均具固有手性(图17)。

图17 固有手性的八元环马鞍型化合物
最近,朱强等报道了手性磷酸CPA催化的不对称缩合环化策略实现了这类化合物的对映选择性合成(图18)[19]。他们用廉价易得的联苯二胺58和苯偶酰59在手性磷酸CPA催化下直接发生不对称缩合环化,通过动力学拆分实现了固有手性6,7二芳基二苯并二氮杂环辛四烯类化合物(60,Ar1= or ≠Ar2)的合成。该反应无需金属参与、原料易得,水为唯一副产物,反应条件温和,收率高,对映选择性好。用此反应通过底物的取代基引入或产物的官能团转化合成了高度光学纯的邻二酚衍生物55、56、57。值得一提的是,朱强团队成功将通过以上策略获得的固有手性氮杂八元环骨架开发为一系列新型的固有手性试剂、配体及催化剂,其中多个化合物均可大量制备。
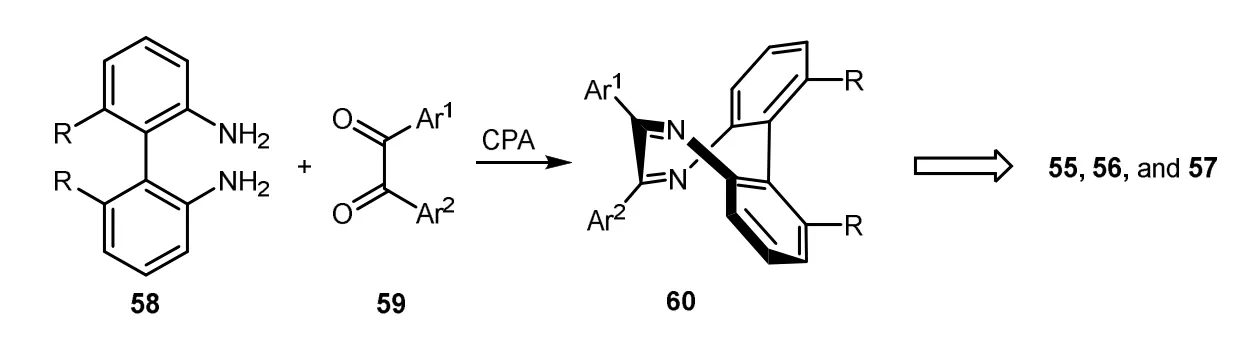
图18 固有手性马鞍型化合物不对称缩合环化合成
7 固有手性的素馨烯(sumanenes)
固有手性化合物除了上述苯环间通过邻、间、对位相互连接形成的大环化合物等外,还存在其他结构类型。素馨烯被认为是富勒烯的组成单元,都是碗状的碳氢化合物。当外围连有取代基时导致其对称面缺失而具固有手性。素馨烯(65)的一对对映体可通过碗型翻转相互转换,翻转能为87.8 kJ·mol−1,在较低温度下可拆分。Sakurai等用底物手性诱导的方法合成了(M)-65[20],他们将手性化合物(1S,4S)-61三分子偶联成62,再通过烯醇磷酯化后与甲基格式试剂偶联合成了(−)-63,随后经两次烯烃复分解反应得到(+)-64,再在零度下快速氧化成(M)-65,其消旋化半衰期为2 h (图19)。

图19 固有手性素馨烯(M)-65的合成
8 固有手性的分子笼(cages)
2022年,王其强等通过对称笼的分层去对称化合成了一系列固有手性分子笼[21]。固有手性分子笼71和72的合成如图20所示,他们用三溴三酚66与三氯三唑67及均三酚69制备了C3v对称的分子笼70,其结构为三个缺电子的三嗪臂被溴代间苯三酚和间苯三酚封端。然后将其三嗪臂上的氯原子分层取代合成了(±)-71和(±)-72,它们经手性HPLC拆分分别获得了光学纯的固有手性笼(−)-71、(+)-71、(−)-72、(+)-72。由于锁定笼连接,该类分子笼不会发生环翻转导致的外消旋现象。该作者相信,获得固有手性笼为扩大功能化学领域铺平了道路,并预见该策略可以扩展到其他类型的分子笼及更复杂的功能分子结构。

图20 固有手性分子笼71和72的合成
9 结语
综上所述,随着手性研究的不断深入,一系列具有新型结构的固有手性化合物被设计、合成出来,极大丰富了分子手性的内涵。由于固有手性化合物结构特殊,其在手性光学材料、刺激响应材料、手性传感器、手性催化剂、手性载体和手性纳米材料等领域的应用具有广阔的发展空间和研究意义。
