模拟太阳光下驱动H2O2生成及含量测定的综合实验
2024-03-04刘浩申屠宁赖志楠曾晓飞朱乔虹
刘浩,申屠宁,赖志楠,曾晓飞,朱乔虹
杭州师范大学材料与化学化工学院,杭州 311121
1 引言
随着2020年中国“双碳”政策[1]的出台以及全球环保浪潮的兴起,新能源的重要性和紧迫性在当前环境下愈发凸显。太阳能取之不竭且环保无污染[2],使得其能成为推动可持续发展的重要力量。然而,目前在化学本科生的教育和实验中,对太阳能的应用了解仍然有所欠缺。化学本科生对如何利用太阳能进行能源转化的实验技术和知识了解不足,这限制了学生对新能源利用和可持续发展概念的深入理解和创新思维开发。因此,为使得低碳可持续化学的概念深入人心,我们迫切需要加强对化学本科生在能源利用和转换方面的教育和实践教学,以培养出具备深入了解和创新太阳能技术的专业人才。
过氧化氢具有良好的氧化还原特性,且反应后几乎不产生污染物,在有机化工[3]、外科手术[4]、生物医学[5]、废水处理[6]、储能[7]等领域发挥着举足轻重的作用。传统工业生产过氧化氢的方法是蒽醌法,有能耗大、污染排放严重等缺点[8],不能充分满足绿色化学发展的理念。而利用太阳能驱动产生过氧化氢的过程,依靠太阳能可为反应提供持续的能源来源,从而降低生产成本。其次,反应产物绿色环保,一定程度上解决了蒽醌法需要大量排放污染物的问题,减少环境压力,有助于建立可持续的工业生产模式。从Web of Science的检索结果可知(图1),基于g-C3N4太阳能驱动H2O2合成[9]领域相关的研究逐年增多,2022年更是有4078篇相关工作被报道。
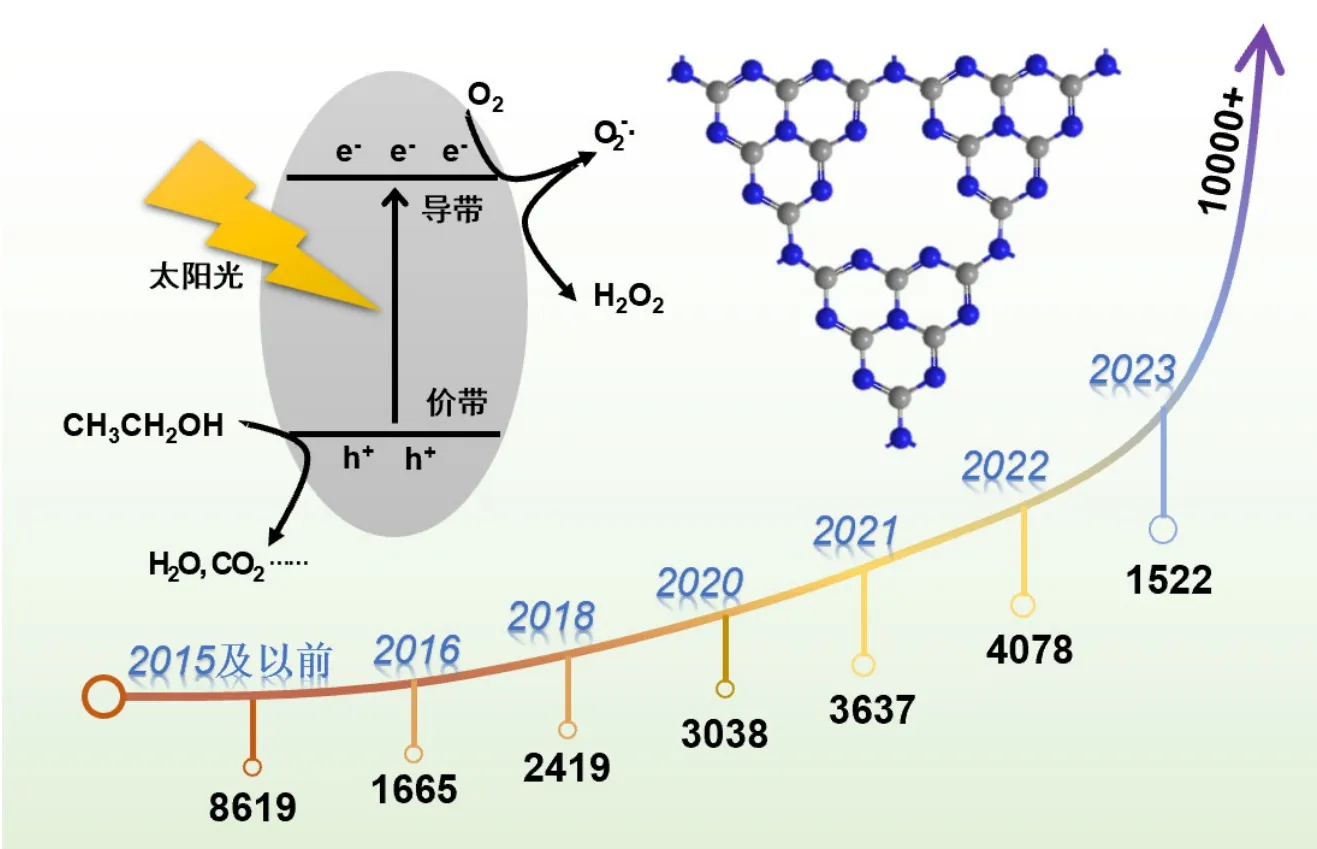
图1 基于g-C3N4太阳能驱动H2O2合成领域论文发文数量统计
基于以上原因,我们设计了“模拟太阳光下驱动H2O2生成及含量测定的综合实验”。该实验包括热聚合法制备光催化剂、光催化剂的结构表征、光催化合成H2O2活性测试和H2O2含量测定。在正式开展实验之前,鼓励学生查阅文献,了解热聚合法制备g-C3N4和光催化生成H2O2的机理;实验过程中,让学生熟悉有氧环境的具体操作方法和紫外-可见光分光光度计的使用,全过程操作简单且安全;实验后,让学生记录分析测试结果、使用Origin进行建模,制作误差棒,结合X射线衍射仪(XRD)、傅立叶变换红外光谱(FTIR)、透射电子显微镜(TEM)综合分析实验结果,培养学生独立思考、总结经验的能力。在实验内容的编排上,该实验将无机化学、物理化学、分析化学等基础化学知识与光催化等热门前沿课题结合,拉近学生与化学前沿的距离,激发学生对科研的热情,同时加深对绿色化学理念的理解,拓展学生思维,让学生知道“光”也是重要的反应条件,满足学生发展需求。本实验总耗时约8 h,符合基础教学实验的要求。
2 实验部分(以双氰胺为例)
2.1 实验原理
2.1.1 热聚法制备g-C3N4形成机制
如图2所示,当温度上升至60–300 °C,双氰胺开始脱氨缩聚形成三聚氰胺;温度继续上升至350 °C,三聚氰胺脱氨形成三聚氰胺二聚体;当温度升至390 °C以上,三聚氰胺二聚体进一步脱氨,重排,形成3-s-三嗪(Melem);Melem作为g-C3N4单体在500 °C继续脱氨,形成聚合度较低的Melon,当温度到达520 °C后,Melon聚合形成g-C3N4[10],一种硬度可以和金刚石相媲美而在自然界中尚未发现的共价化合物。

图2 g-C3N4热聚法形成示意图
2.1.2 光催化产H2O2机理
在能级图中,处于同一能级或者能量差异微小的能级为能带。其中,允许被电子占据的能带为“允带”,允带之间不允许电子占据的范围称为“禁带”。在基态下,被电子占据的允带称为“价带”,上面未被电子占据的允带称为“导带”。导体的禁带很窄,因此可以认为其能带是连续的,电子可以在价带与导带之间自由移动;绝缘体的禁带很宽,电子无法从价带穿越禁带到达导带[11]。而半导体介于两者之间,当太阳光入射给予一定能量后,半导体会产生电子空穴对,具有还原性的电子(e−)可以从价带跃迁到导带,而具有氧化性的空穴(h+)则遗留在价带。太阳能驱动H2O2生成的机理可分为以下步骤:首先受模拟太阳光照射,半导体被激发,产生电子空穴对;氧气被电子还原产生结合H+产生再次被导带电子还原产生,最后与H+结合产生H2O2[12](4),以此循环,实现太阳能到化学能的转换和储能。
2.2 试剂
本实验所需主要试剂如表1所示。

表1 所需主要实验试剂
2.3 仪器
本实验所用主要仪器如表2所示。

表2 所用主要实验仪器
2.4 实验步骤/方法
2.4.1 g-C3N4催化剂的制备
采用热聚合法制备g-C3N4(图3)。在坩埚中加入双氰胺至三分之二处,在马弗炉中以10 °C·min−1的升温速率加热至550 °C,保温2 h,冷却至室温。将得到的黄色固体仔细研磨,转移至离心管中,即得g-C3N4,标记为YCN。
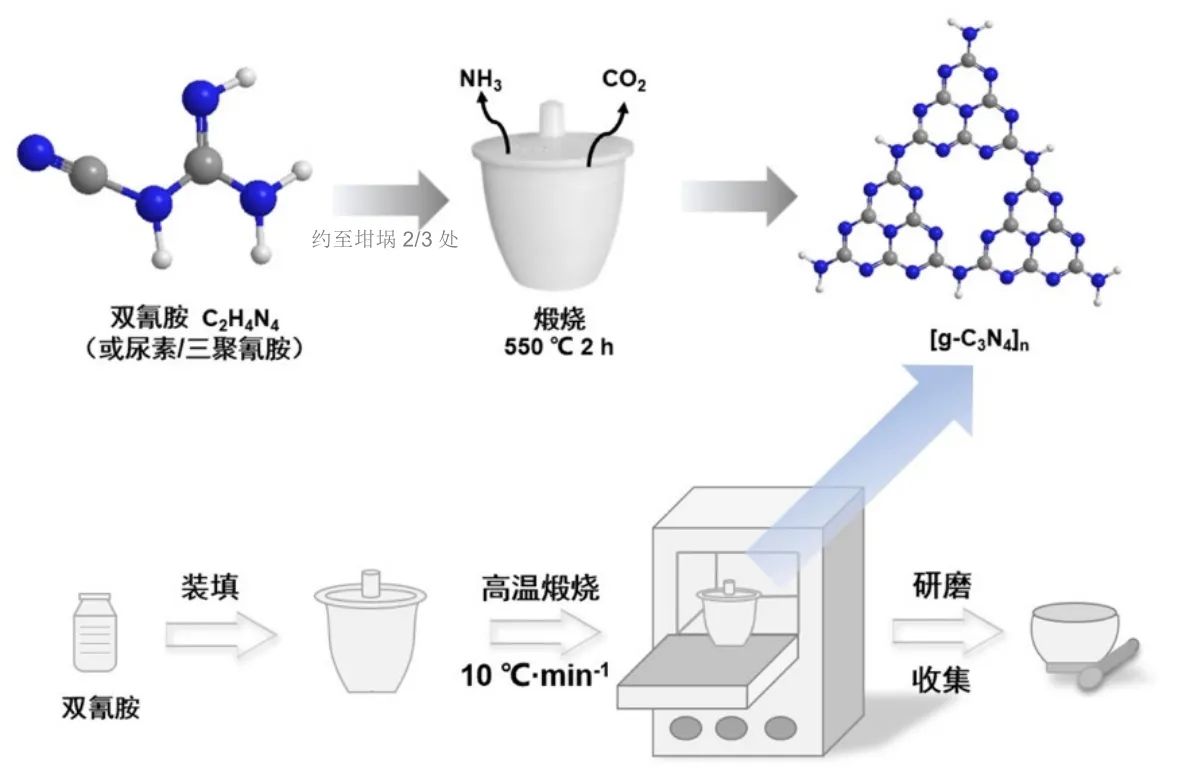
图3 光催化剂制备实验流程图
2.4.2 g-C3N4催化剂的结构表征
样品用X射线光电子能谱仪测定得XRD图,以识别样品的相结构并推断样品的晶体结构和结晶度。
取微量样品与KBr粉末混合研磨后压片,并将制好的薄片轻轻放在锁式试样架上,用傅里叶红外光谱仪扫描得FTIR图,以分析样品中化学基团与化学键等信息。
将少量样品分散于乙醇溶液中进行超声处理。30 min后将混合液滴于铜网上,待干燥后,用透射电子显微镜拍摄得TEM图,以观察样品的形貌结构。
2.4.3 光催化合成H2O2
取20 mg光催化剂于石英试管中,加入磁子、45 mL去离子水和5 mL乙醇[13],待超声后塞上橡胶塞,贴好封口膜。用水泵抽去试管内空气,边抽边振荡,在观察到橡胶塞凹陷时,拔出针管同时插入氧气气球,气球针头需伸入液面以下(对照实验环境为空气和氩气)。重复三次抽换气操作,制造充满氧气的光催化反应环境。将试管固定在磁力搅拌器上,设置搅拌速率,戴上护目镜,开启搅拌器,在模拟太阳光照条件下进行合成H2O2实验(图4),实验进行1 h。每隔10 min取1次样,用0.22 μm注射过滤器除去光催化剂后注入离心管待用。

图4 模拟太阳光驱动H2O2生成实验装置图
2.4.4 H2O2的含量测定及条件优化
用碘量法测定H2O2的浓度。用移液枪取100 μL待测溶液,加入到螺口玻璃瓶中,标记顺序1至6。分别在待测溶液中加入400 μL的去离子水,2000 μL的碘化钾溶液(0.1 mol·L−1)和50 μL的四水合钼酸铵溶液[14](0.01 mol·L−1),摇匀,采用紫外-可见分光光度计在350 nm处检测吸光度,重复三次。此外,使用标准浓度H2O2溶液,以上述步骤测定吸光度A*,重复三次。根据朗伯-比尔定律:A=lg(1/T) = Kbc(A为吸光度;T为透射比,是出射光强度I比入射光强度I0;K为摩尔吸光系数,它与吸收物质的性质及入射光的波长λ有关;b为吸收层厚度,单位为cm;c为吸光物质的浓度,单位为mol·L−1。)将A*带入公式,制作标准曲线(A= 0.0183c+ 0.0492);再将待测溶液吸光度A代入标准曲线,计算生成H2O2的含量。使用Origin软件计算三次反应的误差棒,用于显示实验的误差情况。
2.5 教学实践
本实验采用两人一组形式,一名学生负责主要操作,另一名学生负责辅助操作以及数据处理。为确保实验安全性,本实验在一堂实验课中安排10组学生,共20人。本实验以一整天形式展开,上午制备一轮g-C3N4催化剂和进行g-C3N4结构表征的教学,下午进行三轮光催化合成H2O2及其含量测定,总耗时约8 h。为保证实验高效性,学生仅以双氰胺为原料制备g-C3N4;煅烧期间,以三种预先制备的标准样,对学生进行g-C3N4结构表征的同步教学;催化剂性能测试时,双氰胺(YCN)为原料的g-C3N4为学生制备,以尿素(UCN)、三聚氰胺(MCN)为原料的g-C3N4由实验教师预先准备。实验过程中,使用马弗炉涉及高温操作,必须待炉内温度降至100 °C再用坩埚钳取出坩埚;氙灯发出的强光对眼睛存在潜在伤害,因此,在光催化期间打开通风厨操作时必须戴上护目镜。绝大多数学生反映,通过本实验,学会如何操作马弗炉,了解光化学反应机理,加深对绿色化学的认识,基本达到预定教学目标。
3 结果与讨论
3.1 用于制备H2O2的g-C3N4催化材料的原料优化
g-C3N4可以通过各种富氮原料合成,不同原料合成的材料在催化合成H2O2的性能有所差别。为探究更适合本科的实验教学,选用经济的尿素、双氰胺和三聚氰胺作为原料,以同样的策略合成g-C3N4,分别标记为UCN、YCN和MCN,测定其催化合成双氧水的性能。
3.2 结构表征
为使学生将在结构化学中学习的晶体理论知识与实验相结合,采用XRD测定材料的晶体特征出峰(图5)。在13°附近的出峰对应的是g-C3N4(100)晶面,代表三嗪环结构单元,即面间堆积基元;在27°附近的出峰对应g-C3N4(002)晶面,代表类石墨相物质的层状排列,即π–π层间堆积基元。不同原料合成的g-C3N4均展现明显的特征峰,说明以尿素、双氰胺、三聚氰胺为原料,均可成功制备层状g-C3N4催化材料。此外,XRD显示没有杂峰的出现,表明所有样品均为高纯相。
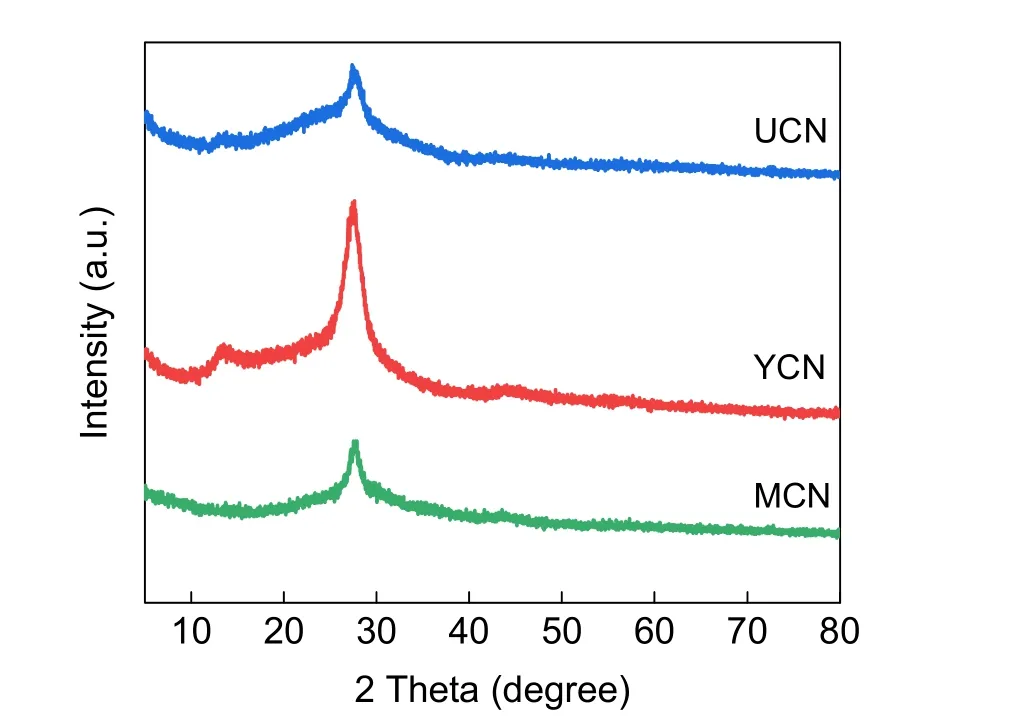
图5 YCN、UCN、MCN的XRD图
为提升学生分析样品内化学基团与化学键情况的能力,实验采用FTIR对材料进行表征。观察图6可知,在808 cm−1处YCN、UCN和MCN均存在尖锐的特征吸收峰,归因于g-C3N4的三嗪环结构;在1200–1650 cm−1处的吸收带是指杂环的C―N和C=N伸展振动;3000–3600 cm−1的宽吸收带对应N―H伸缩振动峰。红外进一步证实,以三种原料都可以成功实现该材料的制备。
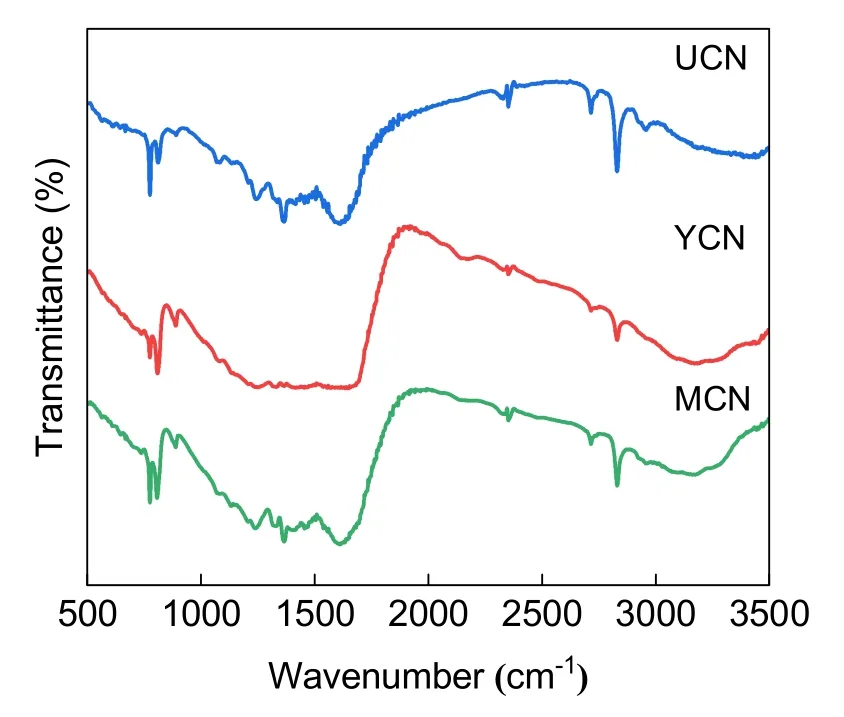
图6 YCN、UCN、MCN的FTIR图
为使学生更直观了解材料实际微观形貌,将TEM引入实验中,结合相机进行介绍,测试结果如图7所示。三种材料均具有g-C3N4典型的层状结构,对应g-C3N4材料的π–π层间堆积。其中UCN形貌最薄且具有较多孔洞,说明面间堆积和层间堆积相对较弱,与XRD中两个特征峰峰强度较弱相互印证。

图7 (a) YCN的TEM图像;(b) UCN的TEM图像;(c) MCN的TEM图像
3.3 催化性能测试
基于紫外-可见分光光度计测试,通过朗伯-比尔定律将吸光度转化为浓度,出于还需加入碘量法所需试剂以及防止超过紫外分光光度计最大量程的考虑,故将试样进行稀释,计算结果的5倍为真实产率。结果如图8显示,不同原料合成的g-C3N4都能驱动过氧化氢生成,速率由快到慢依次为YCN、MCN、UCN,最高的双氧水浓度达到282 μmol·L−1(YCN)。通过该过程,可提升学生的逻辑思维能力和数据分析能力。
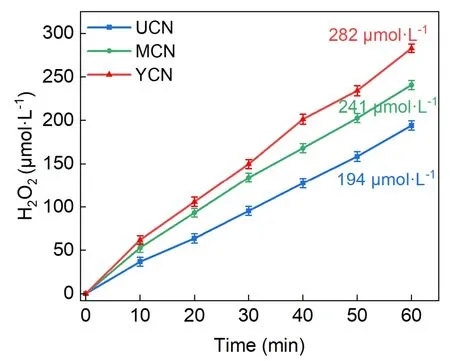
图8 在太阳光照射下H2O2产生的时间过程图
在具体的实验教学中,为提升学生自主设计实验优化反应条件和探究相关机理的能力,可更换气体氛围进行对照实验测试(图9)。随着环境中氧气浓度的降低,双氧水产量大幅下降。在纯氧气氛围下产量最高,而在无氧的氩气氛围下产量几乎为0,这归因于半导体受光照激发后,氧气直接被电子还原为,从而促进双氧水的合成。
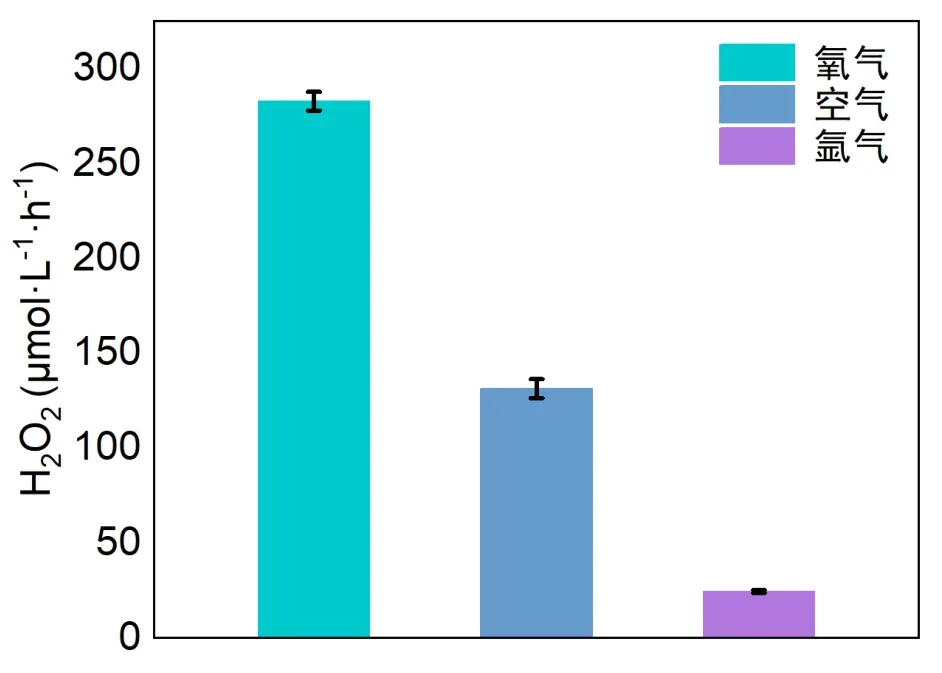
图9 在不同条件下基于YCN的太阳能驱动合成H2O2产量对比图
4 实验拓展(该部分实验数据均为实验教师预先测得)
4.1 光催化材料元素组成和价态分析
基于前期的综合实验,供学有余力的学生进一步进行科学分析和创新研究,设计两个拓展实验。对于聚合物g-C3N4的清晰组成和价态分析,可以考虑用X射线光电子能谱(XPS),定性分析材料表面的组成,同时获得样品中的化学键存在信息(图10)。
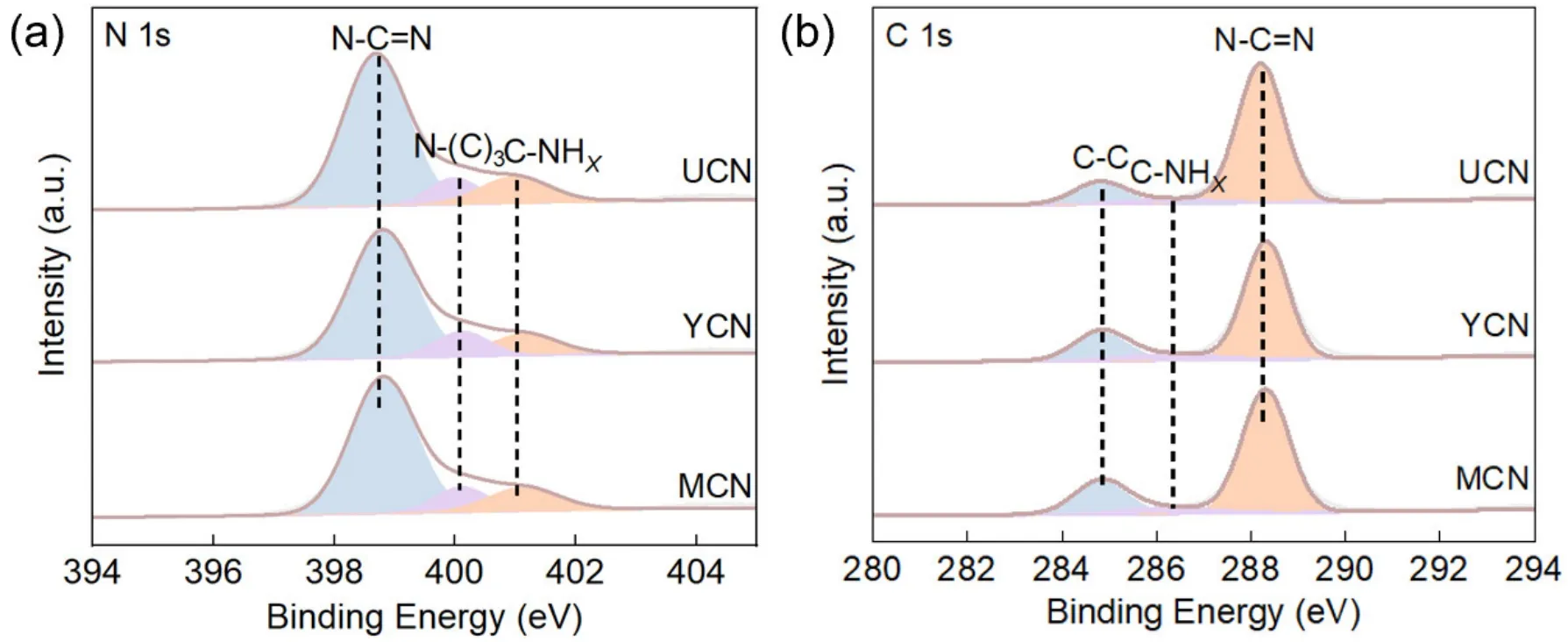
图10 YCN、UCN、MCN的C 1s XPS图和N 1s XPS图
结合测试和分析结果,三种样品的C 1sXPS出峰在288.5、286.40和284.80 eV处含有三个峰,分别对应于g-C3N4的杂环、C―NHX和不定碳的芳环中的N―C=N。N 1sXPS中可观察到398.9、400.3和401.5 eV处的三个特征出峰,分别对应结构中的双配位氮(C―N=C,N2C)、三配位氮(N―(C)3,N3C)和NHX基团。通过使用Origin对元素图绘制曲线并进行出峰拟合,进一步将基础的实验技能和绘图技能融合进本科教学中。
4.2 半导体带隙计算
禁带宽度是导带的最低点和价带的最高点的能量之差,是半导体材料的重要参数。禁带宽度越大,电子由价带被激发到导带越难,本征载流子浓度就越低,电导率也就越低。基于仪器分析中最基础的紫外-可见分光光度计,结合物理化学知识,可以计算本实验中的半导体带隙宽度。
如图11(a)所示,首先利用截线法做出吸收波长阈值λg(nm),得出YCN、UCN、MCN的吸收波长阈值分别为518、466和485 nm。光学吸收系数满足方程:αhν= Bd(hν−Eg)n[15](α为吸收系数;hν为入射光子能量;Eg为样品的禁带宽度(eV);Bd为吸收常数;n= 2)。利用该方程可以进行半导体禁带宽度(Eg)的计算。如图11(b)所示,将hν对(αhν)1/2作变化关系图,做切线交于X轴,该交点即对应半导体材料的Eg,YCN、UCN、MCN三种材料的Eg分别为2.40、2.56和2.66 eV。然后如图11(c)所示作价带谱图,可得材料价带的能带位置。用价带减去禁带宽度即可得材料导带的位置,如图11(d)所示。通过实验操作和计算,使学生掌握常用的计算半导体带隙的方法,熟悉紫外-可见吸收光度计在化学实操中的广泛应用。
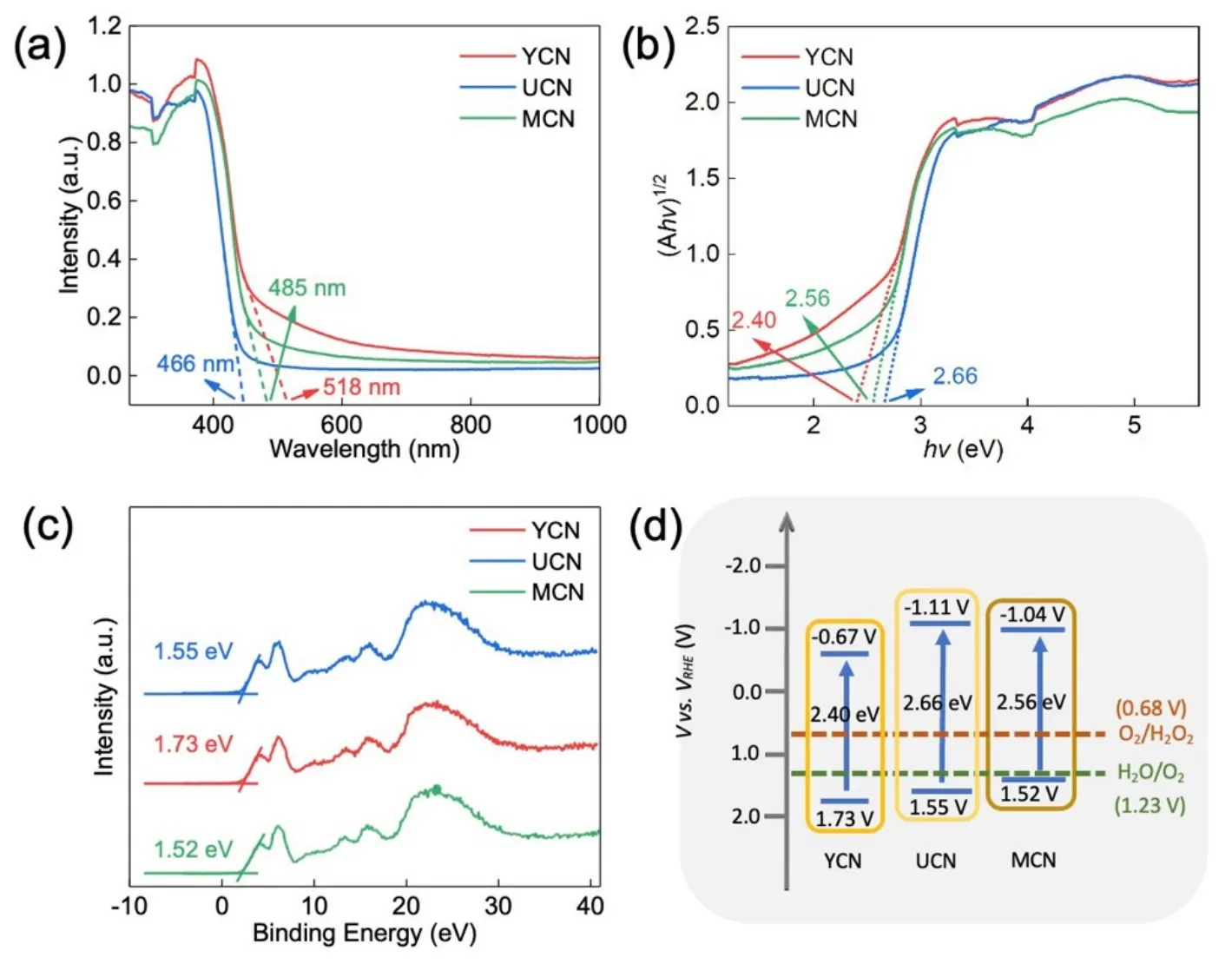
图11 (a) 三种材料的UV-Vis差分反射光谱(DRS)图;(b) 三种材料的的带隙计算图;(c) 三种材料的XPS价带图;(d) 能带结构示意图
5 结语
本实验基于不同原料制备g-C3N4,设计了一个简单的太阳能驱动过氧化氢合成实验。催化反应在1 h内即可完成,并通过显色法和紫外-可见分光光度计检测实验结果。结合材料表征、结构分析和形貌考察,确定了g-C3N4的成功合成。在对其光催化环境氛围探究过程中发现,氧气的存在对于反应有促进作用,证实该类反应在空气中进行的可能性。
本实验结合最新的研究热点和研究进展,通过实验实践、讨论分析和拓展衍生,结合无机化学、物理化学和分析化学的知识基础,引导学生回顾紫外-可见分光光度计的原理和朗伯比尔定律,整合Origin作图分析方法和现代化仪器表征分析方法,实现教学与科研的有效结合,将书本上的知识“实体化”,培养学生的开放思维和创新能力。
