拉考沙胺与卡马西平治疗成人新诊癫痫的有效性和安全性对比Δ
2024-03-04郭夏青李郭飞孙玉华郑东琳河南大学淮河医院神经内科一病区河南开封475000
郭夏青,李郭飞,孙玉华,郑东琳 (河南大学淮河医院神经内科一病区,河南 开封 475000)
癫痫是一种由多种病因引起的脑部神经元同步异常放电的神经系统疾病,常导致患者发生周期发作的、不受控制的神经元电活动,进而引发多种临床症状[1]。癫痫的发作形式多样,包括全身抽搐、意识丧失、行为异常以及感觉、情感、认知障碍等[2]。癫痫的治疗手段包括药物和手术治疗等,其中药物治疗是用于控制癫痫发作的主要方法,以单一药物治疗较为常见[3],常用抗癫痫药(anti-epileptic drugs,AEDs)包括苯巴比妥酸类药物(苯巴比妥、扑米酮等)、钠通道阻滞剂(卡马西平、苯妥英钠等)、钙通道阻滞剂(加巴喷丁、肌苷、丙戊酸钠等)以及γ氨基丁酸促进剂(地西泮、氯硝西泮等)等[4]。癫痫患者常需接受长期治疗,且相关药物的选择和剂量须随时调整,以实现最佳的疾病控制效果[5]。有研究指出,在首次接受适宜的单药治疗后,大部分新诊断患者的病情可得到有效控制,且70%~75%的患者经单药治疗后1年内未再发作[6];但治疗若不及时,约70%的新诊癫痫患者会随疾病进展而出现认知功能下降,并存在较高的痴呆发生风险[3]。可见,合理选择AEDs并尽早进行干预对于新诊癫痫患者的治疗和预后十分重要。
拉考沙胺(lacosamide,LCM)为第三代AEDs,可作用于慢失活钠通道,延长其失活状态时间,从而减少神经元中异常放电的传导,达到抗癫痫的作用。研究指出,LCM可作为新诊癫痫患者的有效治疗药物,对于局灶性癫痫患者的治疗效果尤为显著;此外,LCM不经肝脏代谢,不与其他AEDs发生相互作用,也不会引发低钠血症(第一、二代AEDs的常见不良反应),因此其耐受性和安全性也较好[7]。卡马西平(carbamazepine,CAR)为第一代AEDs,是癫痫治疗的经典药物。本研究基于现有临床证据,采用回顾性分析方法,以CAR为对照,初步评估LCM治疗成人新诊癫痫患者的效果及安全性,为该类患者治疗药物的选择提供参考。
1 资料与方法
1.1 研究对象
根据用药方案的不同,将2020年9月-2022年6月河南大学淮河医院神经内科收治的成人新诊癫痫患者(84例)分为对照组(40例,接受CAR治疗)和观察组(44例,接受LCM治疗)。本研究方案经河南大学淮河医院医学伦理委员会审核批准(审批编号2023224)。
本研究的纳入标准包括:(1)符合2014年国际抗癫痫联盟制定的癫痫诊断标准[8];(2)根据头颅CT或磁共振成像结果,新诊断为局灶性癫痫发作,伴有或不伴有继发性全面性发作,但不包括典型或不典型的失神发作、肌阵挛或失张力发作;(3)年龄为18~55岁,意识清醒;(4)无药物过敏史,且未服用过LCM与CAR。
本研究的排除标准包括:(1)合并有心、肝、肾等严重的基础疾病以及患有免疫和感染相关性疾病者;(2)有精神障碍病史者;(3)对LCM或CAR过敏者;(4)同时服用其他药物抗癫痫者;(5)妊娠及哺乳期妇女;(6)存在颅内进行性疾病者;(7)依从性不良者。
1.2 治疗方法
观察组患者口服拉考沙胺片(江西青峰药业有限公司,国药准字H20193022,规格100 mg),初始剂量100 mg,每天1次;1周后增加至100 mg,每天2次;基于疗效和耐受性,每周增加维持剂量,单次增加50 mg,直至最高推荐日剂量400 mg(即每次200 mg,每天2次)。对照组患者口服卡马西平片(北京诺华制药有限公司,国药准字H11022278,规格100 mg)100 mg,每天1次;基于疗效和耐受性,剂量逐渐增至100 mg,每天2次。两组患者均连续治疗了3个月。治疗过程中,由与患者同住的家属监督用药,以保证患者的依从性。
1.3 观察指标
1.3.1 临床疗效及癫痫发作频率
收集两组患者治疗后第1个月和第3个月时的疗效评估结果。以治疗前3周的平均发作频率为基线,根据治疗后第1、3个月时的癫痫发作频率减少百分比将疗效划分为如下等级:完全控制,即发作减少100%;显效,即发作减少75%~<100%;有效,即发作减少50%~<75%;无效,即发作减少<50%或发作次数较前增多。总有效率=(完全控制患者数+显效患者数+有效患者数)/患者总数×100%[8]。同时,收集两组患者治疗前以及治疗后第1、3个月时的癫痫发作频率。
1.3.2 血脂水平
收集两组患者治疗前及治疗后第3个月时的血脂水平检测结果。两组患者于上述时间点空腹抽取静脉血5 mL,将血浆样品室温静置10 min后,以3 000 r/min离心10 min,取上层血清,检测并记录其中总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)水平。所用仪器为日本TOSHIBA公司的TBA-120型全自动生化检测仪,相关试剂盒均购自郑州麦斯凯生物技术开发有限公司。
1.3.3 安全性
收集两组患者治疗期间的不良事件(adverse events,AEs)发生情况,包括嗜睡、乏力、头晕、恶心呕吐、心悸及烦躁等。
1.4 统计学方法
运用SPSS 22.0软件对数据进行统计分析。计量资料以±s表示,组内前后测量数据采用配对t检验,组间比较采用独立样本t检验,多次测量结果采用重复测量方差分析;计数资料以例数或率表示,组间比较采用χ2检验。检验水准α=0.05。
2 结果
2.1 两组患者的一般资料
对照组患者中,男性20例、女性20例,年龄18~65岁,平均(28.50±9.54)岁;治疗前每月发作频率为1~8次,平均(6.18±2.21)次。观察组患者中,男性24例、女性20例,年龄18~67岁,平均(28.51±7.32)岁;治疗前每月发作频率为1~8次,平均(5.75±3.84)次。两组患者的年龄、性别以及治疗前发作频率和发作类型等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。结果见表1。
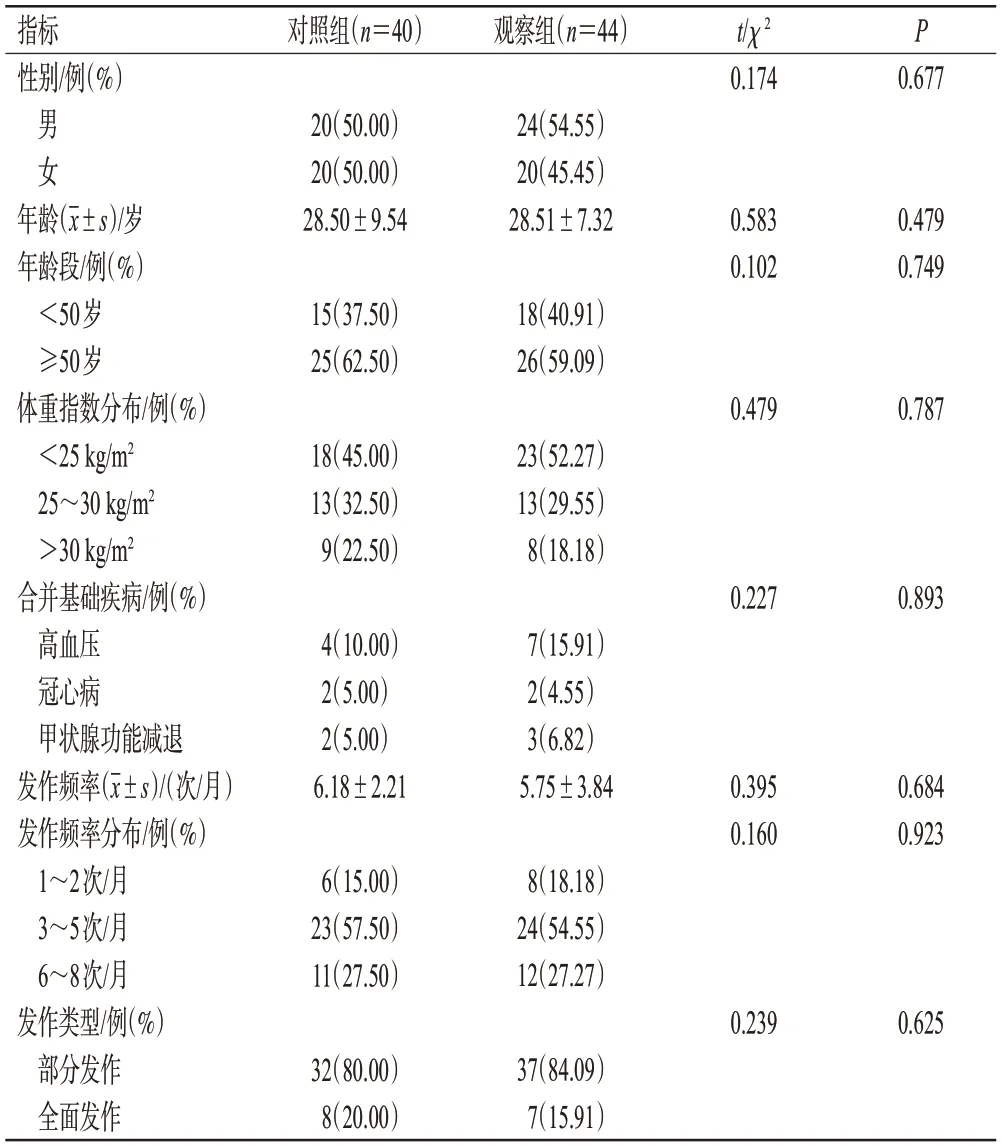
表1 两组患者的一般资料比较
2.2 两组患者的临床疗效比较
治疗后第1个月,对照组完全控制、显效、有效、无效患者分别有3、2、17、18例,总有效率为55.00%;观察组完全控制、显效、有效、无效患者分别有5、10、13、16例,总有效率为63.64%。两组患者的总有效率比较,差异无统计学意义(χ2=0.855,P=0.394)。
治疗后第3个月,对照组完全控制、显效、有效、无效患者分别有3、7、17、13例,总有效率为67.50%;观察组完全控制、显效、有效、无效患者分别有10、18、12、4例,总有效率为90.91%。两组患者的总有效率比较,差异有统计学意义(χ2=7.858,P=0.003)。
2.3 两组患者的癫痫发作频率比较
治疗前,两组患者的癫痫发作频率比较差异无统计学意义(P>0.05);治疗后第1个月,两组患者的癫痫发作频率均较治疗前显著减少(P<0.05),但组间比较差异无统计学意义(P>0.05);治疗后第3个月,两组患者的癫痫发作频率亦较治疗前显著减少(P<0.05),且观察组显著少于同期对照组(P<0.05)。结果见表2。
表2 两组患者不同时间癫痫发作频率比较(±s,次/月)
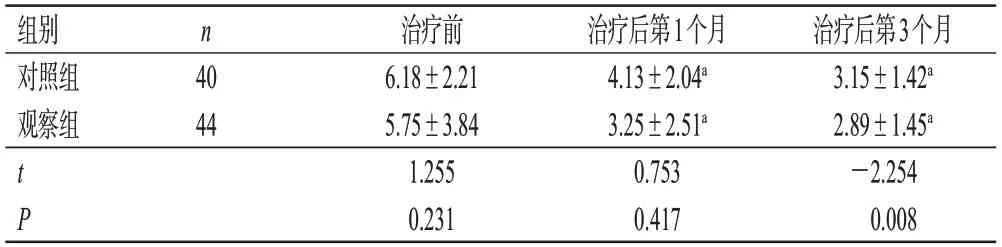
表2 两组患者不同时间癫痫发作频率比较(±s,次/月)
a:与同组治疗前比较,P<0.05。
组别对照组观察组治疗后第3个月3.15±1.42a 2.89±1.45a-2.254 0.008 n 40 44 tP治疗前6.18±2.21 5.75±3.84 1.255 0.231治疗后第1个月4.13±2.04a 3.25±2.51a 0.753 0.417
2.4 两组患者的血脂水平比较
治疗前,两组患者的TC、TG、LDL-C、HDL-C水平比较,差异均无统计学意义(P>0.05)。治疗后第3个月,对照组患者的TC、TG、LDL-C水平以及观察组患者的LDL-C水平均较同组治疗前显著升高(P<0.05);且观察组TC、TG、LDL-C水平均显著低于同期对照组(P<0.05)。两组患者的HDL-C水平比较差异均无统计学意义(P>0.05)。结果见表3。
表3 两组患者不同时间血脂水平比较(±s,mmol/L)
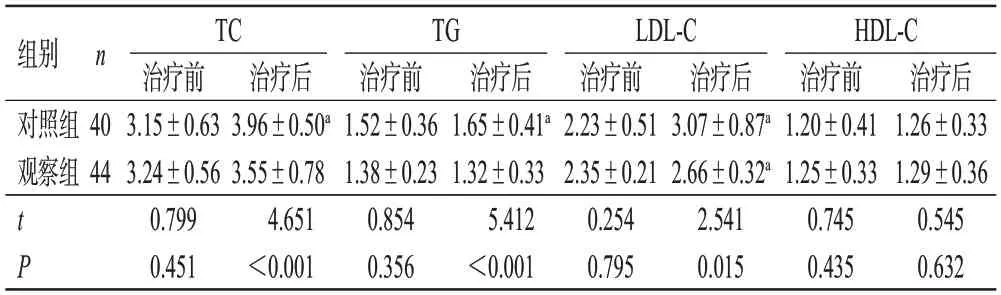
表3 两组患者不同时间血脂水平比较(±s,mmol/L)
a:与同组治疗前比较,P<0.05。
组别对照组观察组n TC治疗前3.15±0.63 3.24±0.56 0.799 0.451治疗后3.07±0.87a 2.66±0.32a 2.541 0.015治疗后3.96±0.50a 3.55±0.78 4.651<0.001 TG治疗前1.52±0.36 1.38±0.23 0.854 0.356治疗后1.65±0.41a 1.32±0.33 5.412<0.001 LDL-C治疗前2.23±0.51 2.35±0.21 0.254 0.795 40 44 tP HDL-C治疗前1.20±0.41 1.25±0.33 0.745 0.435治疗后1.26±0.33 1.29±0.36 0.545 0.632
2.5 安全性比较
用药期间,对照组患者合并头晕1例、恶心1例、心悸2例、嗜睡3例,AEs发生率为17.50%;观察组患者合并头晕2例、恶心2例、易怒1例、嗜睡2例,AEs发生率为15.91%。两组患者的AEs发生率比较,差异无统计学意义(χ2=0.038,P=0.845)。
3 讨论
癫痫发作的类型和严重程度因人而异,可以是部分性发作(影响特定身体部位或功能),也可以是全面性发作(波及整个大脑)[9]。对于新诊癫痫患者,为保证其治疗效果,降低认知功能下降、痴呆等的发生风险,进行合理的早期干预非常重要。
本研究主要比较了LCM与CAR单药治疗成人新诊癫痫患者的有效性和安全性。结果显示,治疗后第1个月,两组患者的总有效率相当;治疗后第3个月,观察组患者的总有效率显著高于对照组,提示LCM和CAR均能显著降低成人新诊癫痫患者的发作频率,且LCM的长期疗效优于CAR。癫痫的发作频率本质上与脑部神经元异常放电频率有关,LCM之所以有更好的长期疗效,可能与该药的作用机制及患者的耐受程度有关:作为第三代AEDs,与CAR等前几代AEDs相比,LCM具有AEs发生率低、致畸率低、可用于孕妇等诸多优势,且其药代动力学特征亦明显更优[10]。Baulac等[11]完成的一项Ⅲ期随机大规模双盲试验结果显示,对于年龄≥16岁的局灶性癫痫患者,LCM具有明显的控制效果,且不劣于CAR单药治疗;近期研究也显示,对于新诊癫痫患者而言,LCM的有效性优于CAR[12—13],与本研究结果相近。
LCM是一种新型N-甲基-D-天冬氨酸受体甘氨酸位点结合拮抗剂,可通过增强脑内抑制性神经递质γ氨基丁酸的活性来抑制兴奋性神经递质的释放,可作用于慢钠离子通道、改善其失活状态且不影响快钠离子通道,同时可选择性地促进电压门控钠离子通道的慢失活,从而调控神经元兴奋性,降低癫痫发作频率[14]。此外,LCM还可通过降低细胞膜的兴奋性来终止持续性放电过程,对癫痫患者正常脑功能的影响较小。该药于2018年在我国获批用于成人癫痫的治疗,疗效确切且安全可靠[15]。CAR为经典癫痫治疗药物,主要作用于快速反应性和移动性钠通道,通过阻断脑内钠通道来降低神经元的兴奋性,从而抑制癫痫发作[16]。本研究的安全性评价结果显示,两组患者的AEs发生率相当,提示LCM用于成人新诊癫痫患者的安全性与CAR相当。
此外,本研究结果还显示,经CAR治疗3个月后,患者TC、TG、LDL-C水平均较治疗前显著升高;而经LCM治疗3个月后,患者LDL-C水平明显升高,TC、TG水平变化不明显,且上述指标均显著低于同期对照组,提示LCM的长期使用对患者血脂水平的影响小于CAR。这可能是因为相比于CAR,LCM并不会对细胞色素P450酶系统产生影响,因此不会通过内源性代谢途径影响患者的血脂水平[17]。
综上所述,LCM和CAR在成人新诊癫痫治疗中均具有一定效果,均可降低患者的癫痫发作频率,且安全性相当;同时,LCM的长期疗效优于CAR,对患者血脂水平的影响小于CAR。但本研究也存在一定的缺陷,如样本量较小、样本来源单一,故结果可能存在一定偏倚,有待后续研究进一步证实。
