胡黄连苷Ⅱ对非小细胞肺癌恶性进展的影响Δ
2024-03-04郭寰宇王卫芳徐丽伟董文博长春中医药大学临床医学院实验中心长春10117长春中医药大学临床医学院生物化学教研室长春10117长春中医药大学附属医院肿瘤血液科长春10112吉林大学第一医院二部检验科长春10061
郭寰宇 ,王卫芳 ,徐丽伟 ,董文博 (1.长春中医药大学临床医学院实验中心,长春 10117;2.长春中医药大学临床医学院生物化学教研室,长春 10117;.长春中医药大学附属医院肿瘤血液科,长春 10112;.吉林大学第一医院二部检验科,长春 10061)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最普遍的组织学亚型,占所有肺癌病例的85%~90%[1]。目前,NSCLC的治疗主要以西医手段为主,包括手术、化疗、放疗、靶向治疗和免疫治疗等[2]。然而,这些治疗通常伴有复发、转移、患者预后差等不良结局,且治疗成本较高等[3]。此外,诸多靶向药物虽可延长晚期NSCLC患者的生存期,但耐药性会严重影响其长期疗效[4]。
研究表明,中医药对NSCLC的辅助治疗或患者预后有促进作用,可减少不良反应的发生,并具有良好的耐受性[5]。胡黄连苷Ⅱ是中药胡黄连提取物的主要活性成分之一,具有抗氧化、抗炎和抗肿瘤等作用[6]。已有研究报道,胡黄连苷Ⅱ可抑制人肾癌ACHN细胞的增殖并促进其凋亡[7],还可抑制人乳腺癌MDA-MB-231细胞的迁移和侵袭[8]。这提示胡黄连苷Ⅱ具有一定的抗肿瘤活性,但其能否抑制NSCLC的恶性进展尚不明确。相关研究显示,抑制鞘氨醇激酶1(sphingosine kinase 1,SPHK1)/1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)/1-磷酸鞘氨醇受体3(sphingosine-1-phosphate receptor 3,S1PR3)信号通路可抑制乳腺癌干细胞的增殖[9],以及肺淋巴管肌瘤细胞的增殖与侵袭[10]。这提示SPHK1/S1P/S1PR3信号通路参与了肿瘤的进展,但胡黄连苷Ⅱ能否通过调节SPHK1/S1P/S1PR3信号通路来抑制NSCLC的恶性进展尚不清楚。基于此,本研究拟基于上述信号通路探究胡黄连苷Ⅱ对NSCLC恶性进展的影响及潜在机制,以期为NSCLC的治疗药物提供更多选择。
1 材料
1.1 主要仪器
xMark型酶标仪、165-8001型蛋白电泳仪、Bio-Rad GelDoc XR+凝胶成像系统均购自美国Bio-Rad公司;DM2500型荧光显微镜购自德国Leica公司;E100型光学显微镜购自日本Nikon公司;SCO2W-2型细胞培养箱购自美国SHELLAB公司。
1.2 主要药品与试剂
胡黄连苷Ⅱ对照品(批号39012-20-9,纯度≥98%)购自上海陌孚医药科技有限公司;K6PC-5对照品(SPHK1激活剂,批号SML1709,纯度≥98%)购自北京百奥创新科技有限公司;CCK-8试剂盒(批号20220703)购自北京沃比森科技有限公司;5-乙炔基-2′-脱氧尿苷(EdU)染色试剂盒(批号CA1170)购自北京索莱宝科技有限公司;兔源增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)、MMP-9、SPHK1、S1PR3、胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)、甘油醛-3-磷酸脱氢酶(GAPDH)单克隆抗体和辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗(批号分别为ab92552、ab92536、ab76003、ab302714、ab248131、ab184699、ab128915、ab6721)均购自英国Abcam公司;RPMI 1640培养基(批号R10-041)购自北京毕特博生物技术有限责任公司;电化学发光试剂(批号20221226)购自北京三品医疗科技有限公司。
1.3 实验动物与细胞
SPF级雄性BALB/c裸鼠30只,5~6周龄,体重18.5~19.5 g,购自山东艾莱克生物科技有限公司,动物生产许可证号为SCXK(鲁)2022 0007。本研究方案获得长春中医药大学实验动物伦理委员会批准,批准编号为2021309。
人NSCLC细胞系A549购自中国科学院上海生科院细胞资源中心。
2 方法
2.1 细胞实验
2.1.1 细胞培养及胡黄连苷Ⅱ干预浓度的筛选
取A549细胞,于含10%胎牛血清的RPMI 1640培养基中培养。取对数生长期的A549细胞,以1×104个/孔接种于96孔板中,分别用0(对照组)、1.25、2.5、5、10、20、40、80 μmol/L的胡黄连苷Ⅱ处理24 h,并设置不含细胞、不含药物的空白组(每个浓度设置6个复孔);随后,于每孔中加入CCK-8试剂10 μL,于37 ℃下孵育2 h,使用酶标仪于450 nm波长处检测各孔的光密度(OD)值,计算细胞存活率[细胞存活率=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%],并将细胞存活率接近50%时对应的胡黄连苷Ⅱ浓度作为胡黄连苷Ⅱ干预的高浓度用于后续实验。
2.1.2 细胞分组与处理
取对数生长期的A549细胞,随机分为对照组,胡黄连苷Ⅱ低、中、高浓度组,K6PC-5组,胡黄连苷Ⅱ高浓度+K6PC-5组。各药物浓度参考“2.1.1”项下结果及相关文献[8,11]设定,具体处理过程如下:胡黄连苷Ⅱ低、中、高浓度组细胞分别用10、20、40 μmol/L的胡黄连苷Ⅱ处理24 h;K6PC-5组细胞用10 μmol/L的K6PC-5处理24 h;胡黄连苷Ⅱ高浓度+K6PC-5组细胞用40 μmol/L的胡黄连苷Ⅱ和10 μmol/L的K6PC-5共同处理24 h;对照组细胞正常培养24 h。
2.1.3 细胞增殖检测
(1)CCK-8实验:取对数生长期的A549细胞,以2×103个/孔接种于96孔板上,按照“2.1.2”项下方法分组(每组设6个复孔)、处理。随后,于每孔中加入CCK-8试剂10 μL,于37 ℃下孵育2 h,使用酶标仪在450 nm波长处检测各孔的OD值,用以反映细胞增殖情况。
(2)EdU染色实验:取对数生长期的A549细胞,以1×104个/孔接种于96孔板中,按照“2.1.2”项下方法分组(每组设6个复孔)、处理。随后,于每孔中加入50 μmol/L的EdU染液适量,染色2 h;弃去染液,细胞以4%多聚甲醛固定1 h后,以阿波罗染液染色30 min,再以4′,6-二脒基-2-苯基吲哚(DAPI)染液染核20 min。使用荧光显微镜观察,使用Image J软件对EdU阳性细胞(呈绿色荧光)进行计数并按下式计算EdU阳性细胞率:EdU阳性细胞率=EdU阳性细胞数/总细胞数×100%。
2.1.4 细胞迁移能力检测
采用划痕实验检测。取对数生长期的A549细胞,以2×105个/孔接种于24孔板中,培养,待细胞铺满后,用无菌移液器枪头在板内垂直划线,用磷酸盐缓冲液清洗后,将细胞按照“2.1.2”项下方法分组(每组设6个复孔)、处理。使用光学显微镜分别于处理0、24 h时观察并测量各组细胞的划痕宽度,并按下式计算划痕愈合率:划痕愈合率=(0 h时的划痕宽度-24 h时的划痕宽度)/0 h时的划痕宽度×100%。
2.1.5 细胞侵袭能力检测
采用Transwell实验检测。取对数生长期的A549细胞,用不含血清的RPMI 1640培养基重悬至1×106个/mL,取上述细胞悬液100 μL置于Transwell上室,同时将含10%胎牛血清的RPMI 1640培养基500 μL置于Transwell下室,培养24 h。将上层细胞按照“2.1.2”项下方法分组(每组设6个复孔)、处理。随后,去除上室底部未穿膜的细胞,将侵袭细胞(即穿膜细胞)用4%多聚甲醛固定,再以0.1%结晶紫染液染色,使用光学显微镜观察细胞侵袭情况并记录侵袭细胞数。
2.1.6 细胞中PCNA、MMP-2、MMP-9蛋白及SPHK1/S1P/S1PR3信号通路相关蛋白表达检测
采用Western blot法检测。取对数生长期的A549细胞,以2×105个/孔接种于24孔板中,按照“2.1.2”项下方法分组(每组设6个复孔)、处理。随后,收集各组细胞,裂解并提取其总蛋白。对蛋白进行定量、变性、电泳分离、转膜、封闭后,加入PCNA、MMP-2、MMP-9、SPHK1、S1PR3、ERK1/2、GAPDH一抗(稀释比例分别为1∶4 000、1∶4 000、1∶3 000、1∶3 000、1∶3 000、1∶4 000、1∶5 000),于4 ℃下孵育过夜;洗膜后,加入相应二抗(稀释比例为1∶2 000),于室温下孵育1.5 h;洗膜后,以电化学发光试剂显影,再置于凝胶成像系统下成像。使用Image J软件分析各蛋白的灰度值,以目的蛋白与内参蛋白(GAPDH)的灰度值比值作为目的蛋白的相对表达量。
2.2 移植瘤裸鼠实验
取1×107个/mL的A549细胞悬液0.2 mL,皮下接种于BALB/c裸鼠腋窝,建立NSCLC移植瘤裸鼠模型(接种后第7天,若移植瘤长径>5 mm,则判定造模成功[12])。取造模成功的裸鼠30只,随机分为裸鼠-对照组,裸鼠-胡黄连苷Ⅱ低、中、高剂量组,裸鼠-K6PC-5组,裸鼠-胡黄连苷Ⅱ高剂量+K6PC-5组,每组5只。各药物剂量参考预实验结果及相关文献[8,13]设定,具体处理过程如下:裸鼠-胡黄连苷Ⅱ低、中、高剂量组裸鼠分别腹腔注射25、50、100 mg/kg的胡黄连苷Ⅱ;裸鼠-K6PC-5组裸鼠腹腔注射0.007 5 mg/kg的K6PC-5;裸鼠-胡黄连苷Ⅱ高剂量+K6PC-5组裸鼠同时腹腔注射100 mg/kg的胡黄连苷Ⅱ和0.007 5 mg/kg的K6PC-5;裸鼠-对照组裸鼠腹腔注射生理盐水。各组裸鼠均每天注射1次,持续30 d。30 d后,处死裸鼠,分离并收集其瘤体,称定瘤体质量并按下式计算瘤体体积:肿瘤体积=0.5×a×b2(式中,a为瘤体长径,b为瘤体短径)。
2.3 统计学方法
采用SPSS 25.0软件对数据进行统计分析。实验数据以±s表示,多组间差异分析采用单因素方差分析,进一步两两比较采用SNK-q检验。检验水准α=0.05。
3 结果
3.1 细胞实验结果
3.1.1 胡黄连苷Ⅱ干预浓度的筛选结果
随着胡黄连苷Ⅱ浓度的升高,细胞存活率显著降低(P<0.05),且有一定的浓度依赖趋势:在0、1.25、2.5、5、10、20、40、80 μmol/L胡黄连苷Ⅱ作用下,细胞存活率依次为(99.97±0.03)%、(97.78±0.12)%、(89.95±0.23)%、(80.55±0.36)%、(73.36±0.28)%、(65.57±0.23)%、(54.43±0.26)%、(43.94±0.22)%。因此,本研究选择胡黄连苷Ⅱ 40 μmol/L作为后续干预的高浓度,以10、20 μmol/L作为后续干预的低、中浓度。
3.1.2 胡黄连苷Ⅱ对A549细胞增殖的影响
与对照组比较,胡黄连苷Ⅱ各浓度组的细胞OD450值、EdU阳性细胞率均显著降低,且呈浓度依赖性(P<0.05);而K6PC-5组的细胞OD450值、EdU阳性细胞率均显著升高(P<0.05)。与胡黄连苷Ⅱ高浓度组比较,胡黄连苷Ⅱ高浓度+K6PC-5组的细胞OD450值、EdU阳性细胞率均显著升高(P<0.05)。结果见表1、图1。
表1 各组A549细胞OD450值、EdU阳性细胞率比较(±s,n=6)

表1 各组A549细胞OD450值、EdU阳性细胞率比较(±s,n=6)
a:与对照组比较,P<0.05;b:与胡黄连苷Ⅱ低浓度组比较,P<0.05;c:与胡黄连苷Ⅱ中浓度组比较,P<0.05;d:与胡黄连苷Ⅱ高浓度组比较,P<0.05。
EdU阳性细胞率/%58.86±2.37 50.69±2.15a 43.37±2.06ab 28.85±1.33abc 66.72±2.85a 46.65±2.17d组别对照组胡黄连苷Ⅱ低浓度组胡黄连苷Ⅱ中浓度组胡黄连苷Ⅱ高浓度组K6PC-5组胡黄连苷Ⅱ高浓度+K6PC-5组OD450值0.92±0.06 0.83±0.07a 0.71±0.06ab 0.44±0.03abc 1.21±0.11a 0.75±0.06d

图1 各组A549细胞增殖的EdU染色显微图
3.1.3 胡黄连苷Ⅱ对A549细胞迁移的影响
与对照组比较,胡黄连苷Ⅱ各浓度组细胞的划痕愈合率均显著降低,且呈浓度依赖性(P<0.05);而K6PC-5组细胞的划痕愈合率显著升高(P<0.05)。与胡黄连苷Ⅱ高浓度组比较,胡黄连苷Ⅱ高浓度+K6PC-5组细胞的划痕愈合率显著升高(P<0.05)。结果见表2、图2。
表2 各组A549细胞划痕愈合率变化比较(±s,n=6)
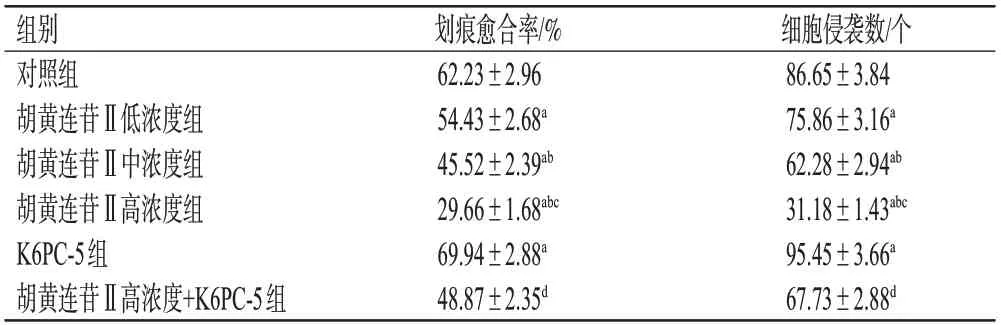
表2 各组A549细胞划痕愈合率变化比较(±s,n=6)
a:与对照组比较,P<0.05;b:与胡黄连苷Ⅱ低浓度组比较,P<0.05;c:与胡黄连苷Ⅱ中浓度组比较,P<0.05;d:与胡黄连苷Ⅱ高浓度组比较,P<0.05。
组别对照组胡黄连苷Ⅱ低浓度组胡黄连苷Ⅱ中浓度组胡黄连苷Ⅱ高浓度组K6PC-5组胡黄连苷Ⅱ高浓度+K6PC-5组划痕愈合率/%62.23±2.96 54.43±2.68a 45.52±2.39ab 29.66±1.68abc 69.94±2.88a 48.87±2.35d细胞侵袭数/个86.65±3.84 75.86±3.16a 62.28±2.94ab 31.18±1.43abc 95.45±3.66a 67.73±2.88d

图2 各组A549细胞迁移情况的显微图
3.1.4 胡黄连苷Ⅱ对A549细胞侵袭的影响
与对照组比较,胡黄连苷Ⅱ各浓度组的细胞侵袭数均显著降低,且呈浓度依赖性(P<0.05);而K6PC-5组的细胞侵袭数显著升高(P<0.05)。与胡黄连苷Ⅱ高浓度组比较,胡黄连苷Ⅱ高浓度+K6PC-5组的细胞侵袭数显著升高(P<0.05)。结果见表2、图3。

图3 各组A549细胞侵袭情况的显微图
3.1.5 胡黄连苷Ⅱ对A549细胞中相关蛋白表达的影响
与对照组比较,胡黄连苷Ⅱ各浓度组细胞中PCNA、MMP-2、MMP-9、SPHK1、S1PR3、ERK1/2蛋白的相对表达量均显著降低,且呈浓度依赖性(P<0.05);而K6PC-5组细胞中上述蛋白的相对表达量均显著升高(P<0.05)。与胡黄连苷Ⅱ高浓度组比较,胡黄连苷Ⅱ高浓度+K6PC-5组细胞中PCNA、MMP-2、MMP-9、SPHK1、S1PR3、ERK1/2蛋白的相对表达量均显著升高(P<0.05)。结果见表3、图4。
表3 各组A549细胞中PCNA、MMP-2、MMP-9、SPHK1、S1PR3、ERK1/2蛋白相对表达量比较(±s,n=6)
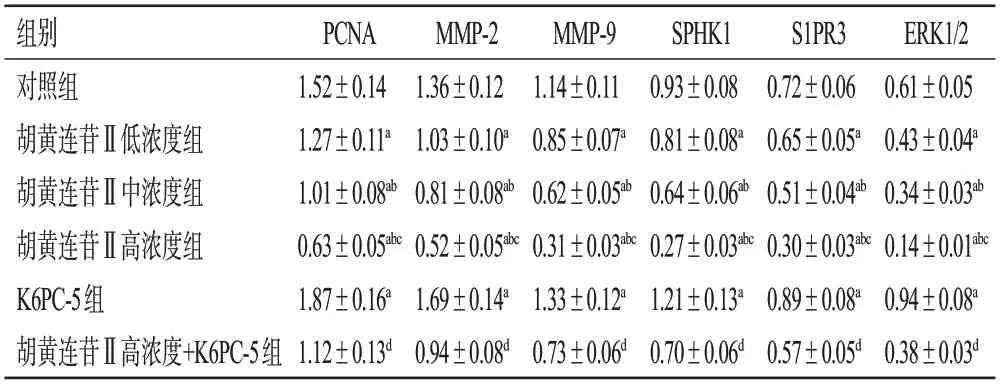
表3 各组A549细胞中PCNA、MMP-2、MMP-9、SPHK1、S1PR3、ERK1/2蛋白相对表达量比较(±s,n=6)
a:与对照组比较,P<0.05;b:与胡黄连苷Ⅱ低浓度组比较,P<0.05;c:与胡黄连苷Ⅱ中浓度组比较,P<0.05;d:与胡黄连苷Ⅱ高浓度组比较,P<0.05。
ERK1/2 0.61±0.05 0.43±0.04a 0.34±0.03ab 0.14±0.01abc 0.94±0.08a 0.38±0.03d组别对照组胡黄连苷Ⅱ低浓度组胡黄连苷Ⅱ中浓度组胡黄连苷Ⅱ高浓度组K6PC-5组胡黄连苷Ⅱ高浓度+K6PC-5组PCNA 1.52±0.14 1.27±0.11a 1.01±0.08ab 0.63±0.05abc 1.87±0.16a 1.12±0.13d MMP-2 1.36±0.12 1.03±0.10a 0.81±0.08ab 0.52±0.05abc 1.69±0.14a 0.94±0.08d MMP-9 1.14±0.11 0.85±0.07a 0.62±0.05ab 0.31±0.03abc 1.33±0.12a 0.73±0.06d SPHK1 0.93±0.08 0.81±0.08a 0.64±0.06ab 0.27±0.03abc 1.21±0.13a 0.70±0.06d S1PR3 0.72±0.06 0.65±0.05a 0.51±0.04ab 0.30±0.03abc 0.89±0.08a 0.57±0.05d

图4 各组A549细胞中PCNA、MMP-2、MMP-9、SPHK1、S1PR3、ERK1/2蛋白表达的电泳图
3.2 胡黄连苷Ⅱ对裸鼠体内移植瘤生长的影响
与裸鼠-对照组比较,裸鼠-胡黄连苷Ⅱ各剂量组裸鼠体内的瘤体质量均显著降低,体积均显著缩小,且均呈剂量依赖性(P<0.05);而裸鼠-K6PC-5组裸鼠体内的瘤体质量显著升高,体积显著增大(P<0.05)。与裸鼠-胡黄连苷Ⅱ高剂量组比较,裸鼠-胡黄连苷Ⅱ高剂量+K6PC-5组裸鼠体内的瘤体质量显著升高,体积显著增大(P<0.05)。结果见图5、表4。
表4 各组裸鼠体内肿瘤质量与体积变化比较(±s,n=5)

表4 各组裸鼠体内肿瘤质量与体积变化比较(±s,n=5)
a:与裸鼠-对照组比较,P<0.05;b:与裸鼠-胡黄连苷Ⅱ低剂量组比较,P<0.05;c:与裸鼠-胡黄连苷Ⅱ中剂量组比较,P<0.05;d:与裸鼠-胡黄连苷Ⅱ高剂量组比较,P<0.05。
肿瘤体积/mm3 158.33±6.14 135.42±5.84a 112.52±5.25ab 47.92±2.13abc 185.42±6.53a 118.75±5.03d组别裸鼠-对照组裸鼠-胡黄连苷Ⅱ低剂量组裸鼠-胡黄连苷Ⅱ中剂量组裸鼠-胡黄连苷Ⅱ高剂量组裸鼠-K6PC-5组裸鼠-胡黄连苷Ⅱ高剂量+K6PC-5组瘤体质量/g 0.76±0.06 0.65±0.05a 0.54±0.04ab 0.23±0.02abc 0.89±0.07a 0.57±0.04d

图5 各组裸鼠体内移植瘤生长情况
4 讨论
胡黄连苷Ⅱ是一种糖苷类衍生物,可抑制人食管癌Eca109细胞和人结直肠癌SW480、SW620细胞的增殖、侵袭与转移[14-15],提示该成分具有一定的抗肿瘤活性。本研究结果显示,胡黄连苷Ⅱ可浓度/剂量依赖性地抑制A549细胞的增殖、迁移、侵袭以及裸鼠体内移植瘤的生长,表明该成分能够抑制NSCLC的恶性进展。
作为细胞增殖的标志蛋白,PCNA对于肿瘤细胞的DNA复制至关重要[16];MMP-2和MMP-9可降解细胞外基质并参与肿瘤细胞的侵袭和转移,其表达水平与肿瘤细胞的侵袭、迁移能力成正比[17]。本研究检测了A549细胞中PCNA、MMP-2、MMP-9蛋白的表达情况,结果显示,胡黄连苷Ⅱ可浓度依赖性地抑制细胞中PCNA、MMP-2、MMP-9蛋白的表达,从蛋白水平上初步证实了胡黄连苷Ⅱ对A549细胞增殖、侵袭、迁移的抑制作用。与此同时,本研究结果还显示,胡黄连苷Ⅱ可剂量依赖性地抑制移植瘤裸鼠体内的肿瘤生长,从动物水平上初步证实了该成分对恶性肿瘤的体内抑制作用。由此可见,胡黄连苷Ⅱ有望成为NSCLC的潜在治疗药物之一。
由SPHK1产生的S1P是鞘脂代谢的中心分子,S1P可与S1PR3结合,进而激活S1P下游分子ERK1/2的表达,从而调节肿瘤细胞存活、迁移等生物学过程[10,18];另有研究证实,SPHK1/S1P/S1PR3信号通路可参与卵巢癌细胞的血管生成[19]。以上研究表明,SPHK1/S1P/S1PR3信号通路在肿瘤的恶性进展中具有重要作用。此外,SPHK1/S1P/S1PR3信号通路中S1P的活化包括其受体(S1PR)及受体活化所引起的一系列细胞反应[20],故可通过检测SIPR3的表达来反映S1P的活性。鉴于此,本研究检测了SPHK1、S1PR3、ERK1/2蛋白的表达情况。结果显示,胡黄连苷Ⅱ可浓度依赖性地下调细胞中SPHK1、S1PR3、ERK1/2蛋白的表达,推测该成分对NSCLC恶性进展的抑制作用可能与抑制SPHK1/S1P/S1PR3信号通路有关。同时,本研究结果还显示,经SPHK1激活剂K6PC-5干预后,细胞中SPHK1/S1P/S1PR3信号通路相关蛋白SPHK1、S1PR3、ERK1/2的表达均较对照组显著升高,细胞的增殖、迁移、侵袭能力亦显著增强,裸鼠体内移植瘤的生长明显加快,表明SPHK1/S1P/S1PR3信号通路确实参与了NSCLC的恶性进展。为验证上述推测,本研究在高剂量胡黄连苷Ⅱ的基础上联合该激活剂来干预A549细胞及移植瘤裸鼠,结果显示,K6PC-5减弱了高剂量胡黄连苷Ⅱ对A549细胞增殖、迁移、侵袭的抑制作用以及对裸鼠移植瘤生长的抑制作用,进一步证实了胡黄连苷Ⅱ抑制NSCLC恶性进展的作用可能是通过抑制SPHK1/S1P/S1PR3信号通路来实现的。
综上所述,胡黄连苷Ⅱ可能通过抑制SPHK1/S1P/S1PR3信号通路来抑制NSCLC的恶性进展。但胡黄连苷Ⅱ抑制NSCLC恶性进展还可能涉及其他机制,还有待后续研究深入探讨。
