纺织精炼酶对蚕丝脱胶工艺条件优化及性能影响
2024-03-04马忻狄黄元元全军梁红娴刘云鹤蓝平蓝丽红
马忻狄 黄元元 全军 梁红娴 刘云鹤 蓝平 蓝丽红



摘要:为提高蚕茧脱胶率和蚕丝性能,实现绿色环保的蚕茧脱胶工艺,可对蚕茧进行酶法脱胶。文章采用碱性蛋白酶(NP-TEE)和纺织精炼酶(AP-TRE)对蚕茧进行脱胶处理,以脱胶率、单纤维拉伸断裂强力及白度作为考察蚕丝性能的指标,并通过正交试验确定蚕茧酶脱胶法的最佳工艺。试验结果表明:两种酶脱胶工艺对蚕茧脱胶效果均有影响,用纺织精炼酶法脱胶后的蚕丝性能与碱性蛋白酶法脱胶相比更好。纺织精炼酶对蚕茧的最佳脱胶工艺条件为酶解温度55 ℃、酶解时间60 min、酶体积浓度5 mL/L,得到蚕茧脱胶率17.07%,单根蚕丝纤维平均断裂强力12.20 cN/dtex,白度(66.04)高于原蚕茧(58.78);红外光谱表明,采用纺织精炼酶法脱胶后的蚕茧与原蚕茧结构无明显差异;扫描电镜下观察到与原蚕丝相比,纺织精炼酶脱胶后蚕丝表面更加光滑平整;热重分析显示,纺织精炼酶脱胶后蚕丝的热稳定性无明显变化。
关键词:蚕茧;蚕丝;纺织精炼酶;碱性蛋白酶;脱胶
中图分类号:TS143.2;S886.7
文献标志码:A
文章编号:10017003(2024)02004407
DOI:10.3969/j.issn.1001-7003.2024.02.005
收稿日期:20230316;
修回日期:20231216
基金项目:广西壮族自治区区级大学生创新训练项目(202010608087)
作者简介:马忻狄(1997),女,硕士研究生,研究方向为生物化工。通信作者:蓝丽红,教授,lanlihong2004@163.com。
蚕丝作为一种天然蛋白质纤维,具有触感柔和、色泽光鲜等特点。蚕丝纤维的主体为70%~80%的丝素,外层包裹20%~30%的丝胶对丝素起到保护作用,但丝胶存在过多会影响蚕丝的光泽度与柔软度,不利于蚕丝制品的加工生产,所以蚕丝脱胶十分必要。目前蚕丝的脱胶方法主要有碱脱胶、皂脱胶、酸脱胶和酶脱胶法等。其中碱法脱胶后蚕丝白度好,但手感粗糙、力学性能差;皂脱胶后蚕丝力学性能好,但脱胶过程耗费时间长,且处理后的蚕丝易泛黄;酸脱胶成本较高,脱胶后蚕丝上残留的化学物质有刺激气味,影响蚕丝品质;酶脱胶法利用酶的生物学特性,使肽键水解断裂成氨基酸和多肽溶解在溶液中被除去,从而达到脱胶效果,过程中无须添加其他化学助剂,处理后的蚕丝丝质好,有利于脱胶废水中蚕丝蛋白的回收利用,达到节省资源、绿色环保的目的。
近年来,已研发出中性蛋白酶、碱性蛋白酶、木瓜蛋白酶等蚕茧的酶脱胶工艺。魏子凯等采用碱性蛋白酶对木薯蚕茧进行脱胶处理,蚕丝脱胶效果明显,且脱胶后蚕丝表面平滑,力学性能与传统减法脱胶相比更好。谭晓慧分别采用风味蛋白酶、菠萝蛋白酶、酸性蛋白酶、复合蛋白酶、中性蛋白酶、木瓜蛋白酶和碱性蛋白酶對蚕茧进行脱胶处理,结果表明采用酶法脱胶的脱胶废水中的蚕丝蛋白与碱法脱胶相比更易回收利用,但酶法的脱胶率要略低于碱法的脱胶率。采用酶制剂对蚕茧进行脱胶的原理主要是利用酶的生物特性,蚕丝蛋白经过蛋白酶水解,肽键断裂,形成生物活性肽。因此,生物酶制剂(蛋白酶类)已越来越多地替代其他化学精炼剂应用于蚕丝的精炼加工,是一个富有前景的研究领域。
本文所用的纺织精炼酶是采用优良菌株经液体发酵混合精制而成的一种含有角蛋白酶、丝蛋白酶和碱性蛋白酶的复合蛋白酶,专为蚕丝丝绵脱胶工艺定制的生物酶制剂,具有无毒、作用条件温和、催化效率高、易降解、专一性强等优点。本文从探究蚕茧的酶法脱胶最佳工艺条件出发,对酶法脱胶后蚕丝的形态、力学性质、白度、结构特征和热稳定性进行表征,研究酶脱胶法在蚕茧脱胶中的优缺点。
1 材料与方法
1.1 试剂与仪器
1.1.1 试 剂
分析纯无水碳酸钠、亚硫酸氢钠、溴化钾(KBr)、食品级酶活力为20 Wu/g的碱性蛋白酶(NP-TEE)和酶活力为
20 Wu/g的纺织精炼酶(AP-TRE)(南宁雄普生物科技有限公司);工业级白色干蚕茧(鹿寨县贵盛茧丝工贸有限公司)。
1.1.2 仪器
QL2241-18CN型电子天平(赛多利斯科学仪器有限公司),PHSJ-3F型酸度计(上海雷磁仪器厂),DF-101S型集热式恒温加热磁力搅拌器(上海力辰邦西仪器科技有限公司),HD012+电子复丝强力仪(南通宏大实验仪器有限公司),Nicolet is10型傅里叶变换红外光谱仪(美国赛默飞世尔科技公司),SUPRA55 Sapphire型场发射扫描电子显微镜(德国卡尔蔡司公司),HP-WSB-3Y型白度仪(济南恒品机电技术有限公司),TG209-F3型热重分析仪(德国NETZSCH公司),DZF-6020A型真空干燥箱(上海力辰仪器科技公司有限)。
1.2 試验方法
1.2.1 酶脱胶方法
取5 g蚕茧,加入到质量比为1∶1的亚硫酸氢钠与碳酸钠(用量为蚕茧用量的1%)混合溶液,采用碳酸钠和碳酸氢钠调节酶液pH值至10,保持浴比25∶1、温度80 ℃条件下,处理30 min,使丝胶蛋白膨润软化;将软化后的蚕茧取出,加入到酶液中对蚕茧进行脱胶处理;脱胶后的蚕茧用40 ℃蒸馏水洗涤3次,放入60 ℃真空干燥箱中烘干至恒重后取出,冷却至室温并称重。
1.2.2 正交试验设计
单一酶影响蚕茧脱胶率的三个主要因素为酶质量浓度、酶解时间和酶解温度。设计3因素3水平正交试验,包含9个水平组合,以脱胶率为指标探究单一酶在蚕茧脱胶过程中的最佳工艺条件。
1.3 测试方法
1.3.1 脱胶率计算
取脱胶后的蚕茧置于真空干燥箱中,60 ℃下干燥至恒重,取出后冷却至室温,称重计算脱胶率(R)。计算公式如下:
式中:m为蚕茧原干质量;m为脱胶后蚕茧干质量。
1.3.2 力学性能测试
蚕丝的力学性质采用HD012+电子复丝强力仪进行测试。测试条件:蚕丝初始长度10 mm,拉伸速度200 mm/min,相对湿度65%,预加张力0.1 cN。采用定速拉伸方式在室温环境下每组样品测试3次。
1.3.3 红外光谱测定
取原蚕茧、碱性蛋白酶和纺织精炼酶脱胶后的3种蚕丝样品,用切片器切成粉末,用KBr压片制样,放入Nicolet is 10型傅里叶变换红外光谱仪中测定,测定条件:扫描范围500~4 000 cm,扫描次数64次,分辨率4 cm。每种样品重复测定3次,对比结果。
1.3.4 蚕丝形态观测
采用SUPRA55 Sapphire型场发射扫描电子显微镜对脱胶前后的蚕丝表面形态进行观测,取每种干燥后的蚕丝500 mg,切成5 mm长固定于导电胶,喷铂后放入扫面电子显微镜下观察。
1.3.5 白度测定
将蚕丝样品用切片器制成粉末状样品,然后压制成结构致密表面平整的样品,使用HP-WSB-3Y型白度仪进行白度测定。每种样品连续测定3次,取平均值。
1.3.6 热重分析
将蚕丝样品切成粉末状,样品质量保持在20 mg左右,均匀分布在坩埚底部,采用TG209-F3型热重分析仪进行测试。测试条件:N环境,升温速率20 ℃/min,温度35~850 ℃,载气流速30 mL/min。在DTA/TG模式下,采用测试类型为“样品+修正”,每种样品测试3次。
2 结果与分析
2.1 碱性蛋白酶脱胶工艺条件
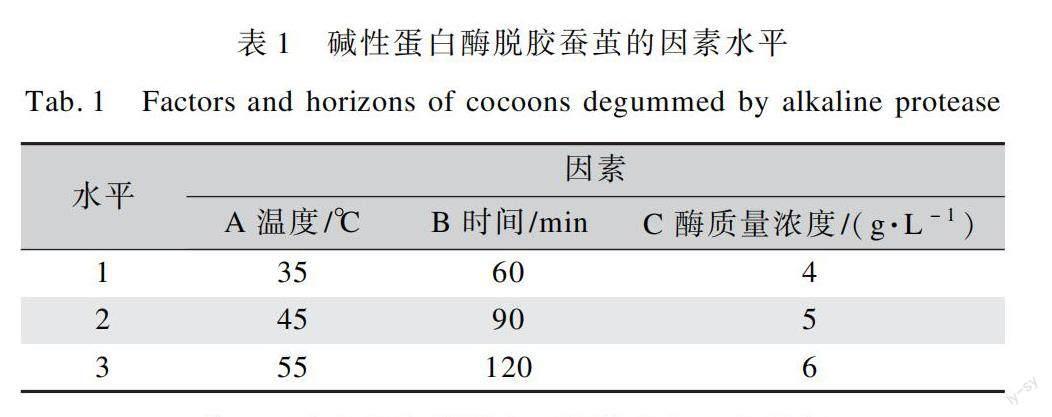
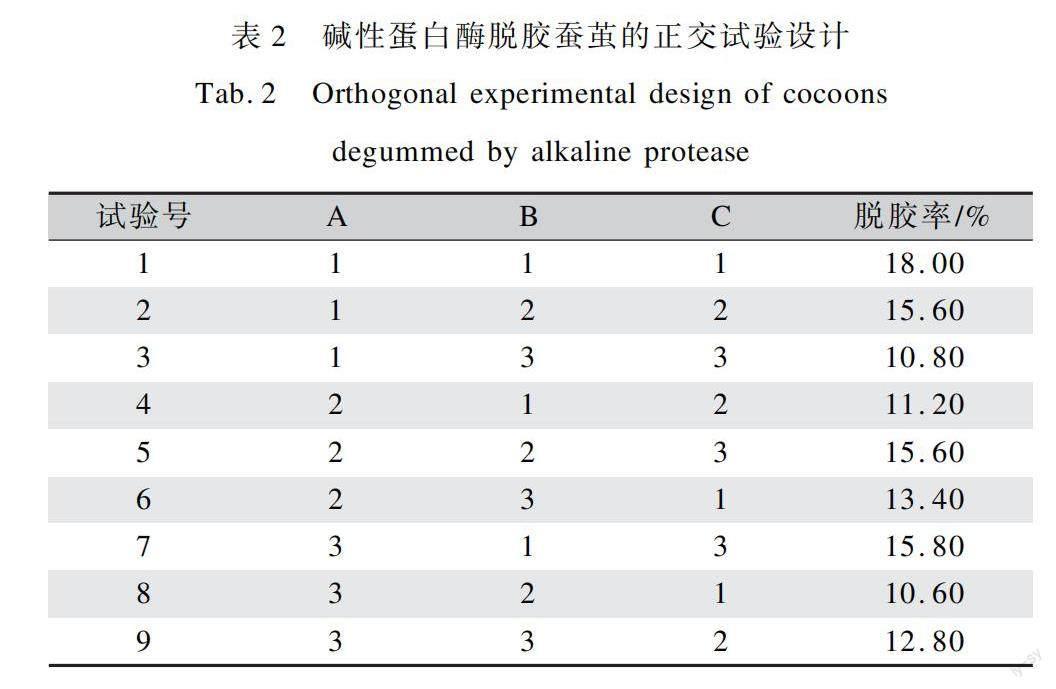
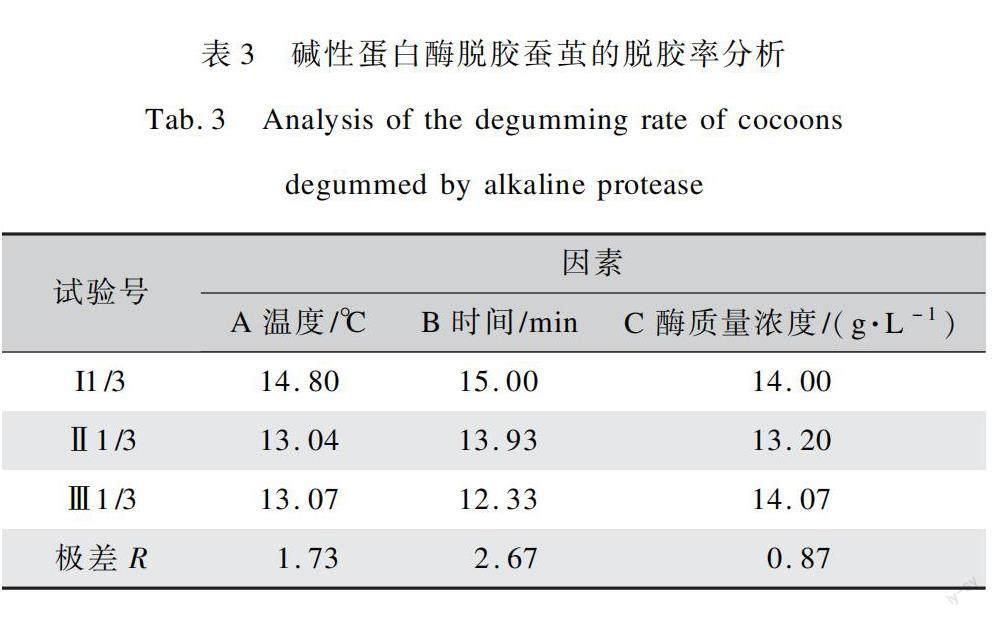
为了得到碱性蛋白酶对蚕茧进行脱胶的最佳工艺条件,本文以酶解温度(A)、酶解时间(B)、酶质量浓度(C)(表1)做3因素3水平的正交试验设计,试验结果如表2所示。对脱胶结果采用极差分析法,研究了三种因素对蚕茧脱胶率的影响程度大小,得出了三种因素对蚕茧脱胶率的影响顺序,结果如表3所示。
由表2中蚕茧脱胶率结果可知,3种因素在不同水平组合下,蚕茧的脱胶率有大幅度波动,最低脱胶率为10.6%,最大脱胶率为18.00%。
在极差分析法中,极差R代表某因素的水平发生变化会对整个试验产生影响的显著程度,R值越大,该因素对整个试验的影响越显著。表3中的试验号I、II、III值是各因素的各水平脱胶率平均值,反映同因素的不同水平对试验结果的影响大小,数值越大,则该水平条件下的试验效果最优。通过表3中极差分析数据可以看出,R值最大的是时间因素,各个因素对蚕茧脱胶率影响大小依次为B>A>C,即酶解时间>酶解温度>酶质量浓度。此试验结果可得到一个较优的水解工艺ABC,即酶解时间60 min、酶质量浓度6 g/L、酶解温度35℃。说明碱性蛋白酶可能由于作用时间的推移有逐渐失活倾向。因此时间(B)为主要影响因素,B条件下脱胶率平均值为15.00%。
2.2 纺织精炼酶脱胶工艺条件
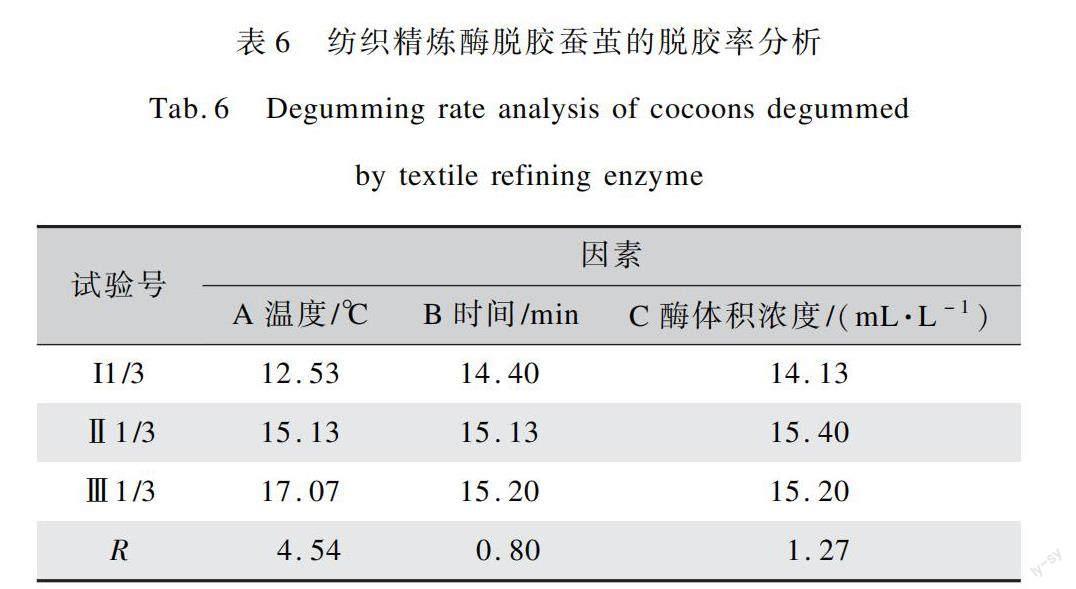
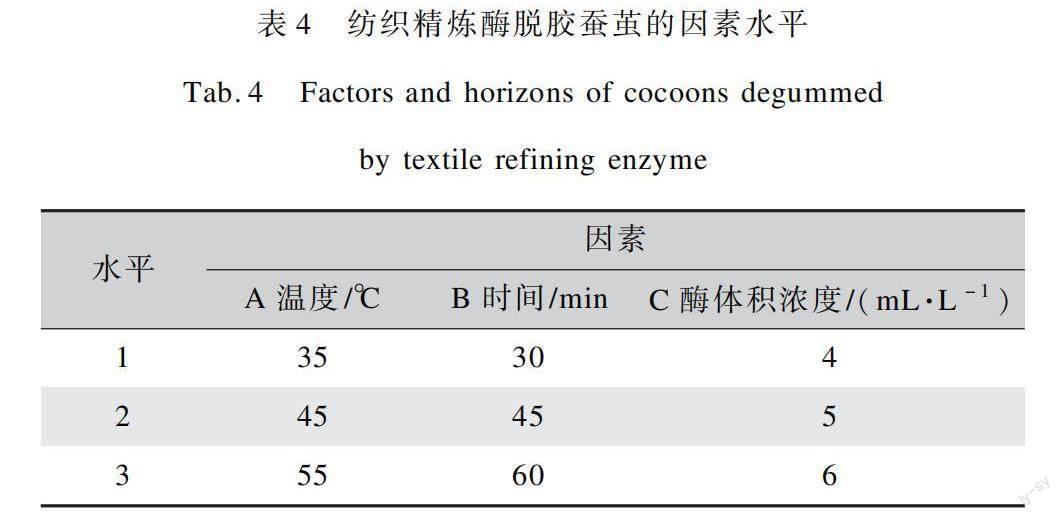
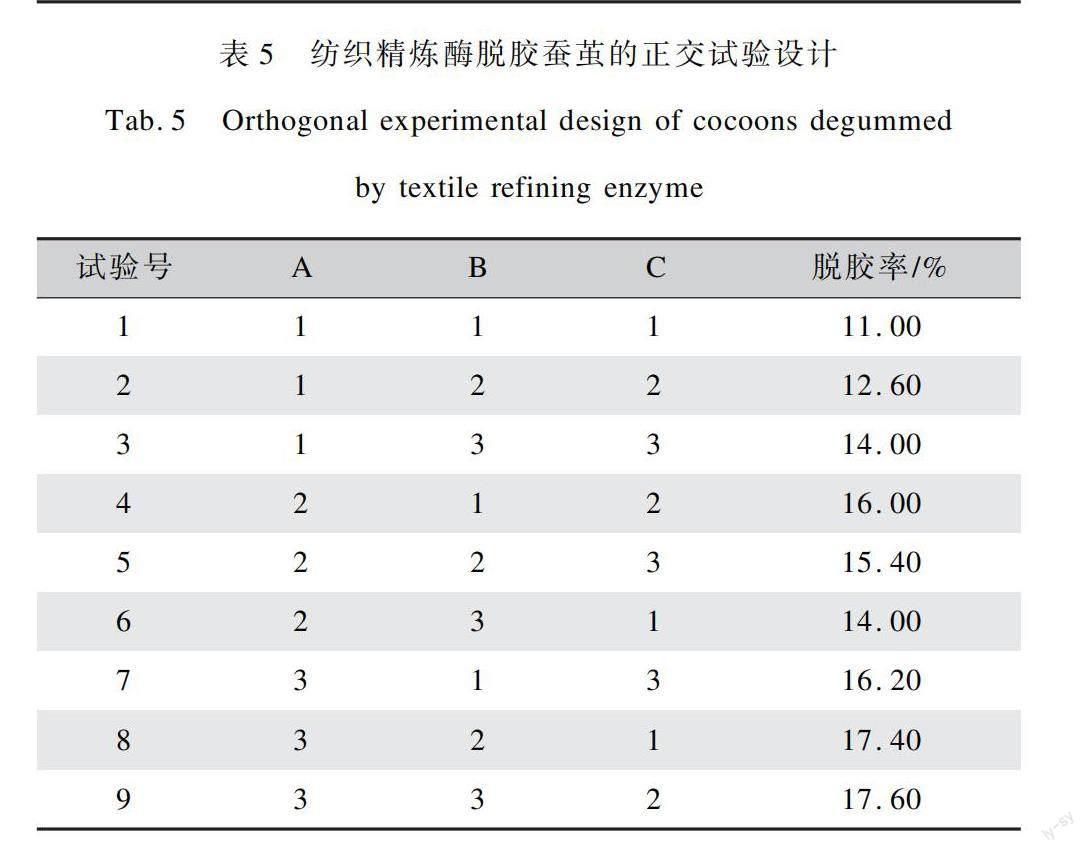
为了得到纺织精炼酶对蚕茧的最佳水解工艺条件,本文以酶解温度(A)、酶解时间(B)、酶体积浓度(C)为试验因素,每个因素采用3个水平做正交试验,其中正交试验设计表如表4所示,试验结果如表5所示。采用极差法对正交试验结果进行分析,结果如表6所示。
经纺织精炼酶对蚕丝进行脱胶后,可以发现脱胶率受上述3种因素影响较大,在最低11.00%到最高17.60%范围内波动。通过极差分析发现,酶解温度对纺织精炼酶脱胶结果的影响最大,说明这种酶在使用过程中对温度较为敏感。通过对比R值得出各个因素对蚕茧脱胶率影响的大小,依次为A>C>B,即酶解温度>酶体积浓度>酶解时间。此试验结果可得到一个较优的水解工艺ABC,即酶解时间60 min、酶体积浓度5 mL/L、酶解温度55 ℃。说明纺织精炼酶在温度为55 ℃时有较高的酶活性,此时温度虽然高于碱性蛋白酶处理温度,但仍然在可实施范围内。以温度为主要影响因素,选取平均脱胶率最大的一组,得到丝胶脱胶率为17.07%,与碱性蛋白酶相比增加了2.07%。在提高蚕茧脱胶率的同时将蚕丝脱胶率有效控制在20%以下,满足脱胶要求并保护了内层丝素不受损害,有利于保证后续加工过程中蚕丝的质量。
2.3 繭丝表面形貌
将脱胶前后的蚕茧丝置于扫描电子显微镜下观察,如图1所示。由图1可见,原蚕丝表面粗糙,丝胶包裹不均匀,有卷曲破损等痕迹,且除丝胶外,还有其他颗粒状杂质在蚕丝纤维表面附着。经过脱胶处理的蚕丝表面均比原蚕茧平整光滑,杂质均有减少。采用碱性蛋白酶脱胶后,蚕丝表面的杂质几乎全部清除,由于丝胶不均匀分布导致的表面不平滑也因丝胶的脱除而有所改善。传统碱法脱胶后,蚕丝表面丝胶虽会被除去,但丝素也有破损情况,说明与传统碱法相比,酶脱胶法是更加温和的蚕茧脱胶方式,在去除丝胶和杂质的过程中对蚕丝纤维的伤害较小。
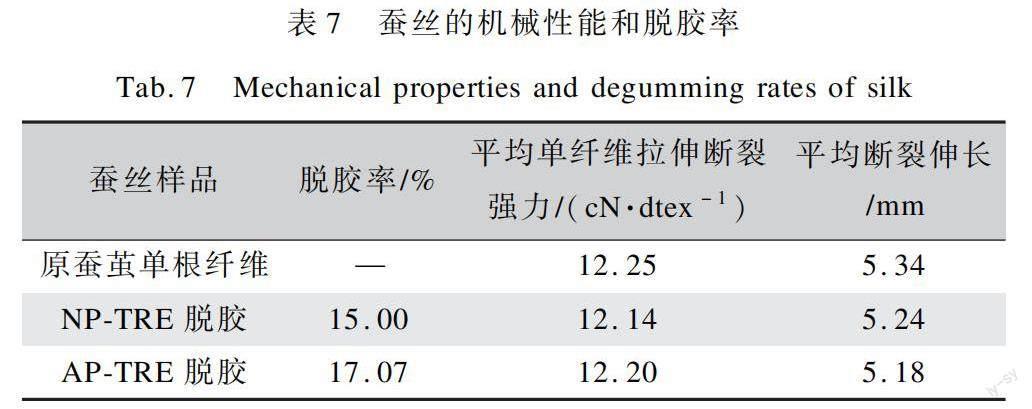
2.4 蚕丝机械性能
表7为脱胶前后蚕丝的机械性能和脱胶率。由表7可知,原蚕茧单根纤维拉伸断裂强力为12.25 cN/dtex,通过酶法脱胶处理后,蚕丝单纤维拉伸断裂强力有所下降,与碱性蛋白酶相比,纺织精炼酶效果最佳,为12.20 cN/dtex。这说明单一与复合酶制剂用于蚕茧脱胶,都基本保留了蚕丝原有的力学性能。与碱性蛋白酶相比,纺织精炼酶会使蚕茧脱胶率有所提高,但其不能对内层丝素造成影响,从而不会影响到蚕丝的拉伸性能。分析认为这是由于纺织精炼酶中碱性蛋白酶含量较少,对蚕丝内层含有的可被碱性蛋白酶专一水解的蛋白质伤害减弱导致。
2.5 白度测定
由表8中蚕茧白度变化趋势可知,纺织精炼酶脱胶处理后蚕丝白度达到最大值66.04,与原蚕茧白度58.78相比有显著提升。这是由于经过酶处理后,蚕茧表层的杂质与氧化物从蚕丝上成功脱除,但与碱性蛋白酶相比,白度相差不大,说明经两种蛋白酶处理均能明显提高蚕丝的白度。
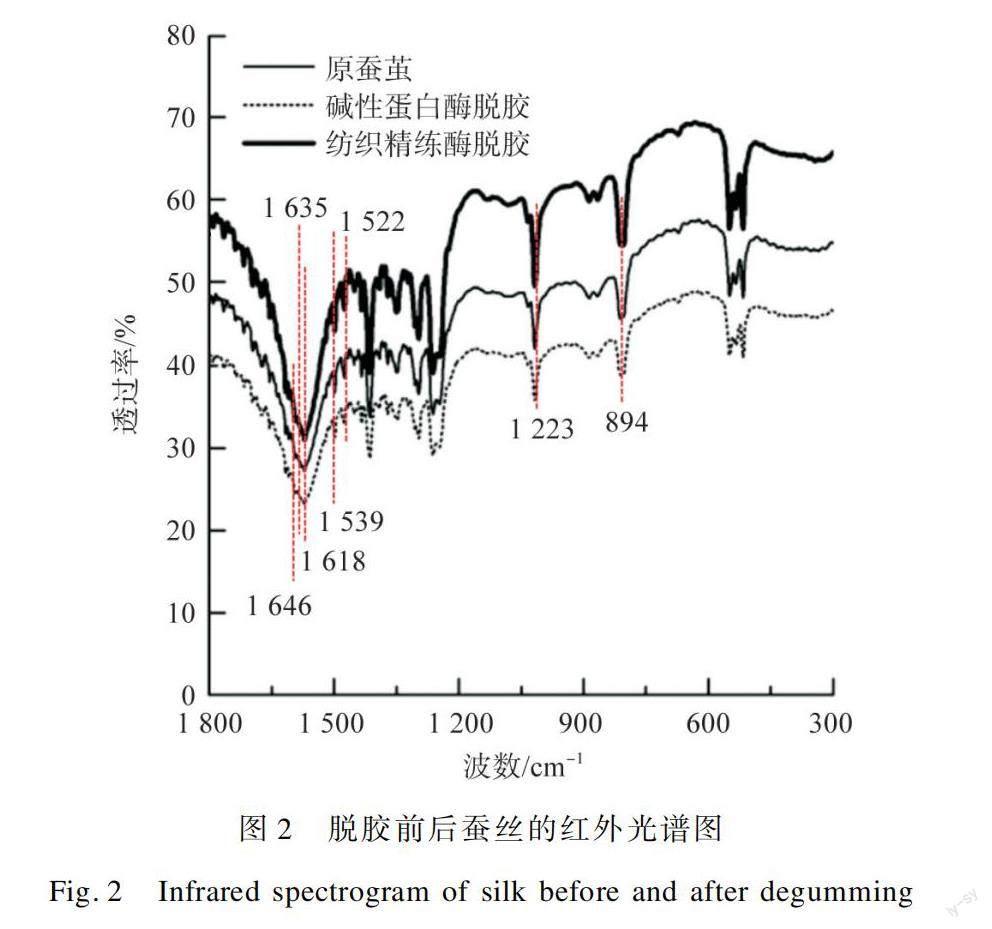
2.6 脱胶前后蚕丝的红外光谱图
图2为原蚕茧、碱性蛋白酶脱胶及纺织精炼酶脱胶后蚕丝样品在600~1 800 cm的红外光谱图。
由图2可见,未经处理蚕丝的红外光谱特征峰为:无规则卷曲为1 646 cm(酰胺I),β-折叠为1 635 cm(酰胺I)、1 618 cm(酰胺I)、1 522 cm(酰胺II)、1 223 cm(酰胺III),α-螺旋为1 539 cm(酰胺II)、894 cm(酰胺II)。可见天然蚕丝以β-折叠为主要二级结构,同时含有少量的α-螺旋和无规则卷曲。经碱性蛋白酶处理后蚕丝在894 cm处的峰值减弱,位置未见偏移,仍属于α-螺旋结构。经纺织精炼酶处理后的蚕丝红外光谱图与原蚕茧的基本一致。这说明经过两种酶的脱胶处理,并未使蚕丝的化学结构发生明显变化。
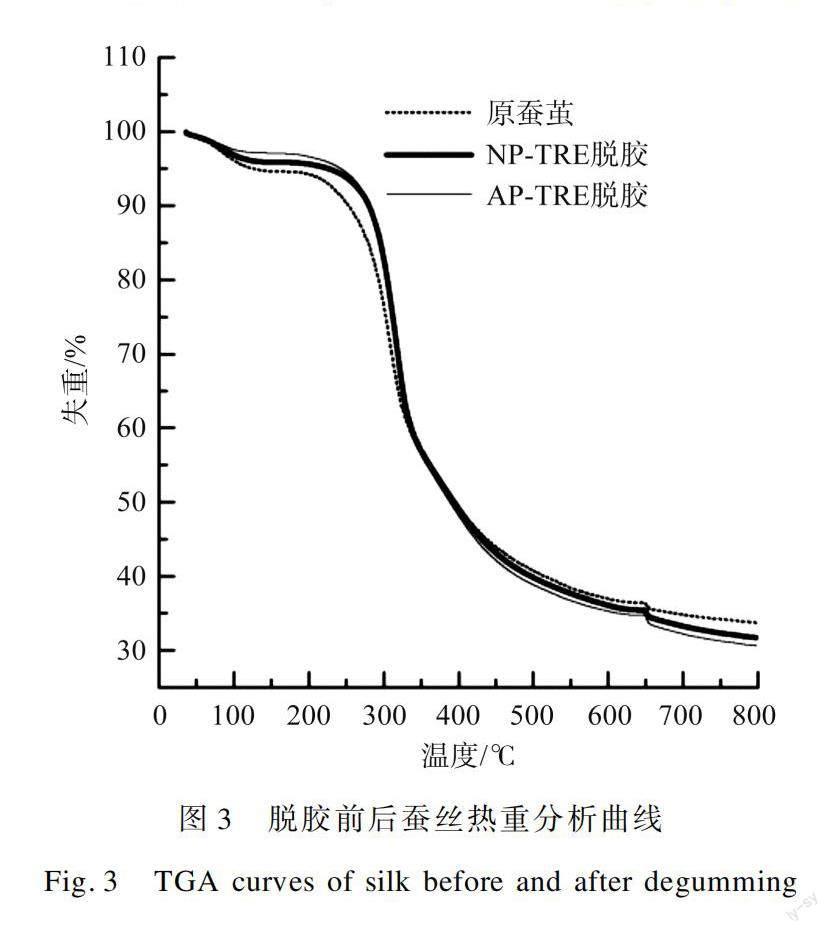
2.7 热重分析
图3为原蚕茧和两种酶脱胶后蚕丝的热性能曲线。
由图3可知,3种蚕丝样品的热重分析曲线变化规律基本保持一致,随温度升高,其热分解速率在起始(300~500℃)阶段逐渐增大,随后逐渐减小。开始失重时的温度几乎相同,其中经过纺织精炼酶处理后的蚕丝与原蚕丝热稳定性更为接近。分析认为这是由于纺织精炼酶对杂质及外层丝胶作用较为强烈,但对内层丝胶并不会完全破坏,可以保留蚕丝主要结构,从而保证其原有的弹性性能。
3 结 论
蚕丝作为天然纤维之一,由于其丝滑柔和的触感已被广泛应用于各类丝织物品中,进而对于蚕丝表面的处理问题也成为行业关键话题。本文选用碱性蛋白酶和纺织精炼酶对蚕茧进行脱胶处理,并从蚕丝的脱胶率、表面形态、力学性能、白度、化学结构等方面探究脱胶后的蚕丝性能。首先采用正交试验及方差分析对纺织精炼酶的最优脱胶工艺进行探究,认为在酶解时间60 min、酶体积浓度5 mL/L、酶解温度55 ℃时,纺织精炼酶对蚕茧的脱胶处理达到一个较好的效果,此时蚕茧的脱胶率为17.07%。随后对经过此次处理的蚕丝进行力学性能测试,发现原蚕茧单根纤维拉伸断裂强力为12.25 cN/dtex,纺织精炼酶处理后为12.20 cN/dtex。这说明纺织精炼酶复合酶制剂用于蚕茧脱胶,基本保留了蚕丝原有的力学性能。采用扫描电子显微镜观察了经过纺织精炼酶脱胶后蚕丝纤维表面状态,可见其表面光滑平整,原蚕茧表面杂质几乎被完全去除,形状不规则的丝胶也被脱除。从红外光谱测试及热重分析结果来看,经过纺织精炼酶处理的蚕丝样品与原蚕茧热稳定性相比没有明显改变。
参考文献:
[1]董雪. 不同脱胶方法对蚕丝性能和废水COD的影响及脱胶废水处理[D]. 苏州: 苏州大学, 2012.
DONG X. Influence of Different Degumming Methods on Silk Properties and COD of Wastewater and Treatment of Degumming Wastewater[J]. Suzhou: Soochow University, 2012.
[2]闻荻江, 王辉, 朱新生. 丝素蛋白的构象与结晶性[J]. 纺织学报, 2005(1): 110-112.
WEN D J, WANG H, ZHU X S. Conformation and crystallinity of silk fibroin[J]. Journal of Textile Research, 2005(1): 110-112.
[3]RASTOGI S, KANDASUBRAMANIAN B. Processing trends of silk fibers: Silk degumming, regeneration and physical functionalization[J]. The Journal of The Textile Institute, 2020, 111(12): 1794-1810.
[4]杨雪霞, 劳继红. 蚕丝酶精炼研究进展[J]. 丝绸, 2007(8): 66-68.
YANG X X, LAO J H. Research progress of enzymatioc scouring of silk[J]. Journal of Silk, 2007(8): 66-68.
[5]KIM J, KWON M, KIM S. Biological degumming of silk fabrics with proteolytic enzymes[J]. Journal of Natural Fibers, 2016, 13(6): 629-639.
[6]刘作平. 柞蚕茧的酶法脱胶及羊毛织物的酶促改性[D]. 苏州: 苏州大学, 2015.
LIU Z P. Enzyme Degumming of Tussah Cocoon and Enzymatic Modification of Wool Fabric[D]. Suzhou: Soochow University, 2015.
[7]张艳, 董照明, 席星航, 等. 家蚕脱胶蚕丝的蛋白组成成分[J]. 中国农业科学, 2018, 51(11): 2216-2224.
ZHANG Y, DONG Z M, XI X H, et al. Protein components of degumming bombyx mori silk[J]. Scientia Agricultura Sinica, 2018, 51(11): 2216-2224.
[8]王英健. 几种脱胶方法的比较研究[J]. 安徽农业科学, 2008, 36(33): 14623-14624.
WANG Y J. Comparative study on several degumming methods for silkworm silk[J]. Journal of Anhui Agricultural Sciences, 2008, 36(33): 14623-14624.
[9]董文秀. 丝蛋白质结构变化与表面活性性能关系的研究[D]. 柳州: 广西科技大学, 2015.
DONG W X. Study on the Relationship between Structural Changes and Surface-activity of Silk Protein[D]. Liuzhou: Guangxi University of Science and Technology, 2015.
[10]钱崇濂. 国外真丝绸酶炼脱胶工艺现状[J]. 纺织导报, 2004(6): 54-55.
QIAN C L. Recent developments in silk degumming with enzyme at abroad[J]. China Textile Leader, 2004(6): 54-55.
[11]魏子凯, 黄继伟, 林海涛, 等. 木薯蚕茧酶法脱胶工艺及蚕丝性能研究[J]. 上海纺织科技, 2019, 47(5): 41-44.
WEI Z K, HUANG J W, LIN H T, et al. Degumming process silk properties of cassava cocoons with enzyme[J]. Shanghai Textile Science & Technology, 2019, 47(5): 41-44.
[12]谭晓慧. 蚕丝蛋白的开发利用研究[D]. 大连: 大连工业大学, 2010.
TAN X H. The Studies on Development and Utilization of Silk Protein[D]. Dalian: Dalian Polytechnic University, 2010.
[13]陈景浩, 陈兴, 张新宇, 等. 木瓜蛋白酶用于鲜茧缫丝脱胶的工艺试验[J]. 蚕业科学, 2016, 42(1): 111-117.
CHEN J H, CHEN X, ZHANG X Y, et al. Process technology for using papain protease in fresh cocoon degumming and reeling[J]. Acta Sericologica Sinica, 2016, 42(1): 111-117.
[14]陈小龙. 雄蚕茧烘茧及煮茧工艺研究[D]. 杭州: 浙江大学, 2010.
CHEN X L. Studies on the Technologies of Male Silkworm Cocoon Drying and Cooking[D]. Hangzhou: Zhejiang University, 2010.
[15]姚佳, 駱倩倩, 祝成炎, 等. 天然绿色茧的煮茧工艺[J]. 纺织学报, 2013, 34(10): 35-38.
YAO J, LUO Q Q, ZHU C Y, et al. Cooking process for natural green cocoon[J]. Journal of Textile Research, 2013, 34(10): 35-38.
[16]李维贤, 赵耀明, 汪朝阳, 等. 蚕茧的高温高压水脱胶研究[J]. 纺织学报, 2003(2): 76-78.
LI W X, ZHAO Y M, WANG C Y, et al. Study on degumming of silkworm cocoon by high temperature and high pressure water[J]. Journal of Textile Research, 2003(2): 76-78.
[17]刘作平, 邢铁玲, 盛家镛, 等. 2种蛋白酶对柞蚕茧的脱胶工艺条件及脱胶效果[J]. 蚕业科学, 2014, 40(1): 64-68.
LIU Z P, XING T L, SHENG J Y, et al. Degumming technological condition and effect of two proteases to tussah silkworm cocoons[J]. Acta Sericologica Sinica, 2014, 40(1): 64-68.
[18]黄继伟, 洪基武, 林海涛, 等. 鲜茧缫生丝与干茧缫生丝的性能对比[J]. 丝绸, 2013, 50(11): 28-32.
HUANG J W, HONG J W, LIN H T, et al. Contrast on properties of the fresh cocoon silk and the dried cocoon silk[J]. Journal of Silk, 2013, 50(11): 28-32.
[19]吳立新, 陈方玉. 现代扫描电镜的发展及其在材料科学中的应用[J]. 武钢技术, 2005(6): 36-40.
WU L X, CHEN F Y. Development of modern SEM and its application in material science[J]. WISCO Technology, 2005(6): 36-40.
[20]范雪荣, 樊增录, 范丽花. 纺织品的白度测定新公式及白度测定的探讨[J]. 纺织学报, 1996(4): 255-258.
FAN X R, FAN Z L, FAN L H. A new formula for determination of whiteness of textiles and a discussion on the determination of whiteness[J]. Journal of Textile Research, 1996(4): 255-258.
[21]成青. 热重分析技术及其在高分子材料领域的应用[J]. 广东化工, 2008, 35(12): 50-52.
CHENG Q. The application of thermogravimetry analytical technology in polymer materials[J]. Guangdong Chemical Industry, 2008, 35(12): 50-52.
[22]张瑶琴, 陈忠敏, 张艳冬, 等. 丝胶蛋白分子结构及其制取条件[J]. 中国组织工程研究与临床康复, 2011, 15(3): 468-472.
ZHANG Y Q, CHEN Z M, ZHANG Y D, et al. Structure and extraction conditions of sericin protein[J]. Chinese Journal of Tissue Engineering Research, 2011, 15(3): 468-472.
[23]师体海. 木瓜蛋白酶对蚕丝及其织物的作用[D]. 重庆: 西南大学, 2017.
SHI T H. The Effect of Papain on Mulberry Silk and Mulberry Silk Fabric[D]. Chongqing: Southwest University, 2017.
Effects of textile refining enzymes on the process conditions and performance of silk degumming
MA Xindi, HUANG Yuanyuan, QUAN Jun, LIANG Hongxian, LIU Yunhe, LAN Ping, LAN Lihong
(1a.School of Chemistry and Chemical Engineering; 1b.Guangxi Key Laboratory of Polysaccharide Materials and Modification; 1c.Guangxi Colleges and Universities Key Laboratory of New Chemical and Biological Transformation Process Technology, Guangxi Minzu University, Nanning 530006, China; 2.Laibin Science and Technology Development Center, Laibin 546100, China)
Abstract:Silk, as a natural protein fiber, has a soft touch and bright color. The main body of silk fibers is fibroin, with a proportion of from 70% to 80%, and the outer layer is wrapped with sericin with a proportion of from 20% to 30%, which plays a protective role for the fibroin. Nevertheless, an excessive presence of sericin will affect the luster and softness of the silk, which is detrimental to the processing and production of silk products. Therefore, it is essential to perform degumming treatment on the silkworm cocoons.Traditional methods for degumming silk primarily include alkaline degumming, soap degumming, and acid degumming. However, these degumming methods commonly result in issues such as a rough texture, poor mechanical properties, susceptibility to yellowing, and the presence of residual chemical substances with irritating odors in the silk after degumming.
In recent years, a new type of silkworm cocoon degumming method—enzyme degumming, has been widely applied in the field of silk degumming due to its advantages such as environmental friendliness, non-toxicity, mild reaction conditions, high catalytic efficiency, easy degradation, and strong specificity.The use of enzyme preparations for the degumming of silkworm cocoons primarily relies on the biological characteristics of enzymes. Silk proteins undergo hydrolysis by proteolytic enzymes, causing the cleavage of peptide bonds and the formation of bioactive peptides.Therefore, biological enzyme preparations (proteases) have been increasingly used to replace other chemical refining agents in the refining and processing of silk. This represents a promising and prospective research area.
In this paper, alkaline protease (NP-TEE) and textile refining enzyme (AP-TRE) were used to degum silkworm cocoons. The degumming rate, single-fiber tensile breaking strength, and whiteness were used as the indexes to examine silk properties. An orthogonal test was conducted to determine the optimal process for the enzymatic degumming of cocoons. The experimental results show that the two enzyme degumming processes have an effect on the degumming effect of cocoons, and the performance of silk after degumming with textile refining enzyme is better compared with that of alkaline protease degumming. The optimal degumming process conditions of cocoons by textile refining enzyme are as follows: a degumming temperature of 55 ℃, a degumming time of 60 min, and an enzyme concentration of 5 mL/L. The degumming rate of cocoons is 17.07%, with an average breaking strength of single silk fiber of 12.20 cN/dtex, and whiteness of cocoons of 66.04% which is higher than the original cocoons of 58.78%.The infrared spectra show that there is no significant difference in the structure between cocoons treated with the textile refining enzyme method and the original silkworm cocoons. Under scanning electron microscopy, it is observed that the surface of silk fibers treated with textile refining enzyme appears smoother and more even compared to the original silk fibers. TGA analysis shows that there is no significant change in the thermal stability of silk fibers after degumming with textile refining enzymes. This approach provides a new choice for cocoon degumming process, and it will contribute to subsequent industrial production.
Key words:cocoon; silk; textile refining enzyme; alkaline protease; degumming
