肝癌免疫治疗后神经系统免疫相关不良事件2例报告并文献复习
2024-03-02陈卫煌岑海强汤馥豪康钟杰李作标韩焕钦周海红律东陈华林杨永光
陈卫煌,岑海强,汤馥豪,康钟杰,李作标,韩焕钦,周海红,律东,陈华林,杨永光
(广东医科大学附属医院 1.肝胆胰外科 2.感染内科 3.神经内科 4.心理科 5.肿瘤中心,广东 湛江 524001)
方法:收集并整理广东医科大学附属医院肝胆胰外科收治的2例接受免疫治疗后出现n-irAEs的肝细胞癌患者的诊治经过,并检索、复习相关文献。
结果:2例肝细胞癌患者均为男性,年龄分别为66岁与58岁。在行ICIs治疗后分别出现手足颤抖、失语、惊厥及四肢痛觉过敏等相关神经系统不良事件的临床症状,立即停药并予以激素联合丙种球蛋白等对症治疗,病例1停止免疫治疗改为仑伐替尼联合经导管动脉化疗栓塞术(TACE)治疗,后接受肝中叶切除术。术后恢复顺利,术后病理证实肝细胞癌,有微血管侵犯(M1),术后行辅助性TACE 1次,口服甲磺酸仑伐替尼胶囊维持辅助治疗,患者拒绝放疗,行抗病毒联合口服瑞戈非尼治疗,患者现术后生存19个月,随访至今生活状态良好,无免疫性脑炎复发。病例2接受治疗20 d后肢体触痛消失,疼痛、麻木、乏力等症状明显减轻,出院前患者可自主站立约3~5 min,步行约30 m。出院后行电话随访,无n-irAEs复发,患者因肿瘤进展于2023年1月死亡。
结论:n-irAEs在临床十分少见,但致死率高,因其临床症状与体征呈多样性,且影像学表现及实验室检查缺乏特异性征象,在肝癌的系统治疗中需警惕该不良事件的发生,且一旦发生应尽早诊治。
近年来,以免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)联合抗血管生成药物的靶免治疗在晚期肝癌的治疗中取得了令人瞩目的疗效。随着ICIs治疗癌症的广泛应用,其可能引发的免疫相关不良事件(immune-related adverse events,irAEs)也越来越引起临床关注。与皮肤、胃肠道不良反应等常见的irAEs相比,神经系统免疫相关不良事件(neurologic immune-related adverse events,n-irAEs)的发生更为少见,但临床难预测,早期容易漏诊,且不良后果严重。现总结2例n-irAEs患者的临床表现及诊治经过并复习相关文献,对现有的n-irAEs发生率、临床表现、诊断和处理进行总结,旨在提高临床医生对该类疾病的早期诊疗能力。
1 病例报告
病例 1 男性,66岁。因“右上腹闷痛10 d”于2021年6月收治入广东医科大学附属医院肝胆胰外科。入院检查:血常规、凝血功能未见异常;生化检查:天门冬氨酸氨基转移酶81.7 U/L;丙氨酸氨基转移酶453.6 U/L;总胆红素13.2 μmol/L;直接胆红素6.7 μmol/L;血清白蛋白31.4 g/L;甲胎蛋白(AFP)979.10 ng/mL;乙肝表面抗原(HbsAg)阳性,HBV-DNA 2.18×105IU/mL。上腹部MRI:肝右前叶-左内叶118 mm×105 mm×112 mm异常信号影,边界局部欠清,形状不规则,呈分叶状,内可见片状液化坏死,部分向肝外突出。增强扫描呈动脉期不均匀轻度强化,静脉期及延迟期持续强化,诊断:巨块型肝癌(图1)。入院诊断肝中叶巨块型肝癌(BCLC分期:B期;CNLC分期:IB期)。经MDT讨论,行左三叶切除残余肝体积不足,与患者及家属沟通拟行系统治疗。患者于2021年6月26日接受阿替利珠单抗联合贝伐珠单抗治疗,用药7 d后,患者于2021年7月3日出现无诱因发热,最高体温39.3 ℃;血常规:白细胞5.0×109/L;中性粒细胞百分比65%;降钙素原0.12 ng/mL;C-反应蛋白80 mg/L;血培养阴性,予患者口服非甾体药物及物理降温,2021年7月11日患者体温恢复正常,在无诱因情况下突然出现意识不清、失语、伴手足颤抖等症状;体格检查:患者谵妄状态、肌张力增高,其余检查不能配合。头颅MRI:双额、颞、顶部颅内板下见新月形T1WI低、T2WI高信号,考虑硬膜下积液,见邻近脑组织受压,脑沟、脑裂、脑池增宽、加深(图2)。行腰椎穿刺术,脑脊液检查提示脑脊液压力120 mmH2O(1 mmH2O=0.009 8 kPa);白细胞4.0×106/L,以淋巴细胞为主;蛋白含量0.55 g/L。自身免疫性脑炎抗体检测、抗中性粒细胞胞浆抗体检测、抗核抗体检测均为阴性。院内MDT会诊后诊断为免疫相关性脑炎,次日给予氢化泼尼松60 mg/d,静脉注射,联合丙种球蛋白(IVIG)2.5 g/d,静脉滴注。用药5 d后,患者手足颤抖、惊厥症状缓解,神志变清,语言表达逐渐清晰,改为氢化泼尼松30 mg/d,静脉注射,持续10 d。再减量为氢化泼尼松10 mg/d,静脉注射,继续维持治疗10 d,症状无复发。停止免疫治疗改为仑伐替尼联合经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)治疗,AFP 979.10 ng/mL;复查提示肿瘤最大径缩小30%以上,mRECIST标准疗效评估部分缓解,肝功能Child-Pugh分级达A级,患者于2021年10月20日行肝中叶切除术。术后恢复顺利,术后病理证实肝细胞癌,有微血管侵犯(M1),术后行辅助性TACE 1次,口服甲磺酸仑伐替尼胶囊维持辅助治疗,2022年8月复查AFP 5 074 ng/mL,CT提示肝癌复发合并下腔静脉合并心房癌栓、双肺多发转移;患者拒绝放疗,行抗病毒联合口服瑞戈非尼治疗;2023年3月10日复查,AFP 3.5 ng/mL,CT提示:肝癌复发,心房癌栓及双肺转移灶较前缩小,患者现术后生存19个月。随访至今生活状态良好,无免疫性脑炎复发。

图1 上腹部MRI A:T2期;B:动脉期;C:门脉期
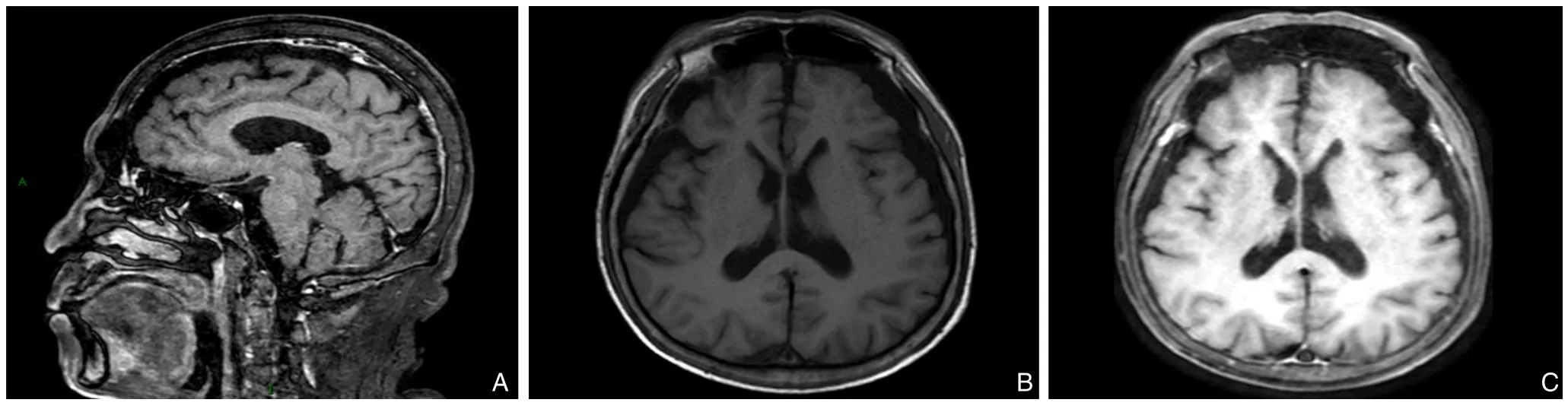
图2 头颅MRI A:矢状位;B:T1期;C:T2期
病例2 男性,58岁,因“四肢有触痛1个月”于2021年10月入院。患者2021年5月因右腹部不适在当地行CT检查诊断肝右叶癌合并门静脉右支癌栓,伴肝门区胃小弯淋巴转移。在外院行肝脏穿刺活组织检查病理诊断肝细胞肝癌后行4周期的仑伐替尼、特瑞普利单抗及FOLFOX-HAIC系统治疗。体格检查:神清,触觉、温度觉正常对称,四肢痛觉过敏,双侧病理征阴性,膝反射、跟腱反射未引出。入院血常规、生化正常;HbsAg阳性,AFP 63.02 ng/mL。上腹部增强CT提示肝右叶低密度影,大小约为67 mm×63 mm,边界不清,内见坏死有部分强化,门静脉右支充盈缺损考虑癌栓,诊断肝右叶肝细胞癌合并门脉右支癌栓(图3)。头颅MRI可见少量缺血灶,余未见明显异常(图4)。免疫神经学相关检查:自身免疫性周围神经病24项提示抗GD1a抗体IgG弱阳性;抗Sulfatide抗体IgM、IgG弱阳性;肌炎谱26项检查提示抗Ro-52阳性;副瘤综合征抗体阴性;神经丝轻链蛋白(Nfl)63.99 pg/mL;脑脊液检查:呈黄色透明,潘迪氏试验(3+),细胞总数10×106/L,高于正常;白细胞数10×106/L,未见异常。腰穿脑脊液检查:葡萄糖6.01 mmol/L、脑脊液微量白蛋白2 497.30 ng/L、脑脊液微量总蛋白3 855.10 ng/L,蛋白细胞分离。神经肌电图检查提示:双侧正中神经、尺神经、胫神经、腓总神经受损。综合患者临床表现、影像学及相关检查,院内MDT会诊后诊断为免疫相关性周围神经病变:吉兰-巴雷综合征可能性大。2021年11月2日起给予甲泼尼龙琥珀酸钠60 mg+0.9%氯化钠注射液100 mL,联合IVIG 2.5 g/d,静脉滴注,持续5 d,患者触痛症状减轻,后减为泼尼松30 mg/d口服,持续7 d,再减量为泼尼松10 mg/d口服,继续维持治疗7 d,症状持续改善。治疗20 d后患者肢体触痛消失,疼痛、麻木、乏力等症状明显减轻,出院前患者可自主站立约3~5 min,步行约30 m。出院后行电话随访,无n-irAEs复发,患者因肿瘤进展于2023年1月死亡。
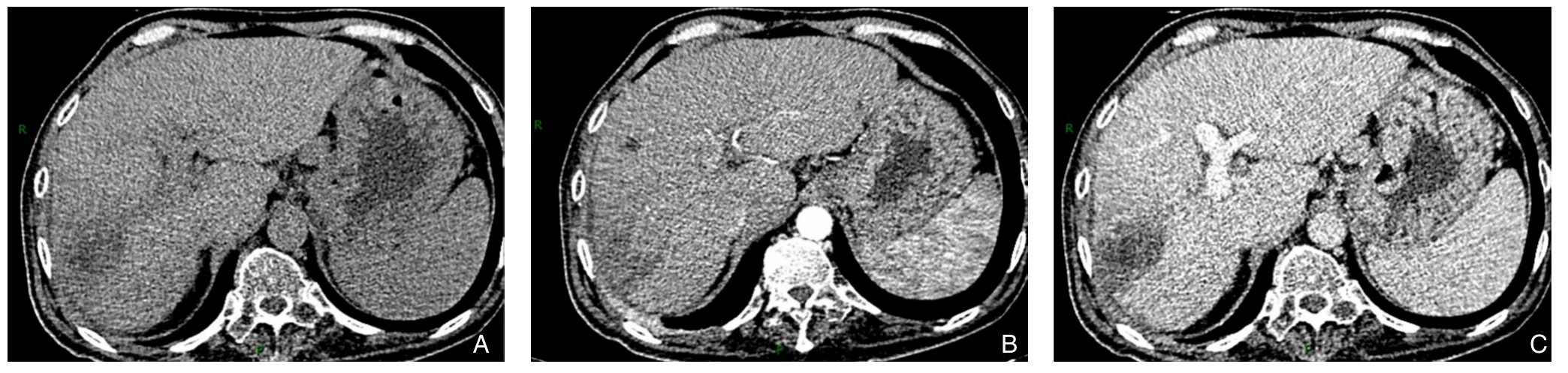
图3 上腹部CT A:平扫期;B:动脉期;C:门脉期

图4 头颅MRI A:矢状位;B:T1期;C:T2期
2 文献复习并讨论
原发性肝癌是第六大常见癌症,也是2020年全球癌症死亡的第三大原因,2020年新增病例约90.6万例,死亡83万例,其中中国新增病例41万例,死亡39.1万例,分别占总数的45%和47%,发病率及病死率均居世界首位,严重威胁人民的健康和生命[1-2]。由于肝癌起病隐匿及发展迅速,70%~80%患者确诊时已是中晚期(BCLC B、C期),手术效果差或失去手术机会。即使是根治性手术治疗,5年内仍有60%~70%患者出现转移和复发,肝癌的高转移和复发特性是影响患者长期生存的主要原因[3-4]。
近年来ICIs在肿瘤领域取得了令人瞩目的疗效,肝癌治疗进入免疫治疗的新时代,大量中晚期肝癌患者通过免疫治疗使病情得到控制,甚至获得了手术机会。在临床取得良好疗效的同时,irAEs的报告越来越多。临床以胃肠道、内分泌腺、皮肤、肝脏和肺脏等脏器较为多见[5],3级或4级irAEs的发生率约为3%~14%[6]。n-irAEs临床少见,发病率约为1.0%~2.8%,[6-7]。临床观察发现,n-irAEs在抗CTLA4抗体中占3.8%,在抗PD-1/PD-L1抗体中占6.1%,在两者的联合治疗中占12.0%,这表明与单用抗PD-1抗体或抗CTLA-4抗体治疗的患者相比,抗CTLA-4抗体与抗PD-1抗体联合治疗的患者更容易发生n-irAEs,这与影响其他器官系统的irAEs发病率不同,irAEs与抗PD-1抗体相关的频率低于抗CTLA-4抗体[8-10]。n-irAEs可发生在多种恶性肿瘤中,但目前尚不清楚哪些特定癌症类型的发病率较高。有文献[11]报道,黑色素瘤和非小细胞肺癌的n-irAEs报告更多。ICIs联合治疗增加了irAEs的风险,其确切发生机制尚未明确,目前多个研究认为与以下因素有关:⑴ 恢复和增强T细胞识别和杀伤与肿瘤细胞表达共同抗原的正常神经系统组织;⑵ ICIs导致预先存在的自身抗体滴度升高、识别和影响正常神经系统组织;⑶ 促炎细胞因子水平升高;⑷ 补体系统激活导致免疫性炎症;⑸ 肠-脑轴相互关系等[12]。此外,一些细胞因子、宿主因素、肠道菌群、遗传危险因素和特异性抗原暴露可能都与irAEs有关[13]。
在irAEs中以n-irAEs最为严重,n-irAEs主要分为中枢神经系统病变与外周神经系统病变[14-15]。中枢神经系统病变包括脑炎、无菌性脑膜炎、中枢神经系统脱髓鞘、视神经炎、中枢神经系统血管炎、神经系统结节病、横断性脊髓炎、副肿瘤综合征、脑膜神经根炎、后可逆性脑白质病综合征等[11]。外周神经系统病变包括周围神经病变、颅神经病变、肌无力样综合征、吉兰-巴雷综合征样病变、肌炎和肌病。所以临床n-irAEs患者的临床症状及体征差异很大;周围神经病变是最常见的n-irAEs,占所有n-irAEs的1/3~2/3[16-17],其主要临床表现为感觉减退或丧失、不对称性疼痛或肢体乏力、肌无力或颅神经病变等。中枢神经系统病变主要表现为寒战、发热、意识水平下降和癫痫发作等。
n-irAEs诊断主要依据患者临床症状、体征、生化及影像学检查等,其中头颅MRI、肌电图、脑脊液检查及相关抗体筛查均有助于疾病的诊断与鉴别[11,18]。根据临床表现的不同进行针对性的相关检查。对于有中枢神经系统症状的患者,颅脑MRI可以排除脑部或软脑膜转移。脑电图可以排除亚临床癫痫活动。通过明确精神症状或头痛的发作时间以及副肿瘤自身抗体的筛查来排除自身免疫性脑炎或副肿瘤综合征。对于周围感觉或运动神经病变的患者,可通过神经传导研究和/或肌电图排查。脑脊液检测亦是非常重要的一环[19-20]。
中枢性n-irAEs患者可出现寒战、发热等前驱症状,脑炎可表现为精神状态异常、行为和记忆的改变、意识水平下降和癫痫发作等[21-22]。无菌性脑膜炎常表现为头痛、发热、呕吐、颈部僵硬等非特异性症状。中枢神经系统脱髓鞘疾病50%表现为运动体征,其他可表现为视觉障碍、疲劳和意识或认知障碍。脊髓炎多表现出运动和感觉症状[23-24];MRI可表现为边缘系统弥散受限,亦可表现为大片病灶伴轻度强化,但部分患者的MRI表现为正常[25-26];脑脊液检查可出现淋巴细胞及蛋白质、葡萄糖水平的升高,也有助于n-irAEs的诊断[11,18]。神经抗体的筛查有助于疾病的确诊[21,27],抗NMDAR脑炎最为常见[27-28],其中NMDAR、LGI1、GABABR、CASPR2和AMPAR前抗抗体的相对频率分别为79.7%、12.8%、5.6%、1.3%和0.6%。外周神经系统病变有很大差异,肌炎可引起高钾血症和肌痛。重症肌无力(MG)可表现出危及生命的呼吸肌受累的症状。上睑下垂、复视、吞咽困难、构音障碍和呼吸困难也很常见。感觉、运动或自主周围神经受累会出现疼痛、感觉异常或无力[20]。Vogrig等[28]调查统计了19例n-irAEs脑炎患者,其中有MRI未见异常7例,脑脊液检查未见异常4例,免疫性脑炎相关抗体筛查未见异常4例。在本文考虑中枢性n-irAEs的患者自身免疫性脑炎抗体也均为阴性;另1例诊断外周性n-irAEs患者仅抗GD1a抗体IgG及肌炎谱抗Ro-52阳性。笔者认为相关神经抗体检查有助于筛查、鉴别诊断n-irAEs,尚需结合临床症状、体征及影像学综合判断。
疑似n-irAEs患者因病情危重不能完善相关检查,或部分检查结果阴性导致诊断依据不足是十分棘手的临床问题。本研究中,病例1接受免疫治疗1周后出现发热、意识不清、失语、惊厥伴手足颤抖等疑似n-irAEs症状,但头颅MRI扫描及自身免疫性抗体检测正常,临床高度怀疑但诊断尚不充分的情况下,笔者团队紧急给予氢化泼尼松+IVIG冲击疗法,诊断性治疗后患者症状逐渐缓解并治愈。总结经验发现,急危重患者诊断性用药在非典型n-irAEs的诊疗中具有一定的临床价值。在发病中位时间上,病例1在免疫治疗后第1周期出现症状,较n-irAEs的中位发病时间3周[18]较早。笔者结合文献及本组病例提出n-irAEs的诊断流程图(图5)。

图5 n-irAEs的诊断流程
目前,ICIs相关不良反应的治疗包括ICI停药、对症支持治疗和激素联合IVIG治疗,必要时行血浆置换[14,29]。1~2级的不良反应一般只需暂时停用ICIs,并使用激素与IVIG联合治疗可使病情得到有效缓解。3~4级的不良反应则必须永久停用ICIs[30]。n-irAEs多为3级不良反应。对于免疫性脑炎患者,首先应完善检查,排除诊断,对轻度病例,暂停免疫治疗,考虑试用甲泼尼龙琥珀酸钠1~2 mg/kg/d。对于中、重度病例暂停免疫治疗并密切观察。如果症状进展,给予甲泼尼龙琥珀酸钠/氢化泼尼松起始剂量0.5~1 mg/kg/d,对于中、重度病例除了给予IVIG,还应考虑冲击量激素(1次/d,3~5 d)。如果在1~2周后疗效有限或未见改善,则考虑使用利妥昔单抗。对于外周神经病变患者,轻、中度病例暂停免疫治疗,密切观察。如果症状进展,给予甲泼尼龙琥珀酸钠/氢化泼尼松起始剂量0.5~1 mg/kg/d,如果进一步恶化,将剂量增加至2~4 mg/kg/d,激素使用的总疗程多在4~6周或以上[31]。n-irAEs总体复发率为12%,且多在激素减量或停药后数周内发生[16]。在预后方面,有文章[11,22]报道,临床出现发热、脑脊液呈炎症变化的患者提示预后良好,抗神经元自身抗体检测阳性、表现为局灶综合征、MRI提示异常的患者提示预后不良,而表现为副肿瘤性脑炎综合征的患者预后最差。
ICIs给恶性肿瘤患者带来了新的希望,n-irAEs在临床十分少见,但致死率高。其临床症状与体征呈多样性,影像学表现及实验室检查常缺乏特异性征象,临床诊断标准尚不统一,临床医师需熟练掌握n-irAEs的诊断、分级及治疗等,做到早诊断、早治疗,进而提高其治疗效果。
利益冲突:所有作者均声明不存在利益冲突。
作者贡献声明:本文由陈卫煌、岑海强主要撰写,杨永光进行校对、修改,汤馥豪、康钟杰、李作标进行病史、图片的收集与处理,韩焕钦、周海红、律东、陈华林提供专科指导意见。
