忍冬VIGS 基因沉默体系构建
2024-03-02褚洪月刘振华张永清蒲高斌
褚洪月,刘振华, ,李 佳, ,张永清, ,蒲高斌, *
1. 山东中医药大学,山东 济南 250355
2. 山东省中药质量控制与全产业链建设协同创新中心,山东 济南 250355
金银花为忍冬科忍冬属植物忍冬Lonicera japonicaThunb.的干燥花蕾或带少量初开的花,始载于《名医别录》,是我国传统中药材,具有清热解毒、疏散风热等功效[1]。金银花市场需求巨大,据统计有500 多个临床组方和200 多种中成药中都含有金银花。山东、河南、河北是金银花的主产区[2],目前栽培面积超过6.7万公顷,年产量3 000 余万千克。由于忍冬育种基础薄弱,传统育种方法周期长、效率低,导致生产中缺乏良种,严重制约了金银花产业的发展。
挖掘忍冬关键性状的决定基因,将分子标记辅助育种与传统育种方式结合,是解决忍冬生产中良种缺乏的有效途径。为此,本课题组前期从忍冬中克隆获得了HQT[3]、C3’H[4]、MLO[5]、MYB[6]、U6 启动子[7]等多个与质量和抗性相关的基因。遗憾的是,由于忍冬稳定遗传转化效率极低,很多基因只能在体外或异源植株中验证功能,缺乏直接的实验证据。
病毒诱导的基因沉默具有操作简便、研究周期短、不需遗传转化等优点,已在多种单、双子叶植物中广泛应用[8-9]。它基于植物对病毒基因复制的防御机制,综合植物病毒的非转基因系统性侵染、植物的免疫应答及细胞RNAi 沉默机制于一体,可以简易快速且高效的沉默靶向基因,极大地方便了植物基因功能的反向遗传学研究[10-11。与传统的基因功能分析方法相比,病毒诱导的基因沉默(virus-induced gene silencing,VIGS)能够在侵染植物当代对目标基因进行沉默和功能分析,无需开发稳定的转化子,并且具有沉默单个或多个基因家族成员的潜力[12]。
在多种植物中,黄瓜花叶病毒(Cucumbermosaic virus,CMV)已被应用于VIGS 体系的开发,包括本生烟草[13]、菠菜[14]、马铃薯[15]、香蕉[16]和玉米[17]等。Wang 等[18]基于天然玉米感染CMV 株,开发了一套CMV 玉米北京分离物(ZMBJ-CMV)的高效病毒诱导基因VIGS,为玉米快速高效的基因功能研究提供了工具。Tasaki 等[19]开发了一种基于香蕉感染CMV分离物CMV 20 的VIGS 系统,并为香蕉开发了一种高效的农杆菌接种方法,高感染率和延长的沉默将为加速香蕉的功能基因组研究提供宝贵的工具。VIGS已成功用于多种药用植物性状功能基因的挖掘,VIGS系统将会在更多的植物物种,尤其是在那些难以通过转基因方法分析的药用植物中得以应用[20-22],成为后基因组时代作物基因功能研究的重要技术手段。
八氢番茄红素脱氢酶(phytoene desaturase,PDS)是类胡萝卜素合成途径中的一个关键酶。沉默表达PDS基因后,类胡萝卜素合成途径受阻,进而导致叶绿素被光氧化降解,植株呈现白化现象[23-24]。因此,PDS基因被作为报告基因在VIGS 沉默体系中普遍应用。然而,有关忍冬VIGS 的研究目前尚未见报道。本研究以忍冬PDS(LjPDS)基因为切入点,通过从忍冬中克隆PDS基因,利用生物信息学分析软件对其进化关系进行分析,构建了VIGS 体系,验证并优化了VIGS 处理忍冬的沉默效果,为开展忍冬关键基因功能研究奠定了基础。
1 材料
选用山东中医药大学培育的忍冬新品种‘华金2 号’幼苗,由山东中医药大学蒲高斌教授鉴定为忍冬L.japonicaThunb.。多糖多酚植物RNA 提取试剂盒购自南京诺唯赞生物科技股份有限公司;PrimeScript RT reagent Kit with gDNA Eraser 和TB Green Premix Ex Taq II 均购自TaKaRa 公司;C58C1菌株购自上海唯地生物技术有限公司;引物合成和测序均由铂尚生物技术(上海)有限公司负责。
2 方法
2.1 样品的处理
其在组培室中播种并培养,培养条件:温度23 ℃,光强度110 μmol/(m2·s),光循环16 h 光照/8 h 黑暗,湿度60%。适合开发VIGS 载体的病毒在植物中应具有高传染性,但症状轻微或无症状。为此选用了Wang 等[18]改造CMV 基因组RNA1、RNA2 和RNA3 重组构建后的ZMBJ-CMV VIGS 载体,该载体由中国农业大学植物保护学院植物病理学系周涛研究组提供,载体最适合的插入片段大小为100~300 bp。
2.2 LjPDS 基因片段的克隆
根据课题组前期的‘华金2 号’全基因测序结果,使用Primer 6.0 选取同源性较高的片段设计LjPDS基因的特异性引物(表1)。

表1 引物序列Table 1 Primer sequence
RNA提取步骤参照试剂盒说明书。提取的RNA经1.0%琼脂糖凝胶电泳检测。使用TAKARA 公司的PrimeScripTM RT reagent Kit with gDNA Eraser试剂盒,将合格的RNA 反转录为cDNA。以上述cDNA 为模板,使用北京聚合美生物科技有限公司2×M5 HiPer plus Taq HiFi PCR mix 高保真Taq 酶mix 进行PDS基因扩增,PCR 扩增体系:2×M5 HiPer plus Taq HiFi PCR mix 10 μL、上引物0.5 μL、下引物0.5 μL、cDNA 1 μL 和ddH2O 8 μL。PCR 扩增程序:95 ℃预变性3 min;95 ℃变性30 s,57 ℃30 s,72 ℃延伸1 min,循环32 次;72 ℃终延伸5 min;4 ℃保存。用1.0%琼脂糖凝胶电泳检测PCR扩增产物,确定条带的正确性和单一性。然后使用胶回收试剂盒进行PCR 产物回收,回收步骤参考说明书。回收产物与pMD18-T 载体按照说明书的步骤和方法进行连接,并转化到DH5α 感受态细胞。经抗性筛选后,挑取阳性单菌落,用引物进行PCR检测,并将阳性菌落送至铂尚生物技术(上海)有限公司测序。
2.3 LjPDS 蛋白生物信息学分析
将LjPDS基因的测序结果进行生物信息学分析。 首先在 NCBI 在线软件 ORF finder(https://www.ncbi.nlm.nih.gov/orffinder/)分析基因的开放阅读框(open reading frame,ORF)和翻译出的蛋白序列;通过NCBI 数据库的在线软件blast(https://blast.ncbi.nlm.nih.gov/)寻找与LjPDS 蛋白序列相似的其他物种的PDS 蛋白序列并下载;DNAMAN 6.0 软件对不同物种PDS 蛋白序列进行多序列比对分析,找出相对保守的结构域;通过MEGA X 软件对LjPDS 蛋白与其他物种PDS 蛋白进行系统进化树分析。
2.4 VIGS 载体的构建方法
将测序正确的大肠杆菌提取质粒,采用限制性内切酶KpnI、XbaI同时对该质粒和pCMV201-2bN81质粒分别进行双酶切。将酶切后的目的片段和pCMV201-2bN81载体回收,利用T4 连接酶进行连接,并转化到大肠杆菌感受态细胞中。经抗性筛选后,挑取阳性单菌落,用载体引物进行PCR 检测。参考Wang 等[18]实验方法,成功连入插入片段的pCMV201-2bN81重组质粒经PCR 扩增得到的产物大小为431 bp 插入片段长度,未能成功插入片段的pCMV201-2bN81质粒经PCR 扩增得到的产物大小约为431 bp。PCR 程序为95 ℃预变性3 min;95 ℃变性30 s,55 ℃、30 s,72 ℃延伸90 s,循环30次;72 ℃终延伸10 min。将正确插入的重组质粒转化根癌土壤杆菌C58C1。
2.5 农杆菌接种
将携带有 pCMV101 、 pCMV201-2bN81、pCMV201-2bN81:LjPDS、pCMV301 的根癌土壤杆菌C58C1 在带有卡那霉素(质量浓度为50 μg/mL)和利福平(质量浓度为25 μg/mL)的LB 培养基中28 ℃、180 r/min 震荡培养36 h。再以1∶100 的比例取新鲜菌液接种于20 mL LB 液体培养基中,使根癌土壤杆菌的A600值在0.6~1.0。4 000 r/min 离心10 min 收集菌体,弃上清液。使用10 mmol/L 氯化镁(MgCl,天津市鼎盛鑫化工有限公司)、10 mmol/L MES 水合物(MES,上海麦克林生化科技有限公司)、100 μmol/L 乙酰丁香酮(AS,上海麦克林生化科技有限公司),加入ddH2O 至100 mL 组成的侵染缓冲液,将重悬洗涤后的菌体吸光度(A)调整至A600=1.0。室温静置诱导至少3 h。
将诱导后的分别携带有pCMV101、pCMV201-2bN81:LjPDS、pCMV301 的农杆菌分别以1∶1∶1 的比例混合,用1 mL 不带针头的注射器浸润接种生长适合的忍冬幼苗叶片背面。设置3 个处理组:野生型忍冬为空白对照组(CK)、空载体注射为阴性对照组(pCMV201-2bN81)、含PDS基因的重组载体注射为实验组(pCMV201-2bN81:LjPDS),每组10 株,平行测定3 次。注射后放置23 ℃黑暗培养2 d,之后正常光照培养。
2.6 测定指标
采集接种病毒15 d 后有明显白化表型症状的忍冬叶片(接种叶上一叶),提取叶片总RNA,并反转录合成cDNA,采用SYBR Green 法进行qRTPCR,分析PDS的相对表达量。选用忍冬Actin基因(NTU60495)为内参基因[4],并设计实时荧光定量PCR 引物(表1)。相对表达量按照2-ΔΔCt法进行计算,数据以±s表示,使用SPSS 软件分析结果,显著性P<0.05、0.01。使用GraphPad prism 软件进行作图。
为验证LjPDS沉默后叶绿素的变化情况,分别取CK 和沉默处理组的等位叶3 组,测定叶绿素和类胡萝卜素含量,方法参考胡黎[25]实验。
叶绿素a 含量=13.95×A665nm-6.88×A649nm
叶绿素b 含量=24.96×A649nm-7.32×A665nm
叶绿素总含量=叶绿素a+叶绿素b
叶绿素的含量=(叶绿素的含量×提取液体积×稀释倍数)/样品鲜质量
类胡萝卜素含量=(1 000×A470nm-2.05×叶绿素a 含量-114.8×叶绿素b 含量)/245
2.7 VIGS 体系的优化
2.7.1 菌液吸光度 采用叶片注射法,将3 种不同A值(A600=0.6、0.8、1.0)的农杆菌注入植株叶片,置于23 ℃黑暗处理24 h 后,转移至光照16 h,黑暗8 h,23 ℃继续培养,每次处理21 株幼苗,重复3 次。
2.7.2 接种方法 处理1,在子叶期,用无针头注射器吸取接种液,注入植株子叶背面,置于23 ℃黑暗处理24 h 后,转移至光照16 h,黑暗8 h,23 ℃继续培养,每次处理21 株幼苗,重复3 次。处理2,在子叶期,先用注射法接种,再将幼苗真空浸润法进行处理,在真空压力为0.60 MPa 条件下静止2 min,置于23 ℃黑暗处理24 h 后,转移至光照16 h,黑暗8 h,23 ℃继续培养,每次处理21 株幼苗,重复3 次。
当植株出现光漂白现象后,统计光漂白植株数量,并计算VIGS 沉默株率。以白化植株出现的百分率标记为VIGS 的沉默株率。
植株沉默株率=白化株数/转化总株数
3 结果与分析
3.1 LjPDS 基因片段克隆
首先,本研究对LjPDS基因片段进行PCR 扩增。PCR 产物经琼脂糖凝胶电泳检测,得到1 条135 bp 的目的条带(图1),条带大小符合预期。经测序,结果显示PDS序列和参考序列一致,说明该条带是目标靶基因。

图1 忍冬LjPDS PCR 扩增结果Fig. 1 Result of PCR amplification of LjPDS gene
3.2 LjPDS 生物信息学分析
本课题组前期研究已获得LjPDS全长序列。PDS全长1 458 bp,通过NCBI 在线软件ORF finder 分析,该基因的ORF 为1 458 bp,编码485个氨基酸。利用MEGA X 软件对LjPDS 蛋白与其他物种PDS 蛋白进行系统进化树分析。结果显示(图2),可以看出LjPDS 与图中的植物同源性都较高。利用DNAMAN 软件将‘华金2 号’PDS 蛋白序列与其他几个物种PDS 蛋白序列进行多序列对比,见图3。黑色阴影表示非常保守的区域,灰色阴影表示相对保守的区域。图中黑色阴影标记氨基酸序列占大部分,PDS 蛋白序列(XP_034916536.1)与猕猴桃Actinidiachinensis( PSS26226.1 )、 芝 麻Sesamumindicum( XP_011087837.1 )、 大 豆Glycinemax(XP_003524753.1)、赤小豆Vignaumbellata(XP_047182202.1)和番茄Solanumlycopersicum(XP_004232522.1)蛋白序列的相似度分别为74.95%、70.70%、70.52%、70.78%和69.61%,说明忍冬LjPDS 与其他几个物种PDS 氨基酸序列同源性非常高,其在进化发育相对保守。

图2 不同物种PDS 蛋白遗传进化关系的分析Fig. 2 Genetic evolutionary relationship analysis of PDS proteins in different species
3.3 VIGS 载体的构建
将双酶切后的目的片段与载体连接,转化大肠杆菌感受态细胞。使用载体引物PCR 检测阳性菌斑,成功连入插入片段的pCMV201-2bN81重组质粒经PCR 扩增得到的产物大小为431 bp+插入片段长度(图4),条带大小符合预期,说明VIGS 载体构建成功,可用于后续实验。

图4 阳性克隆菌落鉴定Fig. 4 Identification of positive clonal colony
3.4 qRT-PCR 检测PDS 基因沉默效果
利用农杆菌将pCMV201-2bN81:LjPDS载体侵染忍冬幼苗叶片,发现当忍冬植株PDS基因被沉默后,植株叶片出现褪绿,白化表型,而阴性对照植株(侵染空载体)表型则没有变化(图5),初步说明VIGS 载体构建成功。

图5 VIGS 瞬时沉默表达LjPDS 的忍冬植株表型Fig.5 Phenotypes of L. japonica plants expressing LjPDS with transient silencing by VIGS
为进一步确定PDS基因的沉默效率,本研究采用qRT-PCR 技术检测PDS基因的表达量。结果表明,与野生型忍冬相比,实验组3 个单株叶片中PDS基因在忍冬体内的表达量显著降低,沉默效率高达80%(图6)。

图6 LjPDS 基因的沉默效果检测Fig. 6 Detection of silencing efficiency of LjPDS gene
3.5 沉默LjPDS 基因忍冬叶片色素含量降低
通过对CK 和沉默LjPDS基因有明显白化现象的忍冬叶片,研究进一步测定了CK 和白化忍冬叶片中叶绿素及类胡萝卜素含量,发现沉默LjPDS会使忍冬叶片叶绿素和类胡萝卜素的含量降低,其降低的程度较为显著(图7)。

图7 沉默LjPDS 叶绿素和类胡萝卜素量降低Fig. 7 Lower chlorophyll and carotenoid contents in silent LjPDS
3.6 VIGS 体系的优化
不同寄主植物中基因沉默的效率及成功率存在差异,为了更好地评价VIGS 的沉默株率,本研究比较不同农杆菌菌液(A600=0.60、0.80 和1.00)及不同的接种方法对忍冬PDS基因沉默株率的影响。结果显示,一定范围内农杆菌接种(A值为0.60~1.00)对VIGS 效率影响不明显,当农杆菌菌液A600=0.80 时,PDS基因的沉默比例最高,为50.79%,农杆菌A600=0.60 和A600=1.00时沉默比例分别为44.44%和49.20%。结果如图8所示,注射法和注射真空浸润法的沉默比例分别为50.79%和66.66%,可以采用注射真空浸润法提高沉默效率。
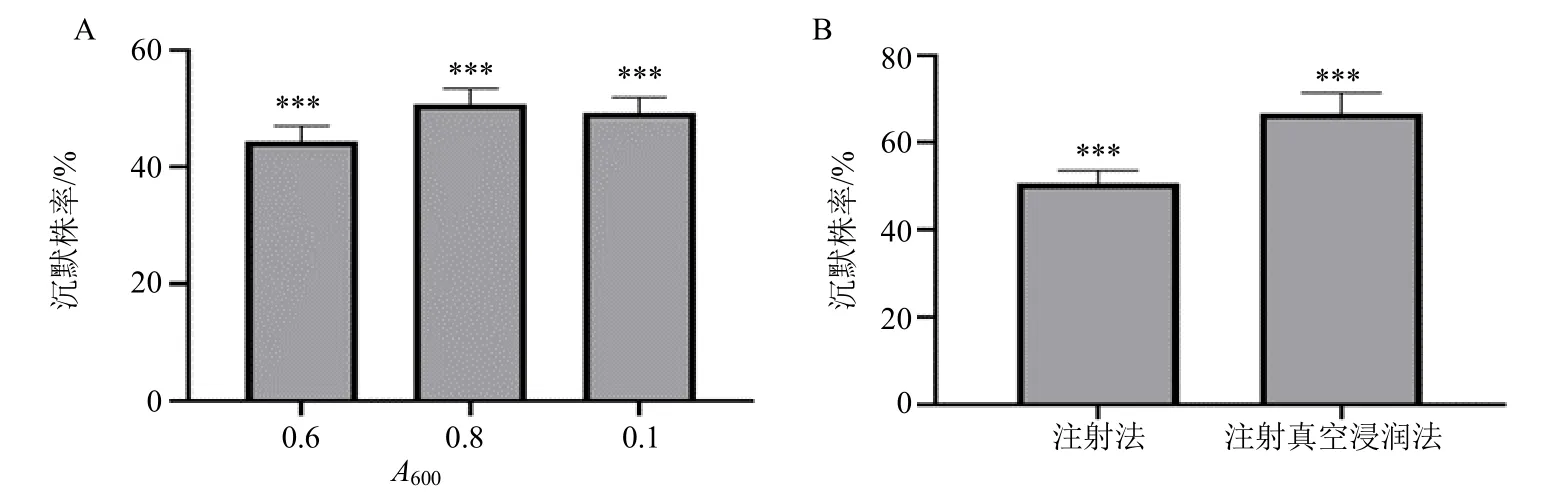
图8 农杆菌不同接种吸光度 (A) 及不同接种方法 (B) 对LjPDS 基因沉默株率的影响Fig. 8 Effects of different inoculation absorbances (A) and different inoculation methods (B) of Agrobacterium tumefaciens on silencing rate of LjPDS gene
4 讨论
目前尚未发现可靠的遗传转化体系、基因沉默体系和基因敲除体系,能够使忍冬植物的再生和遗传稳定转化。然而,能够分析忍冬的重要基因功能将是进一步表征植物的重要前提。因此,本研究利用生物信息学分析和PCR 技术构建VIGS 载体,以期建立忍冬VIGS 体系,为研究忍冬关键基因的功能奠定基础。
1、2、3 号分别为沉默组3 个单株叶片PDS基因表达量,***P<0.01 水平上存在显著差异,下图同。
1, 2, 3 were the expression levels ofPDSgene in the leaves of three single plants in the silencing group, respectively,***P< 0.01 indicates a significant difference at the level, same as below.
本研究通过序列比对发现忍冬科植物中PDS基因高度同源,进而利用其保守结构域设计引物并成功克隆出用PDS基因片段,并利用酶切连接的方法构建了VIGS 载体,转化到根癌农杆菌并侵染忍冬叶片,出现白化现象,qRT-PCR 结果发现VIGS 沉默株系中PDS基因表达量显著降低。综上,VIGS 体系可在忍冬中成功地发挥作用,成功地沉默了忍冬PDS基因,并获得PDS基因沉默的忍冬植株。Li 等[26]建立了1个基于CMV 的VIGS 系统,可以有效的沉默玉米基因,克服了目前玉米VIGS 病毒感染率低、沉默维持时间短的局限性。董婷婷[27]以CMV-Fny 侵染性克隆为基础,构建2b 缺失突变载体pCB301-Fny2-2b del,完成对水芹CMV-Fny 侵染性克隆的改造,改造好的载体成功沉默水芹PDS基因。
VIGS 具有不依赖遗传转化,接种方便,沉默效率高的优势,但由于VIGS 依赖于转录后基因沉默和转录基因沉默以及沉默信号的全身传递,不同个体、器官和组织的沉默程度不同,沉默的起始时间和持续时间也可能因个体和物种而异,因此,还需要进一步研究体系优化,使其沉默效率更加高效。尽管如此,但开发的VIGS 方法可用于执行反向遗传方法以鉴定未知的基因功能,且实验处理组较对照组也有极显著差异,这表明本方法可以用于大规模基因沉默忍冬植物材料的制备,VIGS 可以快速有效地用于分析忍冬中的基因功能。VIGS 的成功建立可以消除组织培养的需要,为研究忍冬的基因功能提供有效的方法,加速忍冬功能基因组研究的进程。为研究忍冬基因功能引入新途径,提供创新的忍冬种质资源。
利益冲突所有作者均声明不存在利益冲突
