基于肠道菌群探究一贯煎多糖的结构及改善小鼠肝纤维化作用
2024-03-02王星星方勤勤秦路平吴建军
魏 霞 ,王星星,方勤勤,徐 莹 ,秦路平,刘 平,刘 伟 *,吴建军*
1. 浙江中医药大学药学院,浙江 杭州 310053
2. 上海中医药大学附属曙光医院药学部,国家中医药管理局中药制剂三级实验室,上海 201203
3. 上海中医药大学附属曙光医院肝肾疾病病证教育部重点实验室,上海市中医临床重点实验室,上海 201203
肝纤维化是病毒性肝炎、非酒精性肝病、胆汁淤积性肝病等慢性肝病共有的病理变化,主要表现为肝组织内细胞外基质(extracellular matrix,ECM)过度增生与沉积,从而导致肝脏组织结构异常改变,并影响肝脏正常生理功能。由于肝纤维化病理机制复杂,目前尚无疗效明确的化学药物或生物学药物可供临床应用[1-3]。一贯煎是现代临床治疗慢性肝病“肝肾阴虚”证的代表方剂,由清代名医魏之琇所创,由生地黄、北沙参、麦冬、当归、枸杞和川楝子组成。古籍中记载为“统治胁痛、吞酸、疝瘕,一切肝病”。近代名医张山雷称其为“涵养肝阴无上良方”。一贯煎作为治疗慢性肝病的代表名方,已有实验研究揭示了一贯煎治疗肝纤维化和肝硬化的部分作用机制,主要与抗氧化应激、提高肝细胞生物合成、抑制肝星状细胞活化、减轻胶原沉积、改善肝窦血管化、促进肝细胞再生等有关[4-6]。近年来,越来越多研究发现包括肝纤维化在内的各种肝脏疾病的发生进展通常伴随着肠道菌群的失调,改善肠道菌群结构紊乱,可有效缓解肝脏疾病[7-9]。一贯煎是否可通过调节肠道菌群进而发挥改善肝纤维化的作用尚不清楚。现代化学成分研究表明一贯煎含有大量的多糖类成分,其含量高达30%[10]。目前,已有针对方中生地黄、北沙参、麦冬、当归和枸杞等单味药材多糖成分的功效研究[11-17],但针对全方多糖的研究尚未见报道。因此,本研究采用四氯化碳(carbon tetrachloride,CCl4)诱导小鼠肝纤维化模型,考察一贯煎多糖组分对小鼠肝功能指标、纤维化相关指标和肝脏病理学改变等的影响,并基于肠道菌群分析,探讨一贯煎多糖发挥药效作用的途径,以期为揭示一贯煎抗肝纤维化物质基础、指导临床应用与研究开发提供实验依据。
1 材料
1.1 动物
6 周龄SPF 级雄性C57BL/6J 小鼠(20~22 g),购自上海斯莱克实验动物有限公司,动物生产合格证号:SCXK(沪)2017-0005。动物饲养于上海中医药大学动物房,温度为(25±2)℃,相对湿度为(50±5)%,光照明、暗周期各12 h。动物实验通过上海中医药大学实验动物伦理委员会批准(PZSHUTCM201016007)。
1.2 药材
生地黄(产地河南温县,生产批号YL-21-01-01)、枸杞子(产地宁夏中宁,生产批号YL-21-01-07)、麦冬(产地浙江金华,生产批号YL-21-01-09)、当归(产地甘肃岷县,生产批号YL-21-01-06)、北沙参(产地内蒙赤峰,生产批号YL-21-01-08)和川楝子(产地四川凉山,生产批号YL-21-01-10)六味药材均由安徽致和堂药业有限公司提供,均经浙江中医药大学药学院吴建军副教授鉴定,分别为玄参科植物地黄RehmanniaglutinosaLibosch.的新鲜或干燥块根、茄科植物宁夏枸杞LyciumbarbarumL.的干燥成熟果实、百合科植物麦冬Ophiopogon japonicus(L.f) Ker-Gawl.的干燥块根、伞形科植物当归Angelicasinensis(Oliv.) Diels 的干燥根、伞形科植物珊瑚菜GlehnialittoralisFr. Schmidt ex Miq.的干燥根和楝科植物川楝MeliatoosendanSieb.et Zucc.的干燥成熟果实。
1.3 药品与试剂
单糖标准品L-岩藻糖(质量分数≥98%)、L-鼠李糖(质量分数≥98%)、L-阿拉伯糖(质量分数≥98%)、D-半乳糖(质量分数≥98%)、D-葡萄糖(质量分数99.6%)、D-木糖(质量分数99.9%)、D-甘露糖(质量分数≥98%)、D-果糖(质量分数≥99%)、D-核糖(质量分数≥98%)、D-半乳糖醛酸(质量分数≥98%)、D-葡萄糖醛酸(质量分数≥98%),均购自上海源叶生物科技有限公司;L-古罗糖醛酸(质量分数≥98%)、D-甘露糖醛酸(质量分数≥98%)均购自青岛博智汇力生物科技有限公司。3500 Da 透析袋购自上海源叶生物公司;DEAE Sephrose Fast Flow 弱阴离子交换树脂购自瑞典GE Healthcare 公司;CCl4、橄榄油、羧甲基纤维素钠、氯化钠、氢氧化钠、乙醇、硫酸、苯酚等试剂均为分析纯,购自国药集团化学试剂有限公司;苏木素-伊红(HE)染色试剂盒,羟脯氨酸试剂盒(南京建成生物工程研究所,批号分别为20200716、A030-1);PCR 引物由上海生工生物工程股份有限公司合成,引物序列见表1。
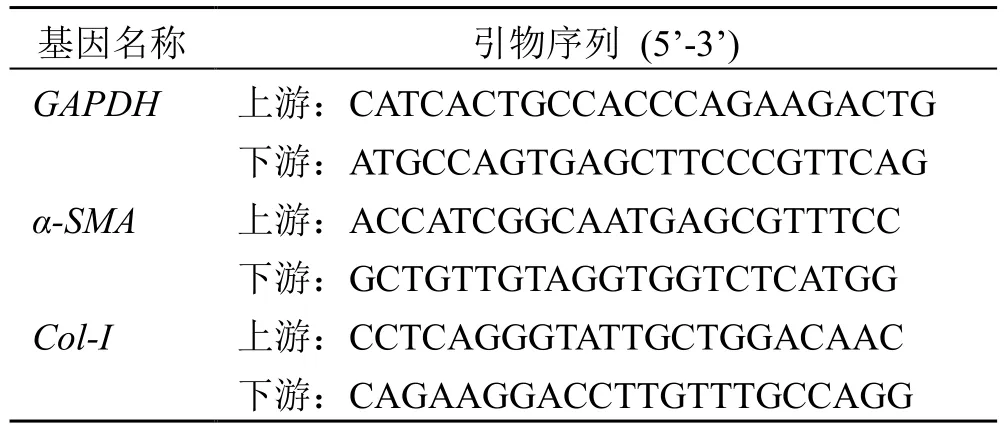
表1 PCR 引物序列Table 1 PCR primer sequences
1.4 主要仪器
Dionex ICS5000 型离子色谱仪(美国 Thermo Fisher Scientific 公司),1100 型液相色谱仪(美国Agilent Technologies 公司),LC-10N-50A 型冷冻干燥机(LICHEN 公司),UV-3600 型紫外可见近红外光谱仪(日本SHIMADZU 公司),2000 傅里叶红外仪(美国PerkinElmer 公司),SU8100 型场发射扫描电子显微镜(日本HITACHI 公司),MC1000型离子溅射仪(日本HITACHI 公司)。
2 方法
2.1 一贯煎多糖功效组分的制备
一贯煎出自清代钱敏捷的《医方絜度》,《古代经典名方关键信息表(7 首方剂)》明确一贯煎处方剂量为北沙参、麦冬、当归各5.60 g,生地黄、枸杞子各11.19 g,川楝子7.46 g,制法为水煎服。根据《按古代经典名方目录管理的中药复方制剂药学研究技术指导原则(试行)》规定“水煎服”应参照《医疗机构中药煎药室管理规范》,即待煎药物应当先行浸泡,浸泡时间一般不少于30 min,加水量应没过药材2~5 cm 为宜,滋补药物先用武火煮沸后,改用文火慢煎约40~60 min,每剂药一般煎煮2 次。本研究根据上述规定进行一贯煎制样,合并2 次水煎液,减压浓缩后加95%乙醇至乙醇体积分数为70%,室温静至过夜后,4 000×g离心20 min,弃去上清液,收集沉淀,沉淀用无水乙醇洗涤2 次,待室温挥干至无醇味,用少量纯水溶解,冷冻干燥,得一贯煎粗多糖YGJP。取约5 g 的YGJP 溶解于15 mL 的蒸馏水,8 000×g离心10 min 后吸取上清液进行上样弱阴离子交换树脂柱(DEAE Sepharose Fast Flow,500 mm×55 mm),依次用蒸馏水及0.2、0.5 mol/L 的NaCl 溶液洗脱,分别收集洗脱液,使用苯酚-硫酸法跟踪监测洗脱峰。按照洗脱峰收集各洗脱部位,减压浓缩,透析48 h,冷冻干燥,即得到各一贯煎多糖组分YGJP-W、YGJP-0.2 和YGJP-0.5[18-19]。
2.2 一贯煎多糖组分的化学表征
2.2.1 总糖、糖醛酸及蛋白含量测定 采用苯酚-硫酸法测定一贯煎多糖样品的总糖含量。精密称取葡萄糖标准品5.00 mg,用蒸馏水定容于50 mL 量瓶中,得质量浓度100.0 μg/mL 的葡萄糖母液。分别精密量取0、0.4、0.8、1.2、1.4、1.6、1.8、2.0 mL的葡萄糖母液于20 mL 具塞试管中,各以蒸馏水补至2.0 mL,配成系列质量浓度为0、20、40、60、70、80、90、100 μg/mL 的葡萄糖对照品溶液,然后加入1.0 mL 的6%苯酚及5.0 mL 浓硫酸,摇匀,室温反应20 min 以后于490 nm 测定吸光度(A)。以对照品质量浓度为横坐标(X),以A值为纵坐标(Y),得标准曲线。取3 份一贯煎多糖样品各5 mg,用蒸馏水定容于50 mL 量瓶中,按照标准品同法操作,根据标准曲线计算一贯煎多糖样品的总糖含量。
采用间羟基联苯法测定一贯煎多糖样品的糖醛酸含量。精密称取半乳糖醛酸标准品约为10.00 mg,用蒸馏水定容于10 mL 量瓶中,得质量浓度约为1.0 mg/mL 的半乳糖醛酸溶液,精密量取0、0.2、0.4、0.6、0.8、1.0 mL 的半乳糖醛酸母液于10 mL 量瓶中,加蒸馏水定容,配成系列质量浓度约为 0、20、40、60、80、100 μg/mL 的半乳糖醛酸对照溶液。依次吸取半乳糖醛酸对照溶液0.5 mL 于20 mL 具塞试管中,冰浴冷却后加入3.0 mL 四硼酸钠-硫酸溶液,混匀,在沸腾水浴中加热5 min;以冰浴冷却至室温后,加入50 μL 的0.15%间羟基联苯溶液,摇匀后,使用紫外分光光度仪在520 nm 处测定其A值。以对照品质量浓度为横坐标(X),以A值为纵坐标(Y),得标准曲线。取3 份一贯煎多糖样品各5.00 mg,用蒸馏水定容于50 mL 量瓶中,取溶液各0.5 mL(每份相当于50 μg 多糖样品)于20 mL 具塞试管中,按照标准品同法操作,根据标准曲线计算一贯煎多糖样品的糖醛酸含量。
使用BCA 蛋白定量分析试剂盒测定,按照试剂盒说明配制工作液,并配制1 mg/mL的样品溶液。根据微孔板方案(样品与工作液的比例为1∶8),取3 份一贯煎多糖样品按照标准曲线同法操作,根据标准曲线计算一贯煎多糖样品的蛋白含量。
2.2.2 紫外光谱扫描分析 将一贯煎多糖样品用纯水溶解后配制成质量浓度为1 mg/mL 的溶液,用紫外-可见光分光光度计在200~400 nm 进行扫描。
2.2.3 相对分子质量测定 采用高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)对一贯煎多糖组分进行相对分子质量测定。分别取相对分子质量已知的Dextran P-系列标准葡聚糖P-5(6 100)、P-10(9 600)、P-20(21 100)、P-50(47 100)、P-100(10 700)、P-200(19 400)、P-400(33 700)和P-800(64 200)各2 mg,加入1 mL 的流动相,即0.22 μm 水相滤膜滤过后的0.2 mol/L 的NaCl 溶液,以10 000 r/min 离心10 min,取上清液置于液相小瓶,即得质量浓度为2 mg/mL的系列标准品溶液;同法制得2 mg/mL 的一贯煎多糖样品溶液,进行HPGPC 分析,色谱条件如下:色谱系统为Agilent1100,色谱柱为Shodex SUGAR KS-804(300 mm×8 mm)和KS-802(300 mm×8 mm)串联;流动相为0.2 mol/L 的NaCl 溶液,柱温为40 ℃,体积流量为0.8 mL/min,进样体积为20 μL,检测器为示差检测器。标准曲线的绘制处理及相对分子质量计算由GPC 软件自动完成,根据测定样品的保留时间,可从标准曲线中求得一贯煎多糖的相对分子质量分布。
2.2.4 FT-IR 分析 取约2 mg 的一贯煎多糖样品与100 mg 的干燥KBr 混合,研细后压片,在400~4 000 cm-1进行红外扫描,对扫描图的吸收峰进行解析。
2.2.5 单糖组成分析 采用高效离子交换色谱仪(high-performance ion exchange chromatogram,HPIEC)测定单糖组成。精密称取13 个单糖对照品(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、古罗糖醛酸、葡萄糖醛酸、甘露糖醛酸)约3 mg,用去离子水配制成30 μg/mL 的混合对照溶液。精密称取YGJP-W 样品约5 mg 置于安瓿瓶中,加入2 mol/L三氟乙酸(TFA)溶液2 mL,在121 ℃加热2 h,准确吸取酸水解溶液转移至管中氮吹吹干。加入甲醇清洗,再吹干,重复甲醇清洗2~3 次。加入去离子水涡旋混匀,吸取200 μL 加入800 μL 去离子水,在12 000 r/min 离心5 min,转入色谱瓶中待测。色谱系统采用Thermo ICS 5000+离子色谱系统(Thermo Fisher Scientific,美国),色谱柱为Dionex CarbopacTMPA20(150 mm×3 mm,10 µm),流动相A 为H2O,B 为0.1 mol/L NaOH 水溶液,C 为0.1 mol/L NaOH、0.2 mol/L NaAc,梯度洗脱(0~26.0 min,95% A、5% B;26.0~26.1 min,95%~85% A、5% B、0~5% C;26.1~42.0 min,85% A、5% B、10% C;42.0~42.1 min,85%~60% A、5%~0 B、10%~40% C;42.1~52.0 min,60% A、0~40%B、40%~0 C;52.0~52.1 min,60%~95% A、40%~5% B;52.1~60.0 min,95% A、5% B);体积流量为0.5 mL/min,进样量为5 µL;柱温为30 ℃;检测器为电化学检测器。根据绝对定量方法,测定不同单糖质量,根据单糖摩尔质量计算出各单糖的物质的量比[20-21]。
2.2.6 SEM 分析 取约5mg 的干燥后的一贯煎多糖粉末样品,粘附于含有双面粘合剂的导电碳膜上,置于离子溅射仪的样品舱中,进行喷金40 s 左右。接着将样品取出,置入扫描电镜观察室,在2.0 kV加速电压下使用扫描电子显微镜,进行观察。
2.3 YGJP-W 对CCl4诱导小鼠肝纤维化的干预作用
2.3.1 动物分组 取35 只雄性C57 小鼠,随机平均分为5 组,分别为对照组、模型组、阳性药组和不同剂量YGJP-W 给药组。
2.3.2 造模与给药 按2 mL/kg ip 15% CCl4-橄榄油,1 周注射3 次(周一、周三与周五),共造模6周,每周记录1 次动物体质量。自造模第4 周第1天起,YGJP-W 低、高剂量组分别按50、100 mg/kg体质量的剂量 ig 0.3% CMC-Na 溶液配制的YGJP-W 溶液,阳性药组按 10 mg/kg ig 0.3%CMC-Na 溶液配制的索拉菲尼,对照组和模型组ig同体积0.3% CMC-Na 溶液,每日ig 1 次。
2.3.3 动物处理取材方法 各组小鼠在造模的第6周末最后1 次给药后禁食12 h。各组小鼠称定质量后用3%戊巴比妥钠,按照0.1 mL/10 g 体质量注射进行麻醉。待麻醉成功后,腹主动脉取血,全血放置4 ℃静置后在4 000 r/min 离心15 min,取上清放置-80 ℃冰箱备用。而后摘取小鼠肝脏和脾脏,用滤纸吸取血液后拍照、称定质量并记录。收集肠道内容物,用于16S RNA 检测。然后取小鼠肝大叶同一部位切取约1 cm×1 cm 大小肝组织放入10%中性甲醛缓冲液固定,以制作病理切片。
2.3.4 血清谷丙转氨酶(alanine aminotransferase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)检测 全自动化分析法检测血清肝功能将血清样本室温解冻,振荡混匀,按标号的顺序依次放入曙光医院检验科全自动化分析仪中,分析仪检测试剂瓶中加入相应的ALT 和AST 试剂,按照试剂盒说明书步骤检测ALT 和AST 活性。
2.3.5 HE 染色和天狼猩红染色观察肝脏组织学变化 取小鼠肝大叶同一部位肝组织,置于10%中性甲醛缓冲液固定,自动脱水机脱水,石蜡包埋,切片。HE 和天狼猩红染色,将封好的片子用数据扫描切片机自动扫描,观察肝细胞损伤、炎症浸润、胆管反应、胶原纤维增生与沉积程度。并采用图像分析软件Leica LAS Image Analysis 对天狼猩红染色阳性面积进行定量分析。
阳性染色面积百分比=阳性染色面积/图片总面积
2.3.6 碱水解法检测肝组织羟脯氨酸(hydroxyproline,HYP)含量 使用碱水解法对肝组织中的HYP 含量进行检测,称取肝组织50 mg,水解,调pH 6.0~6.8,检测步骤按照试剂盒说明书操作进行。
2.3.7 小鼠肠道微生物分析 取收集到的对照组、模型组和YGJP-W 高剂量组的小鼠粪便,采用MagPure Soil DNA LQ Kit(Magan)试剂盒提取粪便总DNA,利用NanoDrop 2000(Thermo Fisher Scientific,美国)和琼脂糖凝胶电泳检测DNA 的浓度和纯度。采用引物343F(5'-TACGGRAGGCAGCAG-3')和798R(5'-AGGGTATCTAATCCT-3')扩增16S rRNA 基因的V3-V4 可变区。PCR 扩增产物使用琼脂糖凝胶电泳检测。使用Illumina NovaSeq 6000 测序平台进行测序。测序由上海殴易生物技术有限公司完成。测序数据进行预处理生成优质序列之后,采用Vsearch 软件,根据序列的相似性,将序列归为多个OTU。序列相似度大于或等于97%被归为1 个OTU 单元,挑选出各个OTU 的代表序列,使用Silva(version138)数据进行比对注释,进行分析。
2.4 YGJP-W 对菌群耗竭后CCl4 诱导小鼠肝纤维化的干预作用研究
2.4.1 抗生素溶液(ABX)制备:称取1 g 甲硝唑、1 g 青霉素G 钾、1 g 硫酸新霉素和0.5 g 盐酸万古霉素,倒入1.5 L 干净的塑料瓶中,加入1 L 的蒸馏水,涡旋混匀,即得抗生素溶液[22]。
2.4.2 动物分组 取42 只雄性C57 小鼠,随机平均分为6 组,分别为对照组、模型组(CCl4)、YGJP-W组(CCl4+YGJP-W)、对照加抗生素组(ABX)、模型加抗生素组(CCl4+ABX)和YGJP-W 加抗生素组(CCl4+YGJP-W+ABX)。
2.4.3 造模与给药 模型组按2 mL/kg ip 15%CCl4-橄榄油,每周注射3 次(周一、周三与周五),共造模6 周,对照组和对照加抗生素组按2 mL/kg ip 空白橄榄油,每周记录1 次动物体质量。自造模第4周第1 天起,YGJP-W 组和YGJP-W 加抗生素组均按100 mg/kg ig 0.3% CMC-Na 溶液配制的YGJP-W溶液,其他组ig 同体积0.3%CMC-Na 溶液,每日ig 1 次。加抗生素组小鼠饮用水换为抗生素溶液,其他组自由饮用正常水。
2.4.4 动物处理取材与指标检测 本实验动物处理取材同“2.3.3”项,血清ALT 和AST、肝组织HE 染色、天狼猩红染色与 HYP 含量检测同“2.3.4”~“2.3.6”项。
2.4.5 血清总胆红素、间接胆红素、直接胆红素和总胆酸检测 将血清样本室温解冻,振荡混匀,按标号的顺序依次放入曙光医院检验科全自动化分析仪中;分析仪检测试剂瓶中加入相应的血清总胆红素(total bilirubin,TBIL)、间接胆红素(indirect bilirubin,IBIL)、直接胆红素(direct bilirubin,DBIL)和总胆酸(total bile acid,TBA)试剂,按照试剂盒说明书步骤检测TBIL、IBIL、DBIL 和TBA 活性。
2.4.6 实时荧光定量聚合酶链式反应(Real-time PCR)称取肝组织50 mg,加trizol 1 mL 提取总RNA,具体操作步骤按说明书进行,应用NanoVue浓度检测仪,检测RNA 浓度及RNA 纯度(A260/280和A260/230)。使用逆转录试剂盒对总RNA 进行逆转录,反应条件为35 ℃反应10 min,55 ℃逆转录20 min,85 ℃变性5 min,即得cDNA。取384 孔PCR 板加样,Real-time PCR 法检测对应指标,采用2-ΔΔCt法计算各mRNA 表达量。
2.5 统计学分析
采用SPSS20.0 软件对数据进行统计学分析,计量资料采用非参数检验,数据以±s表示,组间多重比较分析采用One-way ANOVA 结合LSD 多重比较分析,以P<0.05 为差异具有统计学意义。
3 结果
3.1 一贯煎多糖组分的化学表征
3.1.1 制备及总糖、糖醛酸和蛋白含量测定 根据一贯煎组方,取北沙参、麦冬、当归各56.0 g,枸杞子、生地各111.9 g,川楝子(敲碎)74.6 g,通过2 次煎煮后醇沉制备得到一贯煎粗多糖(YGJP)93.2 g,得率为19.98%。取5.20 g 的YGJP 经弱阴离子交换树脂(DEAE Sepharose Fast Flow,500 mm×55 mm)分别以蒸馏水、0.2 和0.5 mol/L 的NaCl溶液洗脱,洗脱曲线见图1。依次得到3 个部位:YGJP-W(3.02 g)、YGJP-0.2(0.23 g)和YGJP-0.5(0.09 g),得率分别为58.08%、4.42%、1.73%。结果显示YGJP-W 是YGJP 的主要部位,从一贯煎整方药材制备得到YGJP-W 的总得率为11.60%。采用苯酚-硫酸法测定总糖含量,标准曲线的回归方程为Y=5.628X+0.071 6,R2=0.996 7,计算数据显示YGJP-W 的总糖质量分数为(92.48±2.75)%。采用间羟基联苯法测定糖醛酸质量分数,标准曲线的回归方程为Y=7.221X+0.037 3,R2=0.997 8,计算数据显示YGJP-W 的糖醛酸质量分数为(1.87±0.14)%。采用BCA 蛋白定量分析测定蛋白含量,标准曲线的回归方程为Y=0.831X+0.154,R2=0.998 4,计算数据显示YGJP-W 的蛋白含量为(4.39±1.65)%。分析结果说明YGJP-W 主要是中性糖类成分,含有极少量蛋白,几乎不含糖醛酸类成分。

图1 YGJP 经DEAE 琼脂糖离子交换色谱柱的洗脱曲线Fig. 1 Elution curve of YGJP on a DEAE agarose ion exchange chromatographic column
3.1.2 相对分子质量分布测定 采用HPGPC 对YGJP-W 的相对分子质量分布进行测定。如图2-A所示,YGJP-W 的HPGPC 谱图除NaCl 溶剂峰外,分别在14.9、19.7 min 处表现出2 个主要峰,表明YGJP-W 存在非均一性。根据标准曲线和HPGPC软件计算,结果显示2 个主要峰的平均相对分子质量分别为1.74×105和5.6×103,而1.74×105和5.6×103的峰含有1 个明显的肩峰,是由于存在2种相对分子质量接近的多糖导致,HPGPC 结果说明YGJP-W 至少是由2 种不同相对分子质量的多糖组成的精多糖。
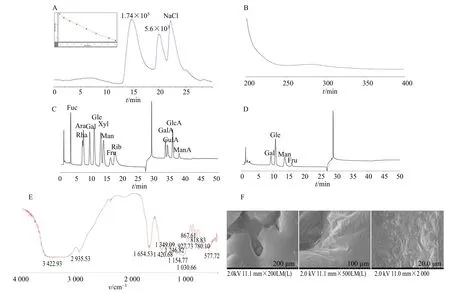
图2 YGJP-W 的基本结构特征Fig. 2 Basic structural characteristics of YGJP-W
3.1.3 紫外光谱扫描分析 如图2-B 所示,YGJP-W在260 nm 处无明显的吸收峰,说明其不含核酸类物质,在280 nm 处表现微弱的吸收峰,说明其含有极少量的蛋白类物质,跟BCA 蛋白定量分析结果一致。
3.1.4 FT-IR分析 YGJP-W的FT-IR图谱表现出典型的多糖特征吸收峰(图2-E)。3 422、2 935、1 420 cm-1的3 个强吸收峰分别来自O-H、C-H 及环外C-O 的伸缩振动,1 654 cm-1的强吸收峰来自羟基O-H 的弯曲振动,而1 349 cm-1的吸收峰来自C-O的弯曲振动,1 250~1 000 cm-1的峰来源于糖环内C-O 的伸缩振动,吡喃糖在此范围内表现为3 个吸收峰。YGJP-W 在此范围内表现出3 个吸收峰(1 030、1 154 和1 246 cm-1),表明吡喃糖的存在。927 和818 cm-1的吸收峰表明存在β-D型果糖呋喃糖。YGJP-W图谱在1 740 cm-1附近没有峰,说明YGJP-W 不含有-COOH 官能团,即不含有糖醛酸,为中性多糖,跟糖醛酸检测结果一致。
3.1.5 单糖组成分析 13 个单糖对照品的离子色谱图显示出13 个峰(图2-C),由于各单糖在离子色谱的响应度不同,导致其13 个单糖对照品的峰面积各异,YGJP-W 完全酸水解后的离子色谱图显示出4 个峰(图2-D),通过对照品比较可知为半乳糖、葡萄糖、甘露糖和果糖,物质的量比为1.0∶2.8∶1.4∶1.6。单糖分析结果再次证明YGJP-W 不含有糖醛酸类,为中性多糖。
3.1.6 SEM 分析 200 倍电镜下(图2-F),YGJP-W呈不规则的致密结构,表面较为光滑,结构较为完整;在500 倍镜下,YGJP-W 致密结构被放大,表面凹凸不平,呈褶皱状;在2 000 倍镜下,样品表面可见不规则凸起结构,可能是由于多糖样品分子间相互作用较强,导致聚合紧密。
3.2 YGJP-W 对CCl4诱导小鼠肝纤维化的干预作用
3.2.1 对血清肝功能的影响 血清生化结果见图3,与对照组比较,模型组小鼠血清ALT、AST 显著升高(P<0.01);与模型组比较,YGJP-W 各给药组与阳性组血清ALT 和AST 均有不同程度降低,其中YGJP-W 低剂量组和阳性药物组血清ALT 和AST 下降明显(P<0.05),YGJP-W 高剂量组血清ALT(P<0.01)和AST 同样下降明显(P<0.05)。
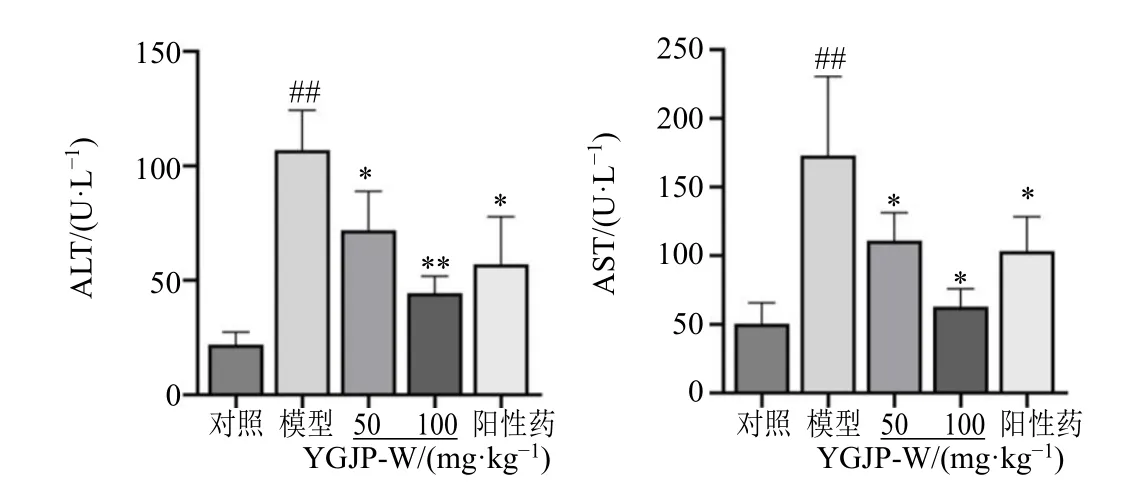
图3 YGJP-W 对CCl4 诱导肝纤维化小鼠血清生化的影响 (±s, n = 7)Fig. 3 Effects of YGJP-W on serum biochemistry in CCl4-induced liver fibrosis mice (±s, n = 7)
3.2.2 对CCl4肝纤维化小鼠肝组织病理学及HYP质量分数的影响 肝组织病理染色结果见图4。HE染色结果显示,对照组肝脏肝小叶结构清晰,无炎性细胞浸润;模型组小鼠肝小叶结构严重破坏,可见存在大量的炎性细胞浸润及组织坏死;YGJP-W各给药组与阳性组炎性细胞浸润及组织坏死较模型组均有不同程度改善,其中以YGJP-W 高剂量组改善效果最为显著。SR 染色结果显示,对照组小鼠肝组织仅在汇管区可见少量胶原纤维沉积;模型组小鼠肝组织出现大量胶原沉积,以汇管区为中心向四周呈发散状分布;与模型组相比,YGJP-W 各给药组与阳性组内胶原沉积均有不同程度地减少,其中以YGJP-W 高剂量组的效果最为显著。HYP 和SR半定量结果见图5,与对照组相比,模型组肝组织内HYP 质量分数显著增加(P<0.01);与模型组相比,YGJP-W 各给药组与阳性组HYP 质量分数显著下降(P<0.05)。天狼星红染色胶原半定量结果显示,与对照组相比,模型组小鼠肝组织胶原面积显著增加(P<0.01);YGJP-W 高剂量组与阳性组胶原面积较模型组显著下降(P<0.05)。

图4 小鼠肝组织病理HE 和SR 染色Fig. 4 HE and SR staining of liver tissue in mice
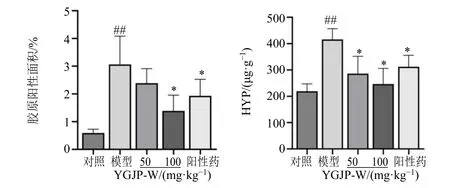
图5 小鼠肝组织HYP 含量和SR 阳性面积 (±s, n = 7)Fig. 5 HYP content and SR positive area of liver tissue in mice (±s, n = 7)
3.2.3 对CCl4肝纤维化小鼠肠道菌群的影响 采用主成分分析(principal component analysis,PCA)比较对照组,模型组和YGJP-W 高剂量组之间的肠道菌群组成差异,通过提取3 组中各样本的16s rDNA 序列的主成分因子,得到PCA 图(图6-A)可知,对照组和模型组基本可以分开,说明CCl4干预能够对小鼠肠道菌群结构产生明显影响,而模型组和YGJP-W 组也基本可以分开,说明YGJP-W能够引起小鼠肠道菌群结构发生变化。

图6 YGJP-W 对CCl4 诱导小鼠肠道菌群的作用Fig. 6 Effects of YGJP-W on gut microbiota in CCl4-induced mice
接着,为了进一步解释YGJP-W 对小鼠肠道菌群结构产生何种具体影响,分别在门级别和种级别评估YGJP-W 干预后的肠道菌群的整体结构。在门水平上(图6-B~F),拟杆菌门(57.3±13.8)%是对照组的优势细菌门,其次是厚壁菌门(29.4±8.4)%、变形菌门(5.0±3.3)%和放线菌门(3.6±2.1)%。CCl4诱导能够显著增加了拟杆菌门的丰度[(79.3±8.1)%,P<0.01],减少了厚壁菌门 [(16.9±9.6)%,P<0.05] 和放线菌门 [(0.3±0.1)%,P<0.01] 的丰度,同时也减少了变形菌门[(2.1±1.9)%,P>0.05] 的丰度,但不具有显著性差异。YGJP-W 干预后,拟杆菌门(57.4±14.6)%,丰度显著性降低(P<0.01),几乎回调到对照组水平,变形菌门(10.4±4.7)%和放线菌门(3.7±2.4)%丰度均显著性升高(P<0.01),提示YGJP-W 逆转了CCl4导致的菌群变化。
在属水平上,对丰度前30 的细菌进行了分析(图6-G),线性判别分析(linear discriminant analysis effect size,LEfSe)结果显示(图6-H),以lg LDA>3.0 为阈值,与对照组相比,CCl4诱导显著影响了9个细菌属的丰度(LDA score>3.0,P<0.05),其中8 个属,包括狄氏副拟杆菌属Parabacteroides、毛螺菌属NK4A136 组Lachnospiraceae_NK4A136_group、活泼瘤胃球菌属Ruminococcus_gnavus_group、普雷沃氏菌科NK3B31 组(Prevotellaceae_NK3B31_group)、扁平丝菌属Planifilum、梭杆菌属Fusobacterium、乳杆菌属Lactobacillus和巨单胞菌属Megamonas的丰度降低,1 个菌属,普雷沃氏菌(Prevotella_9)的丰度增加。YGJP-W 的干预影响了10 个细菌属的丰度(LDA score>3.0,P<0.05),其中6 个细菌属,包括狄氏副拟杆菌属、埃希氏菌-志贺氏菌属Escherichia-Shigella、活泼瘤胃球菌属、萨特氏菌属Sutterella、毛螺菌属NK4A136 组和梭杆菌属的丰度增加,4 个细菌属包括拟普雷沃氏菌属Alloprevotella、肠鼠杆菌属Muribaculum、普雷沃氏菌属UCG-001Prevotellaceae_UCG-001 和另枝杆菌Alistipes的丰度降低。
3.3 YGJP-W对菌群耗竭后CCl4诱导小鼠肝纤维化的干预作用
3.3.1 对血清肝功能的影响 血清生化结果见图7。与对照组组比较,模型组小鼠血清ALT、AST、TBIL、DBIL、IBIL 和TBA 显著升高(P<0.05、0.01);与模型组比较,YGJP-W 组血清ALT、AST、TBIL、DBIL、IBIL 和TBA 均有不同程度降低(P<0.05、0.01)。抗生素耗竭后,与对照加抗生素组相比,模型加抗生素组血清ALT、AST、TBIL、DBIL、IBIL 和TBA 显著升高(P<0.05、0.001);然而,与模型加抗生素组相比,YGJP-W 加抗生素组组不能显著降低血清ALT、AST、TBIL、DBIL、IBIL和TBA。结果提示YGJP-W 改善血清肝肝功能为菌群依赖性。
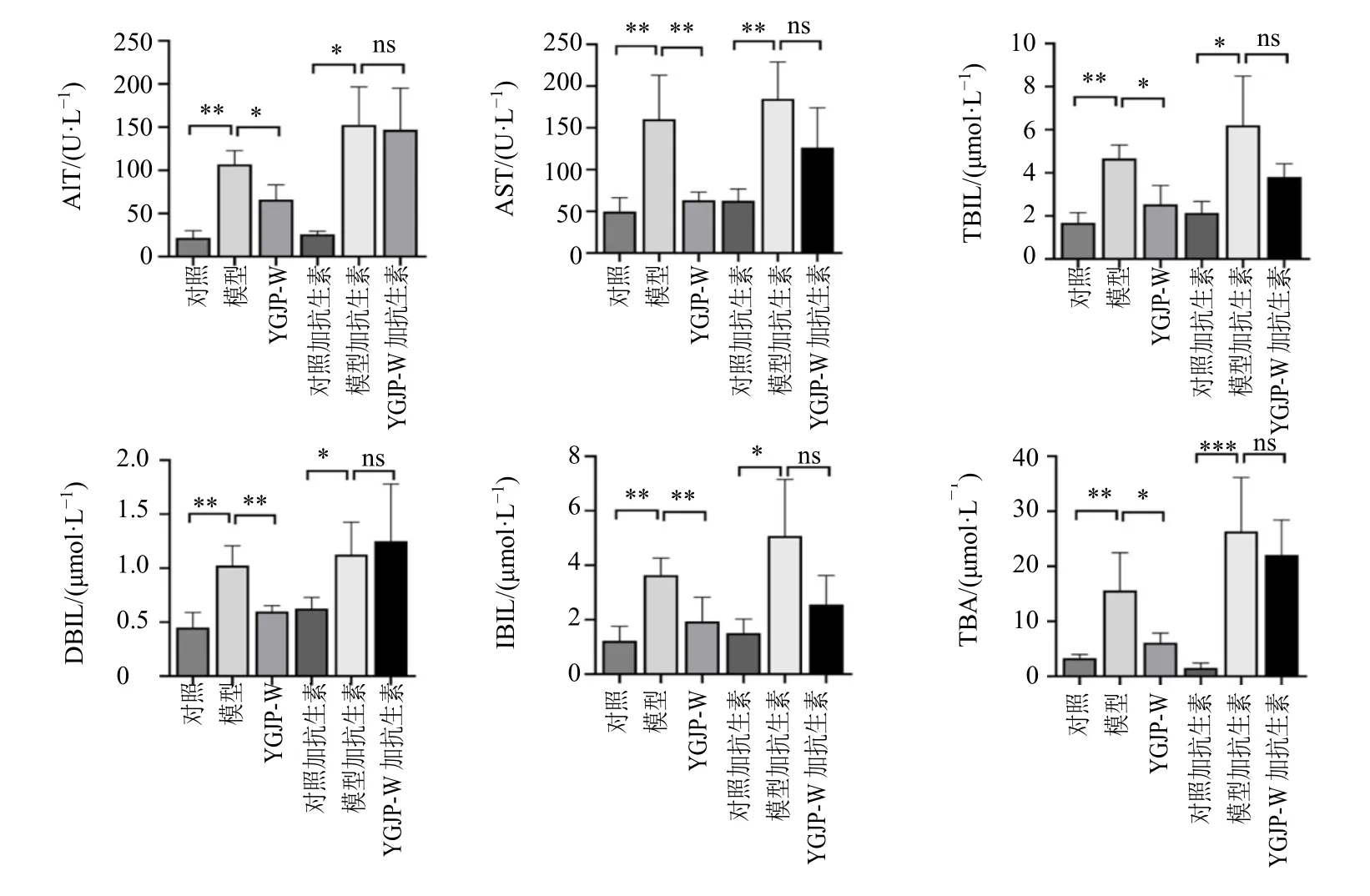
图7 YGJP-W 对菌群耗竭后CCl4 诱导肝纤维化小鼠血清生化的影响 (±s, n = 7)Fig. 7. Effects of YGJP-W on serum biochemistry in CCl4-induced liver fibrosis mice after bacterial depletion (±s, n = 7)
3.3.2 对CCl4肝纤维化小鼠肝组织病理学及HYP含量的影响 肝组织病理染色结果见图8。HE 染色结果显示,对照组肝脏肝小叶结构清晰,无炎性细胞浸润;模型组小鼠肝小叶结构严重破坏,可见存在大量的炎性细胞浸润及组织坏死;YGJP-W 组炎性细胞浸润及组织坏死较模型组改善效果显著。SR染色结果显示,对照组小鼠肝组织仅在汇管区可见少量胶原纤维沉积;模型组小鼠肝组织出现大量胶原沉积,以汇管区为中心向四周呈发散状分布;与模型组相比,YGJP-W 组肝组织内胶原沉积显著减少。HYP 和SR 半定量结果见图9,与对照组相比,模型组肝组织内HYP 质量分数显著增加(P<0.01);与模型组相比,YGJP-W 组HYP 含量显著下降(P<0.05)。天狼星红染色胶原半定量结果显示,与对照组相比,模型组小鼠肝组织胶原面积显著增加(P<0.001);YGJP-W 组胶原面积较模型组显著下降(P<0.05)。HE 染色结果显示,抗生素耗竭后,与对照加抗生素组相比,模型加抗生素组小鼠肝小叶结构严重破坏,存在大量的炎性细胞浸润及组织坏死;YGJP-W 加抗生素组炎性细胞浸润及组织坏死较模型加抗生素组并无显著改善。SR 染色结果显示,与对照加抗生素组相比,模型加抗生素组小鼠肝组织存在大量胶原沉积,且YGJP-W 加抗生素组肝组织内胶原沉积并未得到改善。HYP和SR 半定量结果见图9,与对照加抗生素组相比,模型加抗生素组的肝组织内HYP 质量分数显著增加(P<0.05);与模型加抗生素组相比,YGJP-W加抗生素组HYP 质量分数并未显著下降(P>0.05)。天狼星红染色胶原半定量结果显示,与对照加抗生素组相比,模型加抗生素组小鼠肝组织胶原面积显著增加(P<0.001);YGJP-W 加抗生素组胶原面积较模型加抗生素组并未显著下降(P>0.05),同样提示YGJP-W 抑制胶原沉积作用为菌群依赖性。
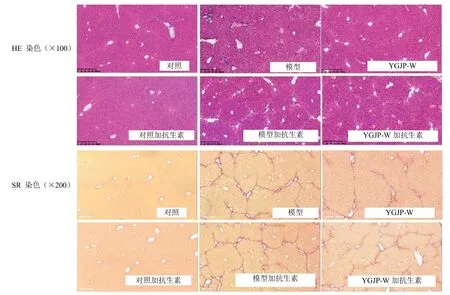
图8 小鼠肝组织病理HE 和SR 染色Fig. 8 HE and SR staining of liver tissue in mice

图9 小鼠肝组织HYP 含量和SR 阳性面积 (±s, n = 7)Fig. 9 Hyp content and SR positive area of liver tissue in mice (±s, n = 7)
3.3.3 对CCl4肝纤维化小鼠α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和CoL-I 表达的影响 Real-time PCR 结果见图10,与对照组比较,模型组小鼠肝组织α-SMA和CoL-ImRNA表达水平显著升高(P<0.001);与模型组比较,YGJP-W 组小鼠肝组织α-SMA和CoL-ImRNA 表达水平有不同程度降低(P<0.01、0.05)。抗生素耗竭后,与对照加抗生素组相比,模型加抗生素组小鼠肝组织α-SMA和CoL-ImRNA 表达水平显著升高(P<0.001);然而,与对照加抗生素组相比,YGJP-W 加抗生素组不能降低小鼠肝组织α-SMA和CoL-ImRNA 表达水平(P>0.05),结果提示YGJP-W 抑制肝纤维化为菌群依赖性。
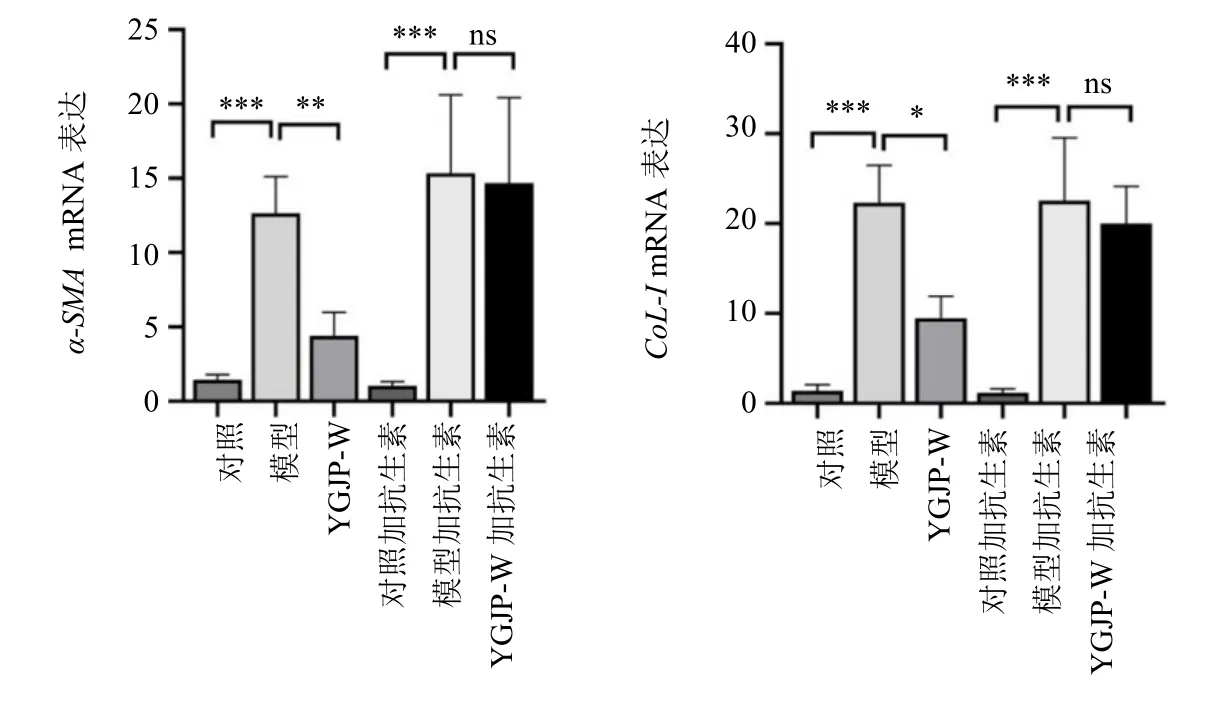
图10 小鼠肝组织α-SMA 和CoL-I mRNA 表达 (±s, n = 7)Fig. 10 α-SMA and CoL-I mRNA expression of liver tissue in mice (±s, n = 7)
4 讨论
多糖是一类广泛存在于中药中的高分子聚合物,现代研究已证明多糖是中药中一类重要的活性物质基础,表现出包括抗肿瘤、免疫调节、改善糖脂代谢、保肝以及抗病毒在内的多种功能[23-25]。中药汤剂因其制法简便,见效迅速的优势,是中药最常用和最经典的剂型之一。长期以来,关于中药药效物质基础的研究多集中在各类亲脂性小分子成分,例如生物碱、黄酮、萜类等,多糖作为中药汤剂中主要存在的一类生物活性大分子物质,由于技术及认识的局限,研究相对缺乏。本研究关注一贯煎的多糖类成分,并从中制备得到活性多糖YGJP-W,其得率高达11.60%,药效学实验表明YGJP-W 具有显著的抗肝纤维化活性,提示多糖类成分YGJP-W 是一贯煎的重要活性物质基础之一。YGJP-W 是由YGJP 过弱阴离子交换树脂,经水洗脱所得,由于糖醛酸能够被弱阴离子交换树脂吸附,水的离子强度低,只能将中性糖洗脱,很难将糖醛酸洗脱。本研究中,糖醛酸检测,单糖组成分析及FT-IR 分析检测结果均说明YGJP-W 为中性多糖,几乎不含糖醛酸,与分离流程相一致,同时说明YGJP 在弱阴离子交换树脂的上样量合理,不存在过载行为。化学分析显示YGJP-W 是由半乳糖、葡萄糖、甘露糖和果糖构成,其物质的量比为1.0∶2.8∶1.4∶1.6,葡萄糖和果糖是YGJP-W 中含量最多的2 类单糖。考虑到葡聚糖是北沙参中的特征性多糖,果聚糖是麦冬中的特征性多糖,因此,我们合理地推测YGJP-W 中含有葡聚糖和果聚糖类,而半乳糖和甘露糖则可能以不同类型的杂多糖的形式存在。但需要注意的是,一贯煎由生地黄、北沙参、麦冬、当归、枸杞和川楝子组成,该6 味中药中含有的多糖被报道由各种不同类型的单糖组成,除了上述4 种,还含有阿拉伯糖、木糖、鼠李糖等,但这些单糖没有在YGJP-W 中检测到,推测可能转移到YGJP-0.2 或YGJP-0.5 部分,但这个问题是否涉及到多糖类成分在中药配伍共煎过程中的变化,还有待进一步研究阐明。
鉴于多糖口服吸收利用率低,其代谢途径有待进一步阐明,关于多糖口服后如何发挥药理活性是困扰多糖研究的关键科学问题之一。近年来,越来越多的研究证实肠道菌群与多种疾病密切相关,通过影响肠道菌群能够改善多种疾病已得到明确[26]。多糖是调节肠道菌群的重要物质,因此,肠道菌群为中药多糖的作用机制研究提供了一条重要途径。为了解释YGJP-W 对CCl4诱导小鼠肝纤维化的干预作用与调节肠道菌群相关,对YGJP-W 干预后的小鼠菌群进行了分析。本研究虽然发现了YGJP-W能够逆转CCl4引起的小鼠肠道菌群结构变化,并通过抗生素联合YJGP-W 干预实验证明了YJGP-W 发挥抗肝纤维化的作用可能与其调控肠道菌群相关。但是YJGP-W 具体是怎样通过调控肠道菌群发挥活性还不清楚,是通过影响肠道菌群的代谢产物,包括短链脂肪酸,长链脂肪酸,胆汁酸,支链氨基酸等发挥活性?还是YJGP-W 被肠道菌群酵解后进而直接发挥活性?有待进一步研究阐明。本研究中十分值得关注的是在16S rRNA 测序结果中发现,在所有菌属中,狄氏副拟杆菌属Parabacteroides变化最为显著。与对照组相比,模型小鼠粪便中狄氏副拟杆菌属明显减少,YGJP-W 可回调这种变化。已有研究报道狄氏副拟杆菌Parabacteroides distasonis可有效抑制小鼠NASH[27];改善小鼠代谢综合征和肥胖症[28];补充狄氏副拟杆菌可通过调节胆汁酸代谢改善硫代乙酰胺(thioacetamide,TAA)和蛋氨酸胆碱缺乏饲料(methionine-and choline deficient diet,MCD)饮食诱导的小鼠肝纤维化[29]、增加未结合的胆汁酸,如UDCA 和LCA 和盲肠内容物中的BSH 活性[30];临床研究报告NAFLD、新生儿胆汁淤积疾病患者和肝纤维化患者肠道中狄氏副拟杆菌水平降低[31];这些已报道的研究均表明增加狄氏副拟杆菌可有效减轻慢性肝病的严重程度,延缓疾病进展,而本研究提示一贯煎YGJP-W 可能通过增加肠道狄氏副拟杆菌等改善肝纤维化,但该问题也有待下一步研究证实。
利益冲突所有作者均声明不存在利益冲突
