罗汉果根多糖的分离纯化及免疫活性研究
2024-03-02张巧铃卢凤来宋静茹刘宏伟蒋小华
张 洁 ,张巧铃 ,卢凤来,宋静茹,刘宏伟,蒋小华*
1. 沈阳药科大学中药学院,辽宁 沈阳 110016
2. 广西植物功能物质与资源持续利用重点实验室,广西壮族自治区中国科学院广西植物研究所,广西 桂林 541006
罗汉果Siraitiagrosuenorii(Swingle) C. Jeffrey ex A. M. Lu et Z. Y. Zhang 为葫芦科罗汉果属藤本植物,主要分布于我国西南地区,其果实为广西的道地药材。罗汉果始载于《岭南采药录》,1987 年被国家卫生部列为首批药食同源中药材,其果实为常用的药用部位,具有止咳化痰、润肠通便等功效。罗汉果块根肥大,味苦、性微寒[1],民间用于治顽癣、痈肿、疮疖等,具有葫芦烷型四环三萜、多糖等活性成分[2-3]。然而,有关罗汉果根的化学成分及药理活性研究明显不足,导致其未得到充分利用,每年有大量的根被丢弃,造成极大的资源浪费。
现代研究表明多种植物多糖具有双向调节的免疫作用,一定浓度范围的多糖可以增强机体的非特异性免疫和特异性免疫[4]。巨噬细胞是机体非特异性免疫的重要组成部分,在炎症反应和宿主防御中发挥着重要作用。已有报道表明罗汉果的果实多糖具有抗氧化、保护糖尿病肾病小鼠、增强免疫功能等作用[3,5-6],而对根多糖的研究较少。本课题组前期通过动物实验发现罗汉果根粗多糖可以增加小鼠胸腺器官指数,推测其具有免疫调节的潜力[3]。本实验通过提取与分离纯化,从罗汉果根中获得均一多糖并进行了初步的结构分析,同时采用巨噬细胞研究其免疫调节活性,为罗汉果根多糖的开发利用提供了新的研究思路与技术储备。
1 材料
1.1 主要材料与试剂
罗汉果根采自广西壮族自治区桂林市永福县,经卢凤来副研究员鉴定为葫芦科罗汉果属植物罗汉果S.grosvenorii(Swingle) C. Jeffrey 的块根。对照品D-无水葡萄糖(批号MUST-22030214,质量分数>99%)、D-甘露糖(批号MUST-23012802,质量分数>99%)、D-核糖(批号MUST-23021307,质量分数>98% )、D- 葡萄糖醛酸( 批号MUST-23021309,质量分数>98%)、L-鼠李糖(批号MUST-22061104,质量分数>99%)、D-半乳糖醛酸(批号MUST-23021308,质量分数>98%)、D-半乳糖(批号MUST-22061105,质量分数>98%)、DL-阿拉伯糖(批号MUST-22022819,质量分数>98%),购自成都曼斯特生物科技有限公司;标准品右旋糖酐系列D0(批号140637-201203)、D1(批号140638-201203)、D2(批号140639-201203)、D3 ( 批号 140640-201203 )、 D4 ( 批号140641-201203)、 D5(批号140642-201203)、D6(批号140643-201203)、D7(批号140644-201203)、D8 ( 批号 140645-201203 )、 D2000 ( 批号140646-201203),相对分子质量(Mw)分别为180、2 500、4 600、7 100、1.0×104、2.14×104、4.11×104、8.44×104、1.338×105、2.0×106,购自中国食品药品检定研究院;CCK-8 检测试剂盒、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)检测试剂盒和白细胞介素-6(interleukin-6,IL-6)检测试剂盒(Ela bscience 公司);一氧化氮(NO)检测试剂盒(上海碧云天生物技术有限公司),HPD100 大孔吸附树脂(赛谱锐思(北京)科技有限公司);DEAE-52 纤维素(上海源叶生物科技有限公司);Sephadex LH-20 凝胶(美国GE 公司);MD55 透析袋 [赛谱锐思(北京)科技有限公司];其他试剂均为分析纯。
1.2 主要仪器与设备
Waters 515 型液相色谱仪(配置Waters 2410 示差检测器,Waters 公司);LC-2030C 型液相色谱仪(日本岛津公司);Nicolet 傅里叶红外光谱仪(美国Therom Fisher 公司);Brucker Avance500MHz 超导核磁共振波谱仪(德国Brucker公司);ALPHA1-2LD PLU 冷冻干燥机(北京博劢行仪器有限公司);SP-756P 型紫外可见分光光度计(美国Spectrum 公司);Zeiss EVO18 型扫描电子显微镜(德国Zeiss公司);Spark 酶标仪(瑞士Tecan 公司);BSP-150型生化培养箱(上海博讯医疗生物仪器股份有限公司);5% CO2细胞培养箱(美国Thermo Forma 公司);Dmi1 倒置相差显微镜(美国徕卡公司)。
2 方法
2.1 罗汉果根多糖的分离纯化
取500 g 干燥的罗汉果根块粉碎过20 目筛,加入10 倍量的95%乙醇溶液回流脱脂(2 h、2 次),残渣干燥后,加入4 倍量的水于70 ℃水浴中加热回流提取(4 h、2 次)。提取液滤过后,合并滤液,55 ℃真空浓缩至原体积的1/4,过AB-8 大孔树脂脱色,水洗部分浓缩,加入4 倍体积的95%乙醇溶液进行沉淀,4 ℃静置12 h,4 000 r/min 离心10 min,得到粗多糖LGP。LGP 加水溶解,采用Sevage法[7]脱蛋白,重复5 次,直至无明显蛋白质为止。脱蛋白后的LGP 依次用30%、50%、70%、90%乙醇进行分级醇沉,分别得到LGP1~LGP4。将70%醇沉部位LGP3 溶解上DEAE-52 柱(42 cm×2.1 cm),依次用水和0.05、0.1、0.15、0.3、0.5 mol/L氯化钠梯度洗脱,体积流量为1.0 mL/min,7 min/管收集,采用苯酚-硫酸法检测吸光度(A)值,绘制洗脱曲线,根据洗脱峰收集组分,减压浓缩,透析(截留相对分子质量3 000)后冷冻干燥得粗多糖LGP3-1~LGP3-6。0.15 mol/L 洗脱组分LGP3-3 经Sephadex LH-20 柱(65 cm×1.4 cm)纯化,25%乙醇等度洗脱,体积流量为0.5 mL/min。透析后冷冻干燥得罗汉果根多糖LGP-A。
2.2 LGP-A 结构表征
2.2.1 纯度和相对分子质量的测定 采用紫外全波长扫描的方法检验多糖的纯度。取2.0 mg 干燥样品溶于纯水中,配成0.5 mg/mL 的多糖溶液,以纯水作为空白对照。在190~400 nm 进行全波长扫描。
采用高效凝胶色谱法(high performance gel permeation chromatography,HPGPC)测定多糖Mw。取干燥LGP-A、D0、D2、D4、D6、D7、D8、D2000等葡聚糖标准品,加水溶解,配成1 mg/mL 的溶液,离心,液相分析[8]。HPLC 条件:TSK-gel G5000PWXL色谱柱(7.8 mm×30 cm,10 μm),流动相为超纯水,柱温为30 ℃,体积流量为0.5 mL/min;RID 10A型示差检测器,进样量为20 μL。以保留时间为横坐标(X),Mw对数为纵坐标(Y)绘制标准曲线。计算LGP-A 的Mw。
2.2.2 单糖组成分析 采用1-苯基-3-甲基-5-吡唑啉酮(PMP)-柱前衍生HPLC 测定单糖组成。取多糖样品1.25 mg,加1.25 mL 2 mol/L 的三氟乙酸溶解,摇匀,封口,110 ℃水解3 h,冷却后加2 mL甲醇,减压蒸干,重复5 次以除去多余的三氟乙酸。取多糖样品和单糖对照品200 μL,加0.5 mol/L 的PMP-甲醇溶液200 μL 和0.3 mol/L 的NaOH 溶液200 μL,于70 ℃烘箱中避光反应100 min 进行衍生化。反应结束后,冷却至室温,加0.3 mol/L 盐酸溶液250 μL,混匀,加三氯甲烷萃取5 次,弃下层,除去过量的PMP,在10 000 r/min 离心,上清液放入4 ℃保存,待HPLC 检测[9]。
混合单糖对照品溶液制备:分别吸取已衍生化的1 mg/mL 的单糖对照品溶液各10 μL,混合均匀,于4 ℃保存备用。
HPLC 条件:ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-磷酸盐缓冲溶液(pH 7.2)15∶85;柱温为30 ℃,体积流量为0.8 mL/min,紫外检测波长为254 nm,进样量为10 μL。
2.2.3 FT-IR 分析 称取干燥LGP-A 样品1.5 mg,干燥溴化钾150 mg,于真空干燥器干燥过夜。在红外灯下混合,研磨均匀,压片,在4 000~400 cm-1进行红外扫描。
2.2.4 NMR 分析 取样品LGP-A 约25 mg 溶于0.5 mL D2O 中,用Bruker AVANCE III 500 MHz 超导核磁共振仪测定 1D-NMR(1H- 和13C-NMR)和2D-NMR(HSQC、1H-1H COSY 及HMBC),通过HSQC 对C-H 进行归属,1H-1H COSY 连接单糖骨架,HMBC 确定糖的连接方式。
2.2.5 刚果红实验 取干燥样品,加水配成0.5 mg/mL 的多糖溶液,与200 μmol/L 的刚果红溶液混合均匀。加入适量体积1.0 mol/L 的NaOH 溶液使其最终浓度分别为0、0.1、0.2、0.3、0.4、0.5 mol/L。室温避光反应10 min,使用紫外分光光度计进行全波长扫描,以NaOH 浓度为横坐标(X),最大吸收波长为纵坐标(Y)绘制折线图[10]。
2.2.6 扫描电子显微镜( scanning electron microscope,SEM)分析 称取1.5 mg 干燥样品,使用热场发射SEM 来分析LGP-A 的微观形态。
2.3 LGP-A 对小鼠巨噬细胞RAW264.7 免疫作用的影响
2.3.1 RAW264.7 细胞的增殖实验 采用CCK-8 法检测多糖对细胞增殖的影响,选取对数生长期的细胞,将其调整为1×105个/mL 接种于96 孔板中,在37 ℃、5% CO2的条件下培养24 h。给药组每孔加入不同质量浓度的多糖溶液(0.625、1.25、2.5、5.0 μg/mL)、阳性对照组加入1.0 μg/mL 脂多糖(lipopolysaccharide,LPS)溶液、对照组(具有细胞)和背景组(无细胞)加入相同体积的完全培养基,每组3 个复孔,给药后培养24 h。每孔加入10 μL CCK-8 溶液,在37 ℃孵育45 min,酶标仪450 nm 下检测A值。按下述公式计算细胞增殖率。
细胞增殖率=(A给药-A0)/(A1-A0)
A给药为给药组平均A值;A0为背景组平均A值;A1为对照组平均A值
2.3.2 RAW264.7 细胞吞噬能力 采用中性红实验检测RAW264.7 细胞吞噬能力,具体方法参考文献报道[11],略有改动。
选取对数生长期的细胞,将其调整为1×105个/mL 接种于96 孔板中,在37 ℃、5% CO2的条件下培养24 h。给药组每孔加入相同体积不同浓度的多糖溶液(0.625、1.25、2.5、5 μg/mL)、阳性对照组加入1.0 μg/mL LPS 溶液、对照组加入相同体积的完全培养基,每组3 个复孔,给药后培养24 h。弃上清液,磷酸缓冲液(PBS)清洗2 次,每孔加0.05%中性红溶液100 μL 培养1 h,弃上清液,PBS清洗2 次,加细胞裂解液(冰醋酸-无水乙醇1∶1)100 μL 室温放置1 h,酶标仪检测540 nm 下A值。吞噬率采用以下公式进行计算。
吞噬率=A给药/A对照
2.3.3 RAW264.7 细胞NO、TNF-α、IL-6 分泌量 采用Griess 法检测LGP-A 对小鼠巨噬细胞NO 分泌量的影响。细胞培养与给药方法按“2.3.1”项下进行,给药后培养24 h。取上清液按试剂盒说明书进行操作,采用酶标仪检测540 nm 下A值。
采用ELISA 法检测LGP-A 对小鼠巨噬细胞TNF-α、IL-6 分泌量的影响。细胞培养、给药方法同上。按试剂盒说明书进行操作,酶标仪检测450 nm下A值。
3 结果与分析
3.1 LGP-A 分离纯化
罗汉果根干燥粉末经95%乙醇脱脂,70 ℃热水提取醇沉、脱蛋白后,浓缩,干燥得罗汉果根粗多糖LGP,得率为1.3%(基于罗汉果根原料质量计算)。经不同的乙醇进行分级醇沉,分别得到LGP1~LGP4。将70%醇沉部位LGP3 上DEAE-52纤维离子交换柱,分别用0.05、0.1、0.15、0.2 和0.5 mol/L 氯化钠洗脱,采用苯酚-硫酸法检测A值并绘制吸收曲线(图1-A),得LGP3-1~LGP3-6。分析后发现0.15 mol/L 氯化钠洗脱部位(LGP3-3)分离度较高,选择该部位继续纯化。经Sephadex LH-20凝胶柱色谱进一步纯化,得到1 个均一的罗汉果根多糖LGP-A,得率为0.13%(基于粗多糖质量计算)。

图1 LGP3 的DEAE-52 纤维素 (A) 与Sephadex LH-20(B) 柱色谱纯化洗脱曲线Fig. 1 Column chromatography purification elution curves of LGP3 by DEAE-52 (A) and Sephadex LH-20 (B)
3.2 LGP-A 结构表征
3.2.1 纯度和相对分子质量分析 核酸和蛋白质在紫外光谱中的特征吸收峰分别是260、280 nm,因此通过紫外扫描的方法可以确定多糖中蛋白质、核酸和肽类等杂质的含量。如图2-A 可看出LGP-A在230 nm 处存在最大吸收,在260~280 nm 未出现明显吸收峰,表明其不含蛋白质、核酸等杂质。LGP-A 经HPGPC 法鉴定纯度,结果显示有一对称性良好的单一色谱峰,保留时间为10.386 min(图2-B),说明多糖Mw分布均一。以已测定Mw的葡聚糖对照品保留时间为横坐标(Х),lgMw为纵坐标(Y),得葡聚糖对照品回归方程为Y=-0.223 9Х+8.588 3(R2=0.978 4),计算LGP-A 的Mw为1.83×106。

图2 LGP-A 紫外全波长扫描 (A) 及Mw 分布 (B)Fig. 2 UV full wavelength scanning analysis (A )and molecular weight determination of LGP-A (B)
3.2.2 单糖组成分析 单糖组成分析是多糖的结构表征及生物活性研究必不可少的部分,对于功能性多糖的质量控制也具有一定的意义。LGP-A 单糖组成分析结果见图3,通过与单糖混合对照品进行比较,推测出LGP-A 主要由半乳糖、阿拉伯糖组成,其百分比为51.23∶44.68,此外还含有微量甘露糖、葡萄糖醛酸等单糖。结果表明,LGP-A 是一种阿拉伯半乳聚糖。
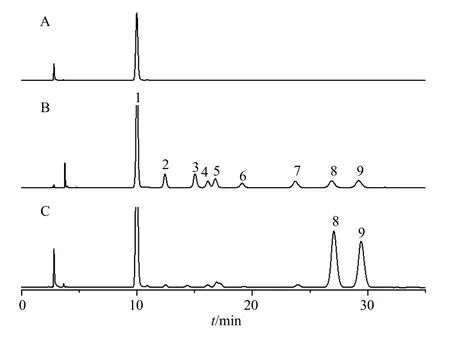
图3 LGP-A 单糖组成成分分析液相色谱图Fig. 3 Liquid chromatogram of monosaccharide composition analysis of LGP-A
3.2.3 FT-IR 分析 采用FT-IR 光谱测定了LGP-A在4 000~500 cm-1的红外吸收光谱,结果如图4 所示,在3 302.79、2 929.89 cm-1处分别为O-H 的伸缩振动峰[12]和C-H 伸缩振动峰[13],是糖类物质的2 个特征吸收峰;1 645.12 cm-1是羧基的C=O 非对称伸缩振动峰,说明存在结合水[14];1 400~1 200 cm-1是C-H 角变振动峰;1 405 cm-1是C-H 面内弯曲振动峰;1 075、1 046 cm-1是C-O-C 和C-O-H 伸缩振动和环振动峰重叠而成[15-16],说明存在吡喃糖;899 cm-1吸收峰说明存在β-糖苷键[17]。

图4 LGP-A 的FT-IR 光谱图Fig. 4 FT-IR spectrum of LGP-A
3.2.4 NMR 分析 在1H-NMR 谱中,通常α 型糖苷的异头氢化学位移大于δ5.0,β 型一般小于δ5.0[18-19],图5-a 给出LGP-A 的1H-NMR 信号,δ4.50~5.39是异头氢信号,其余的氢信号堆积在δ3.00~4.30内,相互交叉重叠。由于存在偶合和裂分,从1H-NMR 谱中还不能确定异头氢的位置,需要借助HSQC 来确定。在13C-NMR 谱中,糖的异头碳位于较低场,δ95~110,此范围内有几个信号,表示有几种单糖组成,但是同一种单糖在多糖中的位置比较接近,几乎重叠[18,20],图5-b 给出LGP-A 的13CNMR,在δ99~110 是异头碳信号,δ84~60 为LGP-A 单糖残基C2~C6信号位移的重叠。结合LGP-A 的HSQC 谱(图5-d),可以清晰地找到8个异头氢和异头碳的偶合信号,分别为A:C1-H1(109.3/5.26)、B:C1-H1(108.0/5.39)、C:C1-H1(107.5/5.09)、D:C1-H1(107.2/5.21)、E:C1-H1(103.7/4.69)、F:C1-H1(103.3/4.52)、G:C1-H1(102.8/4.54)、H:C1-H1(99.5/5.01)。结合单糖组成分析可以初步判断LGP-A中主要以α糖苷键连接的呋喃型阿拉伯糖和β 糖苷键连接的吡喃型半乳糖构成。结合文献报道[21-23]δ109.3/5.26、108.0/5.39、107.5/5.09、107.2/5.21 是α-L-Araf的信号;而δ103.7/4.69、103.3/4.52、102.8/4.54 是β-D-Galp的信号,δ99.5/5.01 是α-D-Galp的信号,具体数据见表1。
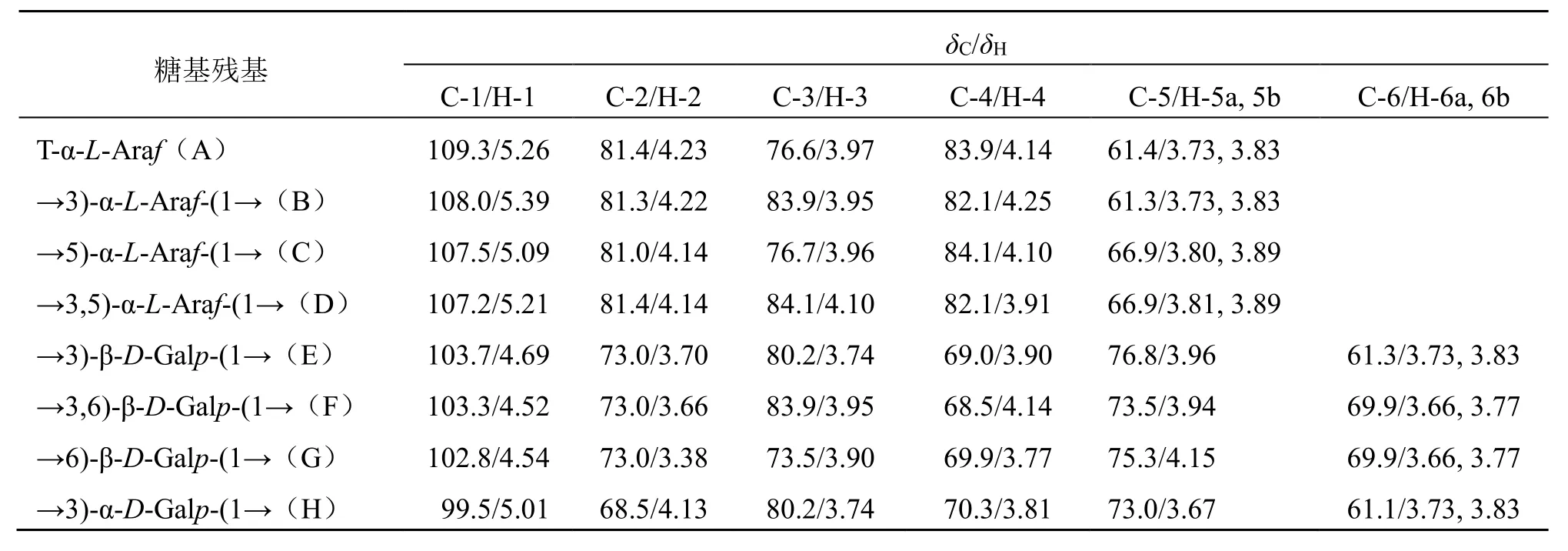
表1 罗汉果根多糖LGP-A 的核磁数据Table 1 13C-NMR and 1H-NMR data of LGP-A

图5 LGP-A 的1H NMR (a)、13C NMR (b)、1H-1H COSY (c)、HSQC (d) 和HMBC(e) 谱Fig. 5 1H-NMR (a), 13C-NMR (b), 1H-1H COSY (c), HSQC (d) and HMBC (e) spectra of LGP-A
以残基A 为例,1H-1H COSY 谱中显示的相关信号有δH5.26/δH4.23、δH4.23/δH3.97、δH3.97/δH4.14、δH4.14/δH3.83、δH4.14/δH3.73,分别为A 残基 H1-H2、H2-H3、H3-H4、H4-H5a、H4-H5b的相关信号,表明A 残基的H2~H5化学位移分别为δH4.23、3.97、4.14、3.83、3.73。此外,根据HSQC谱图可以看到δ5.26/109.3、4.23/81.4、3.97/76.6、4.14/83.9、3.83, 3.73/61.4 的交叉峰,由此推断出A残基的C2~C5化学位移分别为81.4、76.6、83.9、61.4。结合文献报道[21-22,24]中残基化学位移信息可推断残基A 为阿拉伯糖残基,其连接方式为T-α-LAraf。采用以上方法及参考文献数据[21-22,24-27]对其余7 个糖残基的其余信号进行归属如下:→3)-α-L-Araf-(1→(B)、→5)-α-L-Araf-(1→(C)、→3,5)-α-L-Araf-(1→(D)、→3)-β-D-Galp-(1→(E)、→3,6)-β-D-Galp-(1→(F)、→6)-β-D-Galp-(1→(G)、→3)-α-D-Galp-(1→(H)。8 种残基的化学位移值归纳如表1 所示。
根据HMBC 光谱确认相邻糖基残基之间的糖苷键,在LGP-A 的HMBC 光谱(图5-e)中,δ69.9/4.52 处的交叉峰代表→3,6)-β-D-Galp-(1→(F)的C-6 和→3,6)-β-D-Galp-(1→(F)的H-1 相关;δ69.9/4.54 处的交叉峰代表→6)-β-D-Galp-(1→(G)的C-6 和→6)-β-D-Galp-(1→(G)的H-1 相关;δ103.3/3.77、103.3/3.66 处的交叉峰代表→3,6)-β-DGalp-(1→(F)的C-1 和→3,6)-β-D-Galp-(1→(F)的H-6a、H-6b 相关;以上信息表明LGP-A 中含有→3,6)-β-D-Galp-(1→和→6)-β-D-Galp-(1→残基,且多糖中残基F 的连接以1,6 位C 相连。δ83.9/5.26 处的交叉峰代表→3,6)-β-D-Galp-(1→(F)的C-3 与T-α-LAraf(A)的H-1 相关。表明残基A 的C-1 与残基F的C-3相连;δ107.5/5.26处的交叉峰表明→5)-α-LAraf-(1→(C)的C-1 和T-α-L-Araf(A)的H-1 相关;δ83.9/5.09 处的交叉峰表明→3,6)-β-D-Galp-(1→(F)的C-3 和→5)-α-L-Araf-(1→(C)的H-1相关;δ66.9/5.09 处的交叉峰表明→5)-α-L-Araf-(1→(C)的C-5 和→5)-α-L-Araf-(1→(C)的H-1 相关。δ76.6/5.09 处的交叉峰表明T-α-L-Araf(A)的C-3和→5)-α-L-Araf-(1→(C)的H-1 相关;δ84.1/5.26处的交叉峰表明T-α-L-Araf(A)的H-1 和→3,5)-α-LAraf-(1→(D)的C-3 相关;基于上述结果和文献报道[21-27],推断LGP-A 是一种阿拉伯半乳聚糖,且主链是F 的C-1 与C-6 相连,另2 个主要残基A、C 都是C-1 与主链中F 的C-3 相连。
由于多糖结构复杂,NMR 谱图中信号重叠严重,采用NMR 分析结构只能初步推测糖残基之间的连接方式,很难准确判断糖苷键连接位点。后续课题组将继续对LGP-A 的结构进行解析,采用甲基化等分析手段进一步表征多糖结构。
3.2.5 刚果红实验 若1 个多糖具有三螺旋结构与刚果红试剂混合后会发生络合反应,混合溶液的最大吸收波长(λmax)向长波方向移动,即红移。氢氧化钠可以破坏多糖三螺旋结构,因此随着氢氧化钠浓度升高混合溶液λmax逐渐减小,即蓝移[28]。从图6中可以看到LGP-A 与刚果红混合后λmax未发生显著性红移,且随氢氧化钠浓度升高,混合溶液与刚果红单一溶液λmax变化趋势相似,因此判断LGP-A不含三螺旋结构。

图6 LGP-A 刚果红实验Fig. 6 Congo Red experiment of LGP-A
3.2.6 SEM 分析 如图7 所示,LGP-A 在扫描电镜下呈现出带孔的片状堆叠,表面紧密,说明其分子间及分子链间相互作用较强,其结构有网状结构,另有少量棒状结构,说明LGP-A 排布不规律,规整性不强,可能为无定型结构。

图7 LGP-A 的SEM 图Fig. 7 SEM of LGP-A
3.3 LGP-A 细胞免疫活性
3.3.1 对细胞增殖的影响 用 CCK-8 法检测LGP-A 对RAW264.7 细胞增殖率的影响,结果如图8-A 所示,与对照组相比,LGP-A 质量浓度在0.625~5.0 μg/mL 对细胞没有毒性作用,亦未显著促进RAW264.7 细胞增殖。因此采用0.625~5.0 μg/mL 质量浓度的多糖溶液进行以下实验。
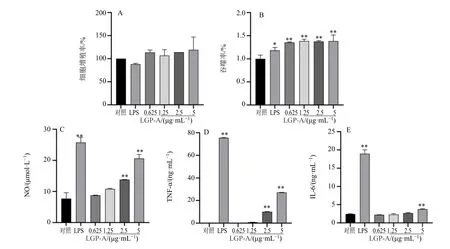
图8 LGP-A 对RAW264.7 细胞的增殖活性 (A)、吞噬中性红 (B) 及释放NO (C)、TNF-α (D) 和IL-6 (E) 的影响(± s , n=3)Fig. 8 Effects of LGP-A on proliferation (A), phagocytosis of neutral red (B), release of NO (C), TNF-α (D) and IL-6 (E) of RAW264.7 cells (± s , n=3)
3.3.2 对细胞吞噬能力的影响 巨噬细胞的吞噬作用是非特异性免疫在病原体入侵时的最初反应,巨噬细胞吞噬病原体后不仅可以激活特异性免疫,对炎症的消退也起到重要作用。因此,巨噬细胞的吞噬能力可以作为机体免疫防御水平的指标之一。有研究表明,中药多糖能够提高巨噬细胞吞噬能力,增强机体免疫调节能力。LGP-A 多糖的结果如图8-B 所示,以对照组为100%吞噬率,在0.625~5.0 μg/mL LGP-A 可以显著性增强RAW264.7 细胞的吞噬能力(P<0.01),1.25 μg/mL 下吞噬率为138.5%。
3.3.3 对细胞NO、TNF-α、IL-6 分泌量的影响 NO作为细胞产生的一种信号转导介质,可以激活巨噬细胞启动非特异性免疫,促进巨噬细胞代谢,提高巨噬细胞吞噬能力[26],是评价免疫应答水平的重要指标。细胞因子主要是巨噬细胞在免疫应答过程中的产物,可以参与免疫应答,调节巨噬细胞功能。其中TNF-α 是一种强促炎因子[29],参与机体多种生命活动,对肿瘤也有一定的抑制活性。IL-6 可以诱导机体产生炎症反应,还可以调节代谢及再生[30]。因此TNF-α、IL-6 等细胞因子水平的上升是巨噬细胞激活的标志之一。有研究表明,多糖提高RAW264.7 细胞NO、TNF-α、IL-6 等因子的分泌,且分泌水平低于LPS 诱导组,以此来评价其免疫调节活性[31]。
由图 8-C~E 可知,LGP-A 多糖可以促进RAW264.7 细胞NO、TNF-α、IL-6 等细胞因子的分泌,且呈剂量相关性。与对照组相比,5 μg/mL LGP-A 组的NO、TNF-α 分和IL-6 分泌量均较显著上升,分别为(20.64±1.29)μmol/L、(27.16±0.17)ng/mL 和(3.77±0.13)ng/mL,但低于1 μg/mL LPS组分泌量 [(25.79±1.63)μmol/L、(75.54±0.23)ng/mL、(18.97±0.11)ng/mL]。综合细胞因子与细胞吞噬实验结果,可知LGP-A 具有一定的免疫调节作用。
4 讨论
目前对罗汉果根多糖的构效关系未有充分研究,但在其他多糖的研究中发现单糖组成是影响多糖生物活性的重要因素,其中半乳糖、阿拉伯糖等单糖是否存在和含量高低会影响其免疫活性。由阿拉伯糖和半乳糖聚合而成的中性多糖称为阿拉伯半乳聚糖(AG),安全无毒,且具有良好的生物活性。如从落叶松中提取的AG 能促进TNF-α、IL-6 和IL-1β 等细胞因子,具有很强的免疫调节活性。在临床试验中发现AG 可以提高人体对细菌抗原的免疫力,还可以治疗风寒感冒等呼吸道疾病[32-33]。除了免疫活性外,AG 在抗肿瘤、抗氧化、抗病毒、维持肠道稳态等方面也有较好的活性。
本研究通过红外光谱、核磁波共振波谱、相关参考文献和结合单糖组成分析结果,对LGP-A 结构进行初步分析,推断其是一种阿拉伯半乳聚糖。实验证明LGP-A 具有较好的免疫活性,可能与其相对分子质量大小有关。相对分子质量是多糖发挥生物活性的重要影响因素,多糖需要与受体结合跨越细胞屏障才能进入机体发挥生物活性。多糖相对分子质量过高难以跨越细胞屏障,相对分子质量过低难以形成活性聚合物结构[34]。研究发现不同植物多糖发挥免疫活性的最佳相对分子质量范围不同,如单糖组成、糖链主要结构及官能团基本一致但相对分子质量有明显差异的铁皮石斛多糖在免疫调节活性方面具有显著差异,在1.2×105~5.44×105免疫效果强于3.91×104[35],推测在一定范围内,多糖相对分子质量越大活性越强。本实验从罗汉果根中分离得到的LGP-A 多糖,经PMP-HPLC 分析后发现与红花多糖HH1-1 单糖组成[21]及比例相似,相对分子质量与草菇多糖相似。研究表明红花多糖HH1-1 与草菇多糖可以增加巨噬细胞NO 生成量,促进细胞因子TNF-α、IL-6、IL-1β、iNOS 的分泌及其mRNA表达量[36],表现出良好的免疫调节能力,本实验结果与以上研究比较一致。
目前罗汉果栽培方式是一年一栽,每年产生大量的根资源。但罗汉果根不是传统的药用部位,尚未得到系统的研究与开发,从而遭受丢弃造成巨大的资源浪费。本实验以罗汉果根为原料,通过脱脂、水提醇沉得到罗汉果根粗多糖,利用DEAE-52 和Sephadex LH-20 柱色谱纯化得到1 个均一性较好的中性多糖LGP-A,通过FT-IR、NMR、SEM 等技术初步表征了其结构,以细胞实验证明其具有免疫调节活性。今后拟进一步加强对LGP-A 精细结构的解析,并开展其体内的免疫活性研究,为开发罗汉果根多糖的大健康产品奠定基础。
利益冲突所有作者均声明不存在利益冲突
