非洲猪瘟病毒D1133 L蛋白单克隆抗体抑制其复制
2024-03-01闫文倩杨金柯史喜绢张大俊别鑫恬陈国辉陈玲玲赵美玉赵思越郑海学张克山
闫文倩,侯 景,杨金柯,郝 雨,杨 行,史喜绢,张大俊,别鑫恬,陈国辉,陈玲玲,何 路,赵美玉,赵思越,郑海学*,张克山*
(1.中国农业科学院兰州兽医研究所 兰州大学动物医学与生物安全学院 动物疫病防控全国重点实验室,兰州 730000;2.甘肃省病原生物学基础学科研究中心,兰州 730046)
非洲猪瘟(African swine fever, ASF)是一种影响家猪和野猪的急性出血性疾病,由非洲猪瘟病毒(African swine fever virus,ASFV)引起,以高发病率和高致死率为特征[1-2]。ASF于1921年在肯尼亚首次被报道,之后不断蔓延到欧洲和亚洲的其他国家,迄今为止,还没有公认有效的商业疫苗可用于ASF,对全球养猪业造成了毁灭性打击[3-4]。ASFV是一种大型的双链DNA病毒,是非洲猪瘟病毒科、非洲猪瘟病毒属的唯一成员,亦是唯一已知的DNA虫媒病毒,可以编码150~200种蛋白质,其中被预测和确定的解旋酶有5种,分别命名为A859L、B962L、D1133L、Q706L、Qp509L[5-8],但对它们的研究仍较少。
D1133L是ASFV编码的非结构蛋白,其基因位于病毒基因组的中央区域,属于晚期表达基因,高度保守[9-10]。D1133L类似于牛痘病毒的D6R蛋白,含有表征超家族Ⅱ解旋酶的氨基酸序列,因此推测其属于超家族Ⅱ解旋酶[11],在ASFV复制中发挥着重要作用[12-14]。单克隆抗体在诊断和治疗方面发挥着重要的作用,在前期的研究中,针对D1133L制备的单克隆抗体7D12具有良好的特异性,但是其功能活性还未被验证。在本研究中,作者探讨了D1133L单克隆抗体对ASFV复制的影响,以期对ASFV 靶向药物和疫苗的研发提供一定的参考依据。
1 材料与方法
1.1 材料
1.1.1 细胞与病毒 猪肺泡巨噬细胞 (porcine alveolar macrophages,PAMs)由本实验室参考文献[15]分离制备,ASFV野生病毒(ASFV-CN/GS/2018)及 ASFV-GFP重组病毒(在ASFV-CN/GS/2018分离株中重组插入GFP标签)均由中国农业科学院兰州兽医研究所非洲猪瘟区域实验室提供。
1.1.2 试剂与抗体 胎牛血清(FBS)、RPMI 1640培养基均购自美国 Gibco 公司;PBS 缓冲液购自北京索莱宝公司;β-actin小鼠单克隆抗体购自Proteintech公司;HRP标记山羊抗小鼠 IgG(H+L)二抗购自 Abbkine 公司;小鼠IgG购于碧云天有限公司,RNA 抽提试剂 Trizol 购自美国 Invitrogen 公司;TB GreenTMPremix ExTaq、PrimeScriptTMRT Master Mix、2×Pro Taq HS Probe Premix购自TaKaRa公司;D1133 L单克隆抗体[16]和 p72多克隆抗体均由本实验室提供。
1.2 细胞总RNA的提取及反转录
采用Trizol法提取细胞总RNA,并将RNA反转录为cDNA,反转录体系20 μL:5×PrimeScriptTMRT Master Mix 4 μL,RNA模板10 μL,DEPC水6 μL。反转录程序:37 ℃反转扩增 15 min;85 ℃变性 5 s,获得cDNA,于-20 ℃保存备用。
1.3 实时荧光定量PCR(RT-qPCR)
相对定量:将反转录成的cDNA,以ASFV p72基因为靶点进行PCR,引物序列见表1。反应体系(20 μL):TB GreenTMPremix ExTaq10 μL,10 μmol·L-1上、下游引物各0.4 μL,DEPC水5.4 μL,cDNA3 μL。反应条件:95 ℃ 2 min;95 ℃ 10 s,60 ℃ 34 s,共40 个循环,利用 2-ΔΔCt方法对其进行分析。

表1 实时荧光定量PCR(RT-qPCR)引物信息
绝对定量:反应体系(25 μL):12.5 μL 2×Pro Taq HS Probe Premix,1 μL 上下游引物,1 μL 探针,3 μL DNA,6.5 μL DEPC水。反应条件:95 ℃预热2 min;95 ℃预热7 s,60 ℃预热12 s,4次循环;95 ℃预热6 s,58 ℃预热11 s,40次循环。引物和探针序列见表 1。
1.4 红细胞吸附试验(HAD50)
采取健康猪抗凝血清,用10倍体积的含有3%双抗的PBS(pH=7.4)清洗至上清无色透明,最后使用PBS配成体积分数为1%的猪红细胞。将PAMs铺入96孔板,加入1%的红细胞悬液20 μL和倍比稀释(10-1~10-8)的样品100 μL,设置8个重复,连续培养7 d,每天观察红细胞吸附现象。按照 Reed-Muench法计算 HAD50。
1.5 蛋白质印迹(Western blot)
在收取的细胞中加入1×loading buffer,100 ℃变性10 min,12 000 r·min-1离心5 min,进行SDS-PAGE和转移至NC膜上,5%脱脂奶粉室温封闭2 h,加入一抗于4 ℃摇床孵育过夜,二抗室温孵育2 h,最后,加入Western Bright ECL化学发光显色,使用化学发光成像分析系统曝光。
1.6 病毒生长曲线
在PAMs上分别接种MOI=0.1的ASFV和ASFV-GFP重组病毒,在感染后指定时间将感染细胞与培养上清一起收集,反复冻融3次后,采用 QIAamp DNA Mini Kits试剂盒提取样品DNA,通过绝对定量 PCR 测定 ASFV 拷贝数。
1.7 荧光显微镜观察荧光数量
在荧光显微镜下观察荧光数量及强弱的变化,并选取多个视野进行拍照记录,并使用Image J软件对选取的视野里的绿色荧光数量进行定量分析。
1.8 数据分析
用 GraphPad Prism 软件进行统计学分析,用t检验进行显著性分析(*.P<0.05;**.P<0.01;***.P<0.001)。
2 结 果
2.1 D1133 L单克隆抗体抑制ASFV的基因转录水平和病毒效价
PAMs同时接种ASFV(MOI=0.1)和不同浓度的单克隆抗体,分别培养12、24和36 h,分别通过RT-qPCR和HAD50测定ASFV 的转录水平和病毒效价。结果显示,加入不同浓度的单克隆抗体后,ASFVp72的转录水平(图1A)和病毒效价(图1B)均显著降低,并且呈剂量依赖性。

A. ASFV p72转录水平;B. ASFV病毒效价。ns. P>0.05;*.P<0.05;**.P<0.01;***.P<0.001A. Transcription level of ASFV p72; B. Virus titer of ASFV. ns. P>0.05; *.P<0.05;**.P<0.01;***.P<0.001
2.2 D1133 L单克隆抗体抑制ASFV的蛋白表达
PAMs同时接种ASFV(MOI=0.1)和不同浓度的单克隆抗体,分别培养12、24和36 h,用Western blot测定ASFV D1133 L和p72蛋白的表达水平。结果显示,加入不同浓度的单克隆抗体后,ASFV D1133 L和p72蛋白的表达水平均显著降低,并呈剂量依赖性(图2)。

图2 D1133L单克隆抗体抑制病毒蛋白表达Fig.2 D1133L monoclonal antibody inhibits the expression of ASFV proteins
2.3 D1133 L单克隆抗体抑制ASFV-GFP荧光蛋白的表达
为了通过ASFV-GFP重组病毒产生的绿色荧光蛋白的表达水平来验证D1133 L单克隆抗体对ASFV复制的影响,首先在PAMs上接种了 ASFV和ASFV-GFP重组病毒,比较两种毒株的生长曲线,结果表明,两种毒株的生物学特性没有差异(图3A)。接着在PAMs同时接种ASFV-GFP重组病毒(MOI=0.1)和不同浓度的单克隆抗体,分别培养24、36和48 h,用荧光显微镜观察绿色荧光蛋白的表达。结果表明,加入不同浓度的单抗后,绿色荧光蛋白的表达水平明显降低,并且呈明显的剂量依赖性(图3B、C)。
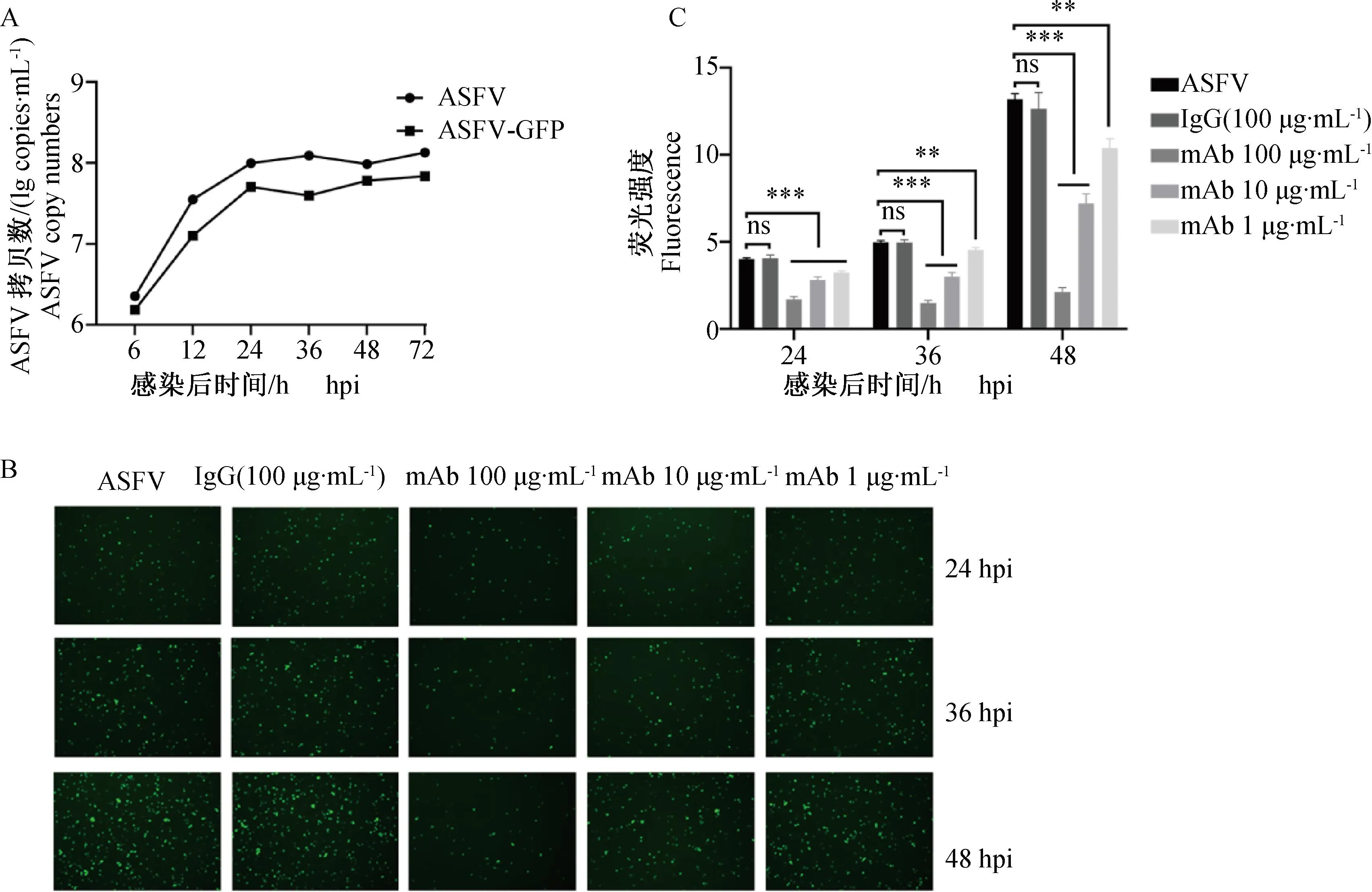
A. ASFV和ASFV-GFP的生长曲线;B. ASFV-GFP绿色荧光蛋白的表达水平;C. Image J对绿色荧光的定量分析。ns. P>0.05;*.P<0.05;**.P<0.01;***.P<0.001A. Growth curve of ASFV and ASFV-GFP; B. Expression of ASFV-GFP green fluorescent protein; C. Quantitative analysis of green fluorescence by Image J. ns. P>0.05;*.P<0.05;**.P<0.01;***.P<0.001
以上结果表明,D1133 L单克隆抗体可以抑制ASFV的复制,且抗体浓度越弱,其抑制作用越弱。
3 讨 论
关于ASFV单克隆抗体的研究中,一方面,结构蛋白p30、p54和p72因其很好的抗原性,基于其制备的单克隆抗体的ASFV检测方法被陆续地研发和报道[17-20],在ASFV的诊断中发挥作用。另一方面,针对非结构蛋白MGF360-9 L制备的多克隆抗体被证明可以显著抑制ASFV的复制[21];ASFV E165R基因编码的dUTPase,作为病毒复制的关键酶,针对其制备的单克隆抗体可以抑制E165R本身的酶活性,可能因而影响ASFV的复制[22]。ASFVpB602 L基因在 ASFV 组装中发挥重要作用,针对其制备的单克隆抗体可能会通过抑制pB602 L 的功能,从而干扰病毒颗粒的产生[23],在调控ASFV复制方面发挥作用。前期制备的D1133 L单克隆抗体具有良好的特异性,因此在本研究中,作者探索了单克隆抗体对 ASFV 复制的影响,以期探究D1133 L蛋白在病毒复制过程中的作用。
在PAMs上同时接种不同浓度的D1133 L单克隆抗体和ASFV(MOI=0.1),发现不同浓度的抗体在不同的感染时间均能抑制ASFV在PAMs中的复制,并且随着抗体的浓度降低,抑制作用减弱。推测D1133 L单克隆抗体可能影响D1133 L的功能,起到抑制ASFV复制的作用,但想要精确验证的抑制功能,还需要在体内评估其抗病毒功效。因此 D1133 L单抗发挥其抑制作用的机制仍需要进一步探究。
4 结 论
本研究明确了D1133 L单克隆抗体在体外对ASFV复制的抑制作用,但是单克隆抗体发挥抑制作用的机制暂不清楚,还需进一步探索。本研究有助于进一步探究D1133 L在ASFV复制过程中发挥的作用,在ASF疫苗开发和抗病毒药物靶点的选择上提供一定的参考。
