大肠杆菌感染奶牛乳腺上皮细胞和小鼠乳腺组织致其线粒体损伤的机制研究
2024-03-01庄翠翠
庄翠翠,韩 博
(1.山西农业大学动物医学学院,晋中 030801;2.中国农业大学动物医学院,北京 100193)
奶业是我国畜牧业发展的支柱性产业。奶牛乳腺炎仍然是奶牛最常见,也是最具挑战性的疾病之一。奶牛乳腺炎不仅会影响动物福利,也会造成牛奶质量下降,从而严重地影响奶业的发展并造成巨大的经济损失[1]。奶牛乳腺炎的严重程度不仅取决于入侵病原体的种类和致病力,也受奶牛自身如哺乳期、年龄、胎次、自身免疫力以及外界饲养环境和挤奶方式等的影响,但病原微生物感染仍是引起奶牛乳腺炎最主要的病因[2]。目前有150多种病原体会诱发奶牛乳腺炎。根据病原体的不同,奶牛乳腺炎可分为细菌性乳腺炎、真菌性乳腺炎、藻类性乳腺炎和支原体性乳腺炎,其中发生率最高,病情最严重且经济损失最大的是细菌性乳腺炎[3]。根据细菌的不同来源及传播方式,奶牛乳腺炎的致病菌可以分为传染性病原菌、机会性病原菌和环境性病原菌,其中传染性病原菌主要有金黄色葡萄球菌、无乳链球菌等,机会性病原菌主要有表皮葡萄球菌、模拟葡萄球菌和产色葡萄球菌等,环境性病原菌主要有克雷伯杆菌、化脓隐秘杆菌和大肠杆菌(Escherichiacoli,E.coli)等[4]。
E.coli是引起奶牛乳腺炎最常见的环境致病菌之一。Gao等[5]对我国161个牛场的3 288份临床乳腺炎来源的牛奶样本进行分析,发现最多的病原菌是E.coli,占14.4%。E.coli感染会引起奶牛乳腺发生急性肿胀、疼痛和发热,乳汁呈水样、带血或凝乳,产奶量急剧减少,并伴有毒血症的临床症状,如体温升高、心率加快、精神沉郁和食欲不振[6-7]。尽管环境乳腺炎受到管理实践的高度影响,但畜群结构和不断提高的牛奶质量标准使乳腺炎成为一种复杂的疾病,且乳腺炎仍然是乳制品行业的首要问题[1,8]。目前,抗生素依然是国内外兽医人员治疗奶牛乳腺炎最常用的方法[9],然而抗生素大量且不合理的使用甚至滥用导致了耐药致病菌株的出现和传播以及畜产品抗生素残留等问题,进而威胁着人类公共卫生安全。线粒体作为细胞中重要的两层膜细胞器,不但能为细胞供给能量,还参与了细胞生长、分化和细胞周期调控、信息传递以及细胞凋亡等。但E.coli感染对线粒体的损伤机制仍不清晰。因此,本研究旨在进一步探究E.coli感染对奶牛乳腺上皮细胞线粒体的影响及其机理,为寻找安全、高效的抗生素替代品提供新思路且为E.coli性奶牛乳腺炎的防治提供新方向。
1 材料与方法
1.1 实验动物及奶牛乳腺上皮细胞
分娩1周的12周龄SPF级昆明小鼠购自北京斯贝福生物技术有限公司,饲养于山西农业大学实验平台的动物房内,每笼3只母鼠,自由采食和饮水。动物房温度23 ℃±3 ℃,湿度50%±10%,每小时换气15次,每天光照12 h。
奶牛乳腺上皮细胞系MAC-T[购自上海晶马生物科技有限公司]在含有10%胎牛血清的DMEM中培养,传8代后用于后续试验。
1.2 E.coli培养
E.coli菌株由本实验室前期从内蒙古患有临床型乳腺炎的奶牛乳样中分离并储存于-80 ℃冰箱中[10],用血平板复苏后,在Luria-Bertani肉汤培养基中培养至对数生长期用于后续试验。该患病奶牛直肠温度高达40.0 ℃,产奶量下降,牛奶中含有大量凝块,乳腺组织持续肿胀。此外,本E.coli菌株在预试验中能够诱发小鼠乳腺炎。
1.3 试验设计
将18只分娩1周的12周龄SPF级昆明小鼠母鼠随机分成3组,分别为空白对照(Control)组、大肠杆菌(E.coli)组和脂多糖(lipopolysaccharide,LPS)组,每组6只。全部小鼠左腿肌肉注射50 mg·kg-1体重舒泰50麻醉后,保定于体视显微镜下,利用无菌超微注射器对E.coli组母鼠的右侧第4对乳腺导管注射25 μLE.coli生理盐水溶液(包含106CFUE.coli),LPS组注射25 μL 20 mg·kg-1体重LPS生理盐水溶液[11],Control组注射等量的无菌生理盐水,处理后24 h,实施安乐死并收集乳腺组织。
以第9代奶牛乳腺上皮细胞为研究对象,随机分成3组,分别为空白对照(Control)组、大肠杆菌(E.coli)组和脂多糖(LPS)组,Control组未被E.coli感染且未被LPS处理;E.coli组被感染复数为5的E.coli感染6 h,LPS组被1 μg·mL-1LPS处理6 h,重复3次试验,每组3个重复,根据后续试验需求收集感染后的奶牛乳腺上皮细胞。
1.4 测定指标及方法
1.4.1 乳腺上皮细胞角18蛋白免疫荧光鉴定 第9代奶牛乳腺上皮细胞生长于细胞爬片后,将细胞爬片上的奶牛乳腺上皮细胞置于500 μL 4 mL·L-1多聚甲醛中冰育固定10 min,磷酸缓冲盐溶液(phosphate buffer saline,PBS)洗涤3次,再加入500 μL的0.2% Triton X100透化,冰育7 min,PBS洗涤3次。细胞爬片室温下于1%牛血清白蛋白封闭液中封闭60 min,加入鼠源角18蛋白抗体(购自Abcam公司,200倍稀释),4 ℃孵育60 min,PBS洗涤3次,加入异硫氰酸荧光素标记的山羊抗鼠二抗IgG(1 000倍稀释),室温下避光孵育30 min,PBS洗涤3次后,利用4′,6-二脒基-2-苯基吲哚(4′,6-diaminyl-2-phenylindole,DAPI)避光孵育5 min,然后PBS洗涤3次。细胞爬片覆盖到含有抗荧光淬灭剂的载玻片上,利用激光共聚焦显微镜观察染色情况。
1.4.2 乳腺上皮细胞透射电镜检测 第9代奶牛乳腺上皮细胞经过不同的处理后,利用2.5%电镜固定液固定奶牛乳腺上皮细胞,4 ℃固定过夜后,采用梯度酒精和丙酮溶液脱水,丙酮树脂混合溶液聚合48 h后,超薄切片机切片,利用3%醋酸铀-枸橼酸铅双染色,透射电镜拍照。
1.4.3 小鼠组织病理学检测 母鼠安乐死后,迅速收集各组乳腺组织并于室温固定于10%中性福尔马林溶液中12 h后,流水冲洗2 h,70%~95%梯度酒精脱水,二甲苯透化和石蜡包埋后切片。制备好的石蜡切片经二甲苯透化、70%~95%梯度酒精脱水和蒸馏水脱蜡后进行苏木素-伊红(hematoxylin-eosin,HE)染色,染色后的切片用中性树胶封片,在光学显微镜下观察乳腺组织的病理学变化。
1.4.4 线粒体纯度测定 严格按照线粒体提取试剂盒(购自南京建成生物工程研究所)说明书提取第9代奶牛乳腺上皮细胞和小鼠乳腺组织线粒体后,根据Caro等[12]的研究方法测定线粒体的纯度,主要通过检测线粒体和细胞质组分内ATP合成酶α亚基(ATP synthetase alpha subunit,ATP5A,一种线粒体标记物)和乳酸脱氢酶(lactic dehydrogenase,LDH,一种细胞浆标记物)的免疫印迹衡量线粒体的纯度。严格按照BCA蛋白浓度测定试剂盒(增强型,购自碧云天生物技术有限公司)说明书测定线粒体匀浆和细胞质组分蛋白浓度,标准品(0、0.025、0.05、0.1、0.2、0.3、0.4、0.5 mg·mL-1)和待测样本中加入200 μL BCA工作液(50体积BCA试剂A与1体积BCA试剂B混匀),37 ℃孵育30 min,D(562 nm)检测吸光光度值,根据标准曲线计算待测样品的蛋白浓度。线粒体匀浆和细胞质组分分别加入上样缓冲液,混匀100 ℃煮沸5 min制成蛋白样品。选取30 μg蛋白样品加入到丙烯酰胺凝胶(上层5%浓缩胶和下层10%分离胶)上样孔内,80 V浓缩20 min后,120 V分离90 min,200 mA转膜90 min,0.2 μm聚偏二氟乙烯膜于含有5%脱脂奶粉的Tris-HCl缓冲盐溶液封闭液(含0.1%吐温20)中封闭90 min后,ATP5A(购自Abcam公司,稀释1 000倍)、LDH(购自Santa Cruz Biotechnology公司,稀释1 000倍)和β-actin(购自北京中杉金桥生物技术有限公司,稀释400倍)一抗4 ℃孵育过夜,含有5%脱脂奶粉的Tris-HCl缓冲盐溶液封闭液(含0.1%吐温20)清洗3次,每次10 min,加入山羊抗鼠(购自北京中杉金桥生物技术有限公司,稀释2 000倍)二抗,室温孵育60 min,含有5%脱脂奶粉的Tris-HCl缓冲盐溶液封闭液(含0.1%吐温20)清洗3次,每次10 min,利用化学发光仪上曝光并采集图像。
1.4.5 奶牛乳腺上皮细胞线粒体膜通透性检测 第9代奶牛乳腺上皮细胞经过不同的处理后,根据Halestrap[13]的研究方法测定奶牛乳腺上皮细胞线粒体膜通透性,主要通过检测硫氰酸钾缓冲液中线粒体肿胀程度判断E.coli感染对线粒体的损伤。缓冲液主要含有150 mmol·L-1硫氰酸钾、10 mmol·L-12-(N-吗啡啉)乙磺酸、10 mmol·L-13-吗啉丙磺酸、5 mmol·L-1Tris、1 μg·mL-1鱼藤酮和1 μg·mL-1抗霉素A,经HCl或KOH调节至所需pH 7.4。奶牛乳腺上皮细胞线粒体以2 mg·mL-1的蛋白质加入到7.4 mL 硫氰酸钾缓冲液中混匀,D(520 nm)检测吸光光度值,根据吸光度的变化判定线粒体膜通透性的改变。若吸光度降低,表明奶牛乳腺上皮细胞线粒体膜通透性增加。
1.4.6 三磷酸腺苷(ATP)含量检测 第9代奶牛乳腺上皮细胞和小鼠乳腺组织经过不同的处理后,严格按照ATP含量检测试剂盒(购自南京建成生物工程研究所)说明书操作,检测D(636 nm)各管吸光光度值,双蒸水调零。
1.4.7 线粒体电子传递链复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ活性测定 第9代奶牛乳腺上皮细胞和小鼠乳腺组织经过不同的处理后,严格按照线粒体呼吸链复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ试剂盒(购自南京建成生物工程研究所)说明书操作,检测D(340 nm)检测0和5 min吸光光度值,样品活性计算公式如下:
样品活性=样本容量(0.1 mL)×5.5(毫摩尔吸光系数)×反应时间/(样本OD-背景OD)×体系容量(1 mL)×样本稀释倍数÷样品蛋白浓度。
1.4.8 线粒体DNA非编码区包含位移环区(D-Loop)基因表达量及线粒体质量检测 第9代奶牛乳腺上皮细胞和小鼠乳腺组织经过不同的处理后,严格按照线粒体提取试剂盒(购自南京建成生物工程研究所)说明书提取线粒体后,再严格按照动物组织/细胞线粒体DNA提取试剂盒(购自北京百奥莱博科技有限公司)说明书操作提取线粒体DNA,通过引物(D-Loop引物序列为F:TAGTGCTAATACCAACGGCC;R:AGGCATTTTCAGTGCCTTGC和β-actin引物序列为F:GTCCACCTTCCAGCAGAT;R:GCTAACAGTCCGCCTAGAA)进行PCR特异性扩增,反应体系为20 μL,其中线粒体DNA 2 μL,上、下游引物各0.8 μL,SYBR Green染料10 μL和水6.4 μL。反应条件:30次循环,94 ℃变性6 min,94 ℃ 45 s,60 ℃ 45 s,72 ℃ 1 min,72 ℃ 10 min。通过2-ΔΔCt法计算D-Loop基因表达量。
1.4.9 线粒体分裂与融合相关基因检测 第9代奶牛乳腺上皮细胞和小鼠乳腺组织经过不同的处理后,严格按照TRIzol试剂(购自北京全式金生物技术股份有限公司)提取奶牛乳腺上皮细胞和小鼠乳腺组织总RNA后,按照反转录试剂盒说明书(购自北京全式金生物技术股份有限公司)将总RNA反转成DNA,通过NCBI Gene中基因序列合成引物(表1)进行PCR特异性扩增,反应体系为25 μL,其中DNA模板2 μL,上、下游引物各1 μL,SYBR Green染料12.5 μL和水8.5 μL。反应条件:35次循环,95 ℃变性3 min,95 ℃ 10 s,60 ℃ 30 s,72 ℃ 1 min。通过2-ΔΔCt法计算基因表达量。
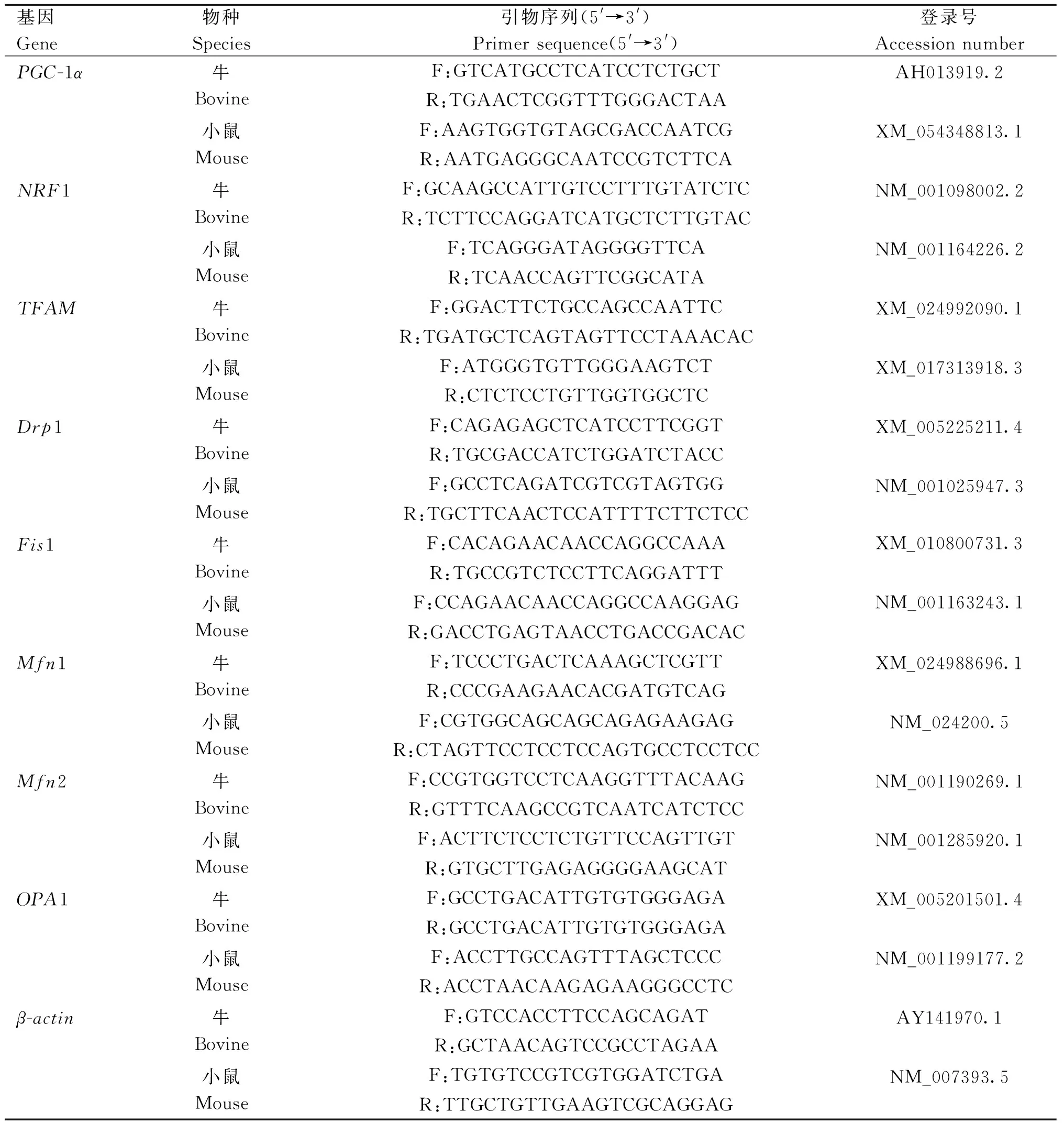
表1 实时定量PCR引物序列
2 结 果
2.1 奶牛乳腺上皮细胞鉴定
对生长至第9代的奶牛乳腺上皮细胞进行角18蛋白免疫荧光检测,激光共聚焦显微镜拍照发现,奶牛乳腺上皮细胞胞浆中角18蛋白染成绿色,均匀分布在细胞浆内,细胞核被DAPI染成蓝色(图1A),表明奶牛乳腺上皮细胞可用于后续试验。
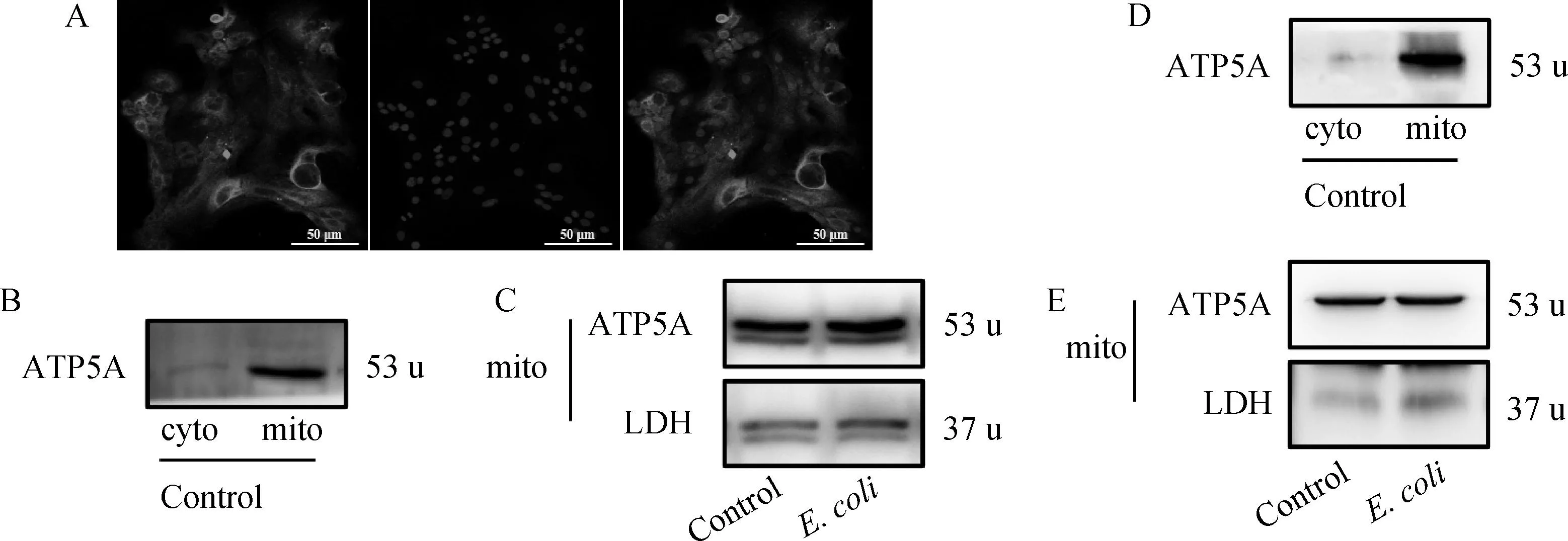
A. 角18蛋白绿色染色,细胞核蓝色染色。标尺=50 μm。B. ATP5A在奶牛乳腺上皮细胞线粒体匀浆和细胞质组分中的蛋白表达量。C. ATP5A和LDH在Control和E.coli组奶牛乳腺上皮细胞线粒体匀浆中的蛋白表达量。D. ATP5A在小鼠乳腺组织线粒体匀浆和细胞质组分中的蛋白表达量。E. ATP5A和LDH在Control和E.coli组小鼠乳腺组织线粒体匀浆中的蛋白表达量。mito为线粒体匀浆,cyto为细胞质组分A. Cytokeratin 18 was stained green and nuclear was stained blue. Scale bars=50 μm. B. The protein expression of ATP5A in the mitochondrial homogenate and cytoplasmic components of bovine mammary epithelial cells. C. The protein expressions of ATP5A and LDH in the mitochondrial homogenates of bovine mammary epithelial cells of Control and E. coli groups. D. The protein expression of ATP5A in the mitochondrial homogenate and cytoplasmic components of mouse mammary gland. E. The protein expressions of ATP5A and LDH in the mitochondrial homogenates of mouse mammary gland of Control and E. coli groups. moti is mitochondrial homogenate and cyto is cytoplasmic component
2.2 奶牛乳腺上皮细胞和小鼠乳腺组织线粒体纯度鉴定
相对于细胞质部分,线粒体匀浆中高度表达了的线粒体的标志物ATP5A(图1B~D)。此外,为了确定线粒体匀浆的纯度,在Control和E.coli组线粒体匀浆中高度表达了ATP5A乳酸脱氢酶,而低表达乳酸脱氢酶(LDH,一种细胞质标记物;图1C和E)。这些结果表明,奶牛乳腺上皮细胞和小鼠乳腺线粒体匀浆内线粒体纯度较高,可用于后续试验。
2.3 E.coli感染对奶牛乳腺上皮细胞超微结构的影响
利用透射显微镜观察奶牛乳腺上皮细胞线粒体的结构(图2),正常培养的奶牛乳腺上皮细胞内线粒体结构完整,细胞连接紧密(图2A),而经E.coli感染的奶牛乳腺上皮细胞间隙增大,线粒体肿胀,线粒体嵴缺失且部分模糊消失(图2B)。这些结果表明,E.coli感染造成了奶牛乳腺上皮细胞内线粒体损伤。
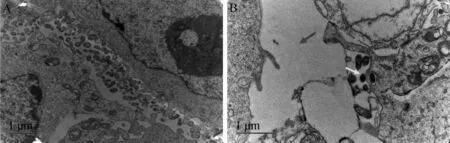
红色箭头标示为细胞间隙增大;黄色箭头标示为E.coli;绿色箭头标示为线粒体肿胀;粉色箭头标示为线粒体嵴缺损,部分模糊消失Red arrow indicates increased intercellular space; The yellow arrow indicates Escherichia coli; The green arrows indicate mitochondrial swelling; The pink arrows indicate the mitochondrial crests′ defect and partial missing mitochondrial crests
2.4 E.coli感染对小鼠乳腺病理变化的影响
病理组织结果如图3所示。Control组小鼠乳腺腺泡结构清晰,并有散在的乳汁;E.coli组小鼠组织腺泡壁被破坏,腺泡内有游离的中性粒细胞并有散在的淡染乳汁;LPS组小鼠组织腺泡内有游离的中性粒细胞并有散在的淡染乳汁。
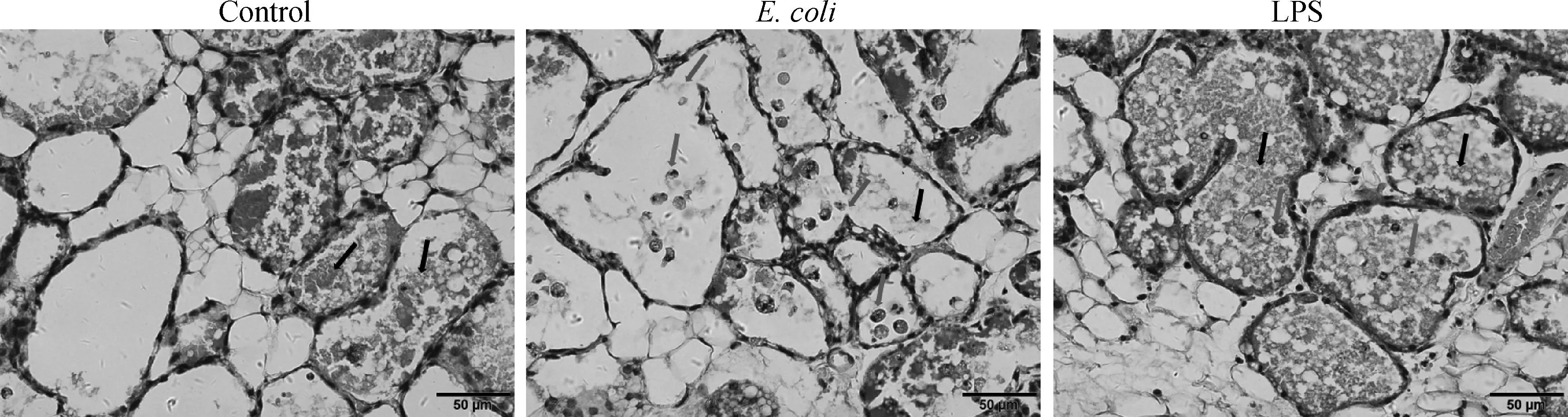
黑色箭头标示为乳汁;粉色箭头标示为中性粒细胞;绿色箭头标示被破坏的腺泡壁Black arrows indicate milk; The pink arrows indicate neutrophils; The green arrow indicates the damaged acinar walls
2.5 E.coli感染对奶牛乳腺上皮细胞和小鼠乳腺线粒体膜通透性及线粒体电子传递链的影响
相较于Control组,E.coli感染或LPS极显著降低了奶牛乳腺上皮细胞和小鼠乳腺组织内线粒体电子传递链复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ活性和ATP的含量以及奶牛乳腺上皮细胞D(520 nm)吸光值(图4A~G,P<0.05或P<0.01)。E.coli感染分别降低了奶牛乳腺上皮细胞D(520 nm)吸光值、线粒体电子传递链复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ活性和ATP含量的51.83%、40.22%、36.13%、60.67%、41.41%、57.48%和36.16%,LPS分别降低了奶牛乳腺上皮细胞D(520 nm)吸光值、线粒体电子传递链复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ活性和ATP含量的45.40%、38.18%、27.91%、43.42%、32.57%、43.20%和25.15%。此外,E.coli感染分别降低了小鼠乳腺线粒体电子传递链复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ活性和ATP含量的24.77%、71.45%、37.34%、39.38%、30.09%和27.38%,LPS分别降低了小鼠乳腺线粒体电子传递链复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ活性和ATP含量的19.37%、58.18%、26.74%、31.24%、32.57%、25.80%和13.11%。这些结果表明E.coli感染或LPS均破坏了奶牛乳腺上皮细胞和小鼠乳腺线粒体结构的完整性,膜通透性增加,膜的流动性降低,进一步降低了线粒体传递电子的效率,最终导致线粒体能量代谢紊乱。
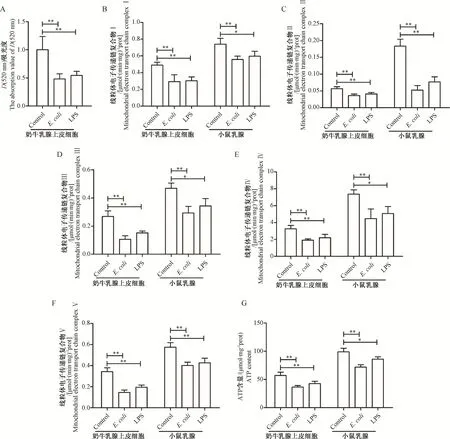
*.P<0.05;**.P<0.01。下同*.P<0.05;**.P<0.01. The same as below
2.6 E.coli感染对奶牛乳腺上皮细胞和小鼠乳腺线粒体融合/分裂的影响
相较于Control组,E.coli感染或LPS极显著降低了奶牛乳腺上皮细胞和小鼠乳腺内动力蛋白相关蛋白1(Drp1)和线粒体分裂蛋白1(Fis1)调控。此外,线粒体融合蛋白1(Mfn1)、线粒体融合蛋白2(Mfn2)和蛋白质视神经萎缩1(OPA1)mRNA表达(图5A~E,P<0.05或P<0.01)。E.coli感染分别降低了奶牛乳腺上皮细胞内Drp1、Fis1、Mfn1、Mfn2和OPA1 mRNA表达的38.00%、42.67%、35.00%、30.00%和44.00%,LPS分别降低了奶牛乳腺上皮细胞内Drp1、Fis1、Mfn1、Mfn2和OPA1 mRNA表达的32.00%、33.00%、32.67%、33.00%和35.33%。此外,E.coli感染分别降低了小鼠乳腺Drp1、Fis1、Mfn1、Mfn2和OPA1 mRNA表达的33.57%、32.20%、22.93%、31.37%和21.23%,LPS分别降低了小鼠乳腺Drp1、Fis1、Mfn1、Mfn2和OPA1 mRNA表达的23.70%、24.20%、23.73%、30.80%和24.97%。这些结果表明,E.coli感染或LPS均抑制奶牛乳腺上皮细胞和小鼠乳腺内线粒体的融合/分裂。
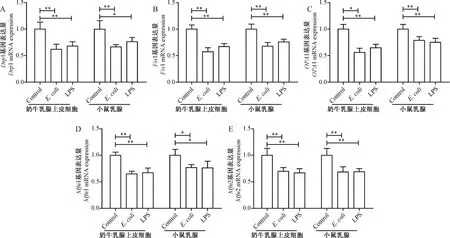
2.7 E.coli感染对奶牛乳腺上皮细胞线粒体生物发生的影响
相较于Control组,E.coli感染或LPS极显著降低了奶牛乳腺上皮细胞和小鼠乳腺内过氧化物酶增殖物激活受体γ共激活因子1α(PGC-1α)、核呼吸因子1(NRF1)和线粒体转录因子A(TFAM)和D-Loop的基因表达(图6A~D,P<0.05或P<0.01)。E.coli感染分别降低了奶牛乳腺上皮细胞内PGC-1α、NRF1、TFAM和D-Loop的基因表达的25.93%、27.33%、31.67%和35.40%,LPS分别降低了奶牛乳腺上皮细胞内PGC-1α、NRF1、TFAM和D-Loop的基因表达的37.30%、24.33%、30.67%和43.07%。此外,E.coli感染分别降低了小鼠乳腺PGC-1α、NRF1、TFAM和D-Loop的基因表达的20.40%、28.50%、24.37%和40.13%,LPS分别降低了小鼠乳腺PGC-1α、NRF1、TFAM和D-Loop的基因表达的26.70%、26.60%、32.60%和28.27%。这些结果表明,E.coli感染或LPS均减少了奶牛乳腺上皮细胞和小鼠乳腺内线粒体的生物发生。

A~E. 分别为PGC-1α、NRF1、TFAM和D-Loop mRNA表达水平A-E. The mRNA expression levels of PGC-1α, NRF1, TFAM and D-Loop mRNA expressions,respectively
3 讨 论
奶牛乳腺上皮细胞在奶牛乳腺应对细菌感染的过程中发挥着关键作用[14]。因此,奶牛乳腺上皮细胞已经成为研究奶牛乳腺炎发病机制的体外模型[15]。角18蛋白是中间纤维蛋白家族中的一员,构成多种上皮细胞骨架。因此,角18蛋白被认为是上皮细胞特有的标志物。本研究中,角18蛋白被用于鉴定奶牛乳腺上皮细胞系。研究结果表明,复苏后的第9代奶牛乳腺上皮细胞角18蛋白染色阳性,本研究与前期研究[16]一致,表明本研究中使用的细胞系为奶牛乳腺上皮细胞。此外,在本研究中,E.coli感染和LPS处理均可引起小鼠乳腺腺泡内出现游离的中性粒细胞,这表明E.coli感染和LPS处理均可诱发乳腺炎。因此,本试验中小鼠乳腺炎的模型已成功建立,可用于后续试验。
A~E. 分别为Drp1、Fis1、OPA1、Mfn1和Mfn2mRNA表达水平A-E. The mRNA expression levels of Drp1, Fis1, OPA1,Mfn1 and Mfn2, respectively 图5 E.coli感染或LPS对奶牛乳腺上皮细胞和小鼠乳腺线粒体融合/分裂的影响Fig.5 The effect of Escherichia coli infection or lipopolysaccharide on mitochondrial fusion/division in bovine mammary epithelial cells and mouse mammary gland
研究发现,ATP5A和LDH分别是线粒体和细胞浆的典型标志物[17]。本研究中,相对于细胞质部分,线粒体匀浆中ATP5A高度表达。此外,为鉴定线粒体匀浆的纯度,本研究检测了线粒体匀浆中LDH蛋白表达,发现Control组和E.coli组奶牛乳腺上皮细胞和小鼠乳腺中ATP5A高度表达,LDH也有部分表达,这表明线粒体匀浆纯度较高,仅有较少量的细胞质组分污染,可用于后续试验。
线粒体是机体多种细胞储存和供应能量的细胞器,研究发现线粒体大小、线粒体形态变化以及线粒体膜通透性可被用于衡量线粒体损伤及降解程度[18]。本研究中,E.coli感染的奶牛乳腺上皮细胞间隙增大,线粒体肿胀,线粒体嵴缺失且部分模糊消失。此外,E.coli感染显著降低了D(520 nm)吸光值。这些结果表明,E.coli感染破坏了奶牛乳腺上皮细胞线粒体结构的完整性,膜通透性增加,膜的流动性降低,从而导致了线粒体损伤。
线粒体主要通过涉及电子传递链的氧化磷酸化产生ATP,且能量代谢产物和标志酶可以用于判定线粒体的损伤程度[19]。线粒体电子传递链中电子的传递和氧化磷酸化等产能反应均发生在线粒体膜中,因此线粒体膜的损伤会造成能量代谢紊乱。在线粒体内,电子传递链复合物Ⅰ通过催化还原型烟酰胺腺嘌呤二核苷酸的氧化脱氢生成烟酰胺腺嘌呤二核苷酸[20]。电子传递链复合物Ⅱ通过催化琥珀酸氧化为延胡索酸,进一步使辅酶Q还原成2,6-二氯吲哚酚,最终导致O2减少[21]。电子传递链复合物Ⅲ是线粒体氧化磷酸化的必需物质,也是活性氧的主要来源,通过将还原型辅酶Q的氢传递给细胞色素c,生成还原型细胞色素c。电子传递链复合物Ⅳ是线粒体电子传递链的终端受体,主要通过氧化细胞色素c将O2转化为水[22]。电子传递链复合物V主要是促进产生细胞所需要的ATP能量[17]。本研究中,E.coli感染极显著降低了奶牛乳腺上皮细胞和小鼠乳腺内线粒体电子传递链复合物Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ活性和ATP的含量,与LPS处理的结果一致,说明E.coli感染主要通过LPS诱导线粒体膜损伤,进而干扰了线粒体的电子传递链,最终造成奶牛乳腺上皮细胞和小鼠乳腺能量代谢紊乱。
线粒体通过调控自身的分裂与融合来改变形态以满足细胞的需求。线粒体的分裂过程发生在线粒体外膜上,主要由Drp1和Fis1调控[23]。此外,Mfn1、Mfn2和OPA1共同介导线粒体内膜的融合[24]。在本研究中,E.coli感染极显著降低了奶牛乳腺上皮细胞和小鼠乳腺内Drp1、Fis1、Mfn1、Mfn2和OPA1 mRNA表达,与LPS的作用一致,表明E.coli感染主要通过LPS抑制奶牛乳腺上皮细胞和小鼠乳腺线粒体的融合/分裂。
线粒体生物发生是机体和细胞对能量需求作出的反应,能够显著增加线粒体的质量。线粒体内表达的蛋白多数由线粒体DNA转录和翻译。线粒体DNA仅包含两个非编码区,无内含子,非编码区包含位移环区(D-Loop)[25]。因此,D-Loop可以用于衡量线粒体DNA的总量。PGC-1α通过激活NRF1的转录调节TFAM的表达,进而促进线粒体蛋白的合成、线粒体DNA的复制和转录以及新线粒体的生物发生,提高线粒体的质量,以适应组织、器官增加的能量需求[26]。本研究中,E.coli感染极显著降低了奶牛乳腺上皮细胞和小鼠乳腺内PGC-1α、NRF1、TFAM和D-Loop的基因表达,与LPS的作用一致,这些结果表明,E.coli感染通过LPS减少了奶牛乳腺上皮细胞和小鼠乳腺内线粒体的生物发生。
4 结 论
本研究证明了E.coli感染主要通过LPS造成奶牛乳腺上皮细胞和小鼠乳腺线粒体能量代谢紊乱、抑制线粒体的分裂与融合以及减少线粒体的生物发生,进而造成线粒体损伤。因此,E.coli感染是通过诱导线粒体损伤造成奶牛乳腺炎,且线粒体损伤是造成乳腺损伤的重要原因之一。
