基于微生物组和宿主转录组整合分析香砂六君子汤对ETEC诱导断奶腹泻仔猪回肠损伤的调控机制
2024-03-01刘峻源曾雯玉韩雯珏刘彦泠徐雨婷杨贝妮王自力
肖 乐,刘峻源,曾雯玉,汪 芹,韩雯珏,刘彦泠,范 誉,徐雨婷,杨贝妮,肖 雄*,王自力*
(1.西南大学动物医学院,重庆 400715;2.浙江大学动物科学学院,杭州 310058;3.浙江大学动物医学中心,杭州 310058)
仔猪断奶后腹泻是全球养猪业最具威胁的疾病之一,也是仔猪死亡的主要原因,给养猪业造成巨大的经济损失。研究发现产肠毒素大肠杆菌(enterotoxigenicEscherichiacoli, ETEC)是引起断奶仔猪腹泻的最常见的食源性病原[1]。主要表现为水样腹泻,伴有精神沉郁、食欲不振和脱水等[2]。生产上常用抗生素和饲料添加氧化锌来防治仔猪腹泻,然而抗生素和医学水平的氧化锌长期过度使用会导致细菌耐药性的产生以及土壤中锌浓度升高,对人类健康和环境产生不利影响[3-4]。因此,寻找替代性预防和治疗ETEC感染的药物及方法对养猪业生产至关重要。
中兽医理论认为,断奶仔猪腹泻的主要病因是脾虚湿盛,脾胃虚弱是断奶仔猪腹泻的内因,湿盛则是外因,造成饲料腐熟无力,水谷不化,合污而下,形成腹泻[5-6]。香砂六君子汤出自《古今名医方论》,药方组成包括党参、白术、茯苓、甘草、陈皮、半夏、木香、砂仁,在补脾健胃、燥湿化痰及补中益气方面功效显著[7-8]。研究表明,香砂六君子汤可通过多靶点有效调节胃肠道酸碱度,抑制促炎因子的表达从而缓解肠道炎症反应[9-10]。洪文文[11]发现香砂六君子汤能有效提高机体免疫功能,主要是通过调控淋巴细胞亚群比例和免疫相关细胞因子水平[11]。另外,在日粮中添加香砂六君子汤能有效减轻ETEC诱导的断奶仔猪腹泻,促进小肠黏膜发育[12]。本研究通过灌服香砂六君子汤治疗ETEC诱发的断奶仔猪腹泻,从临床表现、肠道炎性损伤、转录组学、微生物组学和MAPK信号通路综合评估香砂六君子汤对ETEC致断奶仔猪腹泻的防治效果。
1 材料与方法
1.1 主要试剂及仪器
主要试剂:ETEC菌株(CVCC196,O8:H19:K88ac)购自中国兽医微生物菌种保藏管理中心;中药党参、白术、茯苓、炙甘草、陈皮、制半夏、木香、砂仁购自重庆众妙药业有限公司;qRT-PCR荧光定量检测试剂盒(G892)购自Abm公司;BCA蛋白浓度检测试剂盒(P0010 S)、RIPA裂解液(P0013B)、蛋白酶抑制剂和磷酸酶抑制剂(P1045)购自碧云天生物技术有限公司;抗体β-Actin(4970 S)、p-ERK(9101 S)、ERK(9102 S)、p-p38(9215 S)、p38(8690 S)、p-JNK(9251 S)、JNK(9252 S)和Anti-Rabbit IgG(7074 S)购自CST公司;Anti-Mouse IgG(#31430)购自Invitrogen公司。
主要仪器:-80 ℃超低温冰箱(DW-HL860)购自美菱生物医疗;旋转蒸发仪(RE-5286A)购自上海亚荣生化仪器厂;恒温细菌培养摇床(THZ-100B)购自上海市一恒科学仪器有限公司;石蜡切片机(RM-3375)购自Leica公司;光学显微镜(BX53)购自Olymus公司;测序系统(NovaSeqTM 6000 Sequencing System)购自illumnia公司;实时荧光定量PCR仪(7500/Bio-RAD icyoler)购自Bio-Rad公司;电泳仪(Mini-protean tetra)购自Bio-Rad 公司;显影仪(GelDoc XR +)购自Bio-Rad公司。
1.2 香砂六君子汤提取方法
取香砂六君子汤(党参193 g、白术193 g、茯苓193 g、炙甘草65 g、陈皮97 g、制半夏97 g、木香65 g、砂仁97 g)1 000 g,按照1∶10和1∶8的比例先后加水煮沸后,改文火煮沸45 min,合并2次滤液,采用旋转蒸发仪于80 ℃负压蒸发浓缩至1 g生药·mL-1,冷却后分装并置于4 ℃冰箱保存备用[12]。
1.3 动物分组及处理
24头21日龄杜×长×大三元杂交雄性断奶仔猪(重庆市盈和农业科技有限公司)在25 ℃左右,40%~65%的相对湿度下饲养,试验期间给与充足的清洁饮水和无抗饲料。适应性饲喂3 d后,将仔猪随机分为对照组(CON组)、模型组(MOD组)和香砂六君子汤组(XS组)。连续14 d给XS组灌服香砂六君子汤(1 mL·kg-1,1 g·mL-1),其余组灌服等量无菌水,第15天给MOD组和XS组仔猪按1 mL·kg-1体重连续3 d灌服1011CFU·mL-1的ETEC菌液,XS组继续灌服香砂六君子汤。第18天仔猪安乐死,采集各组仔猪肠道组织及回肠内容物样本。
1.4 腹泻评分
攻毒后每日观察仔猪肛周及粪便,按照腹泻评分标准进行评分并记录。腹泻评分标准见表1[13]。

表1 粪便评分标准
1.5 肠道组织病理学检查
取40 mL·L-1中性甲醛固定后的回肠组织制作石蜡切片,HE染色,于光学显微镜下观察肠道组织病理学变化,测量肠绒毛高度与隐窝深度并计算肠绒毛高度与隐窝深度比(V/C)。每个肠段切片选取6根最长绒毛及6处最深隐窝进行测量,取平均值进行统计。
1.6 qRT-PCR法检测回肠组织炎性因子mRNA转录水平
按照RNA提取试剂盒步骤提取总RNA,反转录合成cDNA。根据NCBI数据库查找目的基因序列,利用Primer Premier 5.0设计引物,由华大基因合成。单个样本设计3个复孔,记录Ct值,采用2(-ΔΔCt)法计算目的基因的相对转录量。相关引物信息见表2。

表2 引物序列信息
1.7 RNA序列分析
用Trizol法提取仔猪回肠组织的总RNA并对RNA进行纯化、片段化、反转录、扩增以及质量控制,然后在Illumina平台上进行测序。测序结果经过Cutadapt过滤后,使用HISAT2软件与仔猪参考基因组进行比较并筛选。基因表达的差异性统计分析由DESeq进行,参数为|fold change|>2且P<0.05。使用R语言ggplots2软件包绘制差异表达基因的火山图。使用R语言Pheatmap软件包对样品进行双向聚类分析。利用GO数据库(http:∥www.geneontology.org/)和KEGG数据库(http:∥wego.genomics.org.cn)分别进行GO富集分析和KEGG富集分析。由上海派森诺生物科技股份有限公司完成测序,所有数据分析在派森诺基因云平台进行(https:∥www.genescloud.cn)。
1.8 回肠内容物16S rDNA高通量测序
取-80 ℃冻存的回肠内容物,置于盛有干冰的保温箱后送往上海派森诺生物科技股份有限公司进行16S rDNA V3-V4区高通量测序,引物为 F:5′-ACTCCTACGGGAGGCAGCA-3′,R:5′-GGACTACHVGGGTWTCTAAT-3′。采用Illumina平台对群落DNA片段进行双端测序,运用 QIIME2 dada2方法进行去引物,质量过滤,去噪,拼接和去嵌合体等步骤,并对ASV/OTU表进行抽平。通过计算Alpha多样性指数(包括Chao1指数、Observed_species指数、Shannon指数和Simpson指数等)评价微生物种类的丰富度及均匀度。采用非量度多维尺度分析(NMDS)评估Beta多样性。对组间门、纲、目、科、属水平的类群丰度进行统计学比较。采用LEfSe分析组间肠道微生物的差异,并找出可能的标记物种。基于KEGG数据库,采用PICRUSt进行微生物组功能预测分析。
1.9 Western blot法检测回肠炎性信号通路MAPK相关蛋白的表达
冻存的回肠组织液氮充分研磨后,按照每20 mg组织加入200 μL含蛋白酶抑制剂及磷酸酶抑制剂的RIPA裂解液进行裂解,充分裂解后4 ℃,12 000 r·min-1离心取上清。采用BCA蛋白浓度测定试剂盒测定蛋白浓度后将蛋白煮沸变性,随后进行SDS-PAGE凝胶电泳,转膜,封闭,分别用p-p38、p38、p-JNK、JNK、p-ERK、ERK和β-Actin一抗4 ℃孵育过夜,洗膜3次,二抗室温孵育2 h,洗膜3次后滴加ECL显色液显影,采用Image J软件分析蛋白条带灰度值。
1.10 统计学分析
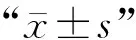
2 结 果
2.1 香砂六君子汤缓解ETEC诱导的断奶腹泻仔猪回肠炎性损伤
与CON组相比,MOD组断奶仔猪腹泻评分极显著升高(P<0.01),与MOD组相比,XS组腹泻评分极显著下降(P<0.01)(图1 A)。CON组回肠组织结构完整,肠上皮绒毛排列整齐无脱落,腺体及隐窝清晰且丰富;与CON组相比,MOD组回肠组织肠上皮绒毛脱落严重,固有层结构疏松,腺体稀疏且结构不完整,V/C值极显著下降(P<0.01);与MOD组相比,XS组回肠组织结构完整,腺体丰富且排列整齐,V/C值极显著升高(P<0.01)(图1B、C)。与CON组相比,MOD组回肠组织IL-1β、IL-6和IL-8 mRNA表达量极显著升高(P<0.01);与MOD组相比,XS组回肠组织IL-1β、IL-6和IL-8 mRNA表达量显著或极显著降低(P<0.01)(图1D~F)。
2.2 香砂六君子汤对ETEC诱导的断奶腹泻仔猪回肠特征基因和通路的调控作用
DESeq分析显示,MOD组与XS组存在110个差异表达基因,其中XS组相对于MOD组上调的差异基因22个,下调基因88个(P<0.05)(图2A)。上调基因包括TNFAIP8L2(先天免疫反应的负调节剂)、TRIM67(NF-κB信号通路的抑制因子)等;下调基因包括CXCL2(参与中性粒细胞募集)、EGF(调节肠道炎症的表皮生长因子)、NOX1(诱导氧化应激和炎性因子产生)、CCL28(黏膜趋化因子)、FABP2(脂肪酸结合蛋白2)、FABP6(脂肪酸结合蛋白6)、IL1RAP(白细胞介素1受体辅助蛋白)、CEBPB(调节免疫和炎症反应)等(图2B)。GO分析表明,MOD组与XS组之间的差异基因主要富集于细胞外区域、对细菌和外部刺激的免疫反应、体液免疫等(图2C)。KEGG富集分析表明,MOD组与XS组之间富集的信号通路包括MAPK信号通路、PPAR信号通路、细胞因子-细胞因子受体相互作用和NOD样受体信号通路等(图2D)。
2.3 香砂六君子汤对ETEC诱导的断奶腹泻仔猪肠道微生物的调控
采用Illumina平台对16S rDNA的V3-V4区域进行测序分析CON、MOD和XS组(n=3)回肠内容物的菌群结构,9个样本共检测到819 702个原始读段,平均每个样本检测到(91 078±10 232)个原始读段。Alpha多样性分析显示,Chao1、Simpson、Observed species和Shannon指数无显著性差异(P>0.05),即各组间肠道微生物Alpha多样性无统计学差异(图3A)。NMDS分析结果显示,各组微生物存在明显聚类趋势(图3 B)。为了研究肠道微生物群的变化情况,对测序鉴定出的各组主要分类群的相对丰度进行了比较。在门水平上,与CON相比,MOD组变形菌门极显著上调(P<0.01),厚壁菌门极显著下调(P<0.01);与MOD相比,XS组变形菌门极显著下调(P<0.01),厚壁菌门极显著上调(P<0.01)。在属水平上,与CON相比,MOD组乳酸菌属下调,志贺氏菌属、盐单胞菌属、梭菌属、放线杆菌属和拟杆菌属上调,但无统计学差异(P>0.05);与MOD相比,XS组乳酸菌属上调,志贺氏菌属、盐单胞菌属、梭菌属、放线杆菌属和拟杆菌属下调,但无统计学差异(P>0.05)(图3C~E)。

A. 腹泻评分;B. 回肠组织切片;C. 肠绒毛高度与隐窝深度比值(V/C值);D. IL-1β mRNA水平;E. IL-6 mRNA水平;F. IL-8 mRNA水平。*/**表示与CON比较,*.P<0.05,**. P<0.01,#/##表示与MOD比较,#.P<0.05,##. P<0.01,下同 A. Diarrhea score; B. Ileal tissue sections; C. The ratio of villus height to crypt depth (V/C value); D. IL-1β mRNA level; E. IL-6 mRNA levels; F. IL-8 mRNA levels. */** indicates comparison with CON group, *.P<0.05 and **.P<0.01, #/## indicates comparison with MOD group, #. P<0.05 and ##. P<0.01, the same as below 图1 香砂六君子汤缓解ETEC诱导的断奶仔猪回肠炎性损伤Fig.1 Xiangsha Liujunzi decoction alleviates ETEC-induced inflammatory injury in the ileum of weaned piglets
为了进一步分析肠道微生物的变化,使用LEfSe分析各组间的差异,结果显示,CON组的Lactobacillaceae富集,MOD组的Shigella富集,XS组的Deinococcus和Eubacterium富集(LDA评分>3.0,P<0.05)(图3E~G)。采用基于KEGG的 PICRUSt2分析预测菌群功能,结果显示脂多糖合成、生物素代谢和胆汁酸合成等通路存在明显差异(图3H)。
2.4 香砂六君汤对ETEC致断奶腹泻仔猪回肠组织MAPK信号通路的调控
与CON组相比,MOD组仔猪回肠组织在ETEC感染后p-p38/p38和p-JNK/JNK比值显著或极显著升高(P<0.01或P<0.05),p-ERK/ERK比值略有升高,但无统计学差异(P>0.05);与MOD组相比,XS组p-p38/p38和p-ERK/ERK比值极显著降低(P<0.01),p-JNK/JNK比值略有降低,但无统计学差异(P>0.05)(图4)。
3 讨 论
ETEC是诱发断奶仔猪腹泻的主要病原之一,主要定植在断奶仔猪的肠道中,可分泌肠毒素破坏肠道屏障并诱发肠道炎症[14]。研究发现,断奶仔猪感染ETEC后除表现明显的腹泻症状外,肠绒毛和隐窝发育阻滞,导致对营养成分的消化吸收能力下降[15-16]。同时,ETEC还诱导断奶仔猪肠道肥大细胞(MCs)的活化和促进炎性细胞因子(如IL-1β、IL-6和IL-8等)的合成和分泌,诱发急性肠道炎症[17-18]。本研究发现,断奶仔猪灌服ETEC后出现明显的腹泻症状,回肠组织结构损伤明显,肠道发育受阻(V/C值下降),炎性因子IL-1β、IL-6和IL-8表达升高,表明ETEC致断奶仔猪腹泻模型构建成功。香砂六君子汤灌服后腹泻仔猪的腹泻评分下降,腹泻得到有效控制,回肠组织结构恢复完整,V/C值升高,炎性因子IL-1β、IL-6和IL-8表达降低,表明香砂六君子汤可有效缓解ETEC诱导的断奶仔猪腹泻,抑制肠道炎症反应,促进肠道发育。
转录组学分析结果显示,MOD组与XS组存在110个差异表达基因,其中XS组相对于MOD组上调的差异基因22个,下调基因88个。其中TNFAIP8L2和TRIM67表达上调,CXCL2、EGF、NOX1、CCL28、FABP2、FABP6、IL1RAP和CEBPB表达下调。研究发现,TNFAIP8L2、CCL28和IL1RAP参与MAPK信号通路的活化,从而调节炎症反应的强度,其中TNFAIP8L2负调节Toll样受体(TLR)和T细胞受体的功能[19-20],CCL28上调Bcl-2和β-catenin表达[21],IL1RAP辅助IL33发挥作用[22]。CXCL2和EGF主要与炎性细胞的募集以及炎症反应中激活的免疫细胞类群相关[23-24]。CEBPB通过促进microRNA-145来活化DUSP6,从而加剧肠道炎症[25]。上述差异基因的功能作用主要聚焦于免疫与炎症,其中多个基因功能与MAPK信号通路关系密切,KEGG通路差异富集分析也表明,MAPK信号通路在香砂六君子汤治疗ETEC致断奶仔猪腹泻中发挥关键作用。
ETEC除了直接引起断奶仔猪腹泻外,同时会影响断奶仔猪肠道菌群组成,对腹泻的发生也有重要影响[25-26]。肠道菌群是与宿主最大的共生生态系统,在维持肠道稳态方面发挥着重要作用[27]。在本研究中,NMDS分析结果显示,ETEC攻毒后肠道菌群Beta多样性发生明显改变,在香砂六君子汤治疗后肠道菌群Beta多样性再次改变并偏向对照组,表明香砂六君子汤可缓解ETEC导致菌群Beta多样性变化。具体而言,ETEC感染组仔猪肠道菌群中的厚壁菌门丰度急剧下降,而变形菌门丰度上升,香砂六君子汤能有效逆转这种变化。研究表明,变形菌门在正常肠道菌群结构中占比较低,且多数为致病菌,其异常升高标志着肠道菌群失调[28-29]。在属水平上,ETEC感染组仔猪乳酸菌属丰度下降,志贺菌属丰度上调,香砂六君子汤能有效逆转这种变化。乳酸菌属成员大都属于有益菌,在抑制致病菌,防止细胞凋亡,增强肠道屏障功能中发挥作用[30-31],志贺菌属成员是与大肠杆菌密切相关的腹泻病原体,长期以来是全球重要的公共卫生问题的罪魁祸首[32-33]。基于KEGG信号通路的菌群结构差异功能预测发现脂多糖合成,生物素代谢,胆汁酸合成等信号通路差异显著。研究发现,肠道菌群差异导致生物素缺乏可导致炎症性肠病表型的肠道炎症[34-35],胆汁酸可活化MAPK(包括ERK和p38 MAPK)信号通路,从而参与炎症反应的调控[36-37]。
结合转录组学和微生物组学分析结果可知,MAPK信号通路在香砂六君子汤对ETEC致断奶仔猪腹泻中发挥了重要作用。MAPK信号通路被证明在肠道炎性损伤中扮演着重要的角色[38]。MAPK信号通路通过p38、ERK和JNK的三个级联激活转录因子C-fos和C-Jun,并促进它们转移到细胞核中形成转录因子AP-1并调节IL-6和TNF-α等炎性因子的转录,最终诱发肠道炎症[39-40]。本研究发现ETEC攻毒后JNK和p38 MAPK信号通路被激活,香砂六君子汤则能有效抑制ERK和p38 MAPK的活化,表明香砂六君子汤可通过抑制MAPK信号通路抑制ETEC诱导的断奶仔猪肠道炎症。
4 结 论
ETEC感染可诱发断奶仔猪腹泻,破坏回肠组织结构,抑制回肠发育,同时能引起肠道菌群紊乱,降低有益菌丰度,并通过激活MAPK信号通路引起肠道炎性损伤;香砂六君子汤可有效缓解ETEC诱导的断奶仔猪腹泻,提高肠道菌群中有益菌的丰度,逆转ETEC诱发的菌群结构的改变,并可通过抑制MAPK信号通路的激活,从而缓解ETEC诱导的断奶仔猪肠道炎性损伤。
