利用1型糖尿病小鼠模型分析犬成纤维生长因子21的长效降糖效果
2024-03-01郭云鹏姜兴昊张立夏任桂萍尹杰超
郭云鹏,牛 顿,李 爽,姜兴昊,张立夏,任桂萍,尹杰超
(东北农业大学生命科学学院,哈尔滨 150030)
犬糖尿病(canine diabetes mellitus,CDM)是一种较为常见的内分泌性代谢病,其主要临床表现包括:多饮、多尿、多食和消瘦[1],据统计犬糖尿病的发病率达到了0.3%~0.6%,且呈逐年上涨的趋势[2]。其主要病因是由胰岛素绝对或相对不足而引起的糖代谢障碍,从而继发脂肪、蛋白质、维生素、水及电解质的代谢紊乱[3-4]。
CDM是一个复杂的多因素疾病,根据临床上犬对胰岛素治疗的表现,可以分为胰岛素依赖型糖尿病(insulin-dependent diabetes mellitus, IDD)和胰岛素非依赖型糖尿病(insulin resistance diabetes,IRD)[5-6]。
IDD多发于5~12岁的中老年犬,类似于人类的1型糖尿病(T1DM),二者的病理过程均为胰岛细胞的进行性破坏造成胰岛素分泌减弱至完全丧失,但二者的致病机制却存在一定的差异。犬IDD表现为原因不明的特发性胰岛β细胞损害,且该过程很少发生在幼犬及青年犬中[1]。同时无论是何种原因(生长/类固醇激素拮抗、妊娠、肥胖、药物、炎症以及细胞信号传导障碍)所引起的IRD,因为长期高血糖造成了胰岛β细胞的耗竭,原发性的IRD最终转归为继发性IDD[7]。由此可见,治疗CDM的关键是长期维持安全的血糖水平及胰岛β细胞的数量与活性。
成纤维细胞生长因子-21(fibroblast growth factor 21,FGF-21)是一种肽类激素,主要在肝、胰腺和脂肪等组织中表达,可调节机体的能量平衡、减轻体重和改善血糖[8-9]。许多研究表明,FGF-21改善肥胖与2型糖尿病(T2DM)的血糖及代谢状态同时对其并发症也有显著的预防与治疗作用[10]。据报道,FGF-21通过加速糖酵解,改善葡萄糖摄取和抑制糖异生从而降低T1DM患者的血糖,同时恢复棕色脂肪的功能,而且还能抑制1型糖尿病患者的并发症[11]。此外,Xu等[12]研究发现犬源化FGF-21(cFGF-21)可通过调节stat3信号通路改善与抑制肝糖异生相关的高血糖的机制,另外通过激活细胞外信号调节激酶 (ERK)1/2和Akt信号通路保护β细胞免于凋亡。因此,FGF-21是一种非常具有应用前景的犬糖尿病治疗候选药物。
在啮齿类动物和灵长类动物中,FGF-21的体内半衰期非常短约为1 h,并且易在体外和体内发生蛋白水解降解[13]。小分子量的FGF-21蛋白(约22 ku)容易通过肾小球过滤而消除[14-15]。因此,增加FGF-21半衰期和稳定性是其临床应用的瓶颈问题。
细胞穿膜肽 (cell penetrating peptide,CPPs) 是一类具有穿过质膜能力的短肽(5~30 aa),被用于以“蛋白质转导”的方式有效地帮助“分子货物”在活细胞中内化,已经成为最有前途的蛋白质递送载体[15]。细胞穿膜肽可根据理化性质分为三类:阳离子肽、两亲性肽和疏水性肽[16]。精氨酸的胍基在富含精氨酸的CPP的细胞穿透活性中起着重要作用,并且精氨酸的同型寡聚体(7~12个精氨酸)比天然富含精氨酸的CPP(如TAT 48-60)明显更有效[17]。据报道,Fc融合蛋白药物是将蛋白药物与免疫球蛋白G(IgG)的可结晶片段(Fc)域相结合从而改善蛋白药物的血清半衰期[18]。本研究分别将犬源IgG的Fc、11个精氨酸组成的穿膜肽R11(RRRRRRRRRRR)和HIV的反式激活调控蛋白(transactivating regulatory protein,TAT)穿膜肽TAT 47-57(YGRKKRRQRRR)与cFGF-21连接,构建融合蛋白Fc-cFGF-21、R11-cFGF-21和TAT-cFGF-21。通过T1DM小鼠模型,来比较这三种重组蛋白药物治疗T1DM的药效差异,为研发治疗犬糖尿病长效性降糖药物提供重要的前期试验数据。
1 材料与方法
1.1 材料
1.1.1 基因和细胞 基因R11-cFGF-21、Fc-cFGF-21、TAT-cFGF-21由上海生工公司合成;pSUMO-cFGF-21质粒和HepG2细胞由东北农业大学生物制药教研室提供。
1.1.2 实验动物 6周龄健康的C57BL/6雄性小鼠(n=70),购自辽宁长生生物技术股份有限公司(合格证号:No.210726220100493528)。所有动物都饲养在22~25 ℃的可控温度和55%~65%的相对湿度下,每12 h进行光照/黑暗循环,自由进食和饮水。
1.1.3 主要试剂 T4 DNA连接酶购自New England BioLabs公司;标准分子量蛋白Marker购自Fermentas 公司限制性内切酶购自TaKaRa 公司;IL-1β ELISA试剂盒购自Andygee公司;IL-10 ELISA 试剂盒购自Andygee公司;IL-17A ELISA试剂盒购自Andygee公司;胰岛素ELISA试剂盒购自Andygee公司;SOD试剂盒购自南京建成生物工程研究所;ROS试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 cFGF-21的制备及体外活性检验 将R11-cFGF-21、Fc-cFGF-21和TAT-cFGF-21基因分别与pSUMO载体进行连接获得重组质粒,然后重组质粒分别转化到Rosetta受体细胞中。选择鉴定正确的质粒接种于含氨苄青霉素(100 μg·mL-1)的液体培养基中,37 ℃,100 r·min-1,培养6 h。以1∶100比例接种于8 L的发酵罐中,当菌液OD600 nm升至7~8时,加入诱导剂IPTG(终浓度0.25 mmol·L-1),6 h后收集菌体。而后利用AKTA purifier 100系统对表达产物进行第一次亲和层析,将SUMO蛋白酶按1∶50的比例加入蛋白中进行酶切,再通过镍柱二次亲和去除SUMO获得纯度为60%的目标蛋白。
将cFGF-21、Fc-cFGF-21、R11-cFGF-21和TAT-cFGF-21蛋白稀释至终浓度为10、100和1 000 nmol·L-1并与饥饿12 h HepG2细胞于37 ℃共同培养24 h。用GOD-POD法检测培养基中残留的葡萄糖含量。培养结束后取2 μL上清液加到200 μL检测液中,设立3个复孔检测剩余葡萄糖量,避光处理8 min后,检测其OD490 nm值,通过公式计算出葡萄糖的消耗率,统计学分析蛋白的降糖活性。细胞中葡萄糖的吸收率公式如下:
葡萄糖浓度(mmol·L-1)=(A样品/A标准)×5.55;细胞葡萄糖消耗率=[(C空白葡萄糖-C给药葡萄糖)/C空白葡萄糖]×100%。
1.2.2 动物模型与治疗方案 建立T1DM模型,首先制备链脲佐菌素(STZ)溶液,STZ溶解在无菌柠檬酸盐缓冲液(0.05 mol·L-1柠檬酸钠,pH4.5)中;而后将饥饿12 h的小鼠以60 mg·kg-1的剂量进行腹腔注射,每天注射1次,3 d后测定小鼠血糖,小鼠血糖浓度>16.67 mmol·L-1则认为造模成功[19]。
分别选取T1DM模型小鼠(40只)和空白对照小鼠(6只)。空白对照组(n=6):生理盐水注射空白组小鼠。模型组(n=8):生理盐水治疗的T1DM模型小鼠。有研究结果表明50 nmol·kg-1FGF-21的剂量治疗糖尿病小鼠是安全有效的[12]。因此,设立4个治疗组(n=8):分别用上述4种重组蛋白(50 nmol·kg-1)治疗的T1DM模型小鼠。本试验分为3个阶段:第一阶段,每天治疗一次(第1~14天);第二阶段,每3 d治疗一次(第15~29天);第三阶段,每5 d治疗一次(第30~44天)。
1.2.3 糖尿病小鼠的血糖、OGTT及HbA1c的检测 治疗过程中,每隔3 d对空腹过夜的小鼠进行尾部采血检测血糖。保证每次测量的小鼠都空腹12 h,为小鼠尽量建立统一的条件。在每个试验阶段结束当天检测小鼠12 h内血糖波动水平(自由饮食),早上8:00开始第一次检测,此后每隔4 h检测一次小鼠血糖。试验结束前对所有小鼠空腹12 h后进行口服葡萄糖耐量试验(oral glucose tolerance test, OGTT)。给每只小鼠喂食新鲜葡萄糖溶液(2 g·kg-1),分别在摄入后0、30、60、90、120 min测量血糖。采集各组小鼠血清测定其HbA1c(东北农业大学校医院测定)的含量和胰岛素水平(胰岛素ELISA试剂盒,北京安迪基因生物技术有限公司)。
1.2.4 氧化应激和炎症因子检测 在保存的胰腺组织加入放射免疫沉淀试验(radioimmune precipitation assay,RIPA)溶液和蛋白酶抑制剂(上海碧云天生物技术有限公司),充分研磨组织,收集上清液。胰腺的超氧化物歧化酶(superoxide dismutase, SOD)和活性氧(reactive oxygen species,ROS)通过SOD测定试剂盒和ROS测定试剂盒。白细胞介素-1β(IL-1β)、白细胞介素17(IL-17A)和白细胞介素10(IL-10)采用IL-1β ELISA试剂盒、IL-17A ELISA试剂盒和IL-10 ELISA试剂盒测定。
1.2.5 实时荧光定量PCR 分别取各组小鼠肝、肾、肠和脂肪等组织,用TRIzol法提取总RNA,逆转录为cDNA。通过实时荧光定量PCR检测肝中靶基因葡萄糖6磷酸酶(G6pase)、磷酸烯醇丙酮酸羧激酶(PEPCK)、葡萄糖激酶(GK)、葡萄糖转运蛋白1(GLUT 1)、葡萄糖转运蛋白4(GLUT 4)的转录水平;肠和肾中靶基因葡萄糖钠协同转运蛋白1(SGLT 1)和钠-葡萄糖协同转运蛋白2(SGLT 2)的转录水平;脂肪组织中过氧化物酶体增殖物激活受体γ(PPARγ)的转录水平。引物序列见表1。

表1 Real-time PCR引物
1.2.6 肝功能及脂代谢检测 血样以3 000 r·min-1离心 10 min分离血清。随后,将各组血清样本送至东北农业大学校医院进行天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL)和低密度脂蛋白(LDL)的检测。
1.2.7 HE染色 将小鼠的胰腺组织在4%多聚甲醛中固定48 h。然后将部分组织包埋在石蜡中并用超薄半自动切片机(上海Leica Microsystems公司)切片。用苏木精和伊红染色后,用光学显微镜观察每张载玻片并拍照。
2 结 果
2.1 重组cFGF-21蛋白制备
SDS-PAGE 分析结果表明,带有SUMO标签的重组蛋白SUMO-cFGF-21、SUMO-R11-cFGF-21、SUMO-TAT-cFGF-21、SUMO-Fc-cFGF-21相对分子质量分别是39、41、41和69 ku;去标签后的cFGF-21、R11-cFGF-21、TAT-cFGF-21、Fc-cFGF-21蛋白相对分子质量分别为21、23、23和50 ku(图1a~h)。体外细胞葡萄糖吸收的结果表明,与对照组相比,3个浓度的cFGF-21、Fc-cFGF-21、R11-cFGF-21和TAT-cFGF-21以剂量依赖性方式显著增加HepG2细胞中的葡萄糖摄取(P<0.01)(图1i)。但是,在相同浓度下,cFGF-21、Fc-cFGF-21、R11-cFGF-21和TAT-cFGF-21在促进葡萄糖摄取方面无显著差异。

a~d. SUMO-cFGF-21、SUMO-R11-cFGF-21、SUMO-TAT-cFGF-21和SUMO-Fc-cFGF-21的表达;e~h. cFGF-21、R11-cFGF-21、TAT-cFGF-21和Fc-cFGF-21的纯化;i. 四种重组cFGF-21对HepG2细胞葡萄糖吸收的影响,与空白组相比,**. 差异极显著(P<0.01)a-d. Expression of SUMO-cFGF-21, SUMO-R11-cFGF-21, SUMO-TAT-cFGF-21 and SUMO-Fc-cFGF-21;e-h. Purification of cFGF-21, R11-cFGF-21, TAT-cFGF-21 and Fc-cFGF-21; i. Effects of four kinds of recombinant cFGF-21 on glucose uptake in HepG2 cells. Compared with the control group,**. Extremely significant difference (P<0.01)
2.2 糖尿病鼠血糖、血糖波动情况和HbA1c检测
在整个研究过程中,cFGF-21、Fc-cFGF-21、R11-cFGF-21在试验的第一阶段能够将血糖水平维持在接近正常水平,将血糖从最初的(20.03±1.98)、(19.45±1.57)和(19.63±1.62)mmol·L-1分别降低到为(8.82±0.47)、(9.85±0.61)和(9.24±0.95)mmol·L-1。TAT-cFGF-21在试验的第一阶段将血糖从最初的(20.03±1.65)mmol·L-1降低到(12.2±0.95)mmol·L-1(图2a),与其他治疗组相比效果略差。末次给药24 h后,cFGF-21、Fc-cFGF-21和R11-cFGF-21组血糖在12 h内波动趋势相近(10~14 mmol·L-1),与cFGF-21组相比,TAT-cFGF-21组在12 h内血糖水平较高(P<0.01),波动较大(14~21 mmol·L-1)(图3a)。

a. 第一阶段小鼠血糖检测;b. 第二阶段小鼠血糖检测;c. 第三阶段小鼠血糖检测。与cFGF-21组相比,*. 差异显著(P<0.05);**. 差异极显著(P<0.01)a. The first stage of blood glucose detection in mice; b. The second stage of blood glucose detection in mice; c. The third stage of blood glucose detection in mice. Compared with the cFGF-21 group,*. Significant difference(P<0.05);**. Extremely significant difference (P<0.01)

a~c分别为第一阶段、第二阶段和第三阶段结束后12 h内血糖波动检测;d. OGTT;e. HbA1c水平。与cFGF-21组相比,*. 差异显著(P<0.05);**. 差异极显著(P<0.01)a-c are the blood glucose fluctuation tests within 12 hours after the end of phase 1, phase 2 and phase 3, respectively; d. OGTT; e. HbA1c levels. Compared with the cFGF-21 group,*. Significant difference(P<0.05);**. Extremely significant difference(P<0.01)
在试验的第二阶段,每3 d给药一次,用药时间间隔变大,cFGF-21、TAT-cFGF-21治疗组的血糖较Fc-cFGF-21和R11-cFGF-21有明显上升。cFGF-21、TAT-cFGF-21组的血糖分别上升到(15.1±0.53)和(17.86±0.92)mmol·L-1,而Fc-cFGF-21、R11-cFGF-21组的血糖无显著增长,仍能保持在(10.82±0.57)和(11.2±0.67)mmol·L-1(图2b)。末次给药72 h后,cFGF-21、Fc-cFGF-21和R11-cFGF-21组血糖在12 h内波动趋势相近(11~15 mmol·L-1),与cFGF-21组相比,TAT-cFGF-21组在12 h内血糖显著升高(P<0.01),保持高水平波动(19~24 mmol·L-1)(图3b)。
在试验的第三阶段,每5 d治疗一次,cFGF-21、TAT-cFGF-21组血糖从第30天(即第一次连续5 d没有给药)开始升高,两组血糖显著高于Fc-FGF-21、R11-FGF-21组(P<0.01)(图2c)。末次给药120 h后,与cFGF-21组相比,Fc-cFGF-21和R11-cFGF-21血糖仍维持在较低水平(P<0.01),且波动趋势相近(12~16 mmol·L-1),而TAT-cFGF-21组血糖仍保持在较高水平(P<0.01),血糖保持高水平波动(20~24 mmol·L-1)(图3c)。
与模型组相比,cFGF-21、Fc-cFGF-21和R11-cFGF-21组的HbA1c水平分别显著降低了35.15%、46.67%和46.96%(P<0.01)。与cFGF-21组相比,Fc-cFGF-21和R11-cFGF-21组的HbA1c水平分别显著降低了11.68%和11.81%(P<0.01)(图3e)。以上结果表明,R11-cFGF-21和Fc-cFGF-21长效降糖效果显著优于cFGF-21和TAT-cFGF-21。
2.3 cFGF-21改善糖尿病鼠的口服葡萄糖耐量
与模型组相比,R11-cFGF-21和Fc-cFGF-21组的OGTT显著改善,接近空白组。而cFGF-21和TAT-cFGF-21组与模型组相比虽然有所改善,但与R11-cFGF-21和Fc-cFGF-21组结果有显著差异(P<0.01)。在整个试验过程中,R11-cFGF-21和Fc-cFGF-21组的改善效果明显优于cFGF-21和TAT-cFGF-21组(图3d)。因此,经过Fc和R11修饰的cFGF-21治疗的糖尿病小鼠对血糖的调节能力优于cFGF-21和TAT-cFGF-21组。
2.4 cFGF-21调节葡萄糖代谢的分子机制
实时荧光定量PCR结果显示,与模型组相比,cFGF-21、Fc-cFGF-21、R11-cFGF-21和TAT-cFGF-21治疗显著降低了小鼠肝组织中G6pase和PEPCK的转录(P<0.01)(图4a、c),同时促进了GK、GLUT1和GLUT4转录的升高(P<0.05,P<0.01)(图4b、e、f)。由于G6pase和PEPCK表达的降低会抑制肝糖异生,同时GK、GLUT1和GLUT4表达的升高将会促进葡萄糖的吸收,这些变化将导致血糖的降低。与模型组相比,4个治疗组均显著增加了脂肪组织中PPARγ的转录水平(P<0.01),其中Fc-cFGF-21组的PPARγ的转录水平最高。这表明各治疗组在脂肪组织中的胰岛素敏感性显著提高,葡萄糖吸收能力显著增强(图4 d)。此外,cFGF-21、Fc-cFGF-21、R11-cFGF-21和TAT-cFGF-21治疗后,糖尿病小鼠的SGLT1和SGLT2转录水平显著降低(P<0.01)。与cFGF-21组相比,Fc-cFGF-21和R11-cFGF-21组的SGLT1和SGLT2转录水平明显降低(P<0.01),而TAT-cFGF-21组的SGLT1和SGLT2转录量没有显著差异(图4 g、h)。以上结果表明,4种融合蛋白能促进肝、肠、肾和脂肪组织中的葡萄糖吸收,其中Fc-cFGF-21和R11-cFGF-21增加葡萄糖吸收的能力明显优于cFGF-21和TAT-cFGF-21。

a~h. G6pase、GK、PEPCK、PPARγ、GLUT1、GLUT4、SGLT1和SGLT2的mRNA转录水平;与模型组对照相比,*. 差异显著(P<0.05);**. 差异极显著(P<0.01);与cFGF-21组比较,#. 差异显著(P<0.05);##. 差异极显著(P<0.01)a-h. mRNA transcript levels of G6pase, GK, PEPCK, PPARγ, GLUT1, GLUT4, SGLT1 and SGLT2. Compared with the model group,*.Significant difference(P<0.05);**. Extremely significant difference(P<0.01). Compared with the cFGF-21 group,#. Significant difference(P<0.05);##. Extremely significant difference(P<0.01)
2.5 cFGF-21改善糖尿病鼠的脂质代谢并修复肝损伤
治疗后,cFGF-21、Fc-cFGF-21和R11-cFGF-21组的TG、TC和LDL显著低于模型组(P<0.01),而HDL水平显著高于模型组(P<0.01),与正常水平相当。与模型组相比,TAT-cFGF-21组的TG、TC和LDL的水平显著降低(P<0.05),HDL水平显著高于模型组(P<0.05)。与cFGF-21组相比,TAT-cFGF-21的TG、TC和LDL水平显著上升(P<0.05,P<0.01),而HDL水平显著降低(P<0.05)(表2)。

表2 血脂检测
与模型组对照相比显著,*.差异显著(P<0.05);**.差异极显著(P<0.01);与cFGF-21组比较,#.差异显著(P<0.05);##.差异极显著(P<0.01)
Compared with the model group,*. Significant difference(P<0.05);**. Extremely significant difference(P<0.01); Compared with the cFGF-21 group,#. Significant difference(P<0.05);##. Extremely significant difference(P<0.01)
此外,在试验结束时还测定了肝功能指标。4个治疗组的AST、ALT、ALP、GGT水平显著低于模型组(P<0.05,P<0.01)。与cFGF-21相比,Fc-cFGF-21和R11-cFGF-21组的AST和ALT水平极显著降低(P<0.01),ALP、GGT水平显著降低(P<0.05)。与cFGF-21相比,TAT-cFGF-21组的AST、ALT、ALP水平极显著上升(P<0.01),GGT水平显著升高(P<0.05)(表3)。以上结果表明,Fc-cFGF-21和R11-cFGF-21可以改善糖尿病引起的肝损伤和脂质代谢紊乱。

表3 肝功能检测
与模型组对照相比显著,*.差异显著(P<0.05);**.差异极显著(P<0.01);与cFGF-21组比较,#.差异显著(P<0.05);##.差异极显著(P<0.01)
Compared with the model group,*. Significant difference(P<0.05);**. Extremely significant difference(P<0.01); Compared with the cFGF-21 group,#. Significant difference(P<0.05);##. Extremely significant difference(P<0.01)
2.6 cFGF-21修复糖尿病鼠的胰腺损伤
为探讨cFGF-21对糖尿病小鼠氧化应激的影响,测定了胰中氧化应激相关酶的含量。结果表明cFGF-21、Fc-cFGF-21和R11-cFGF-21组的活性氧ROS水平(图5d)显著低于模型组(P<0.05),而抗氧化酶SOD水平(图5e)显著高于模型组(P<0.01)。与cFGF-21组相比Fc-cFGF-21和R11-cFGF-21组的ROS表达水平更低(P<0.05),SOD水平有更为显著的升高(P<0.01),而TAT-cFGF-21组SOD和ROS的表达水平都与cFGF-21组较为接近。
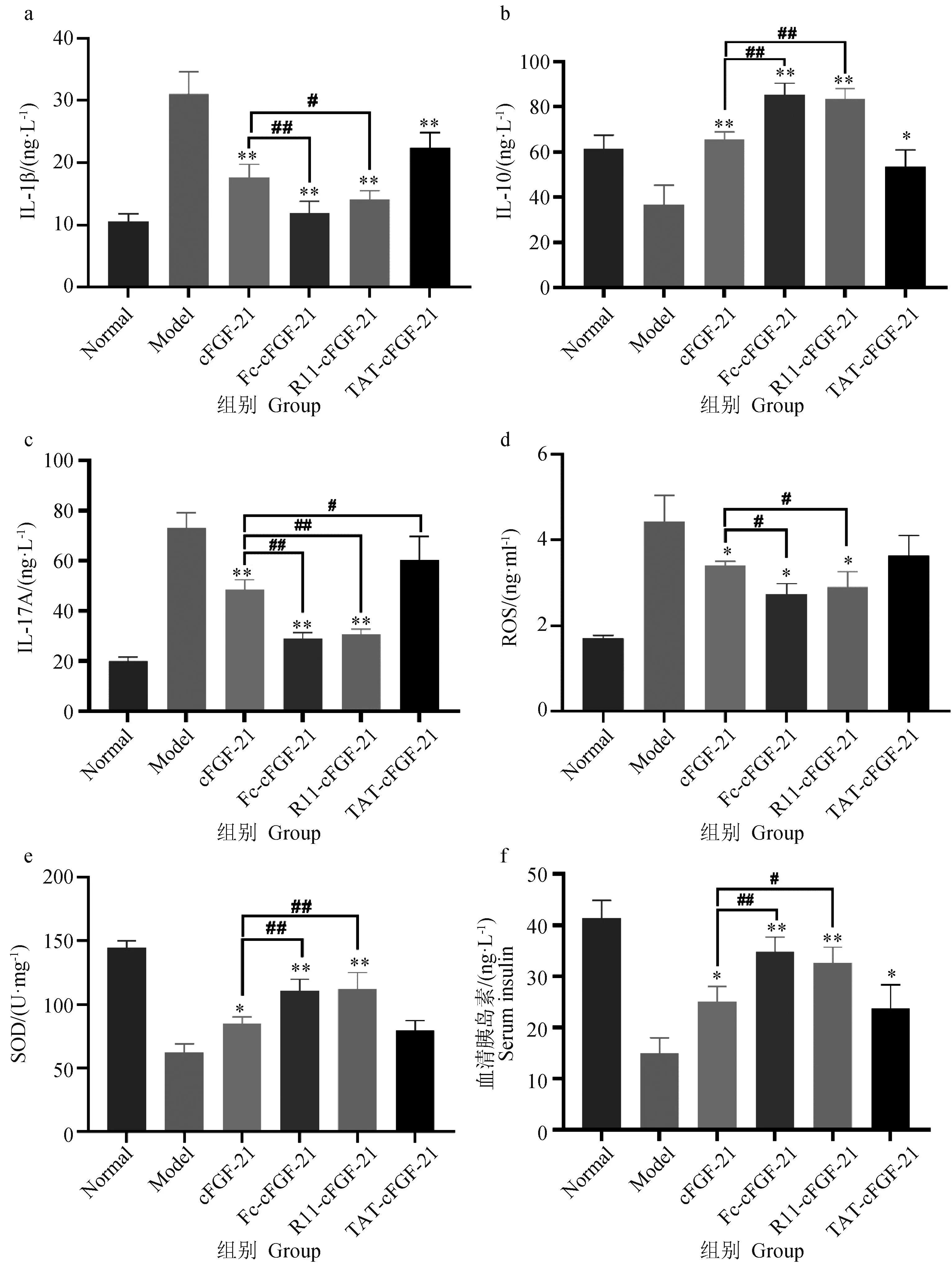
a~f分别为IL-1β、IL-10、IL-17A、ROS、SOD表达水平和血清胰岛素水平。与模型组对照相比,*. 差异显著(P<0.05);**. 差异极显著(P<0.01);与cFGF-21组比较,#. 差异显著(P<0.05);##. 差异极显著(P<0.01)a-f are IL-1β, IL-10, IL-17A, ROS, SOD expression levels and serum insulin levels, respectively. Compared with the model group,*. Significant difference(P<0.05);**. Extremely significant difference(P<0.01). Compared with the cFGF-21 group,#. Significant difference(P<0.05);##. Extremely significant difference(P<0.01)
ELISA结果表明,4个治疗组糖尿病小鼠胰腺中的炎性因子,如IL-1β和IL-17A的表达水平(图5 a,c)与模型组相比显著降低(P<0.01),抗炎因子IL-10表达水平(图5b)与模型组相比显著升高(P<0.01)。TAT-cFGF-21组的IL-1β和IL-10表达水平与cFGF-21组没有显著差异,而IL-17A的表达水平比cFGF-21组有明显升高。Fc-cFGF-21和R11-cFGF-21组炎症因子IL-1β和IL-17A的表达水平明显低于cFGF-21组,而抗炎因子IL-10表达水平远高于cFGF-21组。以上结果表明,Fc-cFGF-21和R11-cFGF-21能更大程度地改善因糖尿病而引发胰腺的炎症反应和氧化应激,而TAT-cFGF-21与cFGF-21没有明显差异。
HE染色结果表明,空白组胰岛区域相对完整,其中包含大量的胰腺β细胞。相反,模型组胰岛由于变形而受损,并且胰腺β细胞几乎不可见。在cFGF-21组中,胰岛的结构得到部分改善,胰腺β细胞的数量增加。TAT-cFGF-21组的胰岛有一定程度的恢复,胰岛β细胞数量仍然减少。而R11-cFGF-21组胰岛结构相对清晰,胰腺β细胞的数量明显增加。Fc-cFGF-21组胰岛结构更加清晰,胰腺β细胞分布更均匀,数量明显升高(图6)。因此,经过Fc-cFGF-21和R11-cFGF-21治疗后,糖尿病小鼠的胰腺修复情况明显优于cFGF-21组,而TAT-cFGF-21组胰腺有一定程度的修复,但与cFGF-21组相比没有显著差异。此外,与模型组相比4个治疗组血清胰岛素都有显著的升高(P<0.05,P<0.01),其中Fc-cFGF-21和R11-cFGF-21组的胰岛素水平明显高于cFGF-21组(P<0.05,P<0.01),而TAT-cFGF-21组与cFGF-21组没有显著的差异(图5f)。

a. 胰腺组织HE染色(红色箭头表示胰岛区域);b. 胰岛β细胞在胰岛中的百分比,与cFGF21组相比,*.差异显著(P<0.05);**. 差异极显著(P<0.01)a. HE staining of pancreatic tissue (Red arrow indicates islet area); b. Percentage of pancreatic β-cells in islets. Compared with the cFGF21 group,*. Significant difference(P<0.05);**. Extremely significant difference(P<0.01)
3 讨 论
对于CDM的分类目前兽医界尚有分歧,但无论哪一类型的CDM在病程的终末都会因为胰岛β细胞的损坏造成对胰岛素的依赖[20]。当前治疗CDM的胰岛素主要为人源及猪源胰岛素类似物,其缺陷为血糖下降较快易造成低血糖、造成低钾血症以及产生抗胰岛素抗体等问题[21]。
犬FGF-21在前期研究中表现出稳定安全降糖的特点,同时可调节机体和氧化应激水平[12]。与胰岛素相比,犬FGF-21治疗犬糖尿病的优点:无免疫原性;调节血脂、肝功能;改善炎症和氧化应激,同时还能保护重要器官(如:胰腺和肝等)。但将其开发成为一种更高效、更长效的降糖药物,仍需要在利用率和半衰期及长期药效方面进行研究。
IgG 型免疫球蛋白的Fc具有许多功能,如延长半衰期、形成二聚体与受体结合等[22]。细胞穿透肽(CPPs)已被证明是一种有效的递送载体,试验表明它能将多种物质如蛋白质、多肽和小分子药物等通过体内及体外的方式,在保证活性分子依然发挥作用的情况下导入到细胞内,而且不会产生免疫反应[23]。作者构建了3种融合蛋白Fc-cFGF-21、R11-cFGF-21和TAT-cFGF-21,通过治疗T1DM小鼠模型来比较3种融合蛋白和cFGF-21治疗效果,为提高cFGF-21治疗CDM的长效性研究提供重要的依据。
3.1 试验设计依据
FGF-21通过结合和激活由共受体β-Klotho和成纤维细胞生长因子受体1c(FGFR1c)组成的受体复合物而发挥其生物效应[24]。由于结构上的差异FGF-21分子的C端相对于N端的蛋白水解速度高达10倍,可能会改变药代动力学及其药效。与FGF-21的C端相连产生的复合物会降低对β-Klotho的亲和力,使其作为FGF-21受体的激动剂的效力降低;而与FGF-21的N-端相连产生的复合物不存在这方面的弊端[25]。因此,为了尽最大程度保证cFGF-21的生物学功能,选择将这3种标签分别与cFGF-21的N端连接,构建3种融合蛋白,即:Fc-cFGF-21、R11-cFGF-21和TAT-cFGF-21。
由于犬FGF-21序列与小鼠FGF-21序列表现出约80%的相似性,并且两个序列之间的功能区几乎相同,因此推测cFGF-21可以在小鼠细胞或模型鼠中表现出其生物学活性。
3.2 Fc和R11提高了cFGF-21的长效降糖作用
在试验的不同阶段,重组蛋白表现出不同的能力,随着给药间隔时间的延长,cFGF-21长效降血糖能力逐渐下降,Fc-cFGF-21和R11-cFGF-21长效降血糖能力逐渐突显。同样12 h血糖波动试验结果表明,Fc-cFGF-21和R11-cFGF-21可将小鼠血糖维持在较低水平且波动平稳。HbA1c能反映患者2~3个月的血糖平均水平,检测结果表明,Fc-cFGF-21和R11-cFGF-21可使小鼠血糖保持长期平稳。
综上所述,Fc和R11的修饰提高了cFGF-21的长效降糖作用,可使糖尿病小鼠的血糖长期保持接近正常的稳定水平。
3.3 cFGF-21调控糖代谢的分子机制
许多研究表明,肝的糖代谢在糖尿病的发病机制中起着重要作用[26]。葡萄糖生成的速度由关键步骤的葡萄糖生成酶(如PEPCK和G6Pase)的表达/激活决定[27]。FGF-21通过诱导脂肪细胞中葡萄糖转运蛋白1(GLUT1)的表达来增强葡萄糖摄取,而胰岛素通过增加葡萄糖转运体4(GLUT4)向细胞膜的转位,增加糖的摄取[28]。钠依赖性葡萄糖协同转运蛋白(SGLT1和SGLT2)在肾和肠道的葡萄糖吸收中起关键作用,已被提出作为糖尿病和心肌病的新型治疗策略[29]。在本研究中,Real-time PCR分析结果显示,Fc-cFGF-21和R11-cFGF-21显著降低了糖尿病小鼠肝中G6pase、PEPCK、肾SGLT1和肠道中SGLT2的转录水平,提高了肝中GLUT1。这些结果表明,Fc-cFGF-21和R11-cFGF-21更有效抑制肝糖异生、促进肝组织的糖吸收以及抑制肾和肠道中葡萄糖重吸收来维持长期降糖作用。
3.4 Fc和R11提高了cFGF-21改善血脂代谢及肝功能的能力
据报道,糖尿病患者血脂异常会产生冠心病等并发症[30]。模型组小鼠出现了严重的血脂异常,而经Fc-cFGF-21和R11-cFGF-21治疗的小鼠LDL、TC和TG水平显著降低(表2),且HDL水平与空白对照组接近,这表明Fc-cFGF-21和R11-cFGF-21改善了糖尿病鼠的血脂代谢紊乱。此外,在糖尿病患者中经常发现伴随的肝疾病[31]。在本研究中,作者还发现糖尿病小鼠在不进行任何治疗的情况下出现了肝损伤(与空白组小鼠相比,ALP、ALT、AST、GGT水平更高),而Fc-cFGF-21和R11-cFGF-21治疗逆转了这一现象。这些结果表明,在各治疗组中Fc-cFGF-21和R11-cFGF-21显著改善了高血糖引起的血脂异常和肝功能。
3.5 Fc和R11提高了cFGF-21修复胰的能力
有研究发现FGF-21通过抗氧化反应和抑制NF-κB炎症途径下调TNF-α、IL-1β和IL-17A,上调IL-10的表达水平来减轻类风湿关节炎、肥胖和急性炎症等的严重程度[32-33]。此外,活性氧ROS增多影响胰岛β细胞生理活性,并降低靶细胞对胰岛素的敏感性[32]。本研究中,糖尿病小鼠肝在未接受任何治疗的情况下处于高氧化应激状态,经Fc-cFGF-21和R11-cFGF-21治疗的小鼠ROS表达水平显著降低,抗氧化酶SOD表达水平显著增加,抑制了胰腺的氧化应激反应。胰腺炎症会导致胰岛β细胞的损伤,进而加重糖尿病患者的病情[33]。此外,脂肪中PPARγ的水平上升导致脂联素分泌增加,间接增加了胰岛素敏感性和抗炎作用[34]。本研究中,Fc-cFGF-21和R11-cFGF-21治疗的模型鼠的炎症因子IL-1β和IL-17A表达水平显著降低,而PPARγ和抗炎因子IL-10表达水平明显增加。这些结果表明,Fc和R11修饰后的cFGF-21抑制了胰腺炎症的发生,改善了氧化应激反应,最终导致胰腺损伤被修复,这可能是Fc-cFGF-21和R11-cFGF-21长效降糖的主要原因。
HE染色结果显示,模型组胰岛严重变形,胰岛β细胞几乎全部消失,各治疗组不同程度地修复了胰腺损伤。其中Fc-cFGF-21组修复效果最为理想,R11-cFGF-21组胰岛结构相对清晰,胰岛β细胞明显增加,TAT-cFGF-21和cFGF-21组的胰岛有一定程度的恢复,胰岛β细胞数量相对较少。病理结果表明,Fc-cFGF-21和R11-cFGF-21显著修复了胰腺损伤,TAT-cFGF-21修复胰腺能力较差。
胰腺的β细胞被损坏导致胰岛素分泌不足,这是CDM的主要病因之一。本研究中,Fc-cFGF-21和R11-cFGF-21提高了糖尿病鼠血清胰岛素水平并改善了糖耐受,且治疗效果显著优于cFGF-21。这些结果表明,Fc和R11修饰的cFGF-21有效地修复胰腺损伤,促进了胰岛素分泌进而改善机体调节血糖的能力。
3.6 不同穿膜肽对cFGF-21治疗效果的影响
穿透肽(CPP)进入细胞的具体分子机制目前还未揭示,不过任何一种CPP都不是以单一方式发挥穿膜作用。推测包括以下两种方式:1、通过胞吞作用进入细胞;2、通过静电作用与细胞膜相结合,而后诱导膜脂质双分子层产生短暂的孔隙进而直接渗透进入靶细胞。
TAT和R11是阳离子CPP,赖氨酸(Lys,K)和精氨酸(Arg,R)对CPP携带正电荷起主要作用。Arg在侧链有一个胍基,而Lys有一个铵基,胍基与脂质双层的相互作用力明显强于Lys的胺基,这通常导致富含Arg的CPP比富含Lys的CPP显示出更高的细胞膜亲和性[35]。富含精氨酸的CPP毒性小,并且Arg的CPP在低微摩尔浓度下不会引起膜渗漏[36]。
因为FGF-21需要与细胞膜受体结合后发挥生物学效应[37],R11的化学组成决定其比TAT对细胞膜更具亲和力,因此这可能是R11-cFGF-21表现出比TAT-cFGF-21具有更好治疗效果的主要原因。但TAT-cFGF-21的总体降糖效果差于cFGF-21,笔者推测可能是TAT更倾向于通过胞吞作用进入细胞,对细胞的渗透作用强于R11,致使有很大一部分TAT-cFGF-21进入细胞中无法发挥其生物学功能,故TAT的融合反而降低了细胞膜外TAT-cFGF-21的浓度。
4 结 论
R11-cFGF-21和Fc-cFGF-21可以显著改善血脂代谢和肝功能,同时通过改善胰腺氧化应激和炎症,从而修复胰岛β细胞,增加胰岛素的分泌,且治疗效果优于cFGF-21和TAT-cFGF-21。经R11和Fc分子修饰的cFGF-21提高了其体内的生物有效性,且增强了长效降糖作用。
