临床腹泻猪空肠组织中肾素-血管紧张素系统(RAS)的表达变化及与肠道炎症的关系
2024-03-01陈雪清李志强吴雨龙张崇昊张源淑
陈雪清,李志强,吴雨龙,张崇昊,张源淑*
(1.南京农业大学 农业部动物生理生化重点开放实验室,南京 210095;2.南京晓庄学院食品科学学院,南京 211171)
肾素-血管紧张素系统(renin-angiotensin system, RAS)作为重要的体液调节系统,在全身或各器官的局部调节多种机体功能,如在全身或血液循环中主要参与调控血压、维持心血管功能稳态、电解质和体液平衡等;而在局部或组织中则以调节多种器官的功能为主,如心、肝、肾以及肺等。经典RAS诸多成分已被证实存在于胃肠道中,并对体液、电解质、葡萄糖和肽的分泌及吸收、胃肠蠕动和肠系膜血液循环等一系列过程产生功能性影响[1]。近年来,研究发现,RAS新的调控因子——血管紧张素转化酶2(angiotensin-converting enzyme 2,ACE2)可促进肠黏膜吸收消化多肽,维持肠道微生态平衡[2-3];ACE2的水解产物Ang(1-7)可通过降低MAPK和NF-κB信号通路的活性抑制炎症性肠病(IBD)的发展[4],这表明,RAS相关成分特别是ACE2在维护肠道健康方面具有积极作用。
ACE2作为血管紧张素转化酶(angiotensin-converting enzyme,ACE)的同系物,是RAS发挥作用的主要成员。自2000年首次发现以来,多项研究结果表明,ACE2在抗组织炎症损伤方面展现出巨大潜力,其主要通过降解Ang Ⅱ产生Ang(1-7),参与血压调节、人体水盐代谢平衡和抗组织纤维化等过程,具有显著的抗炎抗纤维化功能[5-7]。作为RAS中新的ACE2-Ang(1-7)-MasR通路的核心酶,ACE2一方面作为抗炎蛋白降解Ang Ⅱ以缓解或抵抗Ang Ⅱ介导的炎症反应;另一方面通过其下游产物Ang(1-7)激活MasR发挥抗炎作用[8]。这表明RAS具有双重调节功能,既能通过ACE-Ang Ⅱ-AT1R途径发挥收缩血管、损伤黏膜的作用,又能通过ACE2-Ang(1-7)-MasR途径发挥扩张血管、抑制炎症等抗损伤的作用[9]。另外,空肠是猪营养吸收的主要肠段,以腹泻为主要症状的肠道炎性病变极大破坏了肠道屏障,严重影响生猪的生长发育。目前,ACE2的研究主要集中在人和啮齿类动物,关于猪肠道健康的研究不多,特别是通过调控ACE2影响RAS的平衡来探究其与肠道稳态的关系更是缺乏。本研究以临床上出现腹泻症状的保育猪的空肠为研究对象,通过组织病理学及对空肠组织相关炎性因子检测明确由于临床中普遍出现的腹泻症状而导致的空肠炎症性损伤,同时观察此情况下其空肠局部RAS相关组分特别是ACE2的表达变化,探究RAS与腹泻猪空肠炎症的相互关系,从而为肠道局部ACE2的研究奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 主要试剂和仪器 4%多聚甲醛(南京鼎国昌盛生物技术有限公司);3,3′,5,5′-四甲基联苯胺(TMB,江苏凯基生物技术股份有限公司);Trizol试剂盒(日本TaKaRa公司);RNA抑制剂(美国Promega公司);PVDF膜(美国Millipore公司);猪血管紧张素Ⅱ(AngⅡ)、猪血管紧张素1-7(Ang 1-7)、猪肿瘤坏死因子(TNF-α)、白细胞介素1β(IL-1β)、白细胞介素(IL-10)ELISA试剂盒(南京奥青生物技术有限公司)等。
石蜡切片机(RM2235,德国徕卡公司);显微镜(BH-2,日本奥林巴斯株式会社);高速冷冻离心机(Mikro-22R,德国Andreas公司);核酸蛋白测定仪(BioPhotometer D30,德国Eppendorf公司);PCR仪(Tpersonral,美国Biometra公司);电泳仪及半干转印仪(Power pac300,美国BIO-RAD公司);全自动发光成像系统(Tanon-5200 Multi,上海天能科技有限公司)等。
1.1.2 试验动物及样品采集 试验所需动物样本来源于江苏梅林公司华明猪场40~50日龄保育苏姜母猪。挑选健康和临床表现出严重腹泻症状的保育猪分组分栏并进行隔离饲养,每组6只,共两组,期间自由采食和饮水。分别对健康保育猪和患有严重水样腹泻症状且濒临死亡的保育猪颈部放血处死。截取空肠组织并用0.9%氯化钠溶液漂洗,将其中一部分迅速移入液氮中,于-80 ℃保存;另一部分(空肠前、后段)被截取为0.5 cm3左右的组织块并移入4%多聚甲醛,室温保存。
1.2 方法
1.2.1 临床腹泻保育猪空肠组织中相关炎性因子含量的测定 ELISA法检测腹泻保育猪以及正常保育猪空肠组织中TNF-α、IL-1β、IL-10和Ang II、Ang(1-7)的含量。首先称取100 mg空肠组织于1 mL预冷裂解液中匀浆,4 ℃ 12 000 r·min-1离心15 min,取上清。按照ELISA检测试剂盒说明检测相关指标含量变化,根据所测标准品OD450 nm值绘制标准曲线,根据标准曲线方程得出样品浓度(TNF-α、IL-1β、IL-10单位:ng·mL-1;Ang II、Ang(1-7)单位:pg·mL-1),并对最终数据进行分析。
1.2.2 临床腹泻保育猪空肠组织病理学切片制作 首先用4%多聚甲醛固定猪的空肠组织样品,然后将组织样品于固定液中固定24 h或更久,接着取出组织样品分别在固定液、80%酒精、90%酒精、95%酒精和无水乙醇条件下依次梯度脱水,将其放入二甲苯中浸泡并进行浸蜡包埋处理,包埋好的组织冷却后切片(3 μm)并做标记进行HE染色,最后用中性树胶做封闭处理,于显微镜下观察。
1.2.3 临床腹泻保育猪空肠组织ACE2、MasR基因的RT-qPCR检测
1.2.3.1 空肠组织总RNA的提取:取临床表现出腹泻症状的保育猪及正常保育猪的空肠组织约100 mg,彻底匀浆,采用Trizol一步法抽提以上肠段组织的总RNA,以紫外比色法测定总RNA的浓度和纯度。
1.2.3.2 反转录:根据测得空肠组织的总RNA浓度,用DEPC水统一浓度至500 ng·mL-1。选择完整性好且A260 nm/A280 nm/为1.8~2.0的RNA,采用二步法反转录成cDNA。
1.2.3.3 目的基因引物设计:根据GenBank上公布的猪ACE2、Mas受体及β-Actin内参基因序列,用Primer Premier 5软件自行设计引物(表1),由南京擎科生物科技有限公司合成。

表1 目的基因及β-Actin引物序列
1.2.3.4 Real-time PCR检测:以β-Actin为内参,采用荧光定量PCR SYBR Green染料对ACE2、Mas受体基因进行相对定量分析。反应条件为95 ℃ 预变性 2 min;95 ℃ 变性5 s,60 ℃ 退火30 s,72 ℃ 延伸30 s,共40个循环,利用相对定量ΔΔCt法进行数据统计。
1.2.4 临床腹泻保育猪空肠组织RAS相关组分的变化
1.2.4.1 空肠组织中RAS相关组分蛋白表达的Western blot分析:称取100 mg仔猪空肠组织于1 mL裂解液中匀浆,离心取上清,按照“试剂A∶试剂B=50∶1的比例”配制 BCA工作液,酶标仪测定A562nm,根据标准曲线得出蛋白浓度。以120 V,90 min的条件SDS-PAGE电泳,以1.5 mA·cm-2、90 min的条件转印,5%脱脂奶粉液中封闭2 h,先后孵育一抗(ACE2∶1∶3 000;MasR/ACE/AT1R∶1∶2 000;4 ℃过夜)和二抗(室温2 h),抗体孵育按试剂盒说明书进行,避光条件下滴加AB显色液显色5 min并拍照,以GAPDH作内参,目的条带与其相比得到相对量。
2 结 果
2.1 临床腹泻保育猪空肠组织中相关炎性因子的变化
相关炎性因子检测结果如图1所示。与正常猪相比,表现临床腹泻症状的保育猪空肠组织中促炎性因子TNF-α、IL-1β的含量显著升高(P<0.05);其空肠组织中抗炎性因子IL-10有下降的趋势,但无显著性。
2.2 临床腹泻保育猪空肠组织形态学变化
空肠组织形态学观察结果如图2所示。相比于临床腹泻猪,正常猪空肠组织结构相对完整,腺体正常。表现临床腹泻症状的保育猪空肠组织不完整,肠绒毛坏死脱落(4×视野,图2A),肠腺上皮细胞增生(10×视野,图2A),肠绒毛内部结构遭到严重破坏(40×视野,图2A)。当发生严重腹泻时,保育猪空肠可见水样黏液,肠腺浓染(4×视野,图2B),空肠结构被严重破坏,肠绒毛肿胀(10×视野,图2B),并伴有大量出血点(40×视野,图2B)。

A. 腹泻猪空肠;B. 重度腹泻猪空肠;C. 正常猪空肠。扫描文章首页OSID码可查看彩图A. Jejunum of piglets with diarrhea; B. Jejunum of piglets with severe diarrhea; C. Normal piglet jejunum. The color pictures can be found by scanning the OSID code on the front page of the article

与正常猪相比,*表示差异显著(P<0.05)Compared with normal piglets, * indicated that the difference was significant (P<0.05) 图1 空肠组织中炎性因子的含量(n=6)Fig.1 Contents of inflammatory factors in pig jejunal tissues (n=6)
2.3 临床腹泻保育猪空肠组织中ACE2、MasR mRNA表达
ACE2是RAS系统中关键的调控因子,其发挥作用主要依赖于下游Ang(1-7)和Mas受体,探究发生肠道炎症的空肠组织中ACE2与Mas受体变化对于后续研究尤为重要。结果如图3所示。与正常保育猪相比,表现临床腹泻症状的保育猪空肠组织ACE2 mRNA水平下调,但无显著性(P>0.05);ACE2下游受体MasRmRNA水平相比于正常猪极显著下降(P<0.01)。
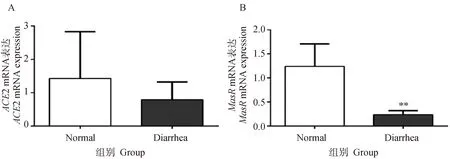
与正常猪相比,**表示差异极显著(P<0.01)Compared with normal piglets,** indicate that the difference was very significant (P<0.01)
2.4 临床腹泻保育猪空肠组织中RAS相关组分含量及蛋白的表达
2.4.1 临床腹泻保育猪空肠组织中Ang II、Ang(1-7)含量的变化 结果如图4所示。与正常猪相比,表现临床腹泻症状的保育猪空肠组织中Ang Ⅱ 含量升高,而Ang(1-7)含量降低。
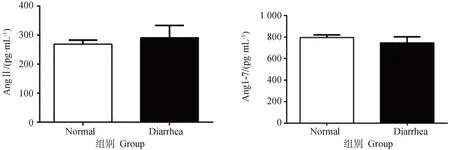
图4 空肠组织中Ang Ⅱ和Ang(1-7)含量(n=6)Fig.4 Contents of Ang Ⅱ and Ang (1-7) in jejunal tissues (n=6)
2.4.2 临床腹泻保育猪空肠组织中ACE2、MasR、ACE和AT1R蛋白的表达 Western blot结果如图5A、B所示。灰度分析发现:表现临床腹泻症状的保育猪空肠组织中ACE2蛋白水平显著低于正常猪(P<0.05)(图5C),Mas受体蛋白水平极显著低于正常猪(P<0.01)(图5D),蛋白水平结果与mRNA结果一致,这说明在肠道炎症状态下ACE2水平的表达下调,其下游受体Mas表达下调。为了探究猪腹泻性肠道炎症与RAS经典轴的关系,继续检测另一条轴ACE和AT1R的蛋白表达,结果如图5E、F所示。ACE和AT1R蛋白在临床腹泻保育猪空肠组织中的表达均极显著高于正常猪(P<0.01)。

与正常猪相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01)Compared with normal piglets, * indicate that the difference was significant (P<0.05),** indicate that the difference was very significant (P<0.01)
2.4.3 临床腹泻保育猪空肠组织中ACE2/ACE蛋白表达比值分析 RAS中ACE-Ang Ⅱ-AT1R轴与ACE2-Ang(1-7)-MasR轴发挥两种截然不同的作用。本研究分别将正常与表现临床腹泻症状的猪空肠组织中ACE2与ACE蛋白表达进行比较分析,发现在正常猪中ACE2/ACE比值大于1(图6),说明此时ACE2表达占优势,ACE表达占劣势,ACE2-Ang(1-7)-Mas轴发挥主要的作用。而在表现临床腹泻症状的保育猪中,ACE2/ACE比值小于1,说明此时ACE2表达占劣势,ACE表达占优势,符合炎症发生时ACE出现上调的趋势,且此时ACE-Ang Ⅱ-AT1轴发挥主要作用。
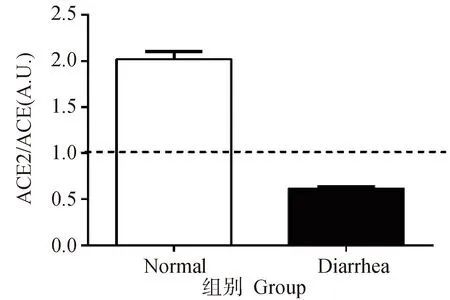
图6 ACE2/ACE比值分析(n=6)Fig.6 Ratio analysis of ACE2/ACE (n=6)
3 讨 论
我国不仅是农业大国,同时也是世界养猪生产的第一大国,无论是生猪养殖规模还是猪肉消费量均居世界第一。尤其是近年来,我国养猪业在技术水平,规模化程度,动物福利研究等方面均取得一定的进展,但仍面临诸多挑战。随着集约化养殖模式的发展与流行,各种细菌性、病毒性疾病严重危害生猪养殖业。其中保育猪需要经过仔猪断奶后变料至育肥阶段,在这一阶段猪自身消化系统发育尚未完全成熟且对环境适应性较差,加之断奶、变温、换舍和换料等应激,极易诱发消化道疾病,引发生猪不同程度的感染,最终导致仔猪出现以腹泻为主要症状的慢性肠道炎症,影响仔猪生长存活率和集约化养殖的整体效益[10]。腹泻是多种疾病发生发展过程中具有的共同现象,由于肠黏膜屏障损伤以及炎症介质过度释放等直接介导肠道炎性损伤的发生,通常表现为腹泻,精神沉郁,个体弱小,严重时甚至死亡[11-12]。本文以临床上出现腹泻症状的保育猪为研究对象,通过分析其空肠组织病理学变化及相关炎性因子的表达,证实临床中表现出的腹泻症状最终能够诱发严重的空肠组织病变,主要表现在肠绒毛坏死脱落,肠腺上皮细胞大量增生,肠内伴有出血点,炎症因子大量释放,空肠结构遭到严重破坏。这极大地威胁了保育猪的生长发育。
一直以来,肾素-血管紧张素系统都在血压调节,水盐代谢等发面发挥重要作用。自2012年Hashimoto等[13]发现ACE2对抑制肠道炎症、维持肠道稳态、保护肠道健康等方面同样具有积极的影响后便开启了ACE2在肠道炎症方面的新篇章。Yisireyili等[14]发现肠道炎症过程中ACE2具有抗炎且促进氨基酸代谢吸收的功能。Garg等[15]发现在肠炎患者体内,RAS经典成员(ACE、Ang Ⅱ、AT1)的含量与对照组相比无显著性差异,而新成员ACE2、Ang(1-7)的表达上调,且Ang(1-7)的表达水平与血小板和白细胞数量呈正相关,提示ACE2和Ang(1-7)具有作为肠道炎症的生物标志物的潜力。
ACE2作为RAS中的关键酶及中性氨基酸转运载体的稳定剂,对控制肠道炎症具有重要作用。越来越多的研究表明 ACE2对肠道炎症反应具有负向调节作用,主要通过水解Ang II,生成Ang (1-7),从而减少细胞因子的释放、组织损伤及纤维化,并与Mas受体结合发挥抗炎和抗增殖的作用[16]。本研究通过仔猪腹泻性空肠炎症变化也发现,由ACE-Ang II-AT1R轴与ACE2-Ang(1-7)-MasR轴构成的RAS平衡被打破,腹泻诱发空肠炎性损伤,并激活ACE-Ang II-AT1R轴。此时,空肠内负责水解Ang II并维持其平衡的ACE2受到抑制,过量的Ang II被释放出来,没有足够的Ang(1-7)与下游Mas受体结合,这进一步导致炎症反应加剧。
目前,ACE2的研究多局限于人和啮齿类动物,在猪上的研究相对迟缓,最早是Yang等[17]研究发现,B0AT1与ACE2可通过特殊的调控机制在仔猪完整的小肠隐窝-绒毛轴表达,B0AT1基因通过完整的隐窝-绒毛轴在上皮转录以及与ACE2在顶点膜上的共表达导致肠段Na+-中性氨基酸吸收活性增强,这对促进肠道营养物质吸收,维护肠道健康具有积极影响。本研究发现腹泻可导致保育猪肠道增生性炎症以及肠内Ang II过表达,会加速炎症反应的发生,RAS相关组分均处于激活状态,ACE介导的ACE-Ang II-AT1R轴处于优势,而ACE2及其下游介导的ACE2-Ang(1-7)-MasR轴处于劣势。因此,作者认为ACE2作为ACE的拮抗剂发挥抑制肠道炎症的功能。另外,根据已有的研究结果可以推测ACE2是肠道微生态稳定、氨基酸平衡、先天免疫以及肠道炎症易感性的关键调控因子,可能参与并维持肠道的微生态平衡,对维持肠道稳态具有积极的作用,这方面的研究值得开展。但就目前检索的结果来看,ACE2在胃肠道方面的研究结果还不是很多,特别是在猪上的研究较少,由于猪消化道如仔猪腹泻、育肥猪增生性肠炎等疾病一直都是养猪业主要解决的问题,因此,还需要进行更深入的研究。
4 结 论
临床腹泻保育猪空肠组织局部RAS被激活,ACE-Ang II-AT1R轴的活性远高于ACE2-Ang(1-7)-MasR轴,ACE2抗炎性损伤作用处于劣势。
