一株铜绿假单胞菌噬菌体全基因组分析及与抗生素体外联合应用效果
2024-03-01王晋宇张凯川王芮杰蒋祺丰
王晋宇,张凯川,王芮杰,高 铎,蒋祺丰,贾 坤
(华南农业大学兽医学院,广州 510642)
铜绿假单胞菌(Pseudomonasaeruginosa,PA)是一种革兰阴性专性需氧菌,也称绿脓杆菌,广泛存在于土壤、空气、海河以及人类和动植物生活的环境中,能够引起动物机体的各种感染,例如皮肤感染、子宫内膜炎、乳腺炎和肠道感染等。铜绿假单胞菌也是医院内一种常见的机会性致病菌,当宿主防御系统受到损伤,导致机体免疫功能下降时,易发生铜绿假单胞菌感染[1]。由于该致病菌引发的感染病症反复,治疗时间长,所以难以彻底治愈[2]。同时,铜绿假单胞菌引起的呼吸机相关性肺炎(VAP)占能够造成VAP的细菌的10%~20%[3],也是导致尿路感染的主要病因之一[4]。铜绿假单胞菌在潮湿环境中更易感染烧伤患者,引发各种并发症[5],由于其引起的菌血症死亡率高达43.2%~58.8%,应得到广泛关注[6]。
噬菌体是一种能够感染细菌、真菌以及放线菌等微生物的病毒,在地球上储量丰富,可达到1031[7],能够从土壤、海洋、污水以及废品中分离得到。而且噬菌体对细菌的杀灭作用是独特的,具有高宿主特异性和低毒性,几乎不影响正常菌群[8]。此外,噬菌体在各种环境下有较强的适应性和对多重耐药(MDR)病原体的有效活性,也被视为抗生素的潜在替代品[9-10]。近年来,应用噬菌体治疗MDR细菌感染的案例屡见不鲜,一项动物试验结果显示,与阴性对照组相比(无感染组愈合率为97.43%),被MDR肺炎克雷伯菌感染的伤口经噬菌体处理过表现出最高为99%的愈合效率,证明了应用噬菌体治疗的可能性[11]。与此同时,铜绿假单胞菌噬菌体全基因组的测序工作也得到快速发展,2019年3月,NCBI数据库中登录的假单胞菌噬菌体全基因组序列有357株,其中93%的噬菌体具有双链DNA结构[12],截至2023年5月,上传到NCBI数据库中的全基因组序列已经达到773株,在此期间还发现一株新型巨型铜绿假单胞菌噬菌体vB_PaeM_MIJ3[13]。因此,对噬菌体的研究还需要更加深入,探索其治疗耐药菌的潜力。本研究分离鉴定出医院源铜绿假单胞菌噬菌体,研究其生物学特性、基因组信息以及与不同抗生素体外联合应用,以期为噬菌体应用于实际奠定基础。
1 材料与方法
1.1 材料
29株不同种铜绿假单胞菌菌株(28株临床分离铜绿假单胞菌和1株标准铜绿假单胞菌CMCC 10104),来自于华南农业大学兽医学院外科教研室保存菌株。噬菌体样本分离自南方医科大学南方医院污水。LB营养琼脂、琼脂粉、PEG8000、NaCl购自广州生工科技有限公司,头孢曲松购自北京悦康药业集团股份有限公司,恩诺沙星购自河南白云牧港生物科技有限公司,庆大霉素购自山西芮城科龙兽药有限公司,脱氧核糖核酸酶、核糖核酸酶、绿豆核酸酶均购自北京索莱宝生物技术有限公司,病毒基因组DNA提取试剂盒购自天根生化科技有限公司,透射电镜(型号FEI/Talos L 120C,厂家捷克/FEI)。
1.2 噬菌体的分离鉴定
1.2.1 噬菌体分离纯化 采集100 mL医院污水,使用0.22 μm滤膜过滤除菌,将滤液12 000 r·min-1离心15 min,收集上清液。将29株铜绿假单胞菌菌株分别培养至对数生长期备用。将30 mL LB液体培养基、500 μL铜绿假单胞菌菌液和1 mL样品上清液加入到50 mL离心管内,置于37 ℃,200 r·min-1的摇床中培养12 h。培养结束后将混合液过滤离心,收集上清液即为待测的噬菌体样品。
采用双层琼脂平板法分离噬菌体,选择菌株PA18作为宿主菌,之后进行噬菌体纯化:用镊子选取平板上单噬菌体斑块,放入装有1 mL生理盐水的EP管中,搅碎斑块后置于42 ℃水浴锅浸出,再以12 000 r·min-1离心10 min,取上清液通过双层琼脂平板法分离噬菌体。重复操作直至琼脂板上的噬菌斑大小形态一致,即为纯化后的单一噬菌体。
1.2.2 噬菌体增殖、浓缩 分别将纯化后的噬菌体和宿主菌按照最佳MOI加入到LB液体培养基中,置于37 ℃,200 r·min-1的摇床中富集培养,然后离心过滤得到噬菌体富集液。参照郭杨毅君文中的PEG沉淀噬菌体颗粒的方法[12],对噬菌体进行浓缩。浓缩后的噬菌体效价达到1011PFU·mL-1以上,就可以用作噬菌体核酸类型鉴定、透射电镜观察和全基因组测序。
1.3 噬菌体生物学特性研究
1.3.1 噬菌体裂解谱测定 使用点样法测定噬菌体裂解谱。将29株铜绿假单胞菌分别在LB液体培养基中培养12 h,然后将100 μL菌液均匀涂布在LB固体培养基表面,同时取10 μL经过纯化的噬菌体滴在LB固体培养基上,另外滴10 μL生理盐水做对照。待噬菌体液滴干燥之后将平板倒置,培养10 h后观察液滴所在处是否透明,确定噬菌体对菌株的裂解性。
1.3.2 噬菌体透射电镜观察 将纯化浓缩后效价为1011PFU·mL-1的噬菌体颗粒加载到铜网上1 min,然后用等量2%醋酸铀进行负染1 min并吸掉多余液体。待其干燥后使用TEM Talos L 120C观察噬菌体形态并采集图像。
1.3.3 最佳感染复数测定 将铜绿假单胞菌培养至对数生长期(菌液浓度为108CFU·mL-1),按照感染复数(MOI)为100、10、1、0.1、0.01、0.001以及0.000 1的比例在离心管中分别加入500 μL噬菌体和500 μL菌液,震荡混匀后在37 ℃温箱中孵育,4 h后将混合物以12 000 r·min-1离心10 min,取上清液通过双层琼脂平板法测定噬菌体效价。
1.3.4 一步生长曲线测定 取1 mL对数生长期的铜绿假单胞菌菌液到离心管中,再以最佳MOI为0.001的比例加入1 mL噬菌体,置于37 ℃温箱中孵育20 min,然后8 000 r·min-1离心10 min,弃掉上清后,使用37 ℃预热的LB肉汤重悬沉淀,重复离心操作一次,将沉淀转移到预热的10 mL LB肉汤中,重悬沉淀后置于37 ℃,200 r·min-1的摇床中培养。在前30 min以10 min的时间间隔取样,之后每隔15 min进行取样,每次取样量为500 μL,试验时间持续2 h,同时通过双层琼脂平板法测定噬菌体效价,试验重复三次,使用GraphPad Prism 软件绘制一步生长曲线。噬菌体爆发量等于裂解结束时的噬菌体数量除以感染初期细菌的初始浓度。
1.3.5 吸附曲线测定 取2 mL对数生长期的铜绿假单胞菌菌液到离心管中,再按照最佳MOI加入2 mL噬菌体,置于摇床当中,设置条件为37 ℃,200 r·min-1,孵育10 min,期间每隔2 min进行取样,每次取样量为500 μL。同时使用双层琼脂平板法测定噬菌体效价,试验重复3次,以时间为横坐标,噬菌体吸附率为纵坐标使用GraphPad Prism 软件绘制噬菌体吸附曲线。
噬菌体吸附率=[(0 min噬菌体总量-未吸附噬菌体数量)/0 min噬菌体总量] ×100%。
1.3.6 噬菌体热稳定性和pH稳定性测定 测定噬菌体在不同温度下的稳定性。分别取1 mL确定效价的噬菌体加入到1.5 mL EP管中,分别置于-20、4、25、37、40、50、60、70和80 ℃下孵育1 h,每个温度下放置3个样品。孵育完成后再将所有样品置于4 ℃冰箱1 h,然后12 000 r·min-1离心10 min收集所得上清液,通过双层琼脂平板法测定噬菌体效价。以温度为横坐标,噬菌体存活率为纵坐标使用GraphPad Prism9软件绘图。
测定噬菌体在不同pH条件下的稳定性。将SM缓冲液分别调节至pH值为1到14共14个梯度,每个梯度取900 μL加入到EP管,再加入100 μL确定效价的噬菌体原液,在37 ℃水浴锅中孵育,1 h后12 000 r·min-1离心10 min收集所得上清液,通过双层琼脂平板法测定噬菌体效价。重复试验3次,以pH为横坐标,噬菌体存活率为纵坐标使用GraphPad Prism9软件绘图。
噬菌体存活率=[2/1 h后噬菌体效价/噬菌体原液效价] ×100%。
1.4 噬菌体全基因组分析
1.4.1 噬菌体核酸类型鉴定 使用Viral DNA Kit试剂盒提取噬菌体基因组,然后使用DNase I、RNase A和MungBean(20 U·μg-1)进行基因组酶溶鉴定,对照组使用ddH2O处理,所有组别在37 ℃水浴锅中处理1 h,产物与Loading Buffer混合,通过1%琼脂糖凝胶电泳分离,使用凝胶成像系统进行观察。
1.4.2 全基因组测序及生物学信息分析 通过酶标仪检测噬菌体基因组DNA浓度,要求达到5 ng·μL-1以上,总量要求40 μL,符合要求后送至华南农业大学兽医学院预防教研室进行基因组测序。首先用Nextera XT DNA文库制备试剂盒并进行质量鉴定,符合要求后使用lllumina Hiseq测序平台全基因组测序,测序完成后用FASTQC工具分析数据质量,通过后用SPAdes v3.11.0[14]对序列进行拼接和组装。获取到完整的基因组数据后,使用GCserver软件绘制全基因组图。
利用在线网站VFDB(VFDB: Virulence Factors of Bacterial Pathogens)查找噬菌体全基因组中是否存在细菌毒力因子;通过在线工具CARD(Comprehensive Antibiotic Resistance Database)和CGE(Center for Genomic Epidemiology)检测抗生素抗性基因;通过在线网站tRNAscan-SE 2.0预测是否存在tRNA基因[15]。利用MEGA11软件对PaVOB全基因组序列进行系统发育分析,选取覆盖率≥95%,一致性>94%的基因组进行进化分析。应用在线网站NCBI中的ORF finder工具预测PaVOB的DNA以查找潜在的蛋白质编码片段,使用blastp验证预测得到的蛋白质,蛋白质数据库选择非冗余蛋白质序列(nr),开始密码子为′ATG′,分析预测得到的开放阅读框(ORF)的功能。
1.5 噬菌体与抗生素体外联合应用
1.5.1 抗生素MIC测定 选择3种不同杀菌机制的抗生素,包括头孢菌素类头孢曲松(100 mg·mL-1)、氟奎诺酮类恩诺沙星(100 mg·mL-1)和氨基糖苷类庆大霉素(40 mg·mL-1),测试宿主菌的最小抑菌浓度(MIC)。将药物在EP管中进行倍比稀释,头孢曲松和恩诺沙星最低稀释到1.5 μg·mL-1,庆大霉素最低稀释到0.3 μg·mL-1,将菌液浓度都调整到108CFU·mL-1备用。参照微量肉汤稀释法(酶标板)的步骤进行加样,然后将96孔板置于37 ℃恒温培养箱中培养12 h,使用酶标仪在OD600 nm波长下检测。
1.5.2 测定噬菌体与抗生素联合应用效果 选择上述三种抗生素,测定与噬菌体联合应用的作用效果。首先准备效价为10~107PFU·mL-1的噬菌体稀释液,药物浓度选择范围根据MIC结果确定,共11个浓度梯度,从高到低使用LB肉汤进行2倍稀释,准备108CFU·mL-1的PA18菌液备用。在无菌96孔圆底微量滴定板中进行试验,先在96孔板每个孔中加入100 μL菌液,然后以药物高浓度到低浓度的顺序分别从第1孔到第11孔横向加入100 μL药物稀释液,第2~8排重复操作,最后纵向加入不同效价的噬菌体100 μL,以第一纵列为例,第1孔加入噬菌体效价为107PFU·mL-1,依次类推第1列第7排孔内噬菌体效价为10 PFU·mL-1,剩余纵列重复操作。最后每个孔内应有混合液体300 μL,不够量的用LB肉汤补齐,加样结束后将96孔板置于37 ℃恒温培养箱中培养12 h,应用酶标仪在600 nm波长下检测OD值,试验重复3次取平均值,应用TBtools软件绘制热图。
2 结 果
2.1 噬菌体的分离鉴定及生物学特性
2.1.1 噬菌体分离纯化鉴定结果 从医院污水中分离到一株铜绿假单胞菌噬菌体并命名为PaVOB,如图1a所示,噬菌体在双层琼脂板上形态表现为圆形、空斑透亮、边缘清晰,直径为2~3 cm。透射电镜(TEM)显示PaVOB病毒颗粒具有一个平均直径为73.02 nm的二十面体头部和一个平均长度为155.57 nm的长尾部(图1b),属于有尾噬菌体目(Caudovirales),长尾噬菌体科(Siphoviridae)。
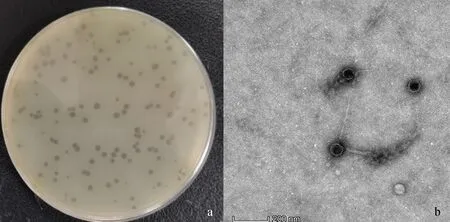
图1 噬菌体PaVOB的噬斑(a)及显微形态(b)Fig.1 Phage plaques (a) and microscopic morphology (b) of phage PaVOB
2.1.2 噬菌体裂解谱 通过点样法对PaVOB的宿主范围进行测定,PaVOB能够裂解29株铜绿假单胞菌中的5株,其中不包括标准铜绿假单胞菌CMCC 10104,裂解率为17.2%,其裂解谱较窄,属于窄裂解谱噬菌体。
2.1.3 噬菌体一步生长曲线 根据最佳MOI建立的一步生长曲线,结果如图2A所示:PaVOB滴度在10 min后快速上升,在120 min趋于平稳。因此,PaVOB的潜伏期为10 min,裂解期为120 min,爆发量为50 PFU·cell-1。
2.1.4 噬菌体吸附曲线 如图2B所示,测定PaVOB对宿主菌PA18的吸附能力。结果表明,PaVOB在2 min内吸附速度最快,吸附率达到69.4%,在6和8 min内吸附率分别为91.4%、95.2%,10 min时吸附率最高,为99.1%,噬菌体吸附基本达到饱和。
2.1.5 噬菌体热稳定性 温度对PaVOB的影响结果如图2C所示,PaVOB耐受低温环境,在-20~40 ℃期间存活率都大于80%,之后随温度升高而下降,但是在60 ℃时还具有61%的存活率,在70 ℃条件下完全灭活。这一结果表明PaVOB耐低温能力较强。
2.1.6 噬菌体pH稳定性 pH对PaVOB的影响结果如图2D所示,PaVOB在pH为4~11之间存活率超过60%,pH为6时存活率接近100%,在pH为3和12时,分别具有25.2%、32.5%的存活率,在pH>12和pH<3时,PaVOB完全失活。这一结果表明PaVOB在pH为4~11的环境中稳定性较好,最适pH为6。
2.1.7 最佳感染复数 如表 1所示,当MOI为0.001时,PaVOB效价最高,为1.84×109PFU·mL-1。因此,PaVOB的最佳MOI为0.001。
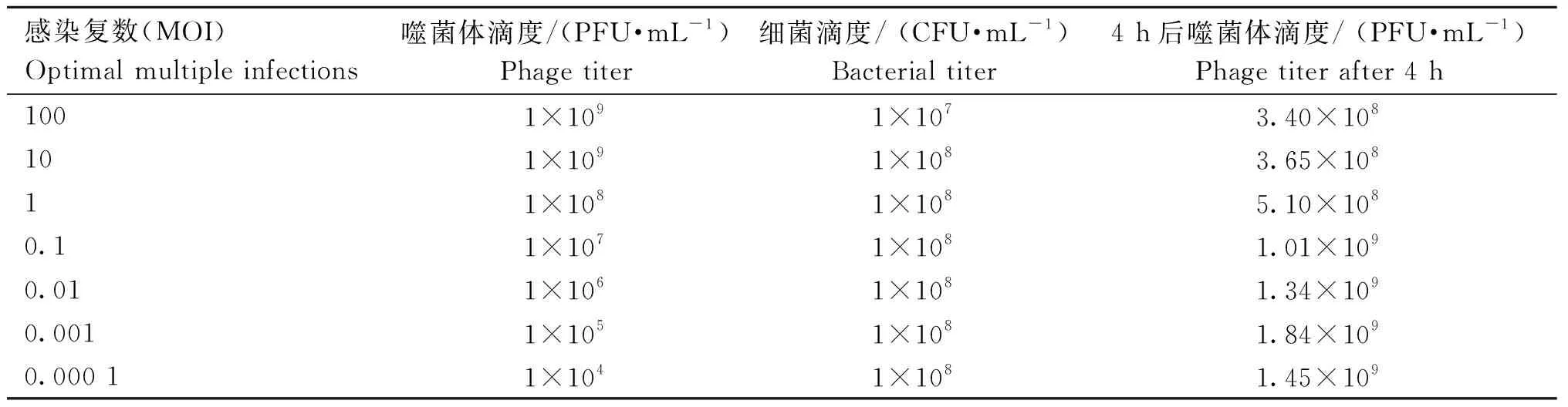
表1 PaVOB最佳感染复数
2.2 噬菌体生物信息学分析
2.2.1 噬菌体核酸类型鉴定结果 对PaVOB使用不同核酸酶处理,结果如图3所示,PaVOB基因组DNA对DNase I敏感,处理之后没有条带,而经RNaseA和Mung Bean Nuclease处理之后,条带大小与阴性对照组基本一致,表明PaVOB基因组为双链DNA。
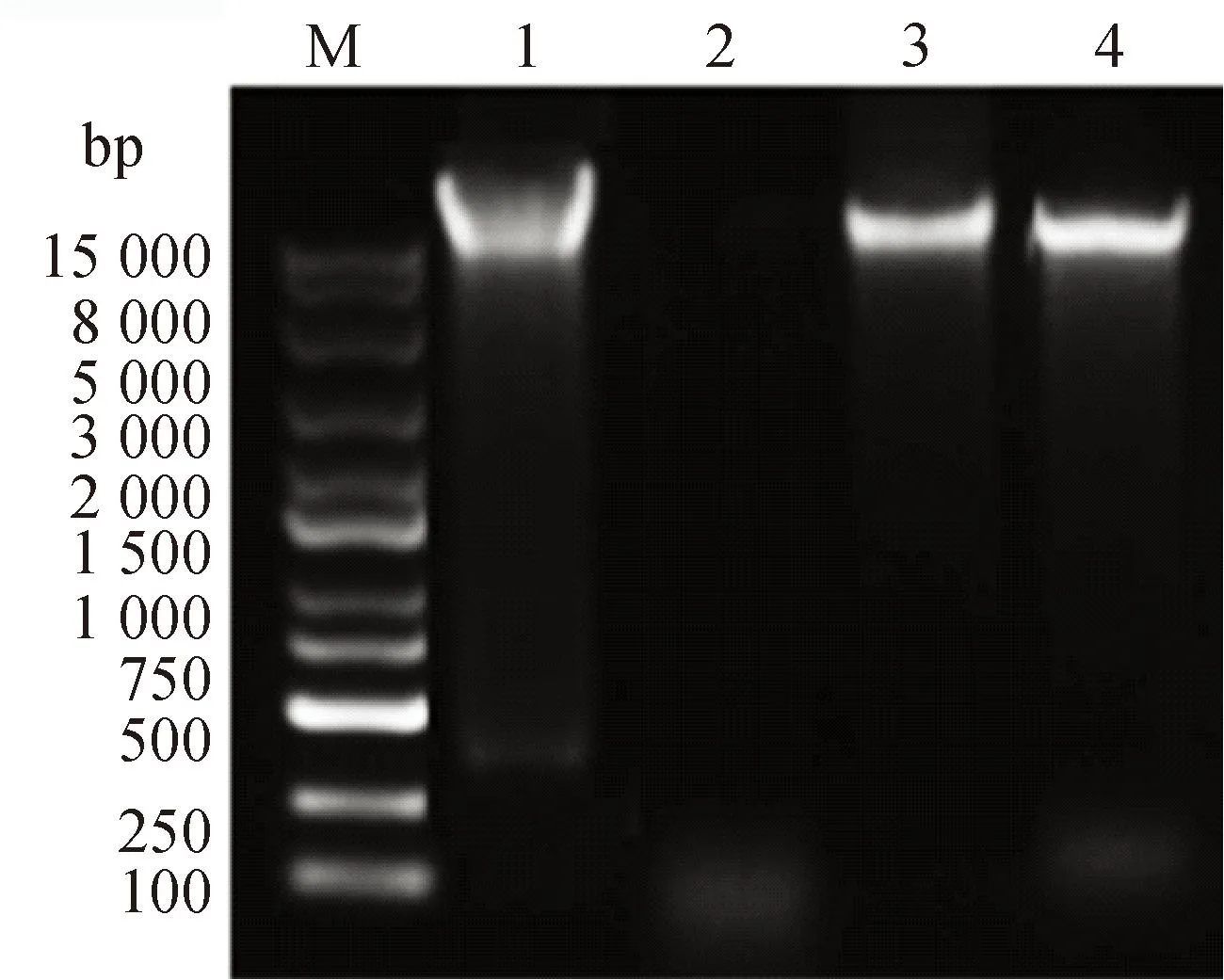
M. DL15000 DNA相对分子质量标准;1. PaVOB核酸阴性对照;2. PaVOB核酸DNase I处理;3. PaVOB核酸RNaseA处理;4. PaVOB核酸Mung Bean Nuclease处理 M. DL15000 DNA marker; 1. PaVOB nucleic acid negative control; 2. PaVOB nucleic acid DNase I treatment; 3. PaVOB nucleic acid RNaseA treatment; 4. PaVOB nucleic acid Mung Bean Nuclease treatment
2.2.2 基因组一般特性分析结果 PaVOB(NCBI登录号OQ743452)的全基因组测序结果如图4所示,PaVOB基因组全长为72 179 bp,C+G含量为54.81%,另外在线软件预测结果显示,未在PaVOB中发现毒力基因、耐药基因和tRNA编码基因的存在。
2.2.3 噬菌体进化分析结果 基于噬菌体全基因组的进化分析结果如图5所示,PaVOB与一个未分类的噬菌体vB PaeP FBPa1亲缘关系小于0.1,且vB PaeP FBPa1属于有尾噬菌体目,结合TEM形态可以确定PaVOB属于长尾噬菌体科的新成员。
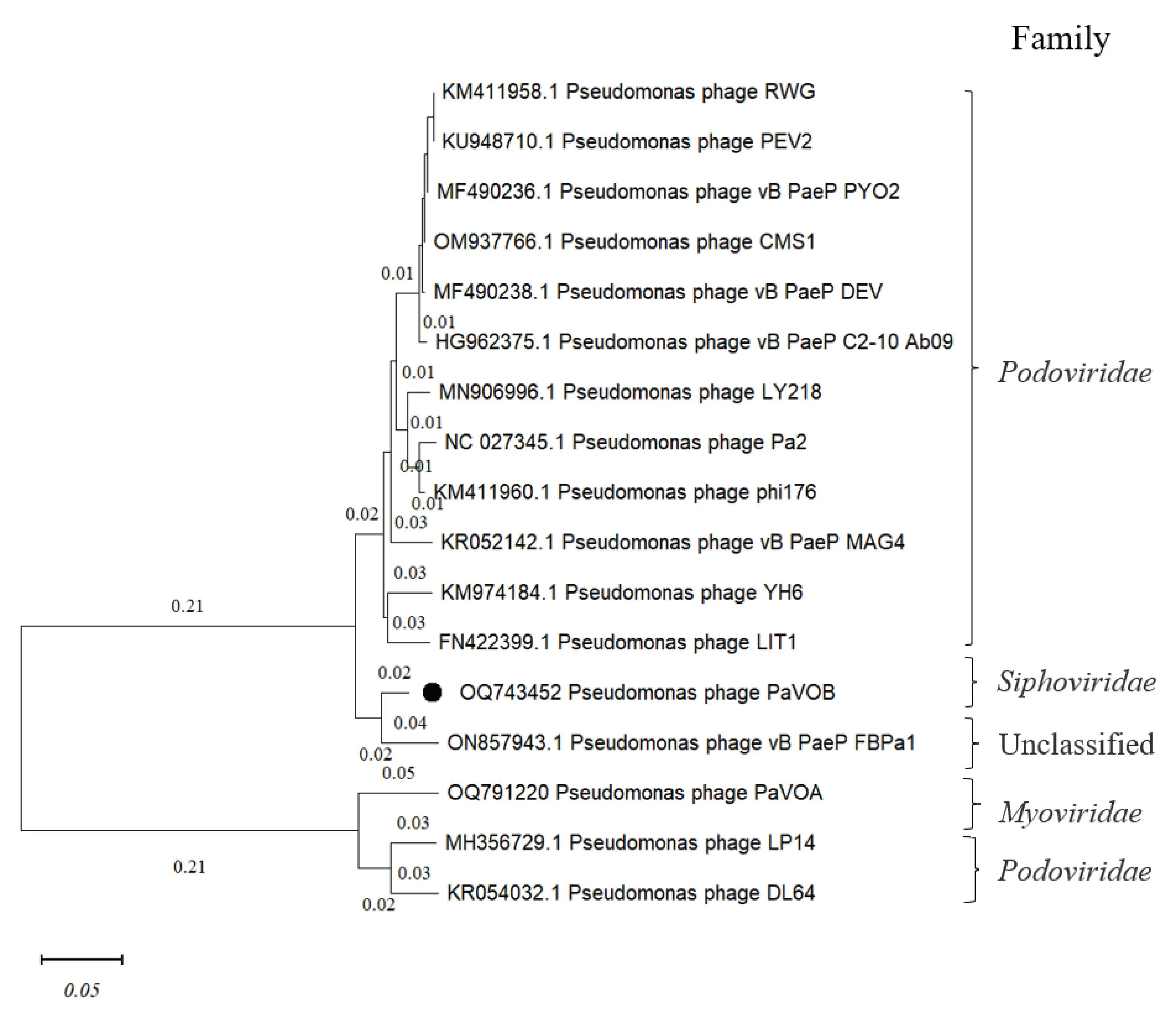
图5 PaVOB进化分析Fig.5 Evolution analysis of PaVOB
2.2.4 预测的噬菌体基因组ORF及其功能注释结果 PaVOB预测共得到74个ORF,其中37个分布在正链上,37个分布在负链上,23个未在蛋白质数据库中找到相似蛋白,13个ORF与数据库中的功能蛋白有较高的相似性(见表2),包括病毒相关RNA聚合酶(ORF41)、推定门户蛋白(ORF47)、终止酶大亚基(ORF66)、推定裂解尾纤维蛋白(ORF40)、假定的DNA聚合酶I(ORF20)、推定结构蛋白(ORF51)、推定的单链DNA结合蛋白(ORF4)、N4 gp67样蛋白(ORF45)、N4 gp55样蛋白(ORF50)、主要衣壳蛋白(ORF62)、假定的dUTPase(ORF61)、N4 gp48样蛋白(ORF27)和dUTP核苷酸水解酶(ORF34),剩余ORF均为假想蛋白。

表2 PaVOB功能蛋白注释信息
2.3 噬菌体与抗生素体外联合应用
如图6a所示,结果呈现了噬菌体与头孢曲松联合应用的效果,数值代表细菌清除率,数值越大,颜色越深,清除效果越好。PaVOB与头孢曲松联合应用有增强作用,在头孢曲松浓度≥24.40 μg·mL-1时,细菌清除率达到55%以上,PaVOB浓度在106~107PFU·mL-1时,与头孢曲松联合杀菌效果最好,细菌清除率达到90%~100%。
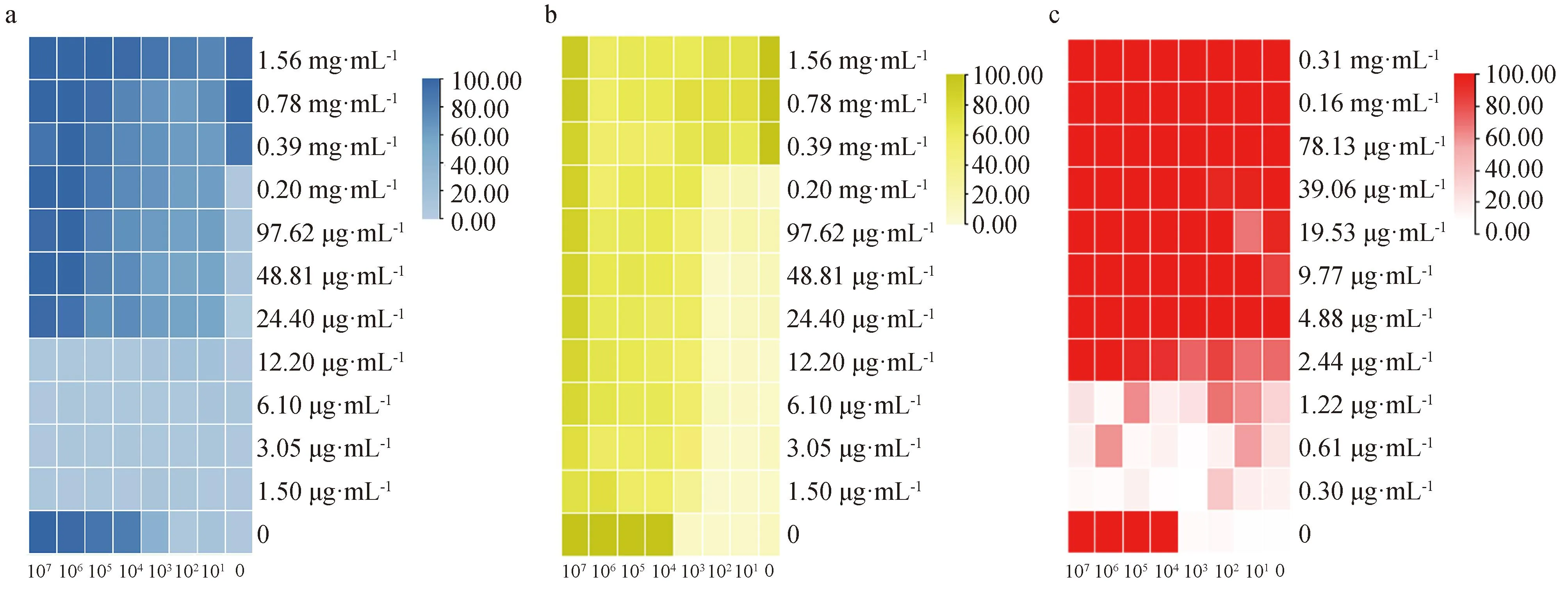
a. 头孢曲松与PaVOB联合应用;b.恩诺沙星与和PaVOB联合应用;c.庆大霉素与和PaVOB联合应用a. Combination application of ceftriaxone and PaVOB; b. Combination application of enrofloxacin and PaVOB; c. Combination application of gentamicin and PaVOB
如图6b所示,PaVOB只有在效价为107PFU·mL-1时,对恩诺沙星的杀菌效果起到增强作用,低效价产生抑制作用,细菌清除率下降20%~90%。庆大霉素与PaVOB联合使用见图6c,PaVOB对庆大霉素未表现出明显的增强或者抑制作用,庆大霉素的MIC无明显变化。
3 讨 论
本研究从广州南方医院污水中分离鉴定出长尾噬菌体PaVOB,能够100%裂解临床分离铜绿假单胞菌菌株,获得直径为2~3 mm的噬菌斑。但PaVOB表现出一个较窄的宿主谱,相比于噬菌体BrSP1对37株铜绿假单胞菌菌株有51.4%的裂解率[16],PaVOB仅仅裂解了17.2%的测试菌株,甚至有些噬菌体PPaMa1/18对铜绿假单胞菌临床分离株的裂解率达到85.7%[17]。
3.1 铜绿假单胞菌噬菌体生物学特性分析
研究噬菌体的生物学特性有助于更好的在临床中应用噬菌体。本研究中的PaVOB的最佳MOI为0.001,表明噬菌体可以在小的数量级感染多达10倍甚至1 000倍的细菌,在实际抗菌方面能发挥出强大作用。PaVOB的潜伏期为10 min,裂解期为120 min,与Kumar等[18]分离的噬菌体2019SD1以及Ma和Lu[19]分离的噬菌体SMP相比,PaVOB的潜伏期更短,表明噬菌体可以更快地感染细菌,体现出PaVOB的高效性。PaVOB在10 min内的吸附率更高,为99.1%,更快地吸附速度有利于及时消灭病原菌,同时也体现了噬菌体对宿主菌独特的吸附机制,这可能与特异性受体有关。
噬菌体对环境的适应性对于临床应用至关重要。本研究显示,在-20~60 ℃温度范围内,PaVOB活性相对稳定,PaVOB在60 ℃时还具有61%的存活率,噬菌体耐低温能力较强,有利于在实际环境中生存。PaVOB在pH3~pH12的范围内都具有活性,表明其能够在多数酸碱环境中存活。
3.2 铜绿假单胞菌噬菌体全基因组测序分析
研究噬菌体全基因组,能够进一步鉴定和了解物种信息,本研究经过高通量测序,鉴定出新的噬菌体PaVOB,通过NCBI进行全基因组序列比对,与其亲缘关系最近的是铜绿假单胞菌噬菌体(相似性大于95%),符合研究目标,说明测序结果准确。
PaVOB的基因组全长为72 179 bp,基因组与铜绿假单胞菌噬菌体PA26大小相似,为72 321 bp[20],C+G含量为54.81%,与其他噬菌体都不相同,这是由于GC含量代表物种的特征。此外,未在PaVOB中发现毒力基因和耐药基因的存在,表明PaVOB用于临床治疗中的可能性,安全性能得到一定程度的保证。tRNA基因是一种噬菌体可以选择性整合到其基因组中的转运基因,可能有助于提高噬菌体的毒力,以达到更好的适应性,本文中PaVOB没有tRNA编码基因,表明噬菌体作为一种寄生病毒自身不能合成蛋白质的特点。从进化关系分析,PaVOB与一个未分类的噬菌体vB PaeP FBPa1亲缘关系小于0.1,也可以推测出vB PaeP FBPa1可能是长尾噬菌体,进化结果也说明了PaVOB为长尾噬菌体科新发现的成员,再一次展示出噬菌体在自然界中的多样性和丰富性,是宝贵的研究材料。
PaVOB 的ORF功能主要分为DNA复制与调控、裂解蛋白和结构蛋白。RNA聚合酶、单链DNA结合蛋白、DNA聚合酶I、dUTPase和dUTP核苷酸水解酶都参与DNA复制以及转录过程,对子代的复制有着不可忽视的作用;噬菌体终止酶能够包装基因组,终止酶大亚基和小亚基构建成终止酶,然而不同的噬菌体大亚基功能不同,例如噬菌体P22的终止酶大亚基(gp2)采用头部机制将DNA包装成预先形成的前衣壳结构[21];门户蛋白的功能类似于DNA传感器,将基因组包装与二十面体衣壳成熟偶联[22];裂解尾纤维蛋白与感染和裂解宿主菌有关,可能也是导致宿主特异性的一种原因,与主要衣壳蛋白都可以作为受体,通过噬菌体展示技术对其进行基因改造是扩大宿主谱的一种方法;噬菌体发挥独特功能主要依靠结构蛋白,在噬菌体的组成、运动以及感染各个过程中都有结构蛋白发挥基础功能,研究噬菌体的基因特性,可以通过蛋白质组技术对结构蛋白进行鉴定和分析,获取详细信息。
此外,PaVOB含有多的N4样蛋白,包括N4 gp48样蛋白、N4 gp67样蛋白、N4 gp48样蛋白和N4 gp55样蛋白。N4是一种裂解性短尾噬菌体,对其基因组研究非常深入和透彻,被认为是N4噬菌体属[23],目前很多新发现的噬菌体也被归类到N4属,例如LUZ7[24]和PEV2[25],这些蛋白在N4中都有特定的功能,而在PaVOB中出现,可能预示着它们之间亲密的关系,也说明该属的分布广泛,是最早被分离研究的噬菌体之一,之后可以参照N4对其基因组进行详细分析。
3.3 噬菌体与抗生素联合应用分析
本研究选用三种不同抑菌机制的抗生素与PaVOB体外联合应用,旨在探索两者的联合效果,发挥出更强大的抗菌作用,而且噬菌体与抗生素联合应用还能大大降低细菌耐受的概率,也是一种对抗超级细菌的手段。头孢曲松是头孢菌素类抗菌药,主要通过抑制细菌细胞壁的合成而发挥抗菌作用。在此研究中,PaVOB与头孢曲松联合应用有增强作用,且与噬菌体浓度有关,噬菌体浓度在106~107PFU·mL-1时,与头孢曲松联合杀菌效果最好。根据之前的研究,亚抑菌浓度的头孢曲松与噬菌体协同作用会导致铜绿假单胞菌细胞显著伸长和丝状化,并提供一种排除干扰噬菌体增殖的作用方式[26],尽管具体机制还未明确,但是这种结果令人信服,Xu等[27]也证实噬菌体vB_1086与头孢曲松具有协同作用。
恩诺沙星是喹诺酮类抗生素,又称乙基环丙沙星,其抗菌机制主要是阻断细菌DNA的复制。本研究中,PaVOB只有在效价为107PFU·mL-1时,对恩诺沙星的杀菌效果起到了增强作用,低效价甚至产生抑制作用。由于恩诺沙星与噬菌体联合应用的报道并不多见,因此参考同一类的环丙沙星,根据Knezevic等[26]的研究,环丙沙星与噬菌体协同作用也会导致铜绿假单胞菌细胞显著伸长和丝状化,还有种可能是噬菌体清除掉细菌生物膜之后,使恩诺沙星的穿透性更强,直接作用在细菌体内,从而起到协同作用,这与Akturk等[28]的研究结果相似,同时需要考虑联合治疗中抗生素浓度和抗生素作用时间对协同应用的影响,例如一项研究显示,在加入噬菌体6 h后添加最低抑菌浓度的抗生素,联合处理可防止细菌再生[29]。
庆大霉素属于氨基糖苷类抗生素,抗菌机制为抑制蛋白质合成与30 S核糖体亚基结合并破坏细胞包膜。本研究中庆大霉素与PaVOB联合使用,未表现出任何作用。这可能与噬菌体类型有关,先前报道指出,丝状噬菌体可以增加铜绿假单胞菌对庆大霉素的敏感性[30],不仅如此,氨基糖苷类抗生素还会通过阻断感染周期的早期步骤来抑制噬菌体感染[31],因此,在测试噬菌体与抗生素的联合效果时,需要考虑到噬菌体的类型和抗生素的种类,减少不必要的工作。
4 结 论
分离鉴定出一株具有双链DNA基因组的长尾噬菌体PaVOB,进化关系显示其为新发现的噬菌体,未携带毒力基因等有害基因。生物学特性表明其对环境适应性良好。体外联合用药结果表明,PaVOB与头孢曲松联合应用有协同作用,PaVOB在效价为107PFU·mL-1时,与恩诺沙星产生协同作用。该噬菌体具有用于临床治疗中的可能性,为进一步研究铜绿假单胞菌噬菌体制剂奠定了基础。
