1株马乳源PVL+ST22型金黄色葡萄球菌致病性分析
2024-03-01吴自豪蔡依龙陀海欣
吴自豪,蔡依龙,陀海欣,陈 伟,*
(1.塔里木大学生命科学与技术学院 新疆生产建设兵团塔里木动物疫病诊断与防控工程实验室,阿拉尔 843300;2.塔里木大学动物科学与技术学院,阿拉尔 843300)
金黄色葡萄球菌(Staphylococcusaureus)是一种可在人和动物之间交叉感染的病原菌,ST22、ST5和ST398等谱系的流行性耐甲氧西林金黄色葡萄球菌(epidemic meticillin-resistantStaphylococcusaureus, EMRSA)已在多个国家和地区报道,可导致人和畜禽的多种疾病,甚至引起死亡[1-3],对世界公共卫生安全和食品生产安全存在威胁。ST22型金黄色葡萄球菌在中国、欧洲、丹麦、马来西亚和新加坡等国家和地区被相继报道,尤其是EMRSA-15(ST22-IVh)谱系的传播最快,有强大的优势取代其它流行的MRSA谱系[3-5]。Panton-Valentine杀白细胞素(PVL,由lukF调控合成)可破坏宿主白细胞,并且与严重的侵袭性皮肤感染高度相关[6-7]。在我国已有PVL+ST22型金黄色葡萄球菌流行株造成的多人皮肤和软组织感染以及血液感染的报道[8],其也曾在悉尼造成新生儿死亡[9]等。ST22型金黄色葡萄球菌常在猫、狗等小型伴侣动物中发现,也可在马和马兽医中被检测到[10-14],表明其可能存在人兽交叉感染风险。但目前我国马源金黄色葡萄球菌的相关报道较少,关于马源PVL+ST22型金黄色葡萄球菌的相关报道更是寥寥无几。
随着我国经济的快速发展,马养殖业及其相关产业也在迅猛发展。关于金黄色葡萄球菌在马的养殖过程中对马本身的危害,及其可能引发的公共卫生安全问题不容忽视。本研究对从新疆伊犁某马场分离得到的1株PVL+ST22型马乳源金黄色葡萄球菌进行毒力基因检测,并进行药物敏感性检测和致病性分析,以期为国内马源金黄色葡萄球菌的相关研究提供基础试验数据。
1 材料与方法
1.1 试验材料
1.1.1 样品采集与菌株 在新疆伊犁某马场随机抽取哺乳期健康母马65匹(养殖规模>300匹;每个马厩养殖15~20匹;样品采集自8个马厩,每个马厩5~10份),使用酒精对乳区进行消毒,然后弃去前三把乳汁,用无菌离心管收集10 mL马乳[15],共65份乳样,于-20 ℃保存,10 d内低温运输至实验室进行处理。
小鼠巨噬细胞RAW264.7、金黄色葡萄球菌ATCC 25923(携带nuc)、奶牛乳源金黄色葡萄球菌72-1-1[16](携带lukF)和表皮葡萄球菌ATCC 35984(强生物被膜形成)由新疆生产建设兵团塔里木动物疫病诊断与防控工程实验室保存。
1.1.2 主要试剂及仪器 PCR基因扩增引物、Tris-HCl、SDS、EDTA、Easy Taq 2X Mix,均购自上海生工生物工程有限公司;PCR仪、凝胶成像系统、电泳仪购自Bio-Rad公司;药敏片均购自温州市泰康生物科技有限公司。DMEM(Dulbecco′s modified eagle medium)和胎牛血清购自于Gibco公司。胰酶购自思拓凡(Cytiva)公司。健康兔血清和去纤维绵羊血由新疆生产建设兵团塔里木动物疫病诊断与防控工程实验室提供。
1.1.3 培养基 甘露醇高盐琼脂培养基(MSA)用于选择性培养金黄色葡萄球菌,胰蛋白胨大豆琼脂/液体培养基(TSA/TSB)用于金黄色葡萄球菌的增殖培养,MHA/MHB培养基用于K-B纸片法药敏试验,DMEM培养基用于小鼠巨噬细胞的培养。
1.2 方法
1.2.1 葡萄球菌的分离与鉴定 取2 mL乳样离心(12 000 r·min-1,2 min),用TSB重悬后加入5 mL TSB培养基中富集培养(37 ℃,18~24 h),然后划线接种到MSA培养基上选择性培养。观察菌落形态,挑取表面光滑、边缘整齐、中度隆起的金黄色或柠檬色菌落,划线接种于TSA培养基上进行纯培养。然后进行革兰染色镜检,将呈葡萄串状的革兰阳性球菌于-80 ℃贮存。
参考文献[17]中的方法,以金黄色葡萄球菌ATCC 25923为阳性对照,无菌水为空白对照,对分离得到的葡萄球菌进行触酶试验、凝固酶试验和甘露醇发酵试验。然后将革兰染色镜检筛出的葡萄球菌全部进行nuc基因扩增检测[18](扩增产物大小在279 bp且条带单一明亮,为阳性菌株)。对nuc基因扩增阳性的菌株进行16S rRNA基因扩增,将PCR扩增产物测序,并将序列在NCBI网站上(https:∥www.ncbi.nlm.nih.gov/)进行比对。
1.2.2 MLST分型与spa分型 多位点序列分型(multilocus sequence typing,MLST)通过PCR扩增测序金黄色葡萄球菌的7个持家基因(arcC、aroE、glpF、gmk、pta、tpi和yqiL),并将基因序列在MLST官方网站(https:∥pubmlst.org)进行对比,获得菌株序列型[19]。
spa分型通过PCR扩增spa基因(葡萄球菌蛋白A)的多态X区并进行测序,然后将基因序列在官方网站(https:∥cge.cbs.dtu.dk)进行对比,获得菌株spa型[19]。
1.2.3 药物敏感性试验 根据美国临床和实验室标准协会指南(CLSI, 2021)标准操作要求和判断标准,以ATCC 25923为质控菌株,使用K-B纸片法对金黄色葡萄球菌进行10类12种药物的敏感性检测。包括β-内酰胺类的青霉素(P)、头孢西丁(FOX)和头孢噻吩(KF);氯霉素类的氯霉素(C);大环内酯类的红霉素(E);噁唑烷酮类的利奈唑胺(LZD);利福霉素类的利福平(RD);四环素类的四环素(TE);磺胺类的复方新诺明(SXT);喹诺酮类的诺氟沙星(NOR);氨基糖苷类的庆大霉素(CN);林可酰胺类的克林霉素(DA)。
1.2.4 毒力基因检测 使用PCR技术对分离得到的金黄色葡萄球菌进行20种毒力基因[16]检测,包括编码葡萄球菌肠毒素(sea、seb、sec、sed、see、seg、seh、sei和sej)、中毒性休克综合征毒素(tsst-1)、剥脱毒素(eta和etb)、PVL(lukF)、溶血素(hla和hlb)、纤连蛋白结合蛋白(fnbA和fnbB)、凝聚因子(clfA和clfB)和胶原蛋白黏附素(cna)的基因。扩增程序为:94 ℃预变性5 min;94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃最后延伸10 min。
1.2.5 生物被膜形成能力检测 分别以表皮葡萄球菌ATCC 35984和无菌水为阳性和空白对照,参考文献[19]中的方法对金黄色葡萄球菌进行生物被膜形成能力检测与判定。操作步骤为:将过夜培养的金黄色葡萄球菌转接至TSB培养基中摇床培养4~6 h,至菌液呈云雾状。再1∶100稀释后取200 μL加入96孔细胞培养板,37 ℃静置培养24 h,然后弃去菌液,用PBS冲洗2~3次,置于56 ℃烘箱中烘干。再用1%的结晶紫染色15 min,冲洗、晾干后使用丙酮/乙醇(20%/80%)进行溶解,测定OD570 nm[19]。
1.2.6 溶血能力检测 取100 μL过夜培养后的细菌上清液(12 000 r·min-1,2 min)与900 μL含3%绵羊红细胞的磷酸盐缓冲液(PBS)混合。37 ℃孵育30 min,离心(8 000 r·min-1,2 min)后,在540 nm处测定上清液溶血程度。阳性对照为1 000 μL含3%绵羊红细胞的ddH2O混合液,阴性对照为1 000 μL含3%绵羊红细胞的PBS混合液[20]。
1.2.7 小鼠皮肤脓肿模型 用脱毛膏去除小鼠背部被毛,然后试验组接种100 μL含有5×107CFU·mL-1金黄色葡萄球菌的PBS,对照组接种100 μL无菌PBS。接种24 h后测量小鼠皮肤脓肿的长度(L)和宽度(W)。面积计算公式为A=π(长×宽)/2[2]。
1.2.8 小鼠致病性试验 将金黄色葡萄球菌于TSA上传代复苏(37 ℃恒温过夜培养),然后挑取单个菌落置于TSB液体培养基中37 ℃,180 r·min-1培养24 h。8 000 r·min-1离心5 min收集菌体,使用PBS洗涤2次,并将菌液浓度分别调整为5×108、5×107和5×106CFU·mL-1。将32只体重为(23±3)g的小鼠随机分为4组(每组8只),试验组小鼠分别腹腔注射0.2 mL不同稀释度的菌液。对照组注射0.2 mL无菌PBS。接种后观察感染小鼠的临床状症及死亡情况[21]。
1.2.9 金黄色葡萄球菌在小鼠巨噬细胞中的黏附作用 将小鼠巨噬细胞RAW264.7在DMEM培养基(10%胎牛血清)中连续培养三代,然后用胰酶消化分散成单个细胞,按每孔1×105个细胞的密度加至6孔细胞培养板中,置37 ℃,5% CO2细胞培养箱中过夜培养至每孔约含2×105个细胞(单层)。收集对数期OD600 nm=0.6的金黄色葡萄球菌菌液,离心后用无菌PBS洗涤3次后用DMEM重悬,按照细菌细胞MOI比为100∶1侵染细胞,每组做3孔重复。6孔细胞培养板用水平微振荡仪室温振荡10 min,使细菌与细胞充分接触;置于37 ℃孵育1 h后,用无菌PBS洗3遍,除去非特异性附着的菌。然后每孔加入1 mL 0.2% TritonX-100,37 ℃孵育10 min;吹打孔底,吸出孔内液体,6 000 r·min-1离心5 min,弃上清,PBS重悬并梯度稀释。取3个合适的稀释度涂布在高盐甘露醇琼脂平板,37 ℃培养过夜,计算黏附率[22]。黏附率=(黏附细菌数/加入总细菌数)×100%。
1.2.10 金黄色葡萄球菌在小鼠巨噬细胞中的侵袭作用 参照“1.2.9”步骤培养细胞,将巨噬细胞用细菌感染置于37 ℃孵育1 h,PBS洗涤后加入含有50 μg·mL-1庆大霉素的DMEM再培养1 h,无菌PBS洗涤并裂解细胞,进行梯度稀释涂板计数,每组3个重复,测定金黄色葡萄球菌对细胞的侵袭率[22]。侵袭率=(侵袭细菌数/加入总细菌数)×100%。
1.2.11 金黄色葡萄球菌在小鼠巨噬细胞中的存活和增殖能力 参照“1.2.9”步骤培养细胞,将细菌侵染巨噬细胞,在感染1 h后加入含有庆大霉素(50 μg·mL-1)的DMEM继续培养1 h,PBS洗涤后再加入不含抗生素的DMEM孵育。以此时为0 h,然后在4、8、12、16和24 h后去除培养基,无菌PBS洗涤3次后裂解细胞,进行梯度稀释涂板计数,每组3个重复,测定金黄色葡萄球菌的细胞内存活和增殖能力[22]。
1.2.12 数据分析 使用GraphPad Prism 7软件选择T检验方法分析数据,P<0.05表示数据具有显著性差异。
2 结 果
2.1 金黄色葡萄球菌的分离鉴定
经生化鉴定和分子鉴定从65份马乳中得到金黄色葡萄球菌1株(命名为282)。生化试验结果显示,其触酶试验、凝固酶试验和甘露醇发酵试验均为阳性。并且nuc基因扩增阳性,如图1。
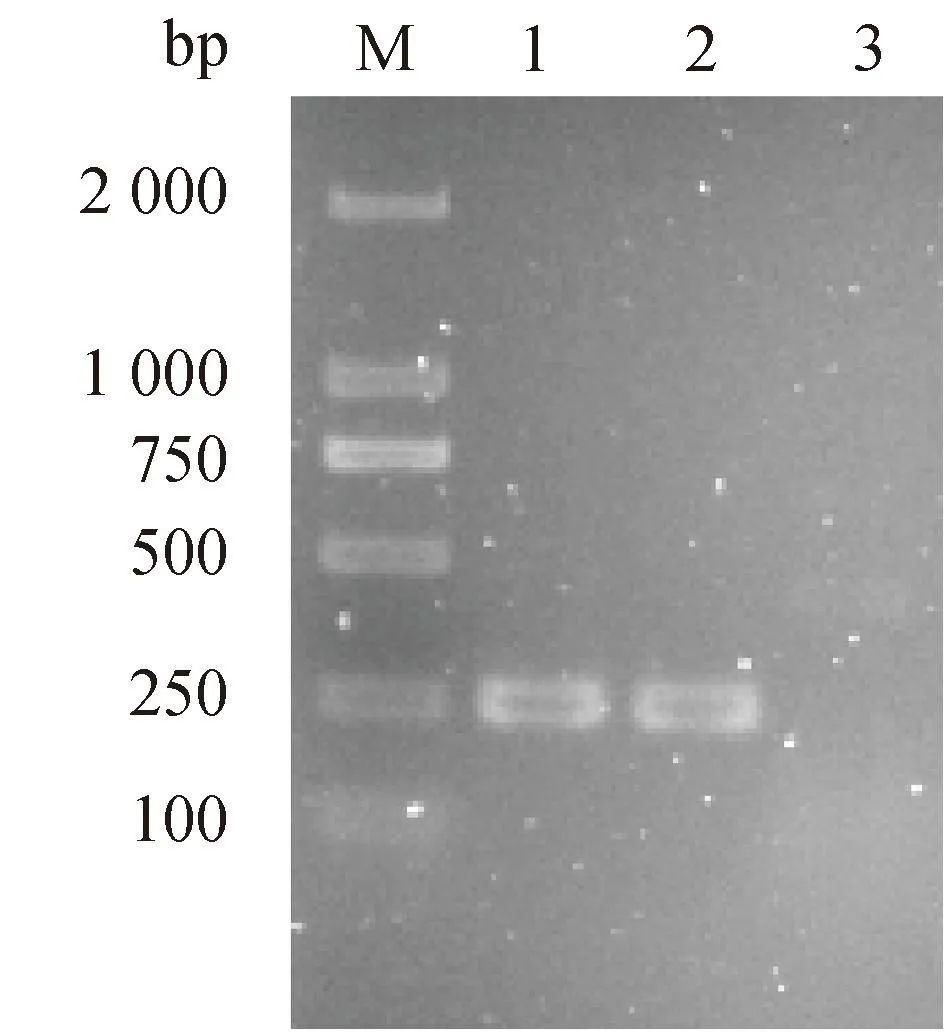
M. DL 2 000 DNA marker;泳道1. 阳性对照,金黄色葡萄球菌ATCC 25923;泳道2. 待检菌株(282);泳道3. 空白对照M. DL 2 000 DNA marker; Lane 1. Positive control, S. aureus ATCC 25923; Lane 2. Strain to be tested (282); Lane 3. Blank control
2.2 MLST分型和spa分型
通过分子分型分析,从马乳中获得的金黄色葡萄球菌282的MLST分型为ST22(MLST allele:7-6-1-5-8-8-6),spa分型为t304(Repeats:26-23-05-17-25-17-25-16-28)。
2.3 药物敏感性试验与生物被膜形成能力检测
药敏试验结果表明,分离得到的金黄色葡萄球菌仅对青霉素耐药,对其他药物均不耐药,并且无生物被膜形成能力(OD570 nm=0.135),见表1。
2.4 毒力基因检测
通过PCR扩增检测,在本研究中的马乳源金黄色葡萄球菌中不仅检测到编码PVL的lukF基因(图2),还检测到9种其他毒力基因,包括编码葡萄球菌肠毒素的sec、seg和seh基因,编码中毒性休克综合征毒素的tsst-1基因,编码溶血素的hla和hlb基因,编码凝集因子的clfA和clfB,编码胶原蛋白黏附素的cna基因(图3)。
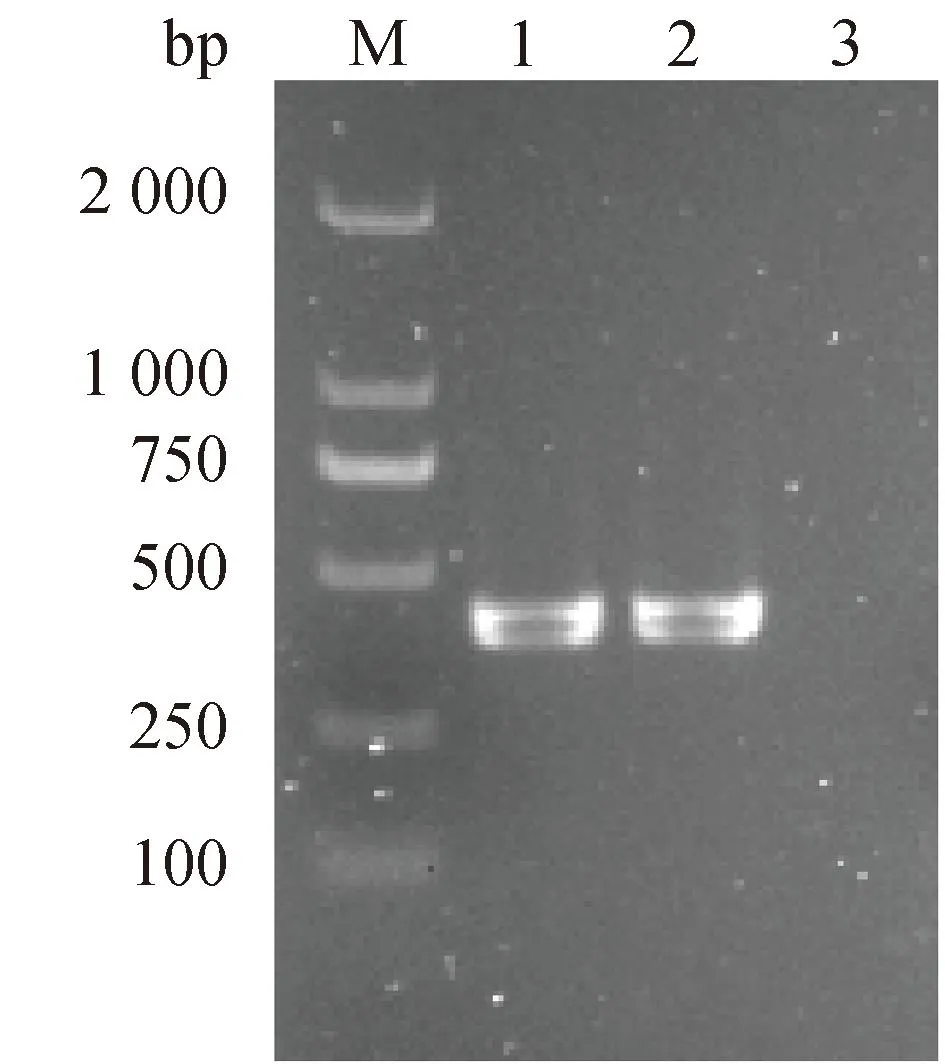
M. DL 2 000 DNA marker;泳道1. 阳性对照,金黄色葡萄球菌72-1-1;泳道2. 待检菌株(282);泳道3. 空白对照M. DL 2 000 DNA marker; Lane 1. Positive control, S. aureus 72-1-1; Lane 2. Strain to be tested (282); Lane 3. Blank control
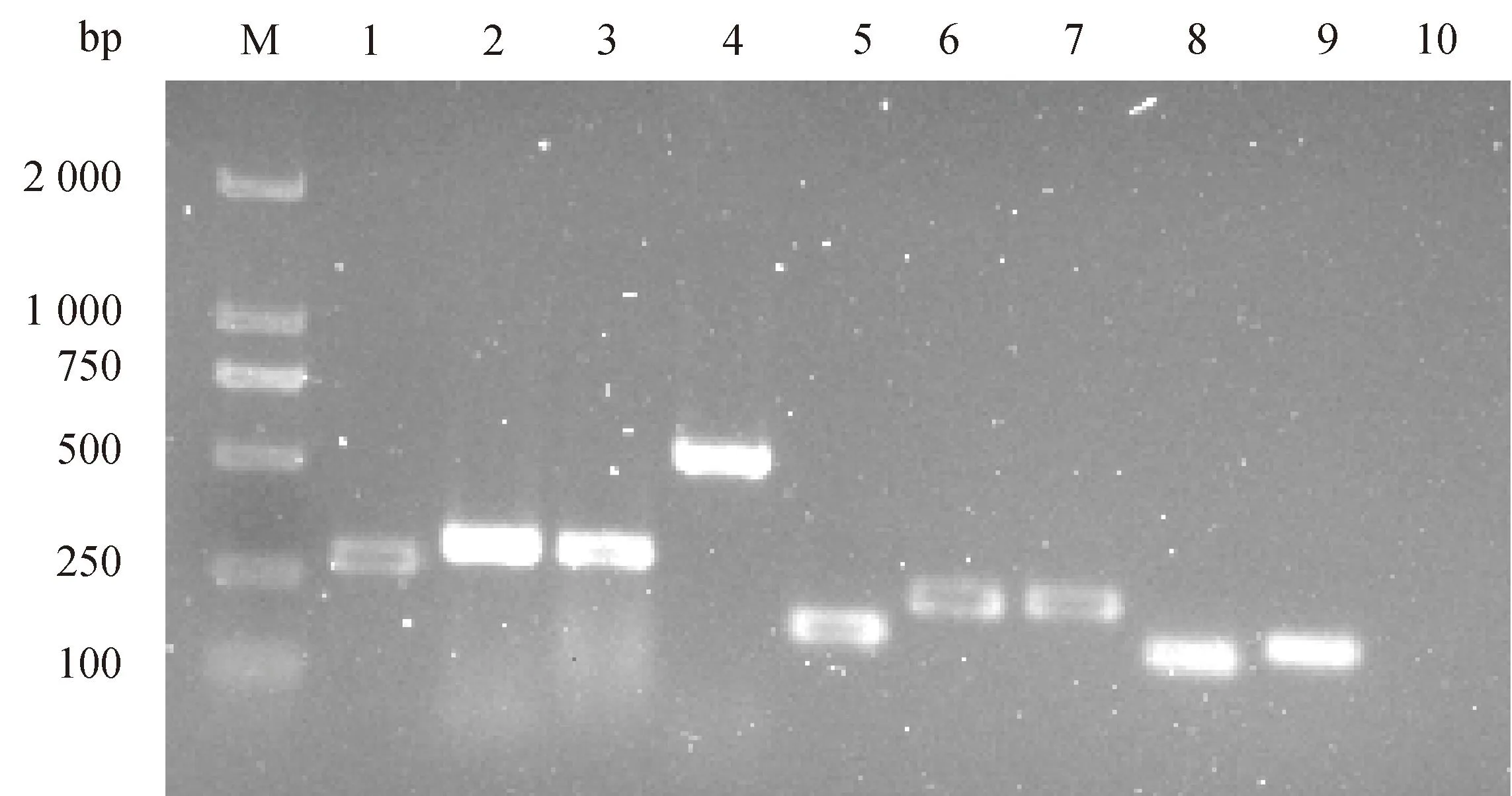
M. DL 2 000 DNA marker;泳道1~9分别为sec(284 bp)、seg(328 bp)、seh(359 bp)、tsst-1(559 bp)、hla(209 bp)、hlb(309 bp)、clfA(292 bp)、clfB(194 bp)和cna(228 bp);泳道10. 空白对照M. DL 2 000 DNA marker; Lanes 1-9 are sec (284 bp), seg (328 bp), seh (359 bp), tsst-1 (559 bp), hla (209 bp), hlb (309 bp), clfA (292 bp), clfB (194 bp), and cna (228 bp), respectively; Lane 10. Blank control
2.5 溶血性检测
溶血活性试验结果表明,金黄色葡萄球菌282具有溶血活性,OD540 nm为2.15(图4)。
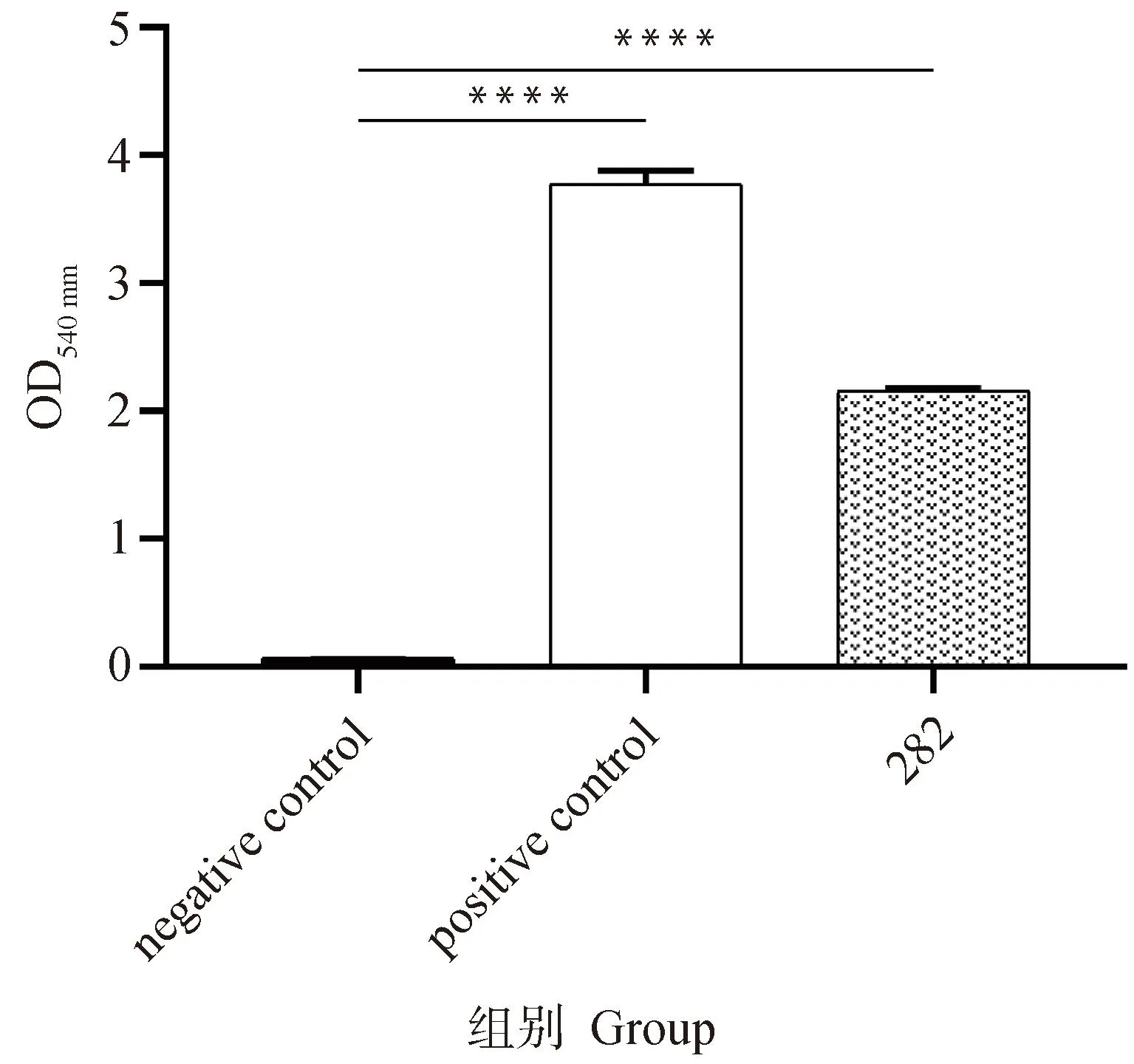
****. P<0.000 1
2.6 皮肤感染试验
小鼠皮肤感染试验表明,本研究中的马乳源金黄色葡萄球菌具有皮肤感染的能力,可在小鼠背部形成A=(99.63±24)mm2的脓肿(图5)。

图5 小鼠皮肤感染模型Fig.5 Mouse skin infection model
2.7 小鼠致病性试验
本研究使用小鼠腹腔感染模型进一步评估金黄色葡萄球菌282的致病性,结果表明,5×108CFU·mL-1注射组在24 h时即有7只小鼠死亡,48 h时全部死亡;5×107CFU·mL-1注射组在24 h时有1只小鼠死亡,其他小鼠出现被毛凌乱、精神沉郁和活动减弱等临床症状,至3 d时开始好转;5×106CFU·mL-1注射组无小鼠死亡,在24 h时出现嗜睡和活动减弱等症状,但轻于5×107CFU·mL-1注射组,并且48 h时好转(图6)。说明金黄色葡萄球菌282具有一定的致病风险。
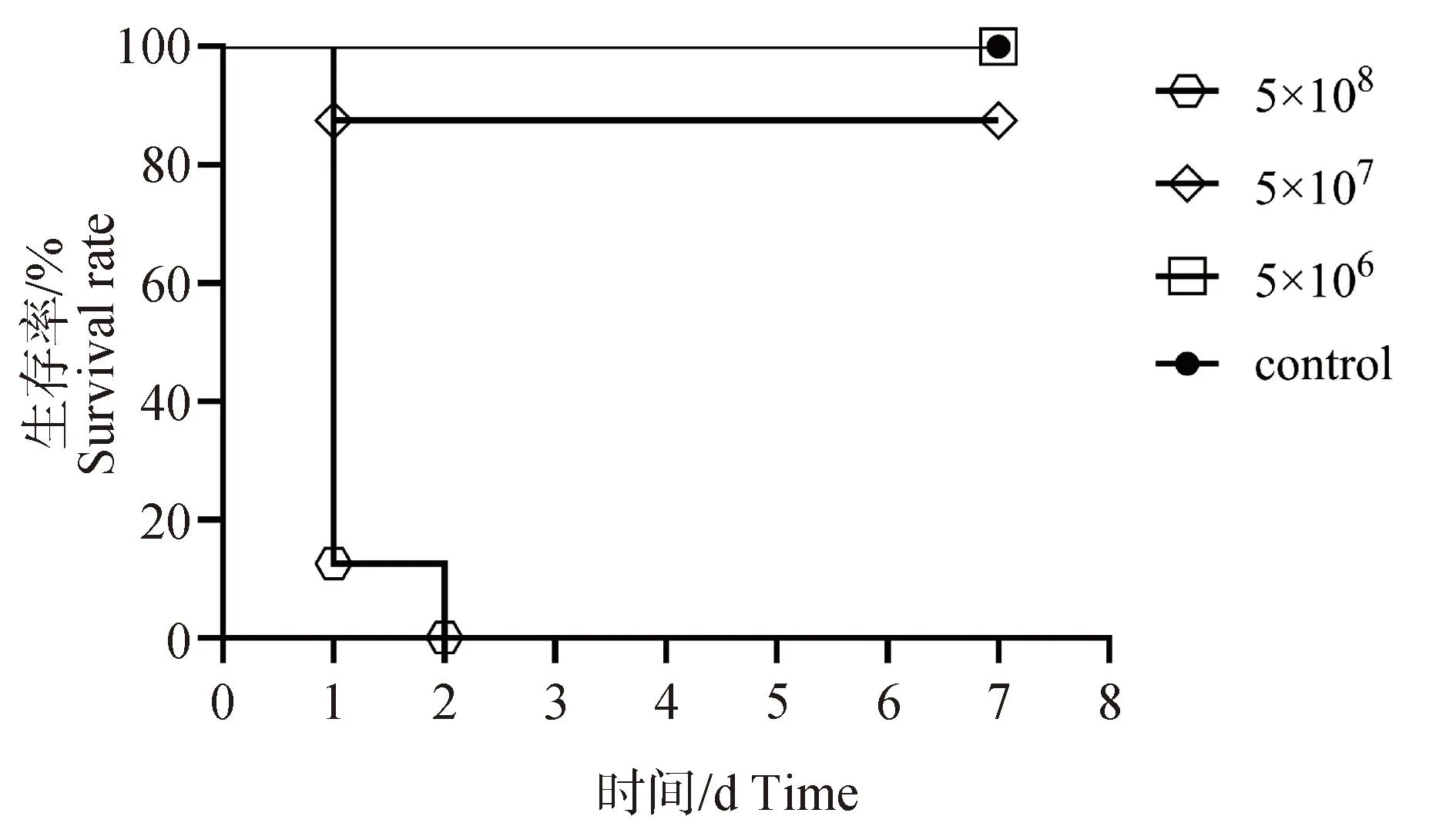
图6 小鼠生存曲线Fig.6 Survival curve of mouse
2.8 细胞黏附、侵袭和胞内增殖试验
小鼠巨噬细胞试验结果表明,马乳源金黄色葡萄球菌具有黏附和侵袭小鼠巨噬细胞的能力,黏附率、侵袭率分别为4.26%和6.45%(图7a)。胞内增殖试验结果也表明,马乳源金黄色葡萄球菌进入小鼠巨噬细胞后0~4 h未迅速增殖,在4~12 h时增殖迅速,12~24 h时细菌的胞内增殖趋于停止(图7b)。
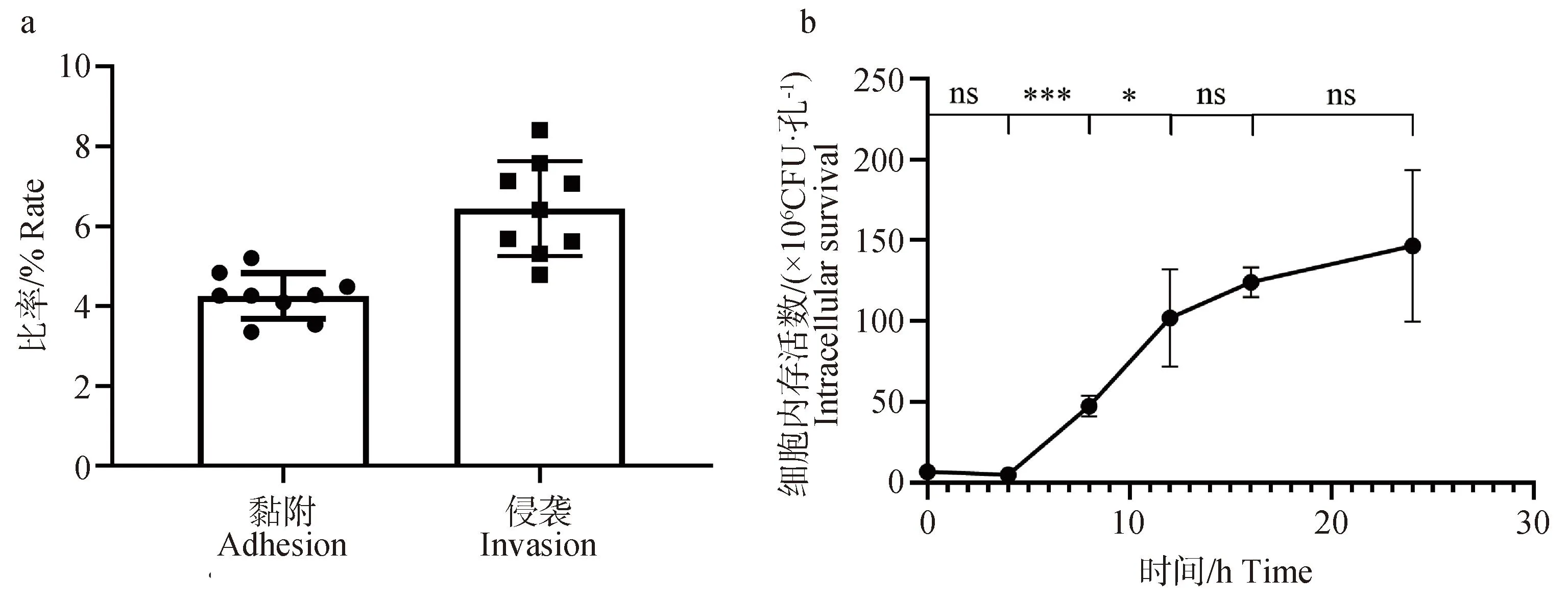
a. 细胞黏附与侵袭;b. 胞内增殖;*. P< 0.05;***. P< 0.001;ns. 差异不显著a. Cell adhesion and invasion; b. Intracellular proliferation; *. P< 0.05;***. P< 0.001;ns. no significance
在荧光倒置显微镜下观察细胞形态可见,培养4 h金黄色葡萄球菌可引起细胞膨大、分化形成伪足(图8b),8 h细胞出现崩解和凋亡(图8c),在12~24 h出现细胞出现大规模凋亡(图8d~e),巨噬细胞基本被破坏(图8f)。
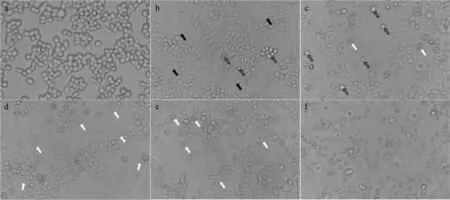
a~f. 分别为培养0、4、8、12、16、24 h;黑色箭头. 细胞分化形成伪足;黑色空心箭头. 细胞脱落;白色箭头. 细胞崩解a-f. Cultured for 0、4、8、12、16、24 h, respectively; Black arrows. Cell differentiation to form pseudopods; Black hollow arrows. Cell shedding; White arrows. Cell disintegration
3 讨 论
不同谱系的金黄色葡萄球菌对特定的物种及其接触群体有着一定的趋向,例如ST398型金黄色葡萄球菌通常被认为是与猪相关的牲畜谱系,ST5和ST22型金黄色葡萄球菌常在医院临床病例中出现等。但随着相关研究的深入,这些特定谱系的金黄色葡萄球菌也在其他物种中被发现,如ST398型金黄色葡萄球菌在牛、羊和人源均有发现,而ST22型金黄色葡萄球菌也在猫、狗和马中发现。ST22型金黄色葡萄球菌不仅具有传播迅速、宿主范围广泛的特点,而且具有较强的致病性[1-4,10]。Xiao等[8]研究表明,ST22型MRSA很可能已经取代ST398型成为北京医院中流行的主要MRSA谱系。目前,国内少有关于马乳源ST22型金黄色葡萄球菌的报道,本研究在新疆健康马乳中分离得到1株ST22型金黄色葡萄球菌,并对其致病性进行了评估。
自20世纪60年代以来,金黄色葡萄球菌已成为世界各地医院的主要医院病原体之一,可导致皮肤和软组织感染、腹泻和中毒性休克综合征等[23]。在金黄色葡萄球菌的致病过程中多种毒素蛋白发挥重要作用,如葡萄球菌肠毒素是金黄色葡萄球菌导致宿主食物中毒的重要因素[24];中毒性休克综合征毒素可减弱宿主免疫反应,导致中毒性休克综合征[25];Panton-Valentine杀白细胞素不仅可破坏宿主白细胞,并且与葡萄球菌性烫伤样皮肤综合征高度相关[6-7]等。研究表明,由携带lukS/F基因(编码Panton-Valentine杀白细胞素)的ST22-MSRA引起的感染病例在不断增加[3],且Chen等[26]报道称,与中国其他ST型金黄色葡萄球菌相比,ST22型携带lukS/lukF基因的比例更高。本研究所获得的1株ST22型金黄色葡萄球菌不仅检测到编码PVL的lukF基因,还携带编码肠毒素的sec、seg和seh基因,编码中毒性休克综合征毒素的tsst-1基因,编码溶血素的hla和hlb基因,以及编码凝集因子的clfA和clfB基因,还有编码胶原蛋白黏附素的cna基因,且具有溶血活性。这表明其具有潜在的致病力,可能对公共卫生与食品安全存在威胁。
Jian等[2]对国内临床分离的ST5型甲氧西林敏感金黄色葡萄球菌(methicillin susceptibleStaphylococcusaureus, MSSA)和MRSA的对比研究中发现,MRSA对抗菌药物的耐受性更强,但是MSSA显示出较高的毒力。MSSA具有较高的溶血能力和黏附上皮细胞能力,在小鼠脓肿模型中引起更严重的感染。MSSA菌株可能在致病性方面比MRSA菌株存在更大的隐患[2],其可能原因是,与MRSA菌株相比,MSSA菌株未得到足够重视,并且MRSA菌株中较大的SCCmec基因盒可降低细菌毒性[27]。研究表明,与CC59型金黄色葡萄球菌相比,ST22型生物被膜形成能力较弱[8]。本研究中,ST22型金黄色葡萄球菌仅对青霉素耐受,并且没有生物被膜形成能力,但其携带多种毒力基因。随后的溶血试验、小鼠皮肤脓肿模型和致病性试验表明,其具有溶血活性、可导致小鼠皮肤脓肿,并且在高剂量感染时可致宿主死亡。细菌在宿主细胞中的黏附、侵袭和胞内增殖是其发挥致病作用非常关键的一步,金黄色葡萄球菌作为一种兼性胞内寄生菌,可在宿主细胞内存活和增殖,然后扩散到宿主的其他组织或器官,进而引发全身性感染[23]。Baldan等[28]证明,与ST228型金黄色葡萄球菌相比,ST22型在体外侵袭人类非小细胞肺癌细胞系(A549细胞系)的能力更强,并且在急性肺部感染小鼠模型中具有更高的致病性。本研究对马乳源ST22型金黄色葡萄球菌进行小鼠巨噬细胞的黏附、侵袭和胞内增殖试验,结果表明,金黄色葡萄球菌282具有黏附和侵袭小鼠细胞的能力,并且可在胞内增殖,然后引起细胞的崩解和凋亡,表明其可对宿主细胞造成较大的伤害。因此,马乳源ST22型金黄色葡萄球菌具有较强的致病性,这提示人们应加强对马乳源金黄色葡萄球菌的检测与管控。
4 结 论
本研究首次对新疆伊犁1株马乳源PVL+ST22型金黄色葡萄球菌进行毒力基因检测、药物敏感性检测和致病性评估,发现本研究中分离得到的金黄色葡萄球菌携带sec、tsst-1、hla等在内的10种毒力基因,并且对青霉素耐药以及具有较强的致病性,因此应加强对马携带的金黄色葡萄球菌的调查与防控。
