新的犬ANP32A的克隆及其在流感病毒跨物种感染中的作用
2024-03-01毕振威王文杰刘雅坤彭大新
毕振威,王文杰,刘雅坤,彭大新
(1.江苏省农业科学院兽医研究所 农业农村部兽用生物制品工程技术重点实验室,南京 210014;2.扬州大学江苏省人兽共患病学重点实验室,扬州 225009;3.兽用生物制品(泰州)国泰技术创新中心,泰州 225300)
A型流感病毒(influenza A virus,IAV)是一种单股、分节段负链RNA病毒,水禽是其最大的天然储存库。该病毒亚型众多,可突破种间屏障跨物种感染传播,宿主范围十分广泛[1]。H3N8亚型犬流感病毒(canine influenza virus, CIV)来源于马,而H3N2亚型CIV是由禽流感病毒(avian influenza A virus, AIV)跨宿主传染至犬形成的,两种CIV均可在犬间传播[2]。2006年,我国第一例H3N2 CIV在广东省被报道,自此之后,H3N2 CIV在我国江苏、浙江、辽宁、黑龙江等多地报道,并一直呈上升趋势[3-5]。除此之外,多种亚型AIV,如H5N1[6]、H5N2[7]、H9N2[8]和H10N8[9]均被报道感染犬,犬越来越成为AIV的宿主。不仅如此,猪流感病毒和人的pdmH1N1(pandemic H1N1)流感病毒也可感染犬[10]。不同亚型流感病毒在犬体内重组而产生了新病毒,如H3N2 CIV与pdmH1N1的重组毒株[10]。因此,犬可成为流感病毒的“混合容器”。犬在促进流感病毒哺乳动物适应性和产生流感病毒重组毒株方面发挥着关键作用。因此,犬体内的流感病毒具有成为人畜共患传染病原的风险。
流感病毒跨物种感染,其生命周期的各个阶段均可能受到新宿主的限制。流感病毒RNA聚合酶催化病毒的复制和转录,同时需要大量宿主因子的参与,而不同物种的宿主因子差异性可能限制病毒RNA聚合酶活性,被认为是重要的物种屏障之一。酸性核磷蛋白32A(acidic nuclear phosphoprotein 32A, ANP32A)是ANP32蛋白家族成员,在细胞中具有多种功能,包括转录调节,染色质重构,mRNA输出、细胞死亡,蛋白磷酸酶PP2A活性抑制等[11]。酸性核磷蛋白32A(ANP32A)在禽类与哺乳类中存在物种差异,禽类ANP32A比哺乳类多出33个氨基酸插入,能够支持AIV的RNA聚合酶活性,而哺乳类ANP32A缺少33个氨基酸插入,而不能支持AIV的RNA聚合酶活性[12]。AIV感染哺乳动物发生基因突变,如PB2 E627K突变,以适应“较短”的哺乳类ANP32A。猪对AIV和哺乳动物流感病毒均易感,一直被认为是流感病毒的“混合容器”。研究发现,猪ANP32A比禽类也缺少33个氨基酸插入,但是猪ANP32A能支持AIV的RNA聚合酶活性。与其他哺乳动物ANP32A(106I/156P)相比,猪ANP32A是106V/156 S,这两个位点的差异使猪ANP32A具有支持AIV的RNA聚合酶活性的功能[13-14]。AIV已经跨物种感染犬,那么犬ANP32A(caANP32A)是否也能像猪ANP32A对AIV RNA聚合酶活性有支持作用?目前已有关于犬ANP32A蛋白对A型流感病毒RNA聚合酶活性影响的报道[15]。但是ANP32A有不同的剪接变体,对流感病毒RNA聚合酶活性的调控也存在差异[16]。犬是否存在与已知报道不同的其它ANP32A形式也未知。
本研究从MDCK细胞及犬的组织中克隆caANP32A,以期发现新的caANP32A。利用流感病毒RNA聚合酶双荧光报告系统探索新的caANP32A对流感病毒RNA聚合酶活性的影响,分析caANP32A在流感病毒跨物种感染中的作用,为解析CIV的哺乳动物的适应机制提供新的理论依据,对于防控CIV具有重要的意义。
1 材料与方法
1.1 主要试剂
Trizol购自北京天恩泽基因科技有限公司;基因组DNA提取试剂盒购自北京索莱宝科技有限公司;反转录酶试剂盒购自翌圣生物科技(上海)股份有限公司;质粒小量提取试剂盒、胶回收试剂盒为OMEGA公司产品;蛋白Marker购自擎科生物科技有限公司;鼠源抗Flag标签抗体为Sigma公司产品;兔源抗Myc标签多克隆抗体(R1208-1,杭州华安生物科技有限公司);HRP标记的羊抗鼠抗体购自博奥龙生物科技有限公司;A488标记的驴抗兔抗体(A488-LKT,A21206)和A546标记的驴抗鼠抗体(A546-LKS,A10036)购自Invitrogen公司;DNA高保真酶Mix、同源重组酶、双荧光素酶报告基因试剂盒购自南京诺唯赞生物科技有限公司;jetPRIME转染试剂为Polyplus公司产品;NP-40细胞裂解液、SDS-PAGE蛋白上样缓冲液购自碧云天生物技术有限公司;EcoRⅠ和XhoⅠ购自NEB公司;DNA Marker购自宝生物技术工程有限公司(大连)。
1.2 样品来源、质粒及毒株
犬脾、肺、肠组织样品均取自中华田园犬,由本实验保存;pCA-Flag-chANP32A-X1、pCA-Flag-chANP32A-X2、pCA-Flag-huANP32A真核表达质粒及H9N2流感病毒[A/chicken/Zhejiang/A2013/2017 (H9N2)]聚合酶活性双荧光素酶报告基因系统由毕振威在南京农业大学免疫研究所攻读博士学位期间构建[17];H3N2亚型犬流感病毒[A/Canine/Nanjing/11/2012(H3N2)]由本实验室分离鉴定[18];以H3N2 CIV流感病毒NA基因为模板,按照毕振威的方法[17],构建含有人PolⅠ启动子的萤火虫荧光素酶报告基因质粒phuPolⅠ-vNA-Luc;含有海肾荧光素酶报告基因的内参质粒pRL-TK均由本实验室制备并保存;293 T细胞、MDCK细胞由本实验室保存;H3N2 CIV的RNA聚合酶PB2/PB1/PA以及NP真核表达质粒均构建于pCAGGS表达载体上。
1.3 引物的设计及合成
参考GenBank中公布的caANP32A基因ORF序列(NM_001003013)设计特异性引物, 并在5′端加上同源臂(下划线部分),针对caANP32A基因组(NM_001003013)的外显子4和外显子5周围的序列设计3对引物,(表1)。引物由生工生物工程有限公司(上海)合成。
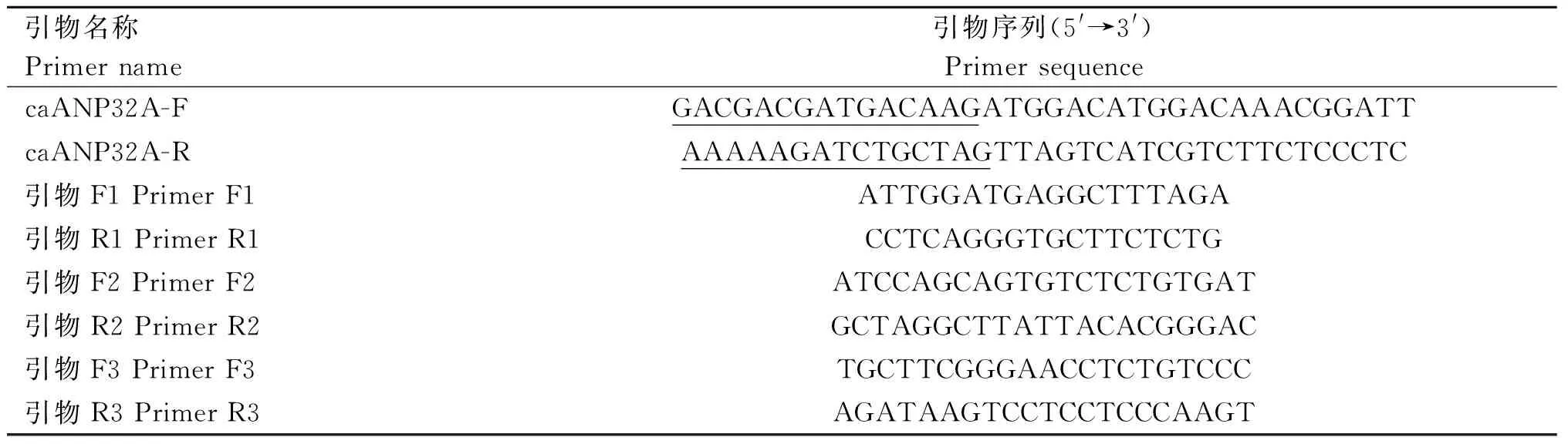
表1 引物序列
1.4 组织、细胞RNA/DNA提取及反转录
将犬脾、肺及肠组织分别取约0.1 g剪成小块,或培养收获MDCK细胞(1×106个),按照TRizol法提取RNA,将提取的RNA进行反转录,取0.5~1.0 μg RNA,以随机引物按照反转录试剂盒说明书反转录获得cDNA。反转录反应体系与程序:模板RNA 0.5~1 μg、5×gDNA digester Mix 3 μL、RNase-free ddH2O加到15 μL,轻轻混匀,42 ℃孵育2 min,加入4×Hifair®Ⅲ SuperMix plus 5 μL,轻轻混匀,25 ℃ 5 min,55 ℃ 15 min,85 ℃ 5 min。将培养收获的MDCK细胞(1×106个)用基因组DNA提取试剂盒提取细胞DNA。将反转录的cDNA产物和提取的DNA置于-20 ℃冰箱冻存。
1.5 caANP32A mRNA和基因的扩增及真核表达质粒的构建
以反转录的cDNA为模板,用caANP32A-F和caANP32A-R为引物扩增MDCK及犬肺、脾、肠的caANP32A。PCR反应体系(50 μL):2×Phanta Max Master Mix(Dye Plus)25 μL、上游引物F和下游引物R各2 μL、DNA模板2 μL、ddH2O 19 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 15 s,56 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 7 min,16 ℃保存。将PCR产物经1%琼脂糖凝胶电泳鉴定,用DNA胶纯化回收试剂盒回收。将pCAGGS-Flag载体用EcoRⅠ和XhoⅠ进行双酶切,取线性化的载体50 ng,加入5×CE II buffer 4 μL和Exnase 2 μL,补水至20 μL,轻轻混匀,置于37 ℃反应30 min,冷却5 min。取5 μL反应产物加入E.coliDH5α感受态细胞,轻轻混匀,42 ℃作用90 s,加入LB培养基,37 ℃摇床45 min;将培养菌液4 000 r·min-1离心5 min收集菌体,用100 μL LB培养基重悬涂于含氨苄青霉素的LB平板。挑取单个菌落由南京擎科生物技术有限公司和通用生物(安徽)股份有限公司测序。以提取的MDCK细胞的DNA为模板,分别用引物F1/引物R1、引物F2/引物R2、引物F3/引物R3进行PCR扩增,PCR反应体系和反应条件与上述方法相同。将扩增的PCR产物连接到pMD-19 T simple载体,并进行测序。利用DNAStar软件进行氨基酸序列比对。
1.6 激光共聚焦试验
将293 T细胞接种到激光共聚焦小皿中,于5% CO2和37 ℃培养箱培养过夜。将pCA-Flag-caANP32A与H3N2 CIV RNA聚合酶亚基pCA-Myc-PB2、PB1和PA共转染293 T细胞。转染24 h后,吸弃培养基,用PBS洗两遍,然后用4%多聚甲醛在室温下固定30 min,并用0.1% Triton-X-100透化15 min,在5%牛血清白蛋白(BSA)中封闭30 min后,将细胞与鼠源抗Flag抗体及兔源抗Myc抗体37 ℃孵育1 h,用PBS洗涤三次,每次5 min,然后用A488标记的驴抗兔抗体和A546标记的驴抗鼠抗体作为二抗,在37 ℃孵育1 h。随后用PBS洗涤三次,细胞核用DAPI染色15 min,洗涤三次。然后将激光共聚焦小皿置于激光共聚焦显微镜观察。
1.7 caANP32A对流感病毒RNA聚合酶活性的影响
将293 T细胞铺于24孔板中,培养约16 h待细胞密度达60%~80%左右,分别将pCA-flag-chANP32A-X1、pCA-flag-caANP32A-1、pCA-flag-caANP32A-2、pCA-flag-huANP32A真核表达质粒与H9N2 AIV、H3N2 CIV的RNA聚合酶亚基和NP基因真核表达质粒pCAGGS-PA/PB1/PB2/NP以及phuPol Ⅰ-vNA-Luc和pRL-TK共转染293 T细胞。所使用的脂质体是jetPRIME,转染体系如下:每孔按PA(0.1 μg)、PB1(0.1 μg)、PB2(0.1 μg)、NP(0.1 μg)、phuPol Ⅰ-vNA-Luc(0.05 μg)和pRL-TK(0.05 μg),以及ANP32A真核表达质粒(0.2 μg)或pCAGGS-Flag空载体(0.2 μg)加入25 μL无血清的Opti-MEM培养基中充分混合均匀,静置5 min,然后加入2 μL jetPRIME转染试剂,混匀后于室温静置5 min。加入铺有293 T细胞的24孔板中的每孔内,置于37 ℃培养箱内培养24 h。转染24 h后弃掉细胞培养液,参照双荧光素酶报告基因检测试剂盒说明书裂解细胞和取样,利用多功能荧光检测仪测定Firefly和Renilla的荧光值,计算出流感病毒聚合酶的相对活性。
1.8 统计分析
2 结 果
2.1 caANP32A的克隆和序列分析
从MDCK细胞中用RT-PCR反应扩增获得大小在750~1 000 bp之间的目的条带(图1A),用同源重组的方法将该目的条带与pCAGGS-Flag载体连接,转化E.coliDH5α,挑取10个阳性单菌落进行测序。结果表明,在MDCK细胞中扩增到两种不同的序列,分别命名为caANP32A-1和caANP32A-2。caANP32A的大小为762 bp,推导的氨基酸序列为253aa。caANP32A-1的59、147位点处的氨基酸为N、V,而caANP32A-2这两个位点处的氨基酸为D、G。将该caANP32A氨基酸序列与禽类ANP32A(chANP32A-X1、chANP32A-X2)及其他哺乳类ANP32A(huANP32A、swANP32A和caANP32A)进行比较,结果本研究扩增的caANP32A比之前已经报道的caANP32A以及huANP32A、swANP32A多出4个氨基酸(176LSLV179),而多出来的4个氨基酸与chANP32A-X1的177LSLV180一样(图1B、图2)。因此,作者扩增和克隆到新的caANP32A。进一步地,从犬肺组织中扩增到caANP32A-1,从犬脾组织中扩增到caANP32A-2,从犬肠组织中扩增到caANP32A-1和caANP32A-2。

A.PCR扩增结果(M. DL5000 DNA 相对分子质量标准;1. caANP32A cDNA的原液; 2. caANP32A cDNA的10倍稀释; 3. caANP32A cDNA的100倍稀释; 4. 正常MDCK细胞); B. 测序结果,黑框为“176LSLV179”对应的核苷酸A. Amplification results of PCR(M. DL5000 DNA marker;1.Original solution of caANP32A cDNA; 2.10×dilution of caANP32A cDNA; 3.100×dilution of caANP32A cDNA; 4. Normal MDCK cells); B. Sequencing result, the black box showed the nucleotide corresponding to "176LSLV179"

图2 不同物种ANP32A氨基酸序列比对Fig.2 Amino acid alignment of ANP32A in different species
2.2 caANP32A部分基因的克隆和测序
禽类ANP32A是由8个外显子拼接而成的,鸡的内含子4含有两个3′剪接位点(3′ splice site, 3′ss),这两个位点相差12 bp。ChANP32A-X1是由近端的3′ss位点剪接而成,而chANP32A-X2是由远端的3′ss位点剪接而成,因此chANP32A-X1比chANP32A-X2多出4个氨基酸残基。与禽类相比,哺乳类ANP32A缺少禽类ANP32A的外显子5(外显子5由99 bp碱基组成,编码33个氨基酸),因此,哺乳类ANP32A是由7个外显子剪接而成的。为了检测新的caANP32A的176LSLV179的来源,设计了3对引物对caANP32A外显子4、外显子5及其之间的内含子4的基因进行PCR扩增(图3)。如图4所示,扩增的序列结果与NCBI中注册的caANP32A(注册号:NM_001003013)一致,均查找不到“TTATCTCTAGTG”,因此氨基酸序列“176LSLV179”并不能从caANP32A基因序列中推导获得,表明这种改变的发生不是在DNA水平上,因此,作者发现的新的caANP32A并不是由基因编码的外显子mRNA剪接形成的。

蓝色框为外显子4,绿色框为外显子5The blue box represents exon 4, and the green box represents exon 5
2.3 caANP32A与H3N2犬流感病毒RNA聚合酶共定位
将pCA-Flag-caANP32A载体转染293T细胞,24 h后收获细胞,进行Western blot,用Flag抗体检测Flag-caANP32A在细胞中的表达。结果显示,空载体未见阳性反应条带,而pCAGGS-Flag-caANP32A-1、pCAGGS-Flag-caANP32A-2和pCAGGS-Flag-huANP32A在33~43 ku出现特异性条带,但与Flag-caANP32A的分子量理论值30 ku(caANP32A的分子量理论值为29 ku,Flag标签的分子量理论值为1 ku左右)稍偏大,这可能与caANP32A在细胞中存在一些翻译后修饰有关,表明pCAGGS-Flag-caANP32A蛋白在293T细胞中成功获得表达(图5A)。将Flag-caANP32A与H3N2 CIV的RNA聚合酶Myc-PB2、PB1、PA共转染293T细胞,激光共聚焦结果显示,caANP32A和RNA聚合酶在细胞核中发生共定位现象(图5B)。

A. Western blot(1. pCAGGS-Flag空载体;2. pCA-Flag-caANP32A-1真核表达质粒;3. pCA-Flag-caANP32A-2真核表达质粒;4. pCA-Flag-huANP32A真核表达质粒); B. caANP32A与H3N2 CIV RNA聚合酶共定位A. Western blot (1. PCAGGS-Flag empty carrier; 2. pCA-Flag caANP32A-1 eukaryotic expression plasmid; 3. pCA-Flag caANP32A-2 eukaryotic expression plasmid; 4. pCA-Flag huaANP32A eukaryotic expression plasmid); B. Co-location of caANP32A and H3N2 CIV RNA polymerase
2.4 caANP32A对流感病毒RNA聚合酶活性的影响
将chANP32A-1、caANP32A-1、caANP32A-2、huANP32A表达质粒分别与H9N2 AIV、H3N2 CIV的RNA聚合酶PB1/PB2/PA和NP真核表达质粒以及vNA-Luc、pRL-TK真核表达质粒共转染293T细胞,24 h后收获细胞,检测流感病毒RNA聚合酶的活性。结果显示,过表达chANP32A-X1均显著促进了H9N2 AIV和H3N2 CIV的RNA聚合酶活性,而过表达新的caANP32A-1、caANP32A-2和huANP32A均不能促进H9N2 AIV和H3N2 CIV的RNA聚合酶活性(图6)。
3 讨 论
禽源ANP32A存在不同的剪接变体,对AIV的RNA聚合酶适应性和病毒进化的驱动力不同。鸡ANP32A是由8个外显子拼接而成的,内含子4含有两个3′的剪接位点(3′ss),这两个位点相差12 bp。由内含子4近端的3′ss位点剪接形成的外显子5为99 bp,而由远端的3′ss位点剪接而成的外显子5为87 bp,由此形成了剪接体chANP32A-X1比chANP32A-X2多出4个氨基酸残基。而chANP32A-X3在剪接时缺少外显子5,比chANP32A-X1少33个氨基酸插入。人ANP32A基因组缺少转录外显子5的基因,因此人ANP32A是由7个外显子剪接而成,比chANP32A-X1少33个氨基酸插入[16]。NCBI中注册的犬ANP32A很少,且为预测的序列信息,张媛等[15]克隆到了1个caANP32A转录本,与其它哺乳动物一样,比chANP32A-X1少33个氨基酸插入。本研究从MDCK细胞和犬组织中克隆出一个新的caANP32A变体,比已报道的caANP32A多出4个氨基酸插入(LSLV),与chANP32A-X1中33个氨基酸插入的150LSLV168一致。通过对caANP32A基因组测序发现,该序列不能从基因组DNA序列中推导获得,表明这种改变的发生不是在DNA水平上,因此,作者发现的新的caANP32A并不是剪接形成的。RNA编辑是转录后的RNA在编码区发生碱基的加入,丢失或转换等现象[19]。该新的caANP32A可能是在RNA水平增加了原来DNA模板中不曾编码的碱基。
2016年,Long等[12]首次揭示了AIV的RNA聚合酶在不同宿主细胞中的适应性与ANP32A的种属特异性相关。禽类ANP32A在175 aa位置处插入了额外的33个氨基酸片段,能支持AIV的RNA聚合酶活性,而哺乳类ANP32A缺少这33 aa片段,限制了AIV的RNA聚合酶活性[12]。33个氨基酸片段有27aa是ANP32A的(149DRDDKEA-PDSDAEGYVEGLDDEEEDED175)的重复序列,剩下的为6个独特的氨基酸 (176VLSLVK181),其中176VLSLV180被认为SUMO互作基序序列(SUMO interaction motif-like sequence, SIM)[20]。作者前期发现,在huANP32A的175 aa处插入6 aa(176VLSLVK181)能支持AIV的RNA聚合酶活性,尽管活性不及整个33 aa,而huANP32A加入27aa则不能支持AIV的RNA聚合酶活性,表明33 aa插入的6个氨基酸(176VLSLV1806aa)在ANP32A支持AIV的RNA聚合酶活性中起着重要的作用[21]。chANP32A-X2由于缺乏6个aa中的4个aa(176VLSL179)严重破坏了其对AIV的RNA聚合酶的支持作用[21]。本研究克隆鉴定到一个新的caANP32A,该caANP32A在175 aa多了6 aa中的4 aa(LSLV片段),但仍然不能促进AIV的RNA聚合酶活性。而作者之前发现huANP32A插入4aa(176VLSL179)也不能促进AIV的RNA聚合酶活性。可见,6个氨基酸(176VLSLV1806aa)的完整性是chANP32A支持AIV的RNA聚合酶所必需的。
猪对于感染禽和哺乳动物的流感病毒均易感,被认为是流感病毒的“混合容器”。尽管猪ANP32A比禽类同样缺少33 aa插入,但与其它哺乳动物不同,猪ANP32A能支持AIV的RNA聚合酶活性。与其他哺乳动物物种的ANP32A(106I/156P)相比,猪ANP32A为106V/156 S,增强了猪ANP32A和AIV RNA聚合酶之间的相互作用从而支持AIV的RNA聚合酶活性[13-14]。作者发现的新caANP32A在这两个氨基酸位点未发生I106V/P156 S突变,也不能支持AIV的RNA聚合酶活性。因此caANP32A对AIV的RNA聚合酶仍然具有物种限制性。
H3N2亚型CIV未发生PB2 E627K哺乳动物适应性突变,仍然保持禽流感病毒PB2 627E位点。与chANP32A-X1能促进CIV 的RNA聚合酶活性相比,caANP32A则不能,表明caANP32A对CIV仍然具有较强的宿主限制性。这可能是单纯的CIV感染并不能引起犬严重的临床症状的重要原因。通过比对发现,caANP32A与huANP32A的核苷酸相似性是94.1%,氨基酸序列相似性为95.2%,存在12个氨基酸变异,但在293 T细胞上过表达caANP32A与huANP32A均不能促进CIV的RNA聚合酶活性,表明caANP32A和huANP32A对AIV的RNA聚合酶的限制作用相同。与CIV能感染犬不同,目前并没有人感染CIV的报道。除了ANP32A,最近研究发现,huANP32B在促使PB2 E627K突变中起关键的主要作用,而caANP32B则不能,表明AIV在犬和人上发生哺乳动物适应性突变不同[22]。另外,犬呼吸道含有IAV使用的两种唾液酸受体(2,3-和2,6-连接)[23],而人则仅仅含有2,6-连接的唾液酸受体。这些发现可能解释CIV尚未感染人的原因。本研究所用的毒株为2012年分离到的,为早期毒株,最新的研究发现,H3N2 CIV具备了人样受体结合能力,且在人支气管上皮细胞中的复制能力也逐渐增加,H3N2 CIV对公共卫生安全的潜在威胁性增强,值得警惕[24]。
4 结 论
克隆了新的犬物种特异的酸性核磷蛋白32A(caANP32A),在176~179位存在四个氨基酸LSLV的插入,但新caANP32A对AIV的RNA聚合酶活性仍然有物种限制性,且该新的caANP32A也未增强CIV的RNA聚合酶活性。
