杆状病毒表达系统表达BCoV纤突蛋白及其对小鼠的免疫原性
2024-03-01喻琦胜张家祺陈涛云张朝辉
喻琦胜,朱 庆,周 群,宋 鑫,张家祺,陈涛云,徐 林,张朝辉*,张 斌*
(1.西南民族大学畜牧兽医学院,成都 610041;2.四川省甘孜藏族自治州动物疫病预防控制中心,康定 626000)
牛冠状病毒病是由牛冠状病毒(bovine coronavirus,BCoV)引起的导致牛呼吸道和肠道感染的病毒性疾病[1],被广泛认为是引起初生犊牛腹泻的重要病原之一。目前国内BCoV广泛流行,严重阻碍了养牛业的发展[2-4]。有研究证实BCoV能感染多种宿主[5-6],说明BCoV在跨物种传播领域具有重要意义,其生物安全影响不容忽视。
BCoV是单股正链RNA病毒,属于套式病毒目、冠状病毒科、β冠状病毒属[7]。其病毒粒子呈球形或多边形,编码五种主要结构蛋白,即纤突蛋白(S蛋白)、核衣壳蛋白(N蛋白)、囊膜糖蛋白(M蛋白)、血凝脂酶糖蛋白(HE蛋白)和小膜蛋白(E蛋白)[8]。其中S结构蛋白含有主要抗原位点,包含S1、S2两个亚基,能诱导机体产生免疫应答,进而诱导中和抗体的产生[9-10]。目前已有多种冠状病毒的疫苗是基于S蛋白进行开发的[11-13]。
杆状病毒表达系统(baculovirus expression system,BES)是以杆状病毒为外源基因表达载体,以昆虫细胞为受体的真核表达系统。其优点是杆状病毒对外源基因的容纳能力较强,只感染节肢动物[14],在实际生产应用中较为安全;昆虫细胞能够对外源蛋白进行加工修饰,使外源蛋白能够正确折叠,保持空间构象及蛋白活性[15-16]。BES已被广泛用于表达重组蛋白[15],已有多种商业化的基因工程亚单位疫苗使用该系统生产重组蛋白,如由GSK公司研发的人乳头瘤病毒二价疫苗,四川大学华西医院研发的重组新冠病毒疫苗,武汉科前生物股份有限公司生产的猪瘟病毒E2蛋白重组杆状病毒灭活疫苗(WH-09株)[17-18]。
目前,有关BCoV S蛋白表达的报道均属于原核表达,缺乏翻译后修饰、蛋白产量较低,而且未表达完整S蛋白[19-20]。因此,本研究构建了携带BCoV S基因的重组杆状病毒,通过杆状病毒表达系统获得重组S蛋白,免疫BALB/c小鼠,对其免疫原性进行评价,为今后BCoV亚单位疫苗的研究提供思路。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞 大肠杆菌感受态细胞(DH5α、DH10Bac)、Sf9细胞、pFastBac-Dual质粒由西南民族大学畜牧兽医学院预防兽医学实验室保存。
1.1.2 主要试剂 质粒小提试剂盒购自OMEGA生物公司,BacPAKTM杆状病毒滴度快速测定试剂盒购自TaKaRa生物公司,超敏ECL化学发光底物购自四正柏生物公司,辣根过氧化物酶(HRP)标记的山羊抗兔IgG、HRP标记的山羊抗鼠IgG均购自北京博奥森生物有限公司,异硫氰酸荧光素(FITC)标记的山羊抗兔IgG、BCA蛋白浓度测定试剂盒均购自博士德生物工程有限公司,RIPA裂解液购自Thermo Fisher Scientific公司,蛋白酶抑制剂混合物(通用型)购自上海碧云天生物技术有限公司,NE41动物免疫佐剂(MF59佐剂)、CpG免疫增强剂均购自北京利昂盛生物技术有限公司。
1.1.3 实验动物 4~6周龄雌性BALB/c小鼠,购自成都达硕实验动物有限公司。
1.2 方法
1.2.1 重组质粒的构建与鉴定 选择BCoV/SWUN/HXD-4/2021株(GenBank:OL456213.1)的S结构蛋白作为模板,由生工生物工程(上海)股份有限公司针对Sf9细胞进行密码子优化并合成,连接至pFastBac-Dual载体上,得到pFastBac-Dual-S重组质粒。
1.2.2 收获重组杆粒 将上述构建成功的pFastBac-Dual-S重组质粒DNA转化至DH10Bac感受态细胞中,涂布到含有庆大霉素、卡那霉素、氯霉素的LB琼脂平板上。在37 ℃二氧化碳培养箱中静置培养48 h后,可观察到蓝色和白色的圆形菌落,挑取白色圆形单个菌落利用菌落PCR筛选出阳性克隆,并通过三线法进一步划线纯化以去除假阳性。将筛选出的阳性克隆扩大培养,提取重组杆粒命名为Bacmid-S,测定浓度后保存于-20 ℃。
1.2.3 重组杆状病毒的拯救 将长满细胞培养瓶的Sf9细胞传代到六孔板中,根据CellfectinTMII Reagent转染试剂说明书进行转染,27 ℃静置培养96 h后,反复冻融3次,收获病毒液,将其作为第一代病毒(P1),命名为rpFastBac-S。盲传代到P4后,收集病毒液,分装保存于-80 ℃。
1.2.4 重组杆状病毒的鉴定
1.2.4.1 基因组PCR:取P4病毒液提取基因组DNA。将rpFastBac-S的DNA作为模板,进行基因组PCR鉴定。
1.2.4.2 间接免疫荧光试验:将长满细胞培养瓶的Sf9细胞进行传代,用Sf9专用培养基将细胞浓度调整到4×105cells·mL-1,进行六孔板铺板,每孔2 mL,8~10 h后按细胞培养液3%的比例接入rpFastBac-S。27 ℃静置培养48 h后弃去培养液,用80%丙酮固定10 min,PBS洗涤3次;5%脱脂奶封闭2 h,PBS洗涤3次;以Anti-BCoV-S2蛋白多克隆抗体为一抗,37 ℃孵育2 h,PBS洗涤3次;以FITC标记的Goat Anti-rabbit IgG作为二抗,37 ℃孵育1 h,PBS洗涤3次;滴入DAPI染色液,室温孵育10 min,使用吸水纸吸取净残留液体后,进行荧光显微镜成像。
1.2.4.3 Western blot分析:通过Western blot分析S蛋白在Sf9细胞中的表达情况。样品制备方法同“1.2.4.2”,27 ℃静置培养48 h后弃去培养液,用PBS重悬细胞,12 000 r·min-1离心5 min,弃去上清;加入200 μL RIPA裂解液裂解细胞,同时加入2 μL通用型蛋白酶抑制剂,冰浴15 min后再次离心,取上清,加入SDS-PAGE上样缓冲液,95 ℃加热5 min,完成样本制备。以5%脱脂奶为封闭液,37 ℃水平摇晃孵育2 h,TBST洗涤3次;以Anti-BCoV-S2蛋白多克隆抗体为一抗,4 ℃水平摇晃孵育过夜,TBST洗涤3次;以HRP标记的Goat Anti-rabbit IgG作为二抗,37 ℃水平摇晃孵育2 h,TBST洗涤3次;使用超敏ECL化学发光底物显影,观察目的条带。
1.2.5 重组杆状病毒滴度的测定 按照BacPAKTM杆状病毒滴度快速测定试剂盒说明书,测定P4重组杆状病毒rpFastBac-S的滴度。
1.2.6 优化不同感染剂量对蛋白表达的影响 将rpFastBac-S分别以MOI=0.005、MOI=0.05、MOI=0.5、MOI=1、MOI=2感染Sf9细胞,3 d后,弃去上清,收集细胞,Western blot检测蛋白表达情况。
1.2.7 收获S蛋白及制备免疫原 将rpFastBac-S按照最佳感染复数感染Sf9细胞,3 d后收获细胞培养液,3 000 r·min-1离心20 min以去除细胞碎片,收集上清进行超速离心纯化,离心条件为“4 ℃、30 000 r·min-1、2 h”,离心后用PBS重悬沉淀。使用BCA蛋白浓度测定试剂盒测定蛋白浓度,分装储存于-80 ℃备用。
1.2.8 rpFastBac-BCoV-S蛋白在小鼠中的免疫原性评价
1.2.8.1 rpFastBac-BCoV-S免疫小鼠的方案设计:4~6周龄雌性BALB/c小鼠24只,随机分为3组,分别为S蛋白组、灭活病毒组、佐剂对照组,每组8只。均采用肌肉注射,S蛋白组每只每次免疫50 μg蛋白,灭活病毒组每只每次免疫200 μL灭活病毒液(剂量为2×104.67TCID50),佐剂对照组每只每次免疫50 μL MF59佐剂,其中S蛋白组与灭活病毒组均混合了等体积的MF59佐剂与20 μg CpG免疫增强剂。首免后14 d进行二免,并在免疫前、首免7 d、首免14 d、二免7 d、二免14 d进行采血,收集血清备用。
1.2.8.2 间接ELISA试验检测小鼠血清特异性抗体水平:根据本实验室建立的基于BCoV S2重组蛋白的间接ELISA抗体检测方法,对收集到的血清样本进行特异性抗体水平检测。将原核表达获得的BCoV S2蛋白用50 mmol·L-1Tris-HCl溶液稀释为0.1 μg·mL-1,每孔100 μL,37 ℃包被1 h后弃液,PBST洗涤三次;每孔加入100 μL 5%脱脂奶,37 ℃封闭1 h后弃液,PBST洗涤三次;以收集到的小鼠血清作为一抗,用2%冷水鱼皮明胶进行梯度稀释后,每孔100 μL,37 ℃孵育1 h后弃液,PBST洗涤三次;将HRP标记的羊抗鼠IgG用2%冷水鱼皮明胶按照1∶10 000稀释,每孔100 μL,37 ℃孵育1 h后弃液,PBST洗涤三次;加入TMB显色液,每孔100 μL,37 ℃避光孵育10 min后,加入终止液终止反应,使用酶标仪读取OD450 nm值。
1.2.8.3 微量中和试验检测小鼠血清中和抗体水平:将长满细胞培养瓶的HCT-8细胞传代至96孔板,37 ℃静置培养8~10 h;将小鼠血清56 ℃灭活30 min,用不含血清与双抗的DMEM培养基进行2倍倍比稀释,与200 TCID50的BCoV混合,37 ℃培养箱感作1 h;取出含有HCT-8细胞的96孔板,弃液,PBS洗涤2次,将感作完成后的混合培养液加入到96孔板中培养96 h后,观察记录每孔的病变情况,按Reed-muech两氏法计算血清中和抗体的效价。
2 结 果
2.1 重组质粒的构建
以S基因为模板,针对昆虫细胞进行密码子优化,CAI(密码子适应指数)从0.39调整为0.87,平均GC含量从35.8%调整为50.6%,利用基因合成技术获得重组质粒pFastBac-Dual-S。
2.2 重组杆粒获取及重组杆状病毒的拯救与鉴定
将上述构建成功的重组质粒转化DH10Bac同源重组后获得重组杆粒,并在转染Sf9细胞后收获重组杆状病毒rpFastBac-S,将拯救的重组杆状病毒rpFastBac-S传代至第四代时,Sf9细胞开始出现典型病变,表现为细胞生长缓慢、变大变圆。为了验证重组杆状病毒rpFastBac-S是否构建成功,作者通过PCR、Western blot、IFA试验对其进行鉴定(图1A~C)。鉴定结果如图1所示,图1A为提取第四代重组杆状病毒DNA后,利用S基因特异引物进行PCR鉴定和琼脂糖凝胶电泳,电泳结果显示在4 000 bp附近出现预期条带,说明收获的重组杆状病毒正确表达了S目的蛋白基因;IFA试验的一抗为Anti-BCoV-S2蛋白多克隆抗体,利用倒置荧光显微镜能观察到试验组产生了很亮的绿色荧光(图1C),说明构建的杆状病毒有效表达了S目的蛋白;收集重组杆状病毒rpFastBac-S感染Sf9细胞48 h后的培养液上清部分,使用Anti-BCoV-S2蛋白多克隆抗体进行Western blot分析,结果显示其能够与Anti-BCoV-S2蛋白多克隆抗体发生特异性结合(图1B),说明重组杆状病毒感染Sf9细胞后可以有效表达S目的蛋白,并且该蛋白具有较好的反应原性。
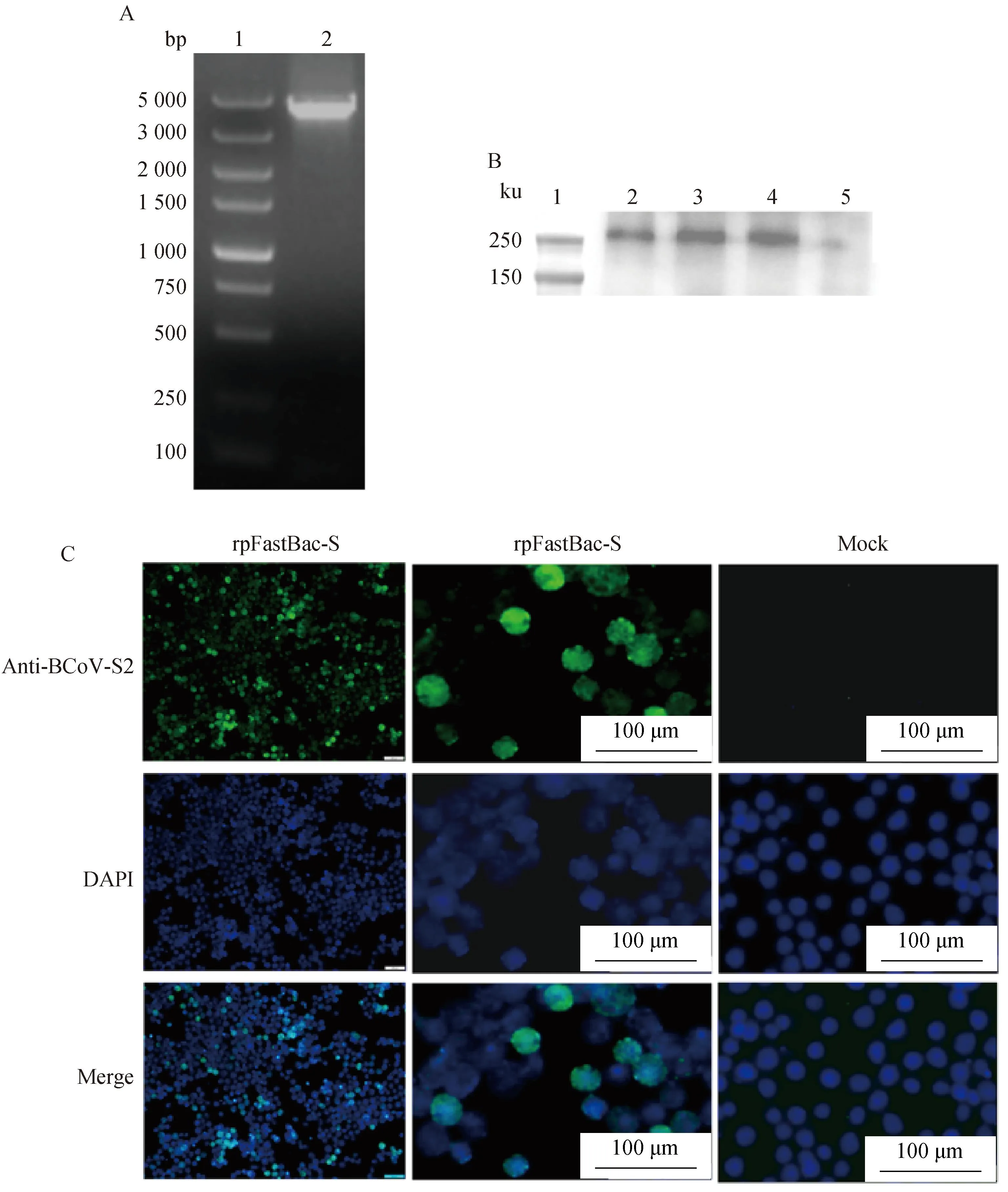
A. S基因PCR产物电泳结果(1. DL5000相对分子质量标准;2. 重组杆状病毒DNA);B. Western blot结果 (1. 蛋白质相对分子质量标准;2~4. 杆状病毒感染后的细胞上清;5. 正常Sf9细胞对照);C. 间接免疫荧光结果A. The PCR results of S gene (1. DL5000 marker; 2.Recombinant baculovirus DNA); B. Western blot results (1. Protein marker; 2-4. Baculovirus infected cell supernatant; 5. Normal Sf9 cell control); C. Indirect immunofluorescence assay results
2.3 杆状病毒滴度测定
鉴定完成后,使用试剂盒测得第四代重组杆状病毒rpFastBac-S的滴度为1.013×107IFU·mL-1,表明第四代重组杆状病毒数量和密度良好,达到要求,能用于Sf9细胞的接种,可以进行大量蛋白的表达。
2.4 优化不同感染剂量对蛋白表达的影响
将rpFastBac-S分别以MOI=0.005、MOI=0.05、MOI=0.5、MOI=1、MOI=2感染Sf9细胞,3 d后,Western blot检测蛋白表达情况。图2显示MOI为0.5时S蛋白表达量最高,所以将其作为后续大量表达蛋白时的最佳感染条件。

A. Western blot结果(1. 蛋白质相对分子质量标准;2~6. 接毒量0.005、0.05、0.5、1、2 MOI);B. Western blot灰度值分析A. Western blot results (1. Protein marker;2-6. Dose 0.005,0.05,0.5,1,2 MOI); B. Western blot analysis of gray value
2.5 rpFastBac-BCoV-S蛋白在小鼠中的免疫原性评价
2.5.1 小鼠血清特异性抗体IgG检测结果 根据本实验室建立的基于BCoV S2重组蛋白的间接ELISA抗体检测方法,对收集到的血清进行特异性抗体检测。由图3可以看出,S蛋白组小鼠在首免一周后抗体水平开始升高,并在二免后抗体水平持续增长,二免7、14 d的特异性抗体效价显著高于灭活病毒组和佐剂对照组,二免14 d特异性抗体效价最高达到1∶12 800。

**. P<0.01;***. P<0.001
2.5.2 小鼠血清中和抗体检测结果 对收集到的各组一免7 d、一免14 d、二免7 d、二免14 d血清进行BCoV中和抗体检测。分析结果如图4所示,S蛋白组小鼠在首免1周后就产生了抗BCoV的中和抗体,效价为1∶20~1∶40,与MF59佐剂对照组相比,统计学差异显著(P<0.05),并且随着时间增长,中和抗体效价在持续升高,二免14 d后中和抗体效价最高达到1∶224。一免14 d后,S蛋白组中和效价平均值高于灭活病毒组,但中和抗体效价相当,统计学差异不显著(P>0.05)。

同一时间点,柱上有相同字母表示差异不显著(P>0.05),具不同标记字母表示差异显著(P<0.05)At the same time point, the same letter above each column indicates no significant difference between the treatments (P>0.05), while the different marked letters indicates significant difference (P<0.05)
3 讨 论
牛冠状病毒最早在1972年由Mebus等从牛腹泻粪便中分离得到[21]。BCoV首先在美洲流行,随后在亚洲和欧洲暴发,流行范围广,可引起呼吸道和肠道双重临床症状[22]。感染BCoV后通常会导致初生犊牛腹泻、冬季痢疾和呼吸道感染症状,进而造成犊牛死亡、肉牛生长缓慢、奶牛产奶量和产奶品质降低等影响,对养殖业造成巨大的经济损失。牛冠状病毒的S蛋白是病毒感染宿主细胞的主要成分,全长1 363个氨基酸[23],基因组较大,其序列高度突变和高重组的特性可能会导致BCoV的抗原性与致病性改变[24-25]。有研究表明,分子伴侣pG-KJE8可促进BCoV病毒样颗粒的可溶性表达,与分子伴侣共表达的VLPs具有免疫活性,免疫小鼠后能使其产生较高IgG抗体水平和细胞因子水平[26]。S蛋白的单克隆抗体在体内可防止BCoV引发的犊牛肠毛萎缩,证实了S蛋白在诱导中和抗体产生的同时,也起到阻断病毒附着和感染的作用,因此该蛋白在疫苗研究方面具有重要参考价值。
目前国内暂无商品化BCoV疫苗。S蛋白是冠状病毒的主要抗原蛋白,可以作为新型疫苗研究的切入点。新型冠状病毒通过S蛋白的RBD结合宿主细胞表面受体——血管紧张素转换酶2,介导病毒进入宿主细胞[13]。2021年9月,中国三叶草生物制药公司一项研究表明,基于SARS-CoV-2 S蛋白的改良疫苗针对该病毒的五种变体提供了较强的保护作用,并且对具有高度传染性的Delta毒株也具有较强的保护作用[27]。2022年,四川大学华西医院研发出RBD-HR/三聚体亚单位疫苗,该研究将Delta变异株的RBD序列与SARS-CoV-2 S2亚基中的HR1和HR2序列直接串联起来,使其通过自组装形成三聚体[28],在多种动物模型中能够诱导持续的体液免疫,产生高水平的针对Omicron变异株的广谱中和抗体,也可在体内诱导强烈的T细胞免疫应答。
本研究发现,利用杆状病毒表达系统表达出的BCoV S重组蛋白经过昆虫细胞较为完整的包括糖基化在内的翻译后修饰,能够正确折叠以维持原有的空间构象和蛋白活性,在此基础上还优化了不同MOI感染后的S重组蛋白的表达量,结果表明MOI=0.5的接毒条件更适合蛋白表达。猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)与BCoV同属于冠状病毒科,在一项应用杆状病毒表达系统表达PEDV纤突蛋白的研究中,S蛋白免疫小鼠后,可刺激小鼠产生IL-4,但血清抗体水平与PBS组相比,并无明显差异[29]。而本研究在BCoV S重组蛋白制备免疫原时使用了MF59佐剂与CpG免疫增强剂,小鼠免疫试验结果显示,该免疫原能够刺激小鼠产生特异性IgG抗体,血清抗体效价最高达到1∶12 800,抗体效价显著高于灭活病毒组和佐剂对照组,同时也能诱导小鼠产生高水平的中和抗体,最高中和抗体效价达到1∶224,且S蛋白组的中和效价平均值高于灭活病毒组。MF59佐剂安全有效并且可以完全降解,在新型冠状病毒疫苗研究中也有使用[28,30],而CpG免疫增强剂能提高免疫原稳定性并延长其在体内的半衰期,可不同程度地诱导体液免疫与细胞免疫,增强机体的免疫应答[31]。本研究为后续BCoV重组亚单位疫苗的研制提供了进一步的参考。
4 结 论
本研究利用杆状病毒表达系统表达了BCoV全长S蛋白,免疫小鼠后,产生高水平的特异性IgG抗体与中和抗体,说明本研究中表达的BCoV S重组蛋白具有良好的免疫原性,为今后BCoV亚单位疫苗的研发提供了进一步的理论依据。
