饲粮中添加腐殖酸钠对鼠伤寒沙门菌感染肉鸡肝组织炎症和抗氧化能力的影响
2024-03-01柳可欣何炎峻邓守翔马卫明
王 栋,柳可欣,何炎峻,邓守翔,刘 云*,马卫明
(1.山东农业大学动物科技学院,泰安 271000;2.东北农业大学动物医学学院 黑龙江省实验动物与比较医学重点实验室,哈尔滨 150030)
沙门菌是一种能通过食物和水传播的人畜共患病原菌,可引起严重的公共卫生问题和食品安全问题[1]。欧洲食品安全局(EFSA)报告称,食用沙门菌感染的禽肉、禽蛋及其加工产品是导致公共卫生问题的主要原因之一[2]。鼠伤寒沙门菌(SalmonellaTyphimurium,S.Typhimurium)是沙门菌的一种,感染肉鸡可导致严重的肠道损伤和败血症并降低其生长性能和免疫力[3]。肝作为机体最主要的代谢器官,在许多生理和病理生理过程中发挥着重要作用。肝的主要功能是促进机体的新陈代谢和提高解毒能力,这使得肝极易受到内毒素和有害物质的损伤[4]。据报道,S.Typhimurium感染能通过损伤肠上皮细胞间的紧密连接等引起肠道屏障损伤,而肠道内的微生物以及毒素则通过受损的肠道屏障进入血液循环导致败血症并引起肝损伤[5]。因此,有效防控沙门菌感染对于提高肉鸡的生长性能和保护公众健康具有重要的意义。然而,出于对细菌耐药性和不良公共卫生后果的担忧,一些国家或机构已经限制或严格禁止在家禽生产中使用抗生素[6-7]。因此,具有抗菌、抗炎和调节肠道稳态的天然产物在家禽生产中受到越来越多的关注。
腐殖酸(umic acids, HAs)是由泥炭中的有机物分解转化而成,目前已广泛应用于农业、医药卫生和环境保护等多个领域[8]。腐殖酸钠(sodium humate, HNa),是HAs的一种钠盐,具有抗菌、抗炎、免疫调节、止泻、止血和促进伤口愈合等特性,在中医中主要用作止血和止泻的治疗剂[9]。本团队前期研究表明,HNa不仅能抑制大肠杆菌(E.coli)和S.Typhimurium的增殖,还能通过调节肠道菌群和抑制肠道炎症反应等减轻E.coli和S.Typhimurium感染引起的小鼠肠道损伤[10-11]。一项对肠产毒素性大肠杆菌(ETEC)感染仔猪的研究表明,HNa干预减少了ETEC在肠道的定植,并缓解了其对仔猪肠道的损伤[12]。此外,陈志敏等[13]的研究表明,饲粮中添加HNa提高了肉鸡的生产性能、免疫功能和抗氧化能力。上述研究结果为HNa缓解S.Typhimurium感染引起肉鸡肝损伤的保护作用提供了证据,然而,其保护作用和相关机制尚待研究。因此,本试验旨在探究饲粮中添加不同浓度的HNa对S.Typhimurium感染肉鸡肝组织学形态、肝功能、肝抗氧化、肝炎症因子和炎症相关信号通路的影响。
1 材料与方法
1.1 试验动物及主要试剂
腐殖酸钠(sodium humate, HNa),由中国科学院山西煤炭化学研究所提供。鼠伤寒沙门菌(S.Typhimurium)由中国农业科学院哈尔滨兽医研究所赠送。将S.Typhimurium接种于LB培养基,置于37 ℃恒温培养12 h,8 000 r·min-1离心10 min。将收集的菌体用PBS洗3次,之后,用PBS将菌体稀释到3×109CFU·mL-1。
苏木精-伊红(HE)染液(上海碧云天生物技术有限公司),总RNA提取试剂盒(Promega,U.S),反转录和实时荧光定量试剂盒(大连TaKaRa公司)。
1.2 试验动物和试验设计
将320只初始体重(41.63±0.64)g的健康1日龄雄性爱拔益加(AA)肉鸡(购于烟台大地牧业股份有限公司)随机分为5组,每组8个重复,每个重复8只鸡。试验分组分别为:对照组(CON,基础饲粮),模型组(ST,基础饲粮),低剂量HNa组(L-HNa,基础饲粮+0.2 g·kg-1HNa), 中剂量HNa组(M-HNa,基础饲粮+0.4 g·kg-1HNa), 高剂量HNa组(H-HNa,基础饲粮+0.6 g·kg-1HNa)。参考Marcq等[14]的方法建立S.Typhimurium感染肉鸡模型。在试验第22~24天,CON组肉鸡每天灌胃1 mL PBS、ST、L-HNa、M-HNa和 H-HNa 组肉鸡每天灌胃1 mL 3×109CFU·mL-1的S.Typhimurium。试验周期为24 d,在整个试验期间肉鸡自由饮水和采食。基础饲粮组成及营养水平参照《肉鸡饲养标准》(NY/T 33—2004)配制,其组成及营养水平见表1。每周记录不同处理组肉鸡的体重和采食量用于计算平均日采食量、平均日增重以及料重比。
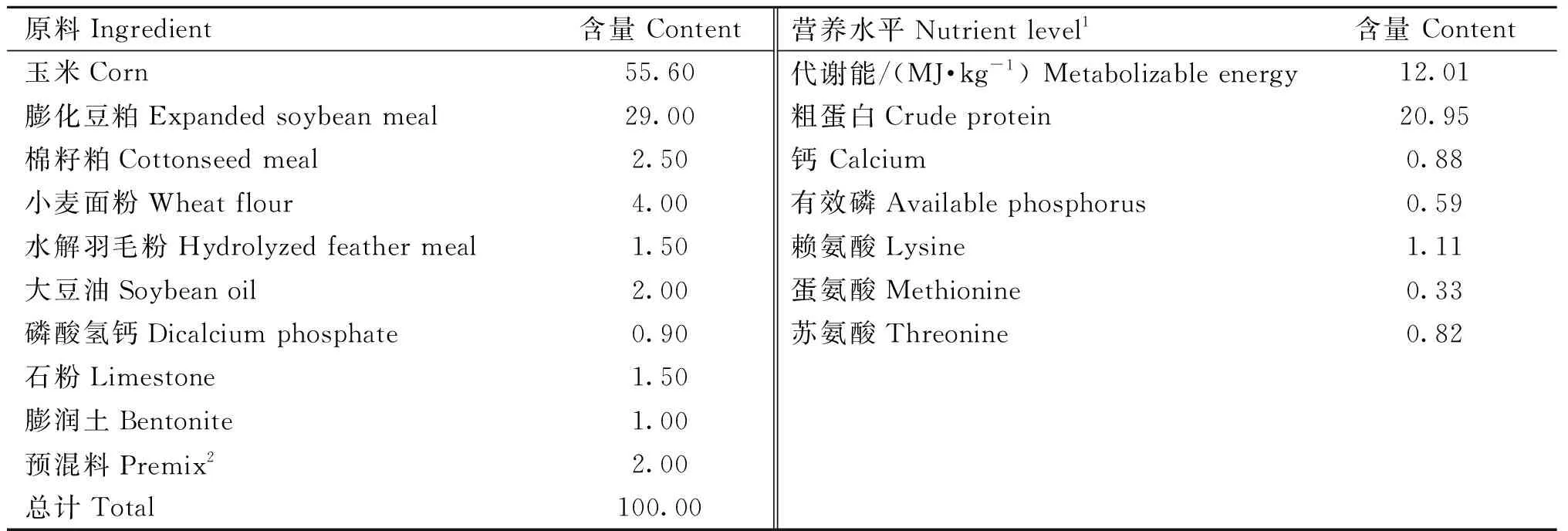
表1 基础日粮组成及营养水平(风干基础)
1.3 样品采集与指标检测
在试验第25天,从翅静脉采集不同处理组肉鸡的外周血,将采集的血液置于含肝素的抗凝管中,4 ℃,3 500×g离心10 min收集血清,之后,采用颈椎脱臼的方式处死肉鸡。解剖肉鸡并分离肝组织,PBS冲洗,将一部分肝组织置于4%多聚甲醛中固定用于病理组织学分析,一部分肝组织放入冻存管,液氮速冻后置于-80 ℃保存,用于后续试验分析。
1.3.1 病理组织学观察 肝组织在4%多聚甲醛中固定后用流水进行清洗,在分级乙醇中进行梯度脱水,用二甲苯透化并嵌入石蜡中。每个样本约5 μm厚的切片用二甲苯去蜡,分级,复水,并用苏木精-伊红(HE)染色。光学显微镜观察并评估肝组织。
1.3.2 肝功能和抗氧化指标检测 应用试剂盒检测肉鸡血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(AKP)活性,试剂盒购自南京建成生物工程研究所。
取不同处理组肉鸡的肝组织制备组织匀浆,离心后收集上清,应用试剂盒检测肉鸡肝中过氧化氢酶(CAT)、总超氧化物歧化酶(T-SOD)的活性,以及总抗氧化能力(T-AOC)和丙二醛(MDA)的浓度,试剂盒购自南京建成生物工程研究所。
1.3.3 RNA提取和实时荧光定量PCR(qPCR)检测 取不同处理组肉鸡的肝组织制备组织匀浆,离心后收集上清,采用总RNA提取试剂盒提取RNA,采用分光光度计检测提取的RNA浓度和纯度,用琼脂糖凝胶电泳检测RNA的完整性,用逆转录试剂盒将提取的RNA逆转录为cDNA,之后,应用qPCR检测肉鸡肝组织中白细胞介素-1β(IL-1β)、IL-18、肿瘤坏死因子α(TNF-α)、IL-10、一氧化氮合酶(iNOS)、白细胞分化抗原68(CD68)、精氨酸酶-1(ARG1)和白细胞分化抗原163(CD163)的 mRNA表达量。引物由上海生工生物工程有限公司合成(表2)。mRNA的相对表达量采用2-ΔΔCt方法计算,β-actin为内参基因。

表2 qPCR引物序列
1.3.4 Western blot检测 用含有蛋白酶抑制剂的RIPA裂解缓冲液匀浆肉鸡肝组织,使用BCA蛋白检测试剂盒测定蛋白浓度,将等量提取的蛋白质经SDS-PAGE凝胶电泳进行分离,之后将凝胶转移至PVDF膜上并置于5%脱脂牛奶封闭2 h,封闭完成后与一抗(NF-κB p65、IκBα、NLRP3、ASC、Caspase-1)过夜孵育(4 ℃),TBST冲洗后,在室温下与二抗孵育1 h,再用增强化学发光试剂检测目标蛋白的表达,并使用Image J软件进行定量分析。
1.4 数据统计分析
试验数据用 Excel 2010 进行初步整理。数据采用SPSS软件进行单因素方差分析,结果采用平均值(Mean)和标准误(SEM)表示,组间差异采用SPSS软件的Tukey′s HSD检验。P<0.05表示差异显著,P>0.05表示差异不显著。
2 结 果
2.1 HNa对S. Typhimurium感染肉鸡生长性能的影响
由表3可知,与CON组相比,S.Typhimurium感染显著降低了肉鸡的终末体重和平均日增重(P<0.05)。相较于ST组,饲粮中添加0.4和0.6 g·kg-1的HNa显著提高了肉鸡的终末体重,此外,饲粮中添加0.6 g·kg-1的HNa也显著提高了肉鸡的平均日增重(P<0.05)。各组间肉鸡的平均日采食量和料重比没有显著差异(P>0.05)。相较于CON组,ST、L-HNa、M-HNa和H-HNa组肉鸡感染S.Typhimurium后表现为食欲降低、羽毛松乱、精神委顿以及排稀粪等,在整个试验期间,没有肉鸡出现死亡。

表3 HNa对S. Typhimurium感染肉鸡生长性能的影响
2.2 HNa对S.Typhimurium感染肉鸡肝组织学形态的影响
肝病理组织学结果如图1所示,相较于CON组,S.Typhimurium感染组肉鸡肝表现为大量的炎性细胞浸润,肝小叶结构不清晰和细胞质空泡化,表明S.Typhimurium感染引起了严重的肝损伤。与ST组相比,饲粮中添加0.2、0.4和0.6 g·kg-1的HNa均减少了肝炎性细胞浸润,改善了肝小叶结构,减轻了肝组织病理学损伤。饲粮中添加0.4和0.6 g·kg-1的HNa对S.Typhimurium感染致肝组织损伤的保护作用优于添加0.2 g·kg-1的HNa。此外,肝脏指数的结果也表明,S.Typhimurium感染显著增加了肉鸡的肝脏指数,CON组、M-HNa和H-HNa组肉鸡的肝脏指数显著低于ST组和L-HNa组(P<0.05)。

A. 肝HE染色;B. 肝脏指数:柱上无字母或相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下同A. Liver HE staining; B. Liver index: Bars with no letter or the same letter mean no significant difference (P>0.05), while with different small letter mean significant difference (P<0.05). The same as below
2.3 HNa对S. Typhimurium感染肉鸡肝功能的影响
HNa对S. Typhimurium感染肉鸡肝功能的影响如图2所示,与CON组相比,ST组肉鸡血清中AKP、ALT和AST的活性显著升高(P<0.05)。相较于ST组肉鸡,饲粮中添加0.2、0.4和0.6 g·kg-1的HNa均显著降低了肉鸡血清中AKP、ALT和AST的活性(P<0.05),且不同剂量间无显著性差异。表明HNa缓解了S.Typhimurium感染引起的肉鸡肝损伤。
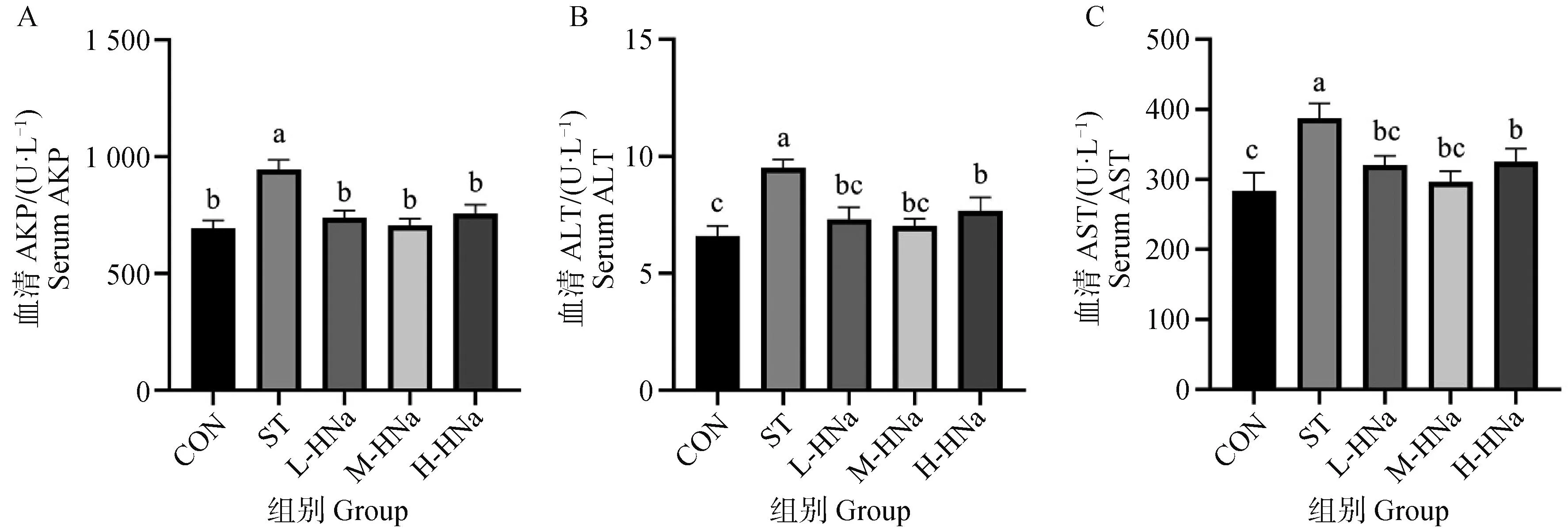
A. 血清AKP活性;B. 血清ALT活性;C. 血清AST活性A. Serum activity of AKP; B. Serum activity of ALT; C. Serum activity of AST
2.4 HNa对S. Typhimurium感染肉鸡肝抗氧化功能的影响
结果如图3所示,与CON组相比,ST组肉鸡肝组织抗氧化酶CAT、T-SOD的活性和T-AOC显著降低,而MDA的含量显著升高(P<0.05)。相较于ST组,饲粮中添加不同浓度的HNa均显著缓解了S.Typhimurium感染对肉鸡肝组织抗氧化功能的损伤,表现为肝CAT、T-SOD活性和T-AOC显著升高,MDA含量显著降低(P<0.05)。此外,M-HNa组肉鸡肝T-AOC显著高于H-HNa组肉鸡(P<0.05)。
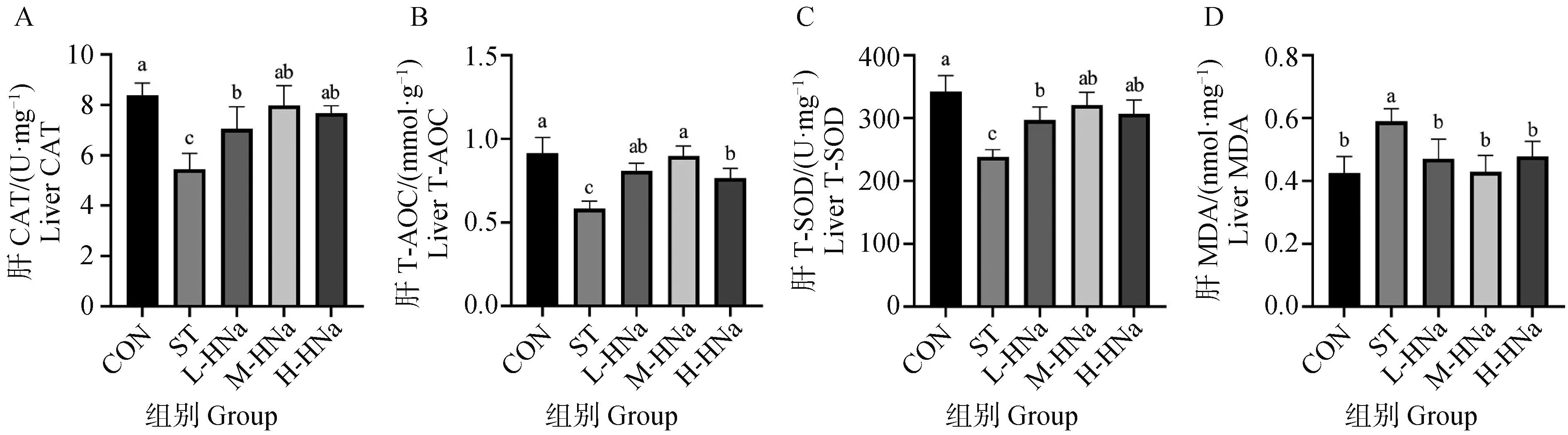
A. 肝CAT活性;B. 肝T-AOC;C. 肝T-SOD活性;D. 肝MDA浓度A. Liver CAT activity; B. Liver T-AOC; C. Liver T-SOD activity; D. Liver MDA concentration
2.5 HNa对S. Typhimurium感染肉鸡肝炎症因子和巨噬细胞极化的影响
为探究S.Typhimurium感染对肉鸡肝炎症的影响以及HNa的缓解作用,分别检测了肉鸡肝炎症因子和M1、M2型巨噬细胞标记物的mRNA表达水平。结果如图4所示,与CON组相比,ST组肉鸡肝促炎细胞因子IL-1β、TNF-α和IL-18的mRNA表达显著升高,而抗炎细胞因子IL-10的mRNA表达显著降低(P<0.05);此外,ST组肉鸡肝组织M1型巨噬细胞标记物iNOS和CD68的mRNA表达显著升高,而M2型巨噬细胞标记物ARG1和CD163的mRNA表达显著降低(P<0.05)。与ST组相比,饲粮中添加不同浓度的HNa均降低了促炎细胞因子(IL-1β、TNF-α和IL-18)和M1型巨噬细胞标记物(iNOS、CD68)的mRNA表达,提高了抗炎细胞因子(IL-10)和M2型巨噬细胞标记物的(ARG1、CD163)mRNA表达(P<0.05)。进一步的研究发现,与L-HNa和H-HNa组肉鸡相比,M-HNa组肉鸡肝组织有更低的IL-1β和TNF-αmRNA表达以及更高的IL-10和ARG1 mRNA表达。以上结果表明,饲粮中添加HNa具有调节肝组织炎症和免疫的作用,且饲粮中添加0.4 g·kg-1HNa优于其它浓度。

A~D. 肝IL-1β、TNF-α、IL-18、IL-10 mRNA表达;E~H. 肝iNOS、CD68、ARG1、CD163 mRNA表达A-D. Liver mRNA expression of IL-1β, TNF-α, IL-18, and IL-10; E-H. Liver mRNA expression of iNOS, CD68, ARG1, and CD163
2.6 HNa对S. Typhimurium感染肉鸡肝组织NF-κB和NLRP3信号通路的影响
本研究进一步探究了S.Typhimurium感染对肉鸡肝组织NF-κB和NLRP3信号通路的影响。结果如图5和图6所示,相较于CON组,S.Typhimurium感染显著提高了肉鸡肝NF-κB p65、NLPR3、ASC和Caspase-1的蛋白表达,显著降低了IκBα的蛋白表达(P<0.05)。饲粮中添加不同浓度的HNa均抑制了S.Typhimurium感染引起的肉鸡肝NF-κB和NLRP3信号通路的激活,表现为降低的NF-κB p65、NLPR3、ASC和Caspase-1的蛋白表达(P<0.05)。

A. 蛋白表达结果;B. NF-κB蛋白表达定量分析;C. IκBα蛋白表达定量分析A. Protein expression results; B. Quantitative analysis of NF-κB protein expression; C. Quantitative analysis of IκBα protein expression
3 讨 论
沙门菌是一种重要的人畜共患病原菌。研究表明,食用家禽制品是沙门菌感染导致公共卫生问题的主要原因之一[2]。因此,防控肉鸡沙门菌感染可有效减轻沙门菌对公共卫生的危害。作为一种具有多种生物活性的天然产物,HNa已被广泛应用于农业、医药和保健等多个领域。本课题组前期研究发现,HNa能通过调节肠道菌群、抑制肠道炎症和调节肠道黏膜免疫等缓解病原微生物感染对肠道和肝的损伤[10-11,15]。然而,HNa对S.Typhimurium感染肉鸡致肝损伤的保护作用尚不清楚。因此,本研究通过检测肝组织学形态、肝功能、肝抗氧化、肝炎症因子和炎症相关信号通路探究了HNa对S.Typhimurium感染肉鸡肝损伤的保护作用及相关机制。
有研究表明,沙门菌感染会降低肉鸡的生产性能,引发肠道损伤以及急性系统性疾病[16]。本研究发现,S.Typhimurium感染显著降低了肉鸡的终末体重和平均日增重。陈志敏等[13]的研究表明,饲粮中添加HNa能显著提高肉鸡的生产性能。对仔猪的研究也表明HNa具有提高生长性能的作用[17]。此外,本课题组前期对犊牛的研究也发现,饲粮中添加HNa可以提高犊牛的生长性能,降低犊牛的发病率[18]。本研究进一步证实了饲粮中添加HNa可以有效缓解S.Typhimurium感染对肉鸡生长性能的影响。此外,本课题组前期研究发现,S.Typhimurium感染引起了小鼠严重的肝损伤[11]。相似的是,本研究表明,S.Typhimurium感染也造成了肉鸡的肝损伤,主要表现为大量的炎性细胞浸润,肝小叶结构不清晰和细胞质空泡化。血清谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(AKP)的活性可作为肝损伤的生物标志物。之前的一项研究表明,S.Typhimurium感染显著提高了小鼠血清ALT、AST、AKP和总胆汁酸(TBA)的水平[19]。与此相一致的是,S.Typhimurium感染也显著提高了本试验中肉鸡血清中ALT、AST和AKP的水平,且肝组织病理学和肝功能的检测结果均表明S.Typhimurium感染导致了肉鸡肝损伤。饲粮添加HNa显著降低了肉鸡肝病理组织学损伤和血清中AKP、ALT和AST的水平,表明HNa缓解了S.Typhimurium感染对肉鸡肝损伤。研究表明,S.Typhimurium感染引起肝损伤的原因主要通过破坏肠道屏障导致S.Typhimurium和肠道有害物质进入血液通过肠肝循环进入肝,导致肝组织发生炎症反应和肝细胞凋亡等引发肝损伤[16]。本团队前期的研究发现,HNa通过调节肠道菌群、抑制肠道炎症和促进肠上皮细胞增殖等缓解了S.Typhimurium和大肠杆菌感染对小鼠肠道屏障的损伤[10-11],此外,本课题组还发现HNa可以通过抑制肝TLR4/NF-κB和NLRP3信号通路的激活缓解LPS诱导的小鼠肝损伤(数据未发表)。与之前的研究一致,本研究的结果表明饲粮中添加HNa缓解了S.Typhimurium感染对肉鸡肝组织的损伤。综上所述,可以推测HNa主要通过提高肠道屏障的完整性和抑制肝炎症反应缓解肝损伤。
免疫系统是机体抵御病原体和有害物质入侵的第一道防线。巨噬细胞具有分泌细胞因子、吞噬和杀伤病原体、维持免疫平衡等多种功能[20]。库普弗细胞(Kupffer cell)是位于肝中的特殊巨噬细胞,在介导肝免疫和炎症反应中发挥重要的作用。研究表明,过度的巨噬细胞浸润会促进炎症的发展[21]。此外,在肝损伤或感染的情况下,巨噬细胞可在促炎的M1型和抗炎的M2型之间转换。M1型巨噬细胞可介导Th1免疫反应,在感染初期和炎症急性期发挥关键作用。M2型巨噬细胞介导Th2免疫反应,负责组织重塑和稳态维持[22]。本研究发现,S.Typhimurium感染显著增加了M1型巨噬细胞标志物iNOS和CD68的mRNA表达,降低了M2型巨噬细胞标志物ARG1和CD163的mRNA表达,表明S.Typhimurium感染诱发了肉鸡肝组织严重的炎症反应。相较于ST组,饲粮中添加HNa降低了iNOS和CD68的mRNA表达,增加了ARG1和CD163的mRNA表达,表明HNa促进了肝中的巨噬细胞向M2型极化。这与本课题组前期研究发现类似,即HNa干预通过促进巨噬细胞M2型极化降低了S.Typhimurium感染诱发的小鼠肠道炎症反应[11]。众所周知,NF-κB是参与炎症性疾病的主要转录因子。作为NF-κB的抑制剂,IκBα通过在细胞质中形成不活跃的NF-κB/IκBα复合物抑制NF-κB的激活。当存在细胞外刺激的情况下,磷酸化介导的IκBα会发生降解,进而激活NF-κB并诱导IL-1β和TNF-α等促炎细胞因子的分泌[23]。研究表明,IL-1β可以激活巨噬细胞表面NOD样受体蛋白3(NLRP3),此外,激活的NF-κB也能与NLRP3启动子结合激活NLRP3。激活的NF-κB信号通路和NLRP3炎性小体可以促进IL-1β和IL-18的成熟和释放,并进一步通过反馈回路加剧炎症反应[24]。研究发现,抑制炎症信号通路的激活和诱导巨噬细胞向M2型极化是炎症性相关疾病的潜在治疗方案[25-26]。本研究发现,S.Typhimurium感染激活了肉鸡肝组织NF-κB信号通路和NLRP3炎性小体,主要表现为NF-κB p65、NLRP3、ASC、Caspase-1、IL-1β、IL-18和TNF-α表达的增加。本研究还发现,饲粮添加HNa显著降低了肉鸡肝组织NF-κB p65、NLRP3、ASC、Caspase-1的蛋白表达以及IL-1β、IL-18和TNF-α的mRNA表达水平,表明HNa对炎症相关信号通路和促炎细胞因子的抑制作用。本课题组前期研究也表明,HNa干预能通过抑制炎症反应有效缓解E.coli和S.Typhimurium感染对小鼠肠道的损伤[10-11]。除了抗炎作用外,对仔猪、犊牛和小鼠的研究均表明,HNa还具有较强的抗氧化作用[11-12,18]。氧化应激的特点是活性氧(ROS)的过度产生超出了机体的抗氧化防御能力。ROS 可导致各种细胞损伤,包括脂质过氧化、DNA 损伤和蛋白质氧化,最终加剧组织损伤和炎症。众所周知,CAT、T-AOC 和 T-SOD 是催化超氧阴离子和过氧化氢(H2O2)转化为无毒化合物的关键抗氧化酶,是细胞抗氧化防御的重要组成部分。脂质过氧化水平可通过检测MDA的浓度进行测量[27-28]。本研究发现,在S.Typhimurium感染的肉鸡肝组织内,抗氧化酶(CAT、T-AOC和T-SOD)的活性急剧下降,而MDA浓度显著升高,表明S.Typhimurium感染对肉鸡肝造成了严重的氧化损伤。相较于ST组肉鸡,饲粮中添加不同浓度的HNa均显著提高了肉鸡肝组织CAT、T-SOD的活性和T-AOC,降低了MDA的浓度,表明HNa提高了肝的抗氧化功能。本团队还发现,喂服HNa能显著提高犊牛抗氧化酶的活性(数据未发表)。此外,Wang等[17]证实,给断奶仔猪服用HNa也能提高抗氧化酶的活性。基于前人和本研究的结果,可以推测,饲粮中添加HNa主要通过提高肉鸡肝组织抗氧化酶的活性发挥抗氧化作用。
4 结 论
综上所述,饲粮中添加HNa可通过降低肝炎症反应、抑制肝NF-κB和NLRP3信号通路的激活以及提高肝抗氧化酶的活性等缓解S.Typhimurium感染对肉鸡肝的损伤。在本试验条件下,饲粮中添加0.4~0.6 g·kg-1的HNa对肉鸡肝损伤有更好的保护作用。
