新西兰白兔BMP15基因的真核表达载体构建、表达模式及其在卵巢组织的表达
2024-03-01陈孟娟刘雨晴王智通温佳乐许会芬于光晴
陈孟娟,刘雨晴,王智通,温佳乐,许会芬,于光晴,李 明
(河南农业大学动物科技学院,郑州 450046)
兔(Oryctolaguscuniculus)是最重要的经济动物之一,可为人们提供肉、皮毛等生产生活资料。兔肉具有低脂肪、低胆固醇和高蛋白质的特点,其深受消费者的欢迎[1]。兔繁殖性能是影响兔产业发展和经济效益的重要因素,雌性动物的繁殖潜力主要取决于卵巢和卵泡的生长和发育[2],因此,探究兔卵巢卵泡生长发育的分子机制,在其生产过程中具有重要的科学意义。
卵巢的发育是一个动态变化过程,在每个生殖周期都经历着广泛的组织重塑,包括卵泡的形成和闭锁、排卵、黄体形成和退化的过程,并且还伴随着血管系统和微环境的变化[3-5]。卵泡是卵巢的功能单位,多种卵巢内因子参与膜内细胞、颗粒细胞和卵母细胞之间的旁分泌/自分泌信号传导,并且有助于优势卵泡的发育[6]。研究发现,卵巢内的信号通路调节着卵泡的发育和生长,如卵泡信号传导过程中转化生长因子-β(TGFβ)家族发挥着重要作用,它可以调控卵泡颗粒细胞的增殖和孕酮的分泌进而调控卵泡的发育和闭锁[7]。
骨形态发生蛋白15(BMP15)由卵母细胞分泌,属于转化生长因子(TGF-β)超家族的多功能胞外分泌蛋白,在哺乳动物卵巢、卵泡的生长发育、成熟以及排卵过程中起着不可或缺的作用[8-9]。BMP15 蛋白作为卵母细胞分泌因子,以内分泌或旁分泌的方式分泌到胞外,通过调节卵泡颗粒细胞的生长和分化来控制卵泡的生成和排卵,最终影响优势卵泡的选择和闭锁卵泡的形成[10]。Hosoe等[11]研究发现,BMP15在成年母牛卵巢卵丘细胞中的表达水平显著高于小牛,且在母牛的卵母细胞和卵丘细胞中均有表达。在小鼠卵巢中,BMP15最早出现于初级卵母细胞中,持续表达于卵母细胞晚期,并维持至排卵发生,存在于卵泡发育的各个阶段[12]。当 BMP15敲除后,导致猪卵巢发育功能不全以及正常卵泡的数量显著减少[13]。绵羊BMP15基因突变为纯合子后,其卵泡发育停滞[14]。BMP15能够刺激颗粒细胞中促卵泡激素(FSH)mRNA表达增加,从而调控卵巢内固醇类激素的合成和促黄体受体(LHR)的表达[15]。还有研究发现,BMP15基因通过TGF-βRⅡ 激活SMAD4信号分子从而实现调控卵泡颗粒细胞的发育[16]。BMP15作为家畜繁殖力的重要候选基因,在卵巢发育过程中起着重要的调节作用,对其深入研究能更好地理解卵巢卵泡生长发育的分子机制。
目前,BMP15的研究已经在多个物种中开展,但BMP15对于兔卵巢发育影响的研究较少,BMP15基因对兔繁殖机能的调控机制尚未清楚。本试验以新西兰白兔卵巢组织RNA反转录的cDNA为模板,克隆出BMP15 基因的CDS区,构建该基因的真核表达载体,对BMP15蛋白进行生物信息学分析,通过激光共聚焦方法检测BMP15在细胞内的定位情况,并且通过实时荧光定量PCR方法检测新西兰白兔BMP15基因在不同组织及器官中的表达情况,初步分析BMP15基因的功能及表达特点,以期为深入研究兔BMP15基因对卵巢发育的调控机制奠定基础,为提高家畜繁殖能力提供理论依据。
1 材料与方法
1.1 试验样品
选取180日龄健康的新西兰白兔雌兔3只,屠宰后迅速采集心脏、肝脏、脾脏、肺脏、肾脏、子宫、腿肌、卵巢组织,用PBS冲洗后,剪成小块,转入2 mL无酶冻存管中,液氮速冻后,放入-80 ℃冰箱内保存备用。本试验所使用的细胞系为人胚胎肾细胞(HEK293 T)和人非小细胞肺癌细胞(H1299)购自中国科学院典型培养物保藏中心。
1.2 主要试剂
Trizol试剂和DH5α感受态细胞均购自于北京全式金生物技术有限公司,KOD高保真酶购自于上海东洋纺生物科技有限公司,DNA Marker、实时荧光定量试剂盒和反转录试剂盒购自于莫纳(武汉)生物科技有限公司,胶回收试剂盒和质粒提取试剂盒均购自于北京天根生化科技有限公司,T4连接酶购自TaKaRa(日本)公司,KpnⅠ、EcoR Ⅰ限制性内切酶购自NEB(北京)公司,PBS、胎牛血清和 DMEM高糖培养基购自武汉普诺赛生命科技有限公司,Lipofectamine 3000试剂购自Thermo(美国)生物科技有限公司,4% PFA多聚甲醛购自上海碧云天生物科技有限公司,DAPI和抗荧光淬灭剂购自武汉赛维尔生物科技有限公司,Myc抗体购自Santa Cruz(美国)公司 (sc-40),BMP15抗体购自上海生工生物工程有限公司 (D121992),β-actin抗体购自赛维尔(武汉)生物科技有限公司(GB11001-100),蛋白质裂解液、蛋白质上样缓冲液、蛋白marker购自上海雅酶生物医药科技有限公司。
1.3 引物设计及合成
参考GenBank中公布的兔BMP15基因序列(GenBank登录号:NM_001 199 117.1),使用SnapGene设计BMP15基因特异性克隆引物,随后使用NCBI网站进行引物验证,使用NCBI设计实时荧光定量引物,扩增片段长度大小为100~200 bp。内参为GAPDH基因(GenBank登录号:NM_001082-253.1),引物序列信息见表1。引物由上海生工生物科技有限公司合成。

表1 引物信息
1.4 RNA 的提取及反转录
取黄豆大小(100 mg)的组织样品进行研磨,用Trizol法提取组织总RNA,1%琼脂糖凝胶电泳检测RNA的质量,超微量分光光度计检测RNA的浓度。用反转录试剂盒将其反转录成cDNA。
1.5 家兔BMP15基因的克隆
以新西兰白兔卵巢组织cDNA为模板进行PCR扩增。PCR反应体系为:模板cDNA(500 ng·μL-1)5 μL,BMP15-F(10 ng·μL-1)1.5 μL,BMP15-R(10 ng·μL-1)1.5 μL, KOD OneTM PCR Master Mix 25 μL,ddH2O补至50 μL。PCR 反应程序:98 ℃预变性2 min;98 ℃变性10 s , 60 ℃退火5 s, 68 ℃延伸13 s, 35个循环;68 ℃终延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测后,胶回收试剂盒回收目的条带,将回收的目的条带、Pmcherry-N1 和pCMV-Myc载体用KpnI、EcoR I限制性内切酶酶切37 ℃、30 min后,酶切产物经1% 琼脂糖凝胶电泳检测后,胶回收,将回收的目的基因以及载体使用T4连接酶连接,体系为:T4连接酶1 μL,Buffer 1 μL,目的基因胶回收产物 5 μL,载体3 μL,16 ℃连接过夜,将连接产物转化,涂在含有卡那霉素、氨苄霉素的培养板上,第2天挑取阳性菌落,菌液PCR结果正确后送擎科生物有限公司测序。
1.6 生物信息学分析
测序结果利用SeqMan软件与兔BMP15基因进行序列比对。利用在线工具进行生物信息学分析,分析工具如表2所示,利用Mega7.0软件对不同物种BMP15基因进行同源性比较,并绘制不同物种BMP15基因的氨基酸序列系统进化树。
表2 生物信息学分析网址
1.7 实时荧光定量 PCR
以新西兰白兔的心脏、肝脏、脾脏、肺脏、肾脏、肌肉、卵巢、子宫的cDNA为模板,准备相对应的1.5 mL无酶EP管,将相对应上下游引物、水、SYBRGreen Mix预混在一起,分别均匀加至每孔,生物重复和技术重复各3个,反应体系为10 μL:cDNA模板1 μL,上、下游引物各 0.2 μL,SYBRGreen Mix 5 μL, ddH2O 补足至 10 μL。使用实时荧光定量仪器进行 PCR 反应。根据荧光定量所得到的 Ct 值,采用2-ΔΔCt法对数据进行分析,GraphPad Prism 7.0软件作图。
1.8 细胞培养
将冻存的H1299细胞和HEK293 T细胞从液氮中取出,放在37 ℃水浴锅中解冻,期间不断摇晃使受热均匀,随后将细胞冻存液移至细胞培养瓶中,分别加入含有10%胎牛血清的RPMI-1640培养基和DMEM高糖培养基,放入含有5% CO2的37 ℃培养箱进行培养。传代2~3次,用于后续实验。
1.9 细胞转染
当细胞密度达到70~80%时,按照Lipofectamine 3000 试剂盒说明书转染质粒,将pCMV-Myc-BMP15转染到HEK293 T细胞内,对照组转染pCMV-Myc空载体,每组各设置3个生物学重复,培养24 h 后,收取细胞样品用于检测mRNA 水平的过表达效果;48 h 后,收取细胞样品用于检测蛋白水平表达效果。同样地按照Lipofectamine 3000 试剂盒说明书转染Pmcherry-N1-BMP15质粒,设置3个生物学重复。
1.10 激光共聚焦分析
待细胞生长状态良好时,将细胞接种于预先加入圆形盖玻片(直径2 cm)的6孔板中,细胞密度为2×105个·孔-1;培养24 h后,转染构建的Pmcherry-N1-BMP15质粒;24 h后,去除培养基,用 PBS漂洗3次,用1 μg·mL-1DAPI 室温下染色10 min,PBS清洗细胞3次;封片:取约5 μL抗淬灭剂滴加到载玻片上,然后将盖玻片倒置于抗淬灭剂上(有细胞的一面向下),用吸水纸吸净溢出来的抗淬灭剂;用Leica 激光扫描共聚焦显微镜观察并拍照。
1.11 Western blotting
使用裂解液提取细胞或组织的蛋白,加入蛋白上样缓冲液后,100 ℃煮10 min。待蛋白样品冷却后,根据蛋白含量,在上样孔中加入5~10 μL蛋白样品和2.5 μL蛋白Marker。将电压设为80 V进行电泳,待溴酚蓝条带进入分离胶,将电压设置为120 V,电泳50~60 min(根据目的蛋白分子量大小调整电泳时间)。电泳结束后进行转膜,将蛋白转印至PVDF膜上,120V,60 min。5%脱脂奶粉封闭60 min,孵育一抗 4 ℃过夜,一抗工作浓度为1∶1000稀释,TBST洗膜3次,每次5 min,室温孵育二抗60 min,二抗工作浓度为1∶10 000,TBST洗膜3次。PVDF膜滴加ECL发光液,放入到暗室中进行显影。
1.12 免疫荧光
采取健康新西兰白兔的卵巢,10%多聚甲醛固定后,制作石蜡切片,将切片置于0.1 mol·L-1、 pH=6的枸橼酸液修复液中进行抗原修复;PBS洗2次,每次2 min,加0.2% TritonX-100透膜15 min;PBS洗两次,每次2 min;玻片上PBS用滤纸擦净,在湿盒内用BSA室温封闭1 h;PBS洗两次后,4 ℃孵育一抗过夜,一抗工作浓度为1∶1 000稀释,PBS洗5次,滴加荧光二抗并在湿盒内室温避光孵育1 h,二抗工作浓度为1∶500稀释;PBS洗3次,滴加DAPI避光孵育15 min,PBS洗两次后,滴加抗荧光淬灭剂封片,烘干后在荧光显微镜下观察。
1.13 数据分析
定量和蛋白量化数据使用 SPSS 26.0 软件进行分析处理,经齐性检验后,进行单因素方差分析比较显著性差异,显著性水平为: *P<0.05表示差异显著,**P<0.05表示差异比较显著,***P<0.05表示差异极显著。使用GraphPad Prism 软件进行统计分析和图形绘制。
2 结 果
2.1 新西兰白兔 BMP15 基因的克隆
以反转录的卵巢组织cDNA为模板,PCR 扩增BMP15基因,扩增片段为1 182 bp,1% 琼脂糖凝胶电泳结果与预期片段相符(图1)。测序后进行序列比对,与NM_001 199 117.1的相似度为100%,可以初步确定为兔BMP15 CDS区序列。

M. DNA 相对分子质量标准;1. BMP15 基因CDS区全长的PCR产物M. 2000 bp DNA marker; 1. PCR amplification product of CDS region of BMP15 gene 图1 新西兰白兔BMP15基因CDS区克隆Fig.1 The CDS region of New Zealand white rabbits BMP15 gene
2.2 新西兰白兔 BMP15 基因及蛋白生物信息学分析
2.2.1 新西兰白兔BMP15基因编码核苷酸序列分析 新西兰白兔BMP15基因序列与小鼠、人、牛、猪、马、绵羊、鸡、犬的同源相似性分别为66.3%、75.5%、81.2%、81.9%、81.2%、79.9%、38.3%、81.7%(图2A)。系统进化树结果表明(图2B),兔与猪的亲缘关系最近,与鸡的亲缘关系最远

A. 新西兰白兔与其他物种BMP15基因核苷酸序列同源性比较; B. 新西兰白兔BMP15基因系统进化树A. Comparison of nucleotide sequence homology of BMP15 gene between New Zealand white rabbits and other species; B. Phylogenetic tree of BMP15 gene in New Zealand white rabbits
2.2.2 新西兰白兔BMP15蛋白理化性质分析 蛋白理化性质分析结果显示,新西兰白兔BMP15蛋白分子式为C2020H3199N591O550S18,其原子总数为6 378,含有393个氨基酸,蛋白质理论等电点为9.69,属于碱性蛋白,不稳定指数为55.32,为不稳定蛋白,脂肪酸指数为92.80%,总平均亲水性为-0.865,为亲水性蛋白(图3)。对新西兰白兔BMP15蛋白氨基酸主成分分析结果如表3所示,其中负电荷残基(Asp+Glu)总数为31,正电残基(Arg+Lys)总数为48。

图3 新西兰白兔 BMP15 蛋白疏水性分析Fig.3 Hydrophobic analysis of BMP15 protein in New Zealand white rabbits
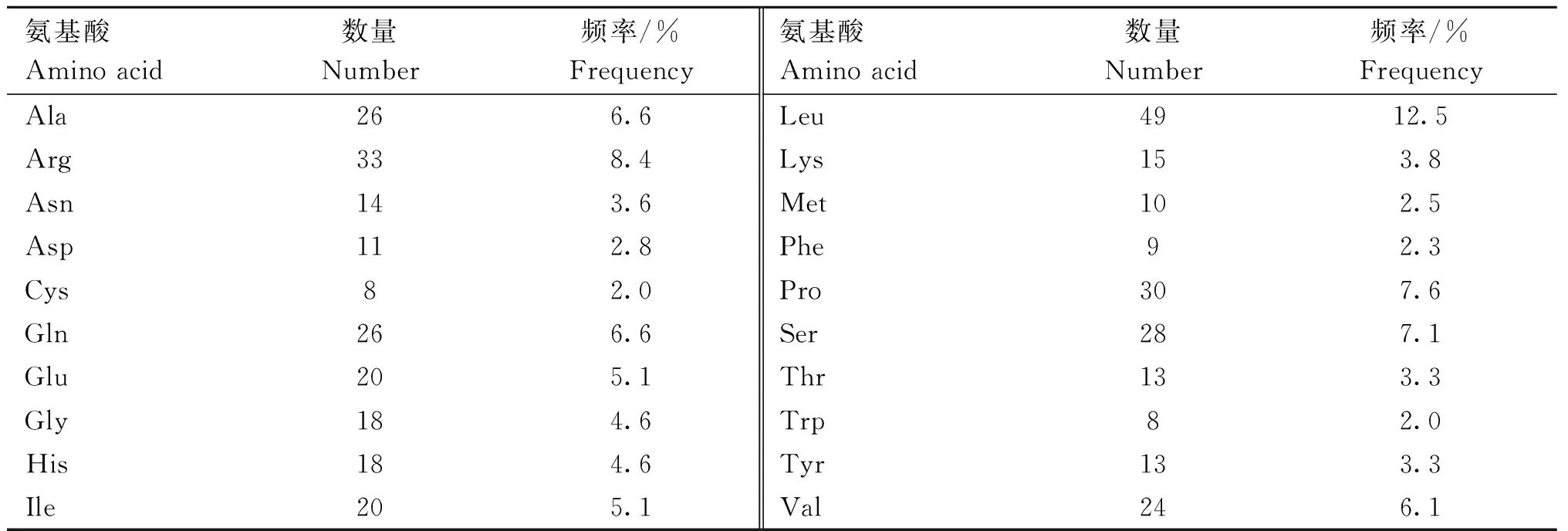
表3 新西兰白兔 BMP15 蛋白的氨基酸组成
2.2.3 新西兰白兔BMP15蛋白跨膜结构和信号肽预测 蛋白跨膜结构分析结果表明,新西兰白兔BMP15 蛋白不含跨膜结构,表明BMP15蛋白不属于跨膜蛋白(图4A)。信号肽预测结果显示(图4B), BMP15蛋白在25位氨基酸处存在一个信号肽,属于分泌型蛋白。
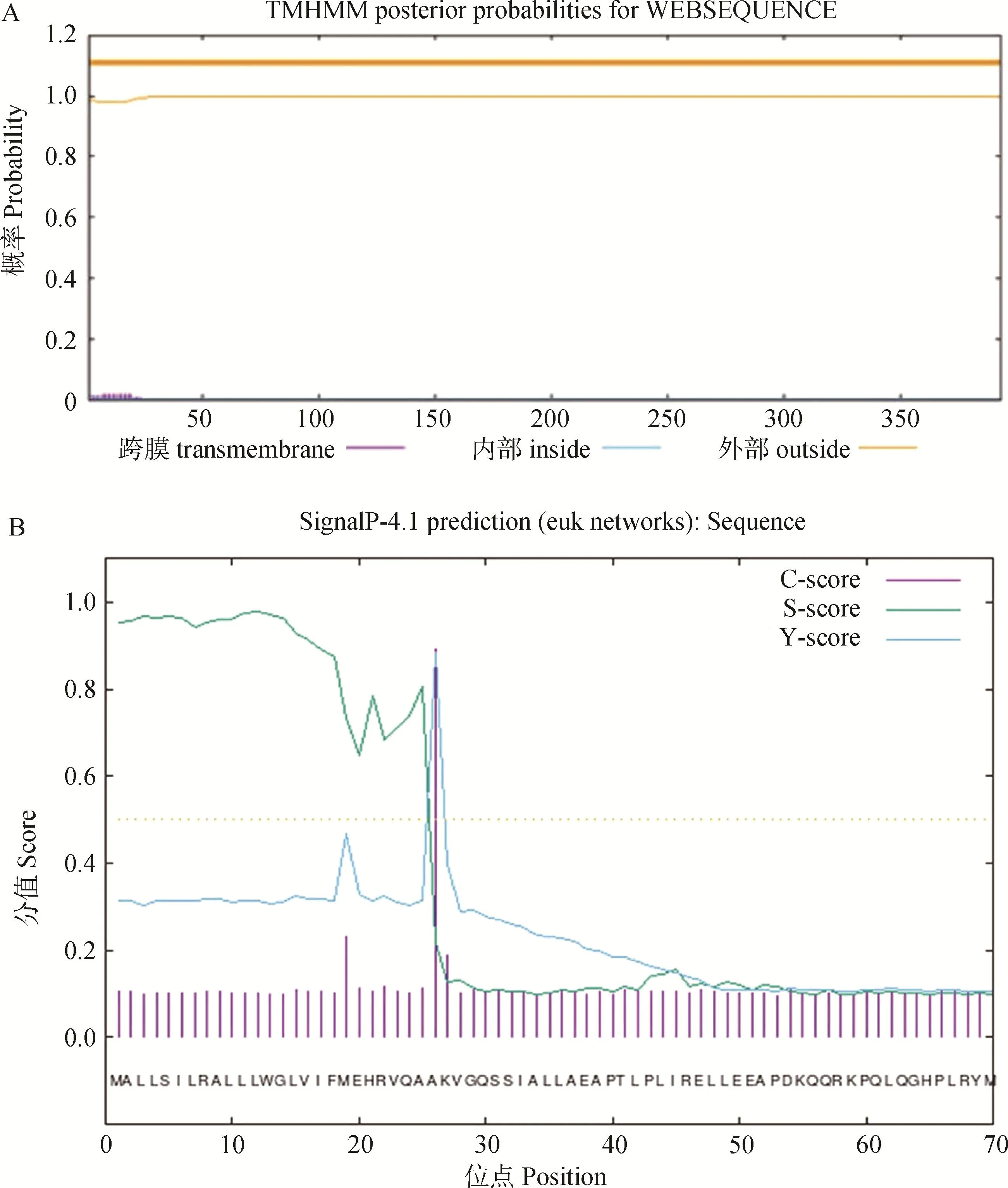
A. 新西兰白兔 BMP15 蛋白跨膜区预测; B. 新西兰白兔 BMP15 蛋白信号肽预测A. Prediction of transmembrane region of BMP15 protein in New Zealand white rabbits; B. Prediction of BMP15 protein signal peptide in New Zealand white rabbits
2.2.4 新西兰白兔BMP15蛋白质磷酸化位点和糖基化位点分析 如图5所示,新西兰白兔BMP15蛋白共检测出26个磷酸化位点,其中19个Serine(丝氨酸)磷酸化位点,7个Threonine (苏氨酸) 磷酸化位点。NetNGlyc4.0分析表明BMP15蛋白共有15个糖基化位点。
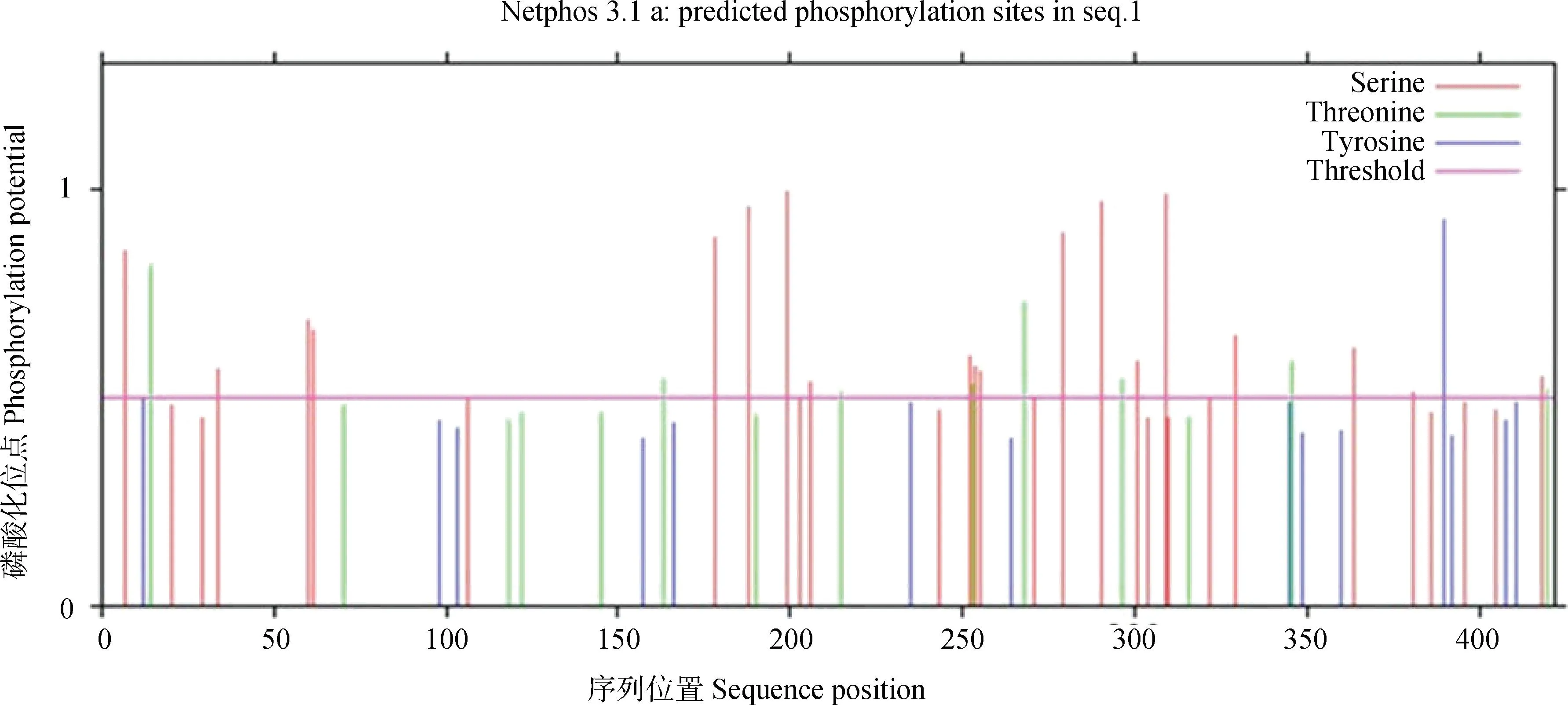
图5 BMP15蛋白磷酸化位点图Fig.5 Phosphorylation site map of BMP15 protein
2.2.5 BMP15蛋白质二级结构、三级结构预测 通过蛋白质在线分析系统预测BMP15蛋白的二级结构,结果显示,新西兰白兔BMP15蛋白主要由α-螺旋、无规则卷曲、延伸链、β-转角组成,占比分别为38.68%、37.4%、15.52%、8.40%,为混合性蛋白(图6)。该蛋白的三级结构预测主要以 α-螺旋和无规则卷曲为主,与二级结构预测结果一致(图7)。

h.α-螺旋;e.延伸链;t.β-转角;c.无规则卷曲h. α-helix; e. Extension chain; t. β-rotation; c. Irregular crimp

图7 BMP15 三级结构预测Fig.7 BMP15 tertiary structure prediction
2.2.6 新西兰白兔BMP15蛋白的互作分析 通过STRING在线数据库检索分析BMP15蛋白的相互作用,如图8所示,发现BMP15蛋白与促卵泡激素受体(FSHR)、生殖系a因子(FIGLA)、骨形态发生蛋白受体1B(BMPR1B)、配体特异性II型受体(AMHR2)、新生儿卵巢同源基因(NOBOX)等蛋白之间存在相互作用。
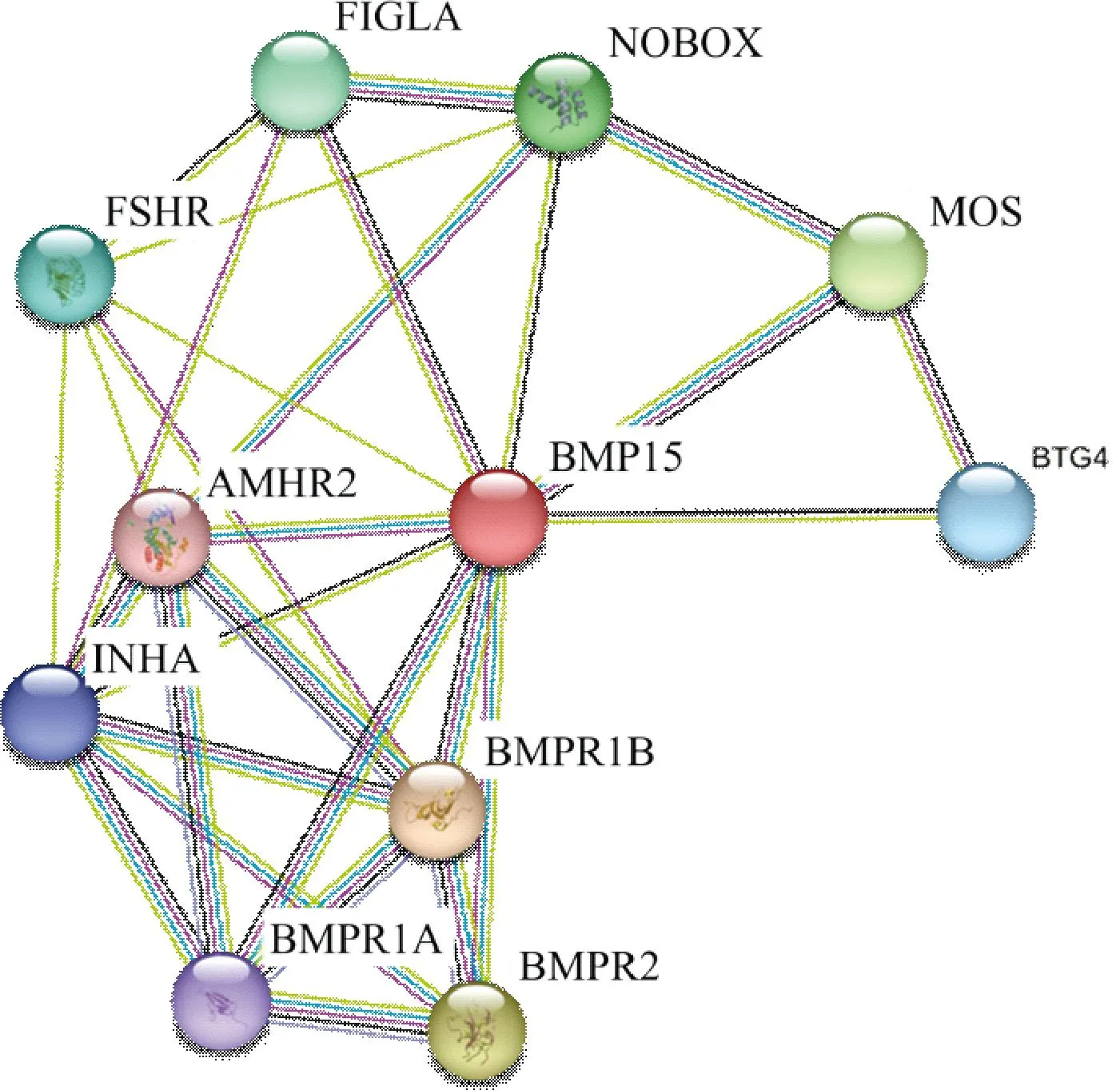
图8 新西兰白兔 BMP15 蛋白与其它蛋白相互作用Fig.8 Interaction between BMP15 protein and other proteins in New Zealand white rabbit
2.3 BMP15 基因在新西兰白兔不同组织和器官中的表达量分析
对BMP15基因在新西兰白兔各个组织中的表达情况进行分析,结果如图9所示,由结果可知,BMP15基因仅在卵巢中表达(P<0.05)。

图9 BMP15基因在新西兰白兔不同组织中的表达量Fig.9 Expression of BMP15 gene in different tissues of New Zealand white rabbits
2.4 BMP15亚细胞定位分析
将已构建成功的红色荧光标签标记的真核表达载体转染至H1299细胞中,BMP15主要分布在细胞质中(图10)。
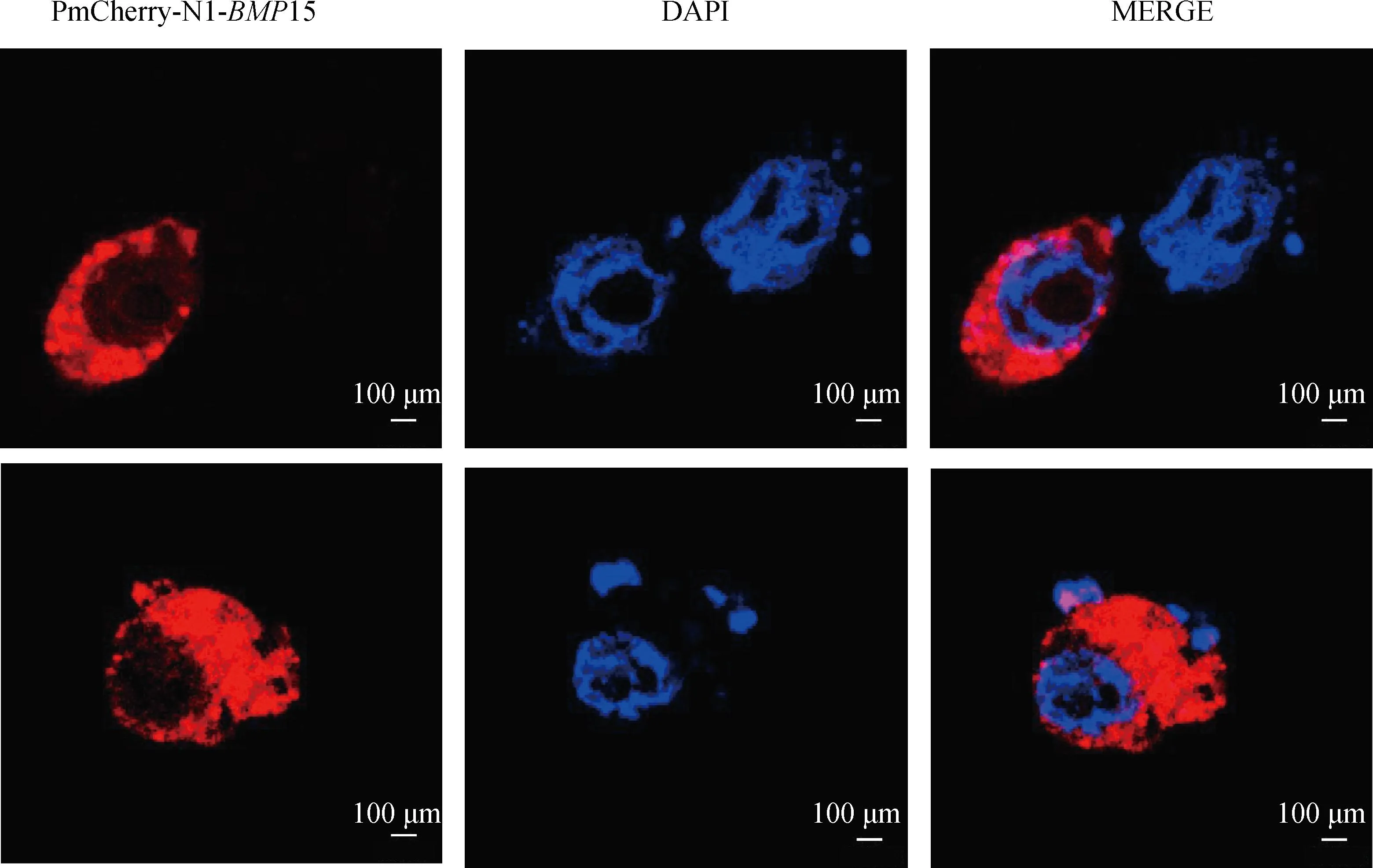
mCherry-BMP15代表红色荧光通道;DAPI代表蓝色荧光通道;MERGE表示两个通道的叠加mCherry-BMP15 represents red fluorescence channel; DAPI represents blue fluorescence channel; MERGE represents the superposition of two channels
2.5 兔BMP15基因在HEK293 T细胞中的过表达
将带有Myc标签的BMP15质粒转染至HEK293T细胞内,定量结果显示(图11A),BMP15 mRNA水平相比对照组上调约13 666倍(P<0.001),Western bloting结果显示,与对照组相比,过表达BMP15后,BMP15蛋白表达量显著上升(P<0.001)(图11B,C)。
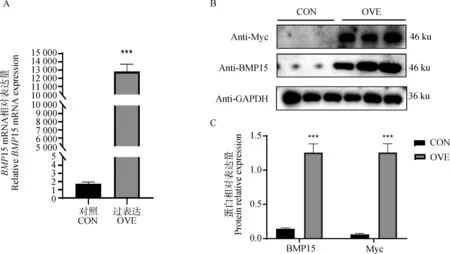
A. 过表达后BMP15 mRNA相对表达量;B. 过表达后BMP15蛋白的表达;C. 蛋白表达量化结果。CON. 空质粒转染对照组;OVE. 重组质粒转染组。***. P<0.001A. Relative expression of BMP15 mRNA after overexpression; B. Expression of BMP15 protein after overexpression. C. Quantitative results of protein expression.CON. Empty plasmid transfection control group; OVE. Recombinant plasmid transfection group. ***. P<0.001
2.6 BMP15 在卵巢组织的定位及表达
卵巢组织免疫荧光结果显示(图12A),BMP15表达于不同发育时期卵泡的颗粒细胞中,并且主要在颗粒细胞的细胞质中表达。同时,BMP15蛋白在新西兰白兔卵巢组织的表达如图12B所示。
3 讨 论
近年来,对于BMP15在卵巢发育中作用的研究不断深入, BMP15对卵泡生长发育影响的分子机制也慢慢明确,但BMP15在兔上的研究还甚少。秦明鸣等[2]通过构建猪BMP15基因报告载体随后显微注射至不同细胞内及体外培养的卵泡中,发现启动子只在卵巢细胞内特异性表达,并且能在卵母细胞体外成熟18 h 启动表达。本研究通过克隆得到新西兰白兔BMP15基因的CDS区序列,并且成功构建出BMP15真核表达载体,可以为深入探究BMP15基因对于兔繁殖性能影响的分子机制提供基础。接下来通过对不同物种间BMP15基因及其编码序列分析发现,兔与猪、犬、牛、绵羊的同源性较高,而与鸡的序列同源性较低,说明在哺乳动物中BMP15基因进化比较保守。
本研究通过TMHMML 和SignalP-4.1在线软件预测BMP15不属于跨膜蛋白,并且含有一个信号肽,属于分泌型蛋白。BMP15的无活性前体包括N端信号肽、前肽和含有成熟蛋白的C端区域,当其发挥生物学功能时,将进行翻译后处理,包括信号肽的去除、二聚化和进一步的剪切[17]。BMP15蛋白成熟区域的二聚化包括其自身的二聚化或者与其它TGF超家族成员的成熟区域进行二聚化[18],有报道称人类BMP15与GDF9成熟蛋白会形成成熟的同型二聚体、多聚体和异二聚体[19-20]。对BMP15蛋白进行磷酸化预测,发现该蛋白共有26个潜在的磷酸化位点,能发生磷酸化的氨基酸位点包括丝氨酸和苏氨酸;糖基化预测发现该蛋白共有15个潜在的糖基化位点。磷酸化和糖基化是重要的蛋白质翻译后修饰,蛋白质的磷酸化与多种生物学过程密切相关,包括 DNA 损伤修复、转录调节、细胞凋亡、信号转导等,糖基化修饰是可以改变多肽的构象,进而使蛋白质更加稳定[21]。体外研究表明,受体需要磷酸化和糖基化来识别BMP15因子,从而保证其生物活性[22]。
蛋白质相互作用预测结果表明,BMP15蛋白与FSHR、FIGLA、BMPR1B等10种蛋白之间存在相互作用关系。其中FSHR蛋白是G蛋白偶联受体超家族成员之一,对于动物卵巢卵泡的发育有着重要的调控作用[23],其突变会导致雌、雄动物的不孕或者是繁殖能力降低[24-25]。在新西兰白兔生长发育过程中,FSHR mRNA 和蛋白质的表达水平随着年龄的增长和卵巢卵泡的生长而同步增加[26]。Du等[27]研究发现,敲低FSHR会诱导猪颗粒细胞凋亡和卵泡闭锁,并且能够降低细胞内信号分子的水平。BMP15 可以通过Smad和非Smad途径诱导人颗粒细胞中的 FSHR 表达,从而控制卵泡的生长[28]。FIGLA(生殖系a因子)是第一个生殖细胞特异性表达的转录因子,在卵泡发育和透明带形成的过程中具有重要的调节作用,FIGLA基因异常会导致卵巢早衰,研究表明FIGLA在早期卵子发生期间通过抑制卵母细胞雌激素信号传导来促进卵泡的形成[29-32]。BMPR1B蛋白与BMP15蛋白一样均属于TGF-β超家族成员,近年来,有大量研究表明BMPR1B基因是多种绵羊品种的多胎主效基因[33],也是绵羊高繁殖力的主效基因和控制绵羊繁殖性能遗传的重要候选基因[34]。赵金[35]研究发现,BMP15通过受体BMPR1B激活MAPK通路调控卵泡颗粒细胞增殖和凋亡。以上这些结果表明,BMP15在卵巢卵泡发育、卵泡闭锁、雌激素生成等众多生理过程中发挥着一定的作用,但这只是初步预测分析结果,还需进一步深入研究验证。
本研究用qRT-PCR技术检测了BMP15基因在180日龄新西兰白兔不同组织中的表达量,发现BMP15基因仅在卵巢组织中特异性表达,这一结果与李明霞等[36]在牦牛上的研究结果一致。但目前,有许多研究表明,BMP15基因的组织表达特点不尽相同,可能不同物种之间有所区别。Elis等[37]研究发现,BMP15基因在鸡的卵巢以及其它组织中均有表达。刘世佳等[38]对绵羊的研究发现,BMP15基因在其卵巢以及十二指肠中高表达。H1299细胞系具有较大的细胞核,常被作为检测亚细胞定位的工具。将BMP15质粒转染至H1299细胞后,用激光共聚焦显微镜观察,发现BMP15基因主要在细胞质内表达,同时卵巢免疫荧光结果显示,BMP15主要定位在卵巢颗粒细胞的细胞质中,这些结果与其可能为分泌型蛋白的结果相一致。
BMP15基因在家兔卵泡生长发育过程中的调控作用还尚未报道,BMP15作为卵巢卵泡生长发育的重要调控因子,通过调控该基因的表达与活性可影响卵泡的生长和颗粒细胞的增殖与凋亡,最终影响家兔的繁殖性能,但其中具体的调控机制还需要深入探究。本研究获得了新西兰白兔BMP15基因的结构特点和表达特征,为进一步开展BMP15基因在家兔生长繁殖过程中的调控作用奠定了基础。
4 结 论
本试验成功克隆了新西兰白兔BMP15基因的CDS区序列,全长1 182 bp ,编码393个氨基酸。生物信息学分析表明,该蛋白与猪的亲缘关系最近,与鸡的亲缘关系最远。同时,该蛋白为碱性不稳定蛋白,并且还含有一个信号肽,可能为分泌型蛋白。蛋白互作分析表明,BMP15基因与多种蛋白质相互作用,这些蛋白在卵巢卵泡发育过程中具有一定的调控作用。组织表达分析表明,BMP15基因在新西兰白兔卵巢组织中特异性表达,并且免疫荧光结果显示BMP15表达于不同发育时期的卵泡颗粒细胞。亚细胞定位表明,BMP15主要分布在细胞质中。本试验结果为进一步开展BMP15基因功能研究提供了理论依据。
