荷斯坦牛肺干细胞分离培养与生物学特性研究
2024-03-01刘晏辰周世莹关伟军
刘晏辰,周世莹,张 洋,高 扬,关伟军*
(1.中国农业科学院北京畜牧兽医研究所,北京 100193;2.首都体育学院,北京 100191)
肺癌是一种高度恶性的肿瘤,给人类健康带来了严重的威胁。化疗、放疗、手术等手段在治疗肺癌方面取得了一定的进展,但其5年生存率仍然很低。因此近年来,人们在分子、基因层面上对肺癌发生发展的机理进行了深入研究,提供了新的治疗思路。研究发现,胚胎肺组织中存在多种前体细胞,而成年肺组织中是否有具有多向分化潜能的间充质干细胞尚不清楚[1]。为了深入了解肺癌的病理机制以及开发新的肺癌治疗手段,一些研究组开始对肺间充质干细胞(LR-MSCs)进行研究。
LR-MSCs是一种干细胞,具有分化多种组织的潜能,其是干细胞研究与临床工作者共同探索的重要方向。在研究过程中,研究者采用阻断组织壁等方法获得LR-MSCs,并将其与原代培养的LR-MSCs进行共培养。研究发现,这些细胞具有向成脂、成骨、软骨等组织分化的能力,并且已经证明LR-MSCs具有多向分化的潜能,这被认为具有很大的实用价值。
目前,原代培养是LR-MSCs体外培养的最为常用的方法。这种方法不仅能够重现LR-MSCs体外形成、增殖、分化的全过程,而且能够直观观察不同因子对LR-MSCs体外培养的影响,还能保持基因背景不变,使得研究结果更加可靠、可信[2-6]。因此,LR-MSCs的形态学、增殖及分化潜能的研究对于肺癌的治疗具有重要意义。肺间质干细胞可以作为潜在的标志物用于帮助早期诊断。研究人员发现,肺间质干细胞特有的标记物和生物学特征,如CD44、CD166等,与肺癌的存在和发展相关联。通过检测这些标记物的表达,可以提高肺癌诊断的准确性和敏感性。在肺癌的治疗方面,肺间质干细胞也可能对治疗结果产生影响。研究表明,肺间质干细胞可以通过多种机制参与肺癌的增殖、转移和耐药性等过程。同时,肺间质干细胞与肿瘤微环境之间存在相互作用,可以调节免疫应答和血管生成等过程,从而影响肺癌的发展和治疗效果[7-9]。
此外,肺间质干细胞还具有一定的应用潜力。通过将抗肿瘤药物或基因载体转导到肺间质干细胞中,可以提高药物的靶向性和疗效,从而改善肺癌的治疗效果。此外,肺间质干细胞还可能被用作肺癌疫苗的载体,以提高免疫治疗的效果。
肺间质干细胞在肺癌中的具体作用机制和其在临床应用中的潜力还需要进一步的研究和验证[10]。此外,由于肺间质干细胞的来源和获取方面的限制,其在临床应用中还面临着一些挑战。因此,进一步深入研究肺间质干细胞与肺癌的关系,将有助于揭示其作用机制,开发更有效的诊断和治疗策略[11-13]。
1 材料与方法
1.1 材料
1.1.1 试验动物 试验所用健康雄性荷斯坦牛胚胎由中国农业科学院北京畜牧兽医所昌平实验基地提供。
1.1.2 主要材料 胰蛋白酶(Tripsin)、胎牛血清(FBS)DMEM/F12 基础培养基、L-DMEM 基础培养基、磷酸盐缓冲液(PBS)均购自 Gibco 公司;胶原酶V购自 Sigma公司;封闭用山羊血清、FITC 标记山羊抗兔二抗购自北京博奥森生物技术有限公司;CD29、CD44、CD73、CD90、CD34、CD45 一抗购自美国 Abcam 公司;RNA 逆转录试剂盒购自TaKaRa 公司;胰岛素生长因子-1 (IGF-1)、碱性成纤维生长因子(bFGF)、胰岛素转铁蛋白(ITS)均购自英国 Perotech 公司;吉姆萨染液、油红O染液、阿利新蓝染液、糖原染液、茜素红染液均购自索莱宝公司。激光共聚焦显微镜(Nikon 公司),TH4-200 倒置显微镜(Olympus 公司),CO培养箱(Heraeus 公司),离心机(Ependorf 公司)。
1.2 方法
1.2.1 LR-MSCs的分离培养 试验所用荷斯坦牛胚胎在无菌情况下取肺部组织,经 PBS冲洗3次后,去肠系膜,将肺部组织切开(1 mm×1 mm×1 mm),用0.1%胶原蛋白4在37 ℃下进行10~20 min的消化。在 DMEM/F12混合液中加入10%的FBS,经中和后进行消化。用100目的筛子过滤得到的悬浮液,在1 200 r·min-1下离心6 min。用 PBS法处理,将不粘着的细胞移除。
组织块贴壁法:小块肺部组织需要经过洗涤处理后才能被贴在细胞培养皿上。这是为了去除可能存在的细菌和污染物,以保证组织的健康生长。组织块需要在完全培养基中进行培养,包括DEME/F12、FBS和bFGF。这些培养基成分可以提供所需的营养物质和生长因子,以促进组织生长。组织块需要在特定的环境下进行培养,包括37 ℃和50 mL·L-1CO2的培养箱。组织块的边缘会出现大量的细胞,这时可以在融合率达到80%时使用胰蛋白酶进行传代,继续培养。
1.2.2 LR-MSCs生长曲线及群体倍增时间检测 在24孔平板上,将3、9、15代的细胞以1×104个·孔-1的密度种植。从接种开始,每隔24 h,在3个小孔中有序地抽取3个小孔,连续8 d,采集细胞悬液。以此为依据,画出生长曲线,并计算出群倍数(PDT)。PDT=lg2(t-t0)/(lgNt-lgN0),Nt为最后的培养细胞数量。
1.2.3 LR-MSCs克隆形成能力检测 将第3、9、15代的LR-MSCs细胞以100个·孔-1接种在6孔板中培养,2周后可见单个LR-MSCs形成较大克隆团,40 g·L-1多聚甲醛固定30 min,PBS洗2次,吉姆萨工作液染色20 min。显微镜下拍照观察克隆形态并计算克隆形成率,克隆形成率=克隆形成数/接种细胞数×100%,试验重复3次以计算平均值。
1.2.4 染色体核型检测 加入秋水仙素0.2 μg·mL-1,于37 ℃和50 mL·L-1CO2培养器中连续培养24 h,将其消化后采集,2 000 r·min-1离心10 min,除去上清,37 ℃进行低渗性预处理30 min,用1 mL的固定溶液轻轻吹动混合均匀后,将1 mL的定量分析溶液混合均匀后置于室内温静置30 min,再进行1次以上的定量分析。然后将其取出,于冷冻后的玻璃片上1.5 m高度,将其均匀地倒在玻璃片上,于室温下进行烘干,用吉姆萨工作液对其进行20 min的染色。经过干燥处理后,在显微镜下进行详细的观察和照片。
1.2.5 LR-MSCs表面标志物检测 将LR-MSCs种植于6孔平板上。当融合率为70%时,用 PBS冲洗,40 g·L-1的聚乙二醇固定30 min,0.25%的TritonX-100渗透10 min。在室温下将羊血清封闭30 min后,加入CD29、CD44、CD73;在4 ℃下培养CD90抗体的稀释剂。丢弃第一抗体,用 PBS冲洗2次,添加 FITC标记的第二抗体,培养1 h。PBS冲洗3次,DAPI培养20 min,PBS冲洗完毕,用激光共焦显微镜对 PBS冲洗完毕的样品进行观察和摄像。
1.2.6 多能性相关基因表达鉴定 采用 Trizol方法,通过 PCR试剂盒(TaKaRa)进行 RNA的合成。通过 Primer Premier5.0软件对特异的引物进行设计(表1),对 RNA进行扩增。PCR反应体系为20 μL,包含10×RT缓冲液2.0 μL,蒸馏水13.4 μL,LEx-Taq 0.2 μL,正、反转引物共2.0 μL,模板 cDNA1.0 μL,dNTP (2.5 mmol·L-1)1.4 μL。根据操作规程,对反应条件进行了设定。PCR扩增产物后,于140 V琼脂电泳恒温培养30 min,检测多能性相关基因的表达。
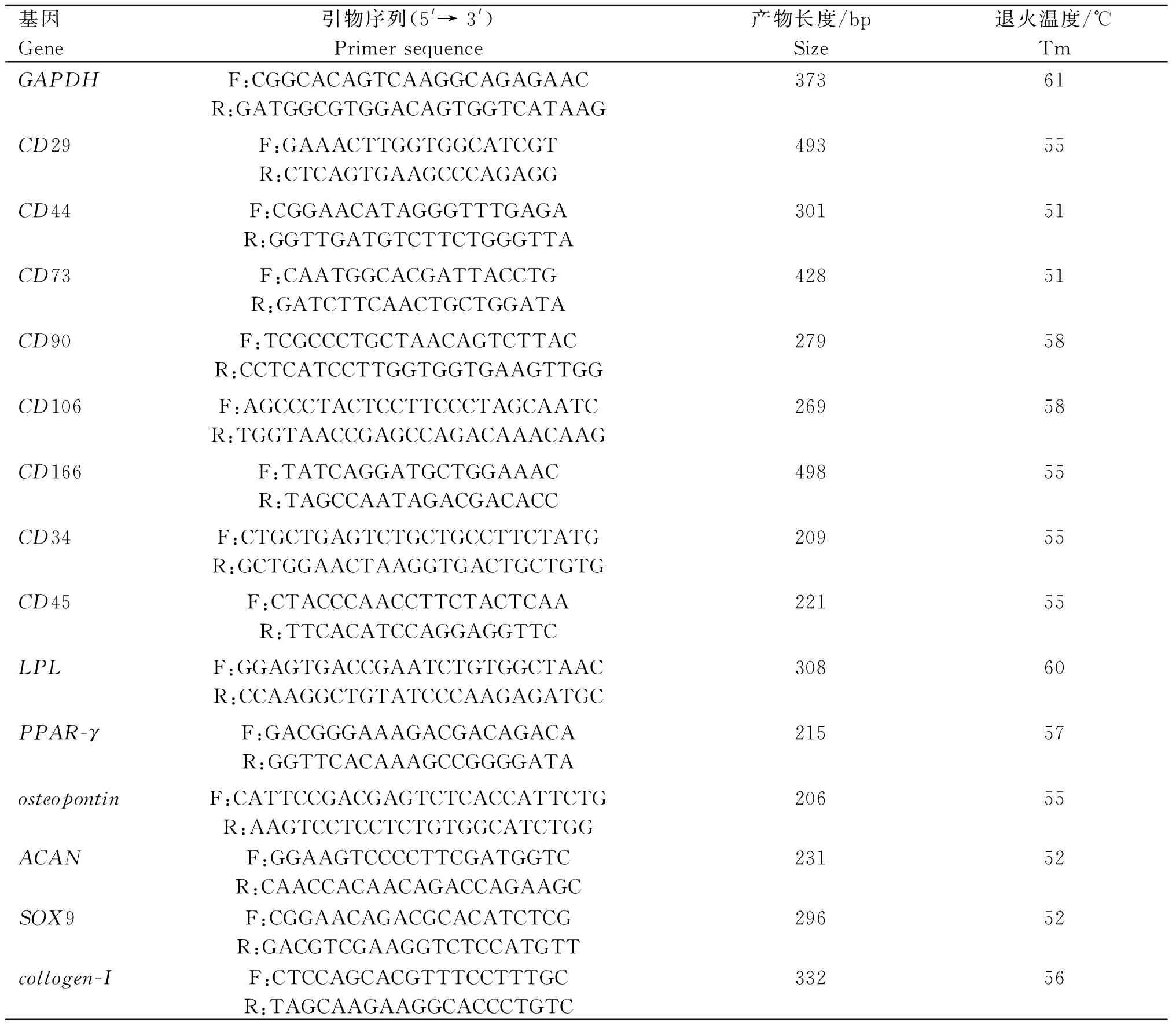
表1 引物信息
1.2.7 诱导分化能力鉴定 成骨诱导剂包括:DMEM/F12、10%的 FBS、0.1 mmol·L-1的地塞米松、10 mmol·L-1的β-甘油、50 mg·L-1的 Vc。本试验的诱发剂为 DMEM/F-12,FBS为10%,地塞米松为10~7 mol·L-1,肺部岛素为8 μg·L-1,吲哚美辛为70 μmol·L-1,IBMX为0.5 mmol·L-1。L-DMEM,FBS 2.5%,ITS1%,脯氨酸50 μg·mL-1,地塞米松0.1 μmol·L-1,丙酮酸钠0.5 mmol·L-1,维生素C 50 μg·mL-1,TGF-β310 ng·mL-1,IGF-1 10 mg·L-1,IGF-110。以茜素红、油红O、阿利新兰、糖原等为主要研究对象,采用RT-PCR技术,对骨特异性基因collogen-I、骨桥蛋白(OPN)进行研究。前期研究发现,成脂特异性的PPAR-γ和 LPL在脂肪组织中均高表达。研究发现,成软骨特异性蛋白 ACAN、SOX9在软骨细胞中表达。
1.3 数据处理
采用 SPSS25.0软件对资料进行了单因子变异数分析和邓肯氏多元比较,结果以“均数±标准差”表示,P<0.05表明差异有显著性,P<0.01表明差异有极显著性。
2 结 果
2.1 LR-MSCs的分离培养
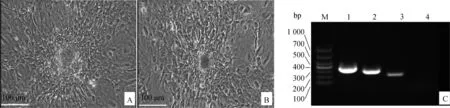
采用组织块贴壁法可以得到LR-MSCs,这种方法所得到的细胞在传到第3代的时候,其形态是长梭形的,并且呈螺旋状生长(图1)。
2.2 LR-MSCs体外增殖能力检测
对LR-MSCs进行第3、9、15代培养后,分别对第3、9、15代培养的LR-MSCs作生长曲线。3个世代的生长周期分别为潜伏期、对数生长期、平缓期、下降期,形成一个典型的“S”形(图2)。结果显示:随着传代次数的增多,细胞倍增能力在不断下降。

图2 荷斯坦牛LR-MSCs生长曲线Fig.2 Growth curves of Holstein cattle LR-MSCs
2.3 LR-MSCs克隆形成能力检测
LR-MSCs的第3、6、9代都可以以较低的浓度形成单克隆群(图3)。荷斯坦牛LR-MSCs第3、6、9代的克隆率分别为(39.4±6.5)%、(34.9±2.6)%、(27.3±4.9)%,随传代次数增加,其克隆形成率呈下降趋势。利用 SPSS软件对其进行了计算,结果显示,在第3、6、9代LR-MSCs的克隆形成率存在着明显的差异(表2)。

A~C.荷斯坦牛LR-MSCs在第3、6、9代(P3.P6.P9)中克隆团簇形态A-C.Holstein cattle LR-MSCs exhibit cloned cluster morphology in the 3rd.6th.and 9th passages (P3.P6.P9)

A~W.组织块贴壁法第0~22代细胞形态A~W.Cell morphology of generations 0 to 22 by the tissue block attachment method 图1 荷斯坦牛 LR-MSCs 形态Fig.1 The morphology of Holstein cattle LR-MSCs

表2 LR-MSCs的克隆形成率
2.4 核型分析
第9代LR-MSCs的染色体数为2n=60,包含一对 XY性染色体。结果显示,LR-MSCs在体外培养过程中,其染色体形态和数量均未发生异常变化(图4)。
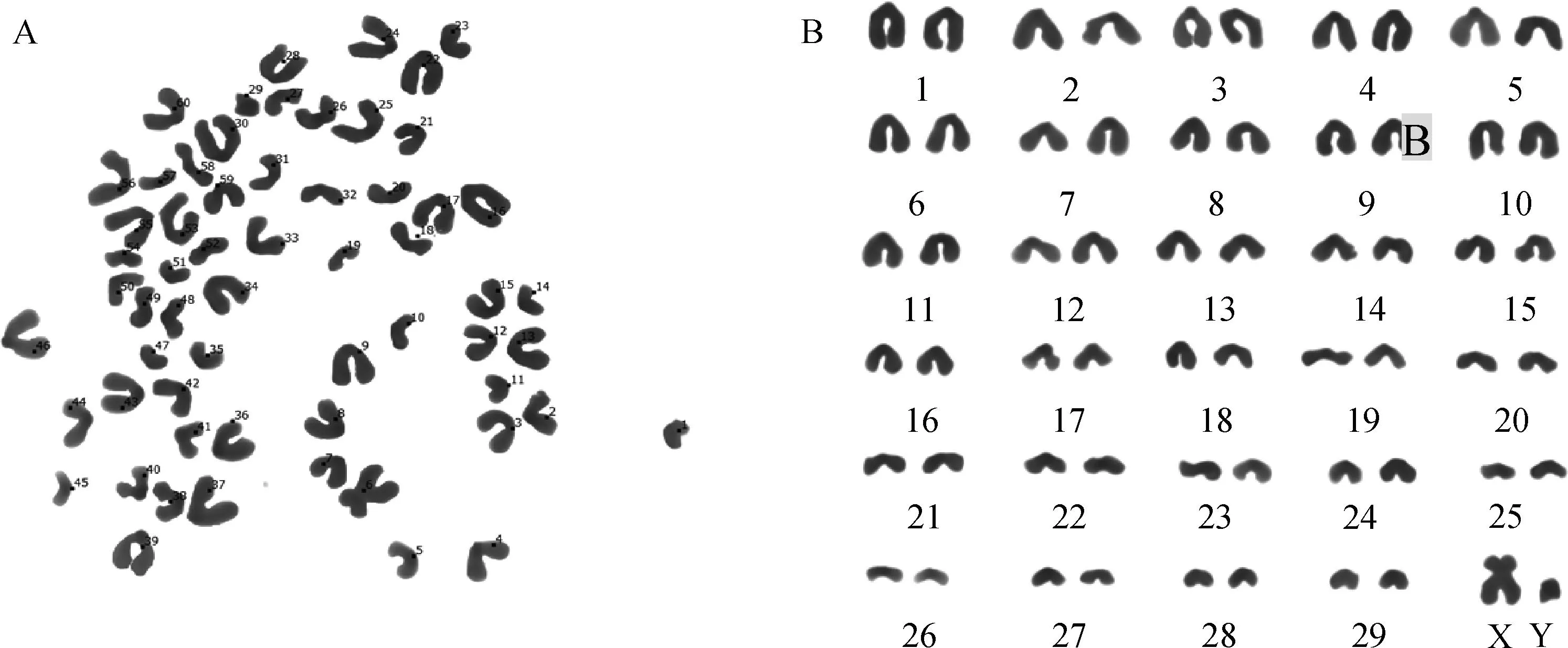
A. 染色体核型形态;B.染色体核型配对A.Karyotypic analysis;B.Chromosome karyotype pairing analysis
2.5 免疫荧光表型分析
在第7代LR-MSCs中检测到CD29、CD44、CD73、CD90、CD105、CD166的表达;显示全部为阳性(图5)。
2.6 多能性相关基因表达鉴定
用Primer Premier5.0软件设计CD29、CD44、CD73、CD90、CD106、CD166、CD34的扩增引物;以GAPDH作为内参考基因,用CD45标记基因扩增引物,检测到 MSC的特异标志基因CD29、CD44、CD73、CD90、CD106、CD166均为阳性。CD34和CD45在MSC特异标志基因中的表达呈阴性(图6)。
2.7 LR-MSCs多向分化能力鉴定
2.7.1 成脂诱导分化能力鉴定 在诱导成脂6 d后,用RT-PCR方法对其进行了检测,结果显示,在诱导成脂6 d后,油红 O染色可见大量的桔红色油珠。LR-MSCs成脂分化过程中,其高表达LPL及PPAR-γ(图7)。

A.对照组,未用油红-O染色。B.诱导组,用油红-O染色。C.M.DNA相对分子质量标准;1.GAPDH;2.试验组 LPL;3.试验组 PPAP-γ;4.对照组LPL;5.对照组PPAP-γA.Control group without Oil Red O staining.B.Induction group with Oil Red O staining.C.M. DNA marker; 1.GAPDH; 2.Experimental group LPL; 3.Experimental group PPAP-γ; 4.Control group LPL; 5.Control group PPAP-γ
2.7.2 成软骨诱导分化能力的鉴定 经阿利新兰染色,15 d后,诱导组小鼠软骨结节呈现出明显的青色,其中以酸性粘多糖为主;RT-PCR结果显示,ACAN与SOX9在LR-MSCs中均有表达(图8)。
A.染色前。B.阿利新蓝染色后。C.M.DNA相对分子质量标准;1.GAPDH;2.试验组Collagen typeⅠ;3.试验组 ACAN;4.试验组 SOX9A.Before staining.B.After Alcian blue staining.C.M. DNA marker; 1.GAPDH; 2.Experimental group Collagen type Ⅰ; 3.Experimental group ACAN; 4.Experimental group SOX9
2.7.3 成骨诱导分化能力的鉴定 在15 d的成骨诱导之后,进行茜素红染色,在诱导之后,能看见沉积的钙盐变为红色。RT-PCR分析显示,LR-MSCs在成骨分化后,其组织中有Ⅰ型胶原蛋白(Collagetype I)和骨桥蛋白(Osteopontin)基因表达(图9)。

A.未染色前。B.茜素红染色后。C.M.DNA相对分子质量标准;1.GAPDH;2.试验组Osteopontin;3.试验组 Collagen typeⅠ;4.对照组 Osteopontin;5.对照组 Collagen typeⅠA.Before staining.B.After Sirius red staining.C.M. DNA marker; 1.GAPDH; 2.Experimental group Osteopontin; 3.Experimental group Collagen type I; 4.Control group Osteopontin; 5.Control group Collagen type I
3 讨 论
肺间充质干细胞(LR-MSCs)是一种重要的免疫调节细胞,可有效的修复组织损伤,并可有效的抑制炎症反应。因此,寻找来自于同一组织或同一部位的干细胞有可能为临床应用提供新的思路[14-18]。 LR-MSCs除用于肺部疾病外,LR-MSCs与 MSCs的体外分化及免疫调控功能在移植机体中同样有很好的应用前景[19-21]。 通过贴壁法可从荷斯坦牛胚胎中获得生长状态良好的LR-MSCs,细胞形态为长梭形且传代时间一致。随着传代次数的增加群体倍增时间逐渐增加,克隆形成率逐渐降低。说明随着细胞传代次数的增加细胞逐渐衰老。二倍体核型和稳定的染色体数目、形状和结构是细胞生长和功能的先决条件。核型分析是区分正常细胞和变异细胞的一种简单实用的方法。荷斯坦牛有30对染色体,包括性染色体X和Y。本研究培养的荷斯坦牛LR-MSCs均为正常二倍体(2 n=60,XY)。这些发现可能对理解染色体融合的分子机制、基因进化具有重要意义[22-26]。
荷斯坦牛LR-MSCs的鉴定主要依据是CD29、CD44、CD73、CD90等特异性标志物。CD44是细胞膜上的一种糖蛋白,在细胞间相互作用、迁移、粘附、活化、循环、归巢等方面起着重要作用[27-29]。CD73是一种以糖类磷脂酰肌醇(GPI)为核心的蛋白,其与细胞膜的结合是CD73的重要功能。CD106和VCAM-1是由细胞因子诱导产生的一种膜蛋白,可介导细胞间的粘附[30-33]。目前,MSCs的鉴定主要依据是细胞形态、生长特性和多种免疫表型,而 MSCs的多向分化能力则是 MSCs鉴定的重要依据。细胞在体外能分化为骨细胞、脂肪细胞、软骨细胞等[34-36]。本课题组前期研究发现,鲁西黄牛LR-MSCs具有向成骨、成脂两种分化能力。在此基础上,利用荷斯坦牛LR-MSCs向中胚层骨、脂肪和软骨细胞定向分化,并在细胞水平上对LR-MSCs定向分化能力进行初步验证。前期研究发现,成骨细胞标志基因(如CollagetypeI、OPN等)与脂肪细胞标志基因(如LPL、PPAR-γ等)密切相关,但其分子机制尚不清楚。其中,ACAN、SOX9是主要的软骨细胞标志基因。蛋白质聚糖(protein polygonuclein.ACAN)是 ECM的重要组分。SOX9作为一种重要的转录因子,可通过时序特异性地调节一系列下游基因,从而影响软骨分化过程[37]。本试验结果表明,对于成骨、成软骨细胞的分化,其融合率应该在50%左右,而对于成脂肪细胞的分化,则应该在80%左右。这一现象的发生,主要原因是在脂肪组织的成脂过程中,细胞停止了增殖,开始了细胞的凋亡。此外,对LR-MSCs的体内特征(生物分布、生物利用率,靶向性等)进行了探讨。药动学等和它们的用途(给药途径、给药剂量、给药时间间隔;药效评价等)尚需深入研究。近年来,人们在皮肤、脂肪、肌肉等非血液系统中发现了一种具有组织特征的干细胞。近50年来,LR-MSCs在生物医药领域的应用受到了广泛的关注[38]。充质干细胞(LR-MSCs)是一种具有高度特异性的干细胞,在组织修复与再生医学领域具有重要意义,是当前组织修复与再生领域的热点。但是,目前还未见荷斯坦牛肺脏组织来源的LR-MSCs的相关研究。为此,本研究从荷斯坦牛的肺脏细胞中分离出了LR-MSCs,并分析了LR-MSCs的生物学特征;本研究将为肺脏成体干细胞的体外培养和临床应用奠定基础[39]。
LR-MSCs的组织培养、 exosomes的提取、制备、筛选适宜的培养基及诱导因素是LR-MSCs组织修复的关键。另外,LR-MSCs的组织及 exosomes的保存、转运及存储也是LR-MSCs研究的重点。用于临床的细胞组织制品,其安全及不良反应均需密切监控。虽然存在着上述问题,但以LR-MSCs为基础的组织工程技术在再生医学领域仍具有广阔的应用前景[40]。
4 结 论
本课题组前期已从荷斯坦牛胎牛肺中获得了LR-MSCs,其体外培养的LR-MSCs具有很强的自我更新能力,且具有很好的体外培养条件。荷斯坦牛LR-MSCs可表达与 MSCs有关的表面标志基因,如CD29、CD44、CD73、CD90、CD106、CD166;而CD34、CD45不表达;荷斯坦牛LR-MSCs具有向成脂、成骨和成软骨分化的能力,这将可能成为一种新型的组织工程种子细胞。牛肺间充质干细胞(LR-MSCs)具有自我更新、多向分化和免疫调节等特性,是当前再生医学领域的研究热点。同时,合适的低氧预处理、物理刺激、基因修饰、可降解载体等也能有效提高LR-MSCs的组织修复能力。同时,LR-MSCs及 exosomes可作为一种自然载体,实现对生物活性物质及药物的靶向递送。牛肺间充质干细胞(LR-MSCs)不仅具有多向分化潜能,而且可分泌多种组织因子,具有调控机体免疫、促造血等作用。由于LR-MSCs特有的生物学性质,使LR-MSCs在组织治疗、基因治疗及组织工程化等领域表现出良好的应用前景。
