半胱氨酸、蛋氨酸对体外培养绒山羊次级毛囊生长及毛乳头细胞增殖的影响
2024-03-01段香茹尹雪姣杨若晨李太春单新雨陈美静张英杰刘月琴
康 佳,段香茹,尹雪姣,杨若晨,李太春,单新雨,陈美静,张英杰,刘月琴
(河北农业大学动物科技学院,保定 071000)
燕山绒山羊是一种产绒量高、绒细且肉质较好的绒肉兼用型山羊,具有经济价值高等优异品质。山羊绒是绒山羊皮肤次级毛囊产生的一种珍贵的动物纤维,主要用于生产高档纺织品,具有极高的创汇能力[1]。次级毛囊是影响绒山羊羊绒产量和质量的主要因素[2],毛乳头细胞(DPCs)是早期毛囊形态变化时,由真皮层接受表皮层发出的传导信号而凝集成的一种特殊成纤维细胞,能够分泌多种生长调控因子,从而调节毛囊干细胞活性、毛囊角质化细胞的增殖分化以及毛囊生长发育[3]。并且DPCs可在一定程度上影响毛囊的大小和粗细[4-6]。因此,研究绒山羊次级毛囊和毛乳头细胞发育情况,对羊绒的生产至关重要。
半胱氨酸(Cys)和蛋氨酸(Met)是在绒毛生长过程中重要的含硫氨基酸[7],是影响毛囊基因表达和发育的重要因素。Cys是一种天然氨基酸,常温下呈白色结晶粉末,在许多生物学途径发挥作用,它可以形成二硫键,最初发现于动物的毛发和结缔组织中,是角蛋白的重要组成部分,在羊毛氨基酸中占据重要地位[8]。Met作为必需氨基酸中唯一的含硫氨基酸,在生物体内既参与蛋白质合成,又可以经转硫基作用生成半胱氨酸,对毛皮动物角蛋白合成具有重要的调控作用[9]。董晓玲[10]研究表明,Cys和Met作为内蒙古绒山羊的限制性氨基酸,对绒毛生长量、绒毛细度和绒毛品质具有重要的作用。王文楠[11]研究发现,含硫氨基酸对绒毛的品质起着关键性的作用。绵羊体内含硫氨基酸含量会影响毛囊的生长发育,缺少含硫氨基酸会大幅度限制绵羊羊毛生长[12-13]。南韦肖[14]通过体外培养水貂毛乳头细胞,发现8 μg·mL-1Met显著促进DPCs增殖,间接调控毛发生长。但含硫氨基酸Cys和Met对于绒山羊羊毛生长的影响还有待研究,在绒山羊的适宜添加量还尚不清楚。
目前,绒毛生长过程中的限制性含硫氨基酸Cys和Met,对于绒山羊绒毛生长及DPCs增殖凋亡的影响报道较少。体外探究Cys和Met对次级毛囊生长以及毛乳头细胞增殖的影响可以为提高燕山绒山羊产绒量提供良好的研究模型。因此,本试验旨在探究体外添加Cys和Met对绒山羊次级毛囊形态、生长以及DPCs增殖凋亡的影响,为进一步探究Cys和Met对绒山羊羊绒生长及营养调控作用奠定理论基础。
1 材料与方法
1.1 试验材料
选取1只1周岁左右健康雄性燕山绒山羊于9月份绒毛生长期采集山羊肩胛骨后缘皮肤组织。采集时剪去选定部位羊毛,使用碘伏进行消毒,试验羊注射0.5 mL麻醉剂(procaine),用活体皮肤取样器采取肩胛骨皮肤组织1 cm2若干,立即放入75%乙醇浸泡30~40 s,用PBS(含6%双抗)反复清洗3遍至表皮无血,放入DMEM/F12(含6%双抗)带回实验室。
1.2 试验方法
1.2.1 次级毛囊与DPCs体外分离培养 将带回实验室的皮肤组织用75%乙醇浸泡1 min,PBS快速清洗6次,去除脂肪和结缔组织,PBS漂洗,切成1 mm2的组织小块,超精密镊子剥离毛囊,放入含有完全培养基、不同浓度Cys和Met工作培养基的24孔板中,37 ℃,5% CO2培养。
将1 mm2组织小块于0.25%中性蛋白酶37 ℃孵育2~4 h,体式显微镜下剥离真皮层和皮下层,轻轻拔出毛囊,放入1.5 mL离心管(含1 mL完全培养基),1 500 r·min-1离心5 min,弃废液,400 μL IV型胶原酶37 ℃ 15 min,加三倍体积的完全培养基终止消化,1 500 r·min-15 min,弃上清,PBS混匀,500 r·min-1离心5 min,弃上清,PBS再次混匀,800 r·min-1离心5 min,弃上清液,加1 mL完全培养基,混匀,过200目细胞筛接种到25 cm2培养瓶,加3 mL完全培养基,37 ℃,5% CO2培养,每隔3 d换一次完全培养基。
纯化DPCs,PBS清洗2次,每次2 mL,4 mL 0.25%胰蛋白酶消化3 min,4 mL 2 mg·mL-1的胶原酶D 20 min,接种于培养瓶,37 ℃孵育约2 h,弃去未贴壁细胞,已贴壁的细胞即为DPCs。
1.2.2 次级毛囊生长与生长速度检测 将分离出来的毛囊随机分成Cys试验组和Met试验组,每组各浓度3个重复,每个重复8根毛囊,Cys试验组添加浓度分别为0、40、80、120、160和200 μg·mL-1;Met试验组添加浓度分别为0、10、15、20、25和30 μg·mL-1。每隔24 h在倒置显微镜下拍摄照片,观察毛囊结构形态变化,利用Image JV1.8.0软件测量次级毛囊生长长度并计算生长速度。
每日生长长度(μm)=测量当天长度-测量前一天长度;
生长速度(μm·d-1)=(结束长度-起始长度)/7 d;
累计生长长度(μm)=测量7 d长度-测量0 d长度。
1.2.3 细胞计数及生长曲线 收集状态良好且处于对数生长期的第5代DPCs细胞,0.25%胰酶消化重悬,细胞计数板计数,以每孔0.5×104个细胞数均匀接种到24孔板,每隔24 h对3个孔细胞进行多次计数并计算平均值,共记录10 d细胞数。
在细胞计数板中间放置细胞专用盖玻片,将细胞悬液稀释至适当浓度混匀,取10 μL细胞悬液缓慢滴入盖玻片,使其充满盖玻片与计数板之间的空隙,利用显微镜观察并计数,计数时只记录完整细胞并记录计数板4个角细胞总数,细胞团按一个细胞计数,同一方格中位于线上细胞,记录上线和左线,不计下线和右线。
细胞数/L=(计数板4个角细胞总数/4)×104×稀释倍数。
1.2.4 DPCs细胞活性 选取第5代对数生长期DPCs细胞,0.25%胰酶消化重悬,细胞计数板计数,以每孔1×104个细胞浆细胞均匀接种到96孔板中,每孔加100 μL细胞悬液,置37 ℃、5% CO2箱培养使细胞贴壁,培养2 h,待细胞生长汇合至70%~80%左右,分别加入10 μL不同浓度Cys工作培养基(0、20、40、60、80和100 μg·mL-1)和Met工作培养基(0、2、4、6、8和10 μg·mL-1),其中0为对照组,每组4个复孔,将96孔板放入培养箱孵育2 h(预试验获得最佳处理时间为2 h);弃上清,每孔加入100 mL完全培养基与10 μL CCK-8试剂,在37 ℃、5% CO2箱培养2.5 h,用酶标仪检测450 nm时吸光度。
细胞活性/%=(A试验孔450-A空白450)/(A对照孔450-A空白孔450);
A(试验孔)为具有细胞、CCK-8溶液和药物溶液的孔的OD值;A(对照孔)为具有细胞、CCK-8溶液而没有药物溶液的孔的OD值;A(空白孔)为具有CCK-8溶液,没有细胞和药物溶液的孔的OD值。
1.2.5 不同浓度Cys和Met对毛乳头增殖凋亡相关基因mRNA表达的影响 DPCs以1.5×105个·mL-1密度接种于6孔板,完全培养基培养至75%~85%时,弃去旧培养液,加入2 mL不同浓度Cys工作培养基(0、20、40、60、80和100 μg·mL-1)和Met工作培养基(0、2、4、6、8和10 μg·mL-1)处理细胞2 h,按照RNAisoTM Plus 提取试剂盒提取总RNA,采用RT-PCR技术测定基因表达水平,引物序列见表1,以山羊GAPDH作为内参基因,使用2-ΔΔCT法对以下目的基因的mRNA表达量进行相对定量数据分析,细胞增殖相关基因PCNA、CCND1、CDC42、CDK4;细胞凋亡相关基因P53、P21、BAX、Bcl-2、Caspase-3;角蛋白相关基因K10、K14;皮肤细胞分化标记相关基因IVL。
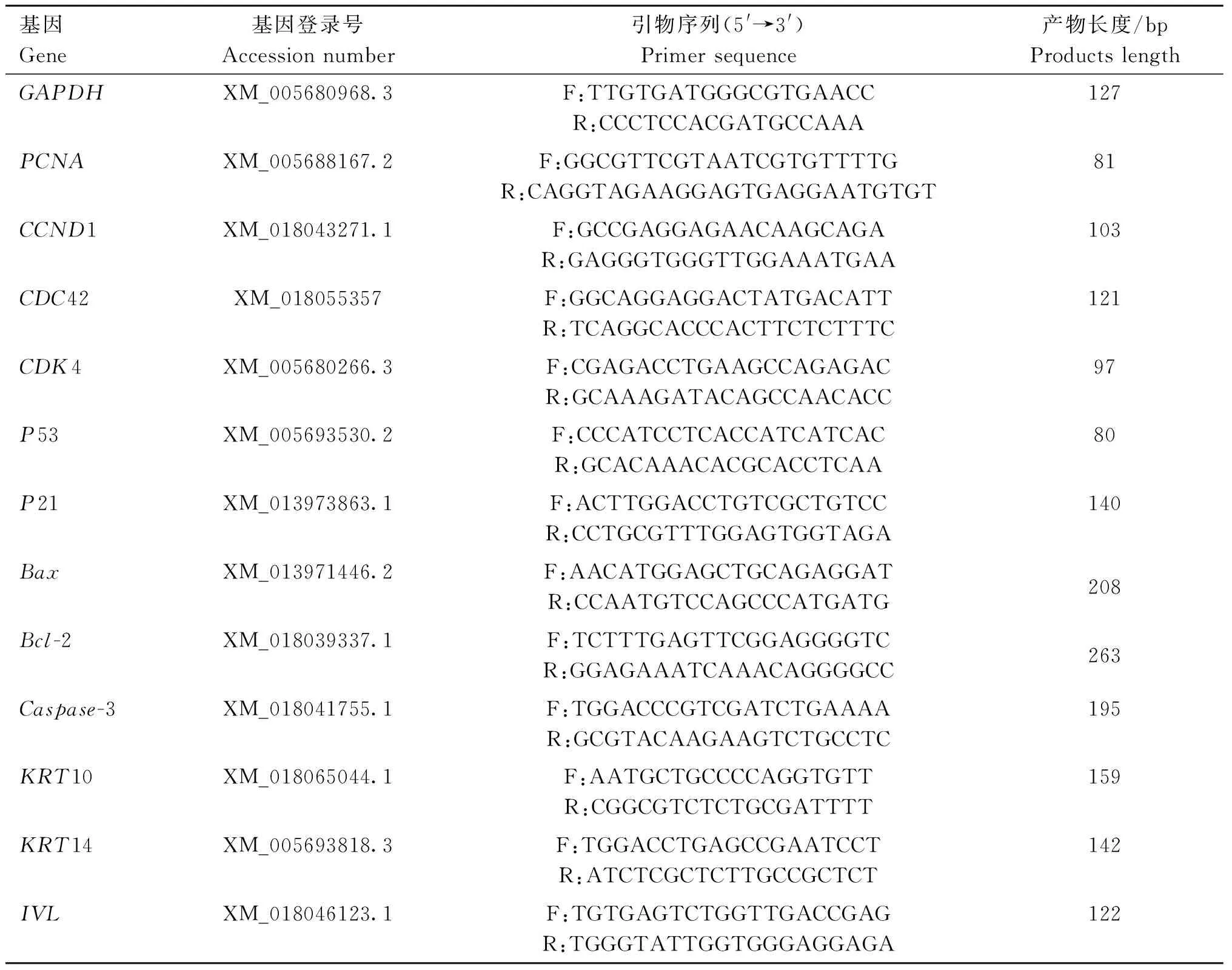
表1 引物序列
1.2.6 数据统计与分析 所有数据用 Excel 归纳整理后,采用SPSS软件进行单因素方差统计学分析(ver. 22.0, IBM Corp.),差异显著性采用LSD法进行多重比较。结果用“平均值±标准误”表示。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 添加Cys与Met对次级毛囊生长形态的影响
添加Cys与Met对次级毛囊生长形态的影响见图1。对照组(图1A)、20 μg·mL-1Met(图1B)和120 μg·mL-1Cys(图1C)在体外培养下,毛球部形态均有不同变化。对照组培养至第4天(图1D),毛球部形态发生变化,呈不规则状,外层真皮鞘上皮细胞结构松散模糊,毛囊生长速度逐渐变得缓慢;培养至第7天(图1G),毛球部逐渐萎缩,毛乳头与毛母质界限逐渐模糊,此时毛囊逐渐停止生长。20 μg·mL-1Met次级毛囊体外培养至第4天(图1E),毛球部形态保持较好,毛囊DPCs分裂增殖,促进内外根鞘和毛干生长,此时毛囊生长速度逐渐变缓,但仍高于对照组,毛母质与毛乳头界限仍分明可见;培养至第7天(图1H),毛球部与内部结构层次界限模糊,毛母质与毛乳头之间模糊,但毛乳头轮廓仍清晰可见。120 μg·mL-1Cys次级毛囊体外培养第4天时毛囊形态未发生变化(图1F),内外根鞘模糊不清,毛球部保存较好,生长速度高于对照组;培养至第7天(图1I),毛囊形态发生变化,内外根鞘模糊不清,毛球部逐渐萎缩,且松散模糊,此时毛囊生长速度逐渐与对照组趋于一致。

A、D、G分别为对照组第1、4、7天;B、E、H分别为20 μg·mL-1 Met组第1、4、7天;C、F、I分别为120 μg·mL-1 Cys组第1、4、7天A, D, G are day 1,4, and 7 of the control group, respectively; B, E, H are day 1,4, and 7 for 20 μg·mL-1 Met group, respectively; C, F, I are day 1,4, and 7 for 120 μg·mL-1 Cys group, respectively
2.2 不同浓度Cys对次级毛囊体外生长的影响
由图2和表2可知,添加80、120 μg·mL-1Cys具有促进毛囊生长的效果,随着浓度增加,促生长效果越明显,且120 μg·mL-1Cys对次级毛囊体外生长具有极显著影响(P<0.01),与对照组相比,7 d后累计生长长度与生长速度分别达到了64.81 μm和9.26 μm·d-1;80 μg·mL-1Cys对毛囊体外生长影响显著(P<0.05),与对照组相比,7 d后累计生长长度与生长速度分别达到了62.77 μm和8.97 μm·d-1;40、160、200 μg·mL-1Cys培养7 d后累计生长长度和生长速率与对照组差异不显著(P> 0.05),因此,120 μg·mL-1Cys对次级毛囊体外生长效果最好。
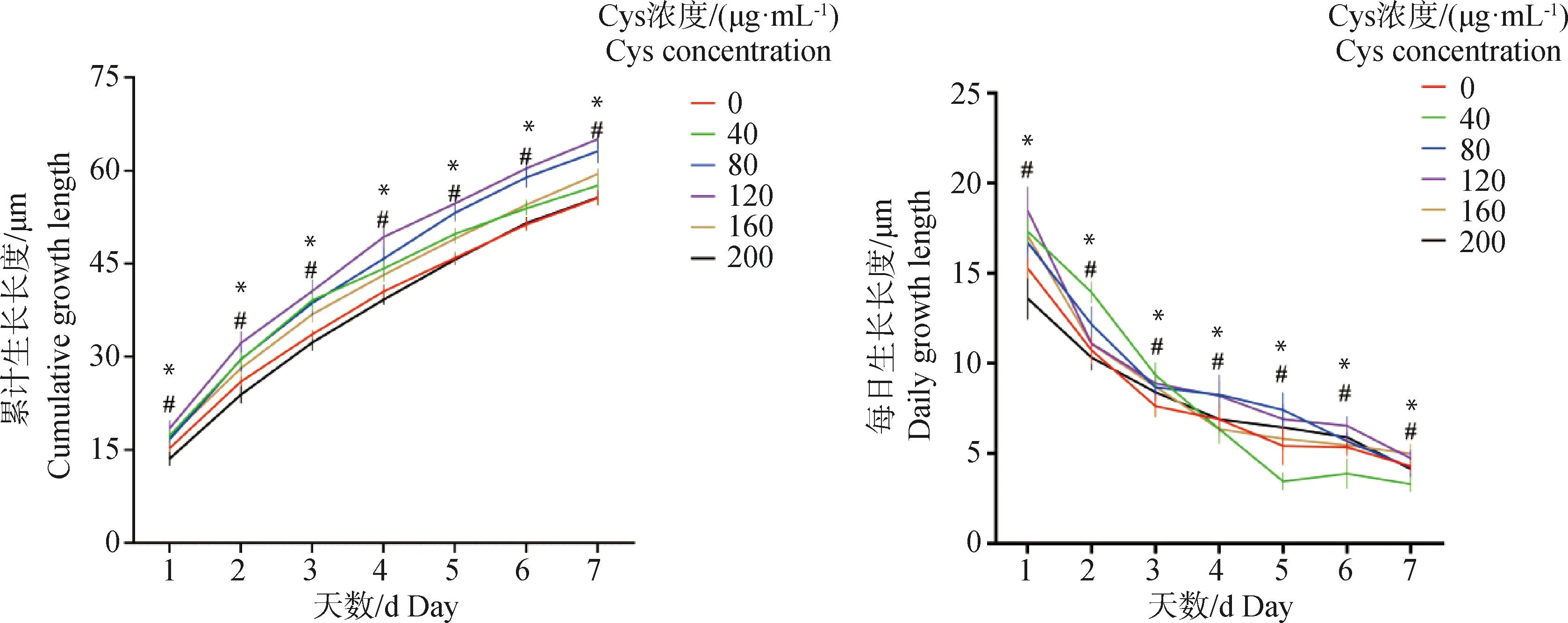
“#”、“*”分别表示80、120 μg·mL-1 Cys组与对照组相比差异显著(P<0.05)“#”and“*” indicate that 80 and 120 μg·mL-1 Cys groups are significantly different from the control group (P<0.05)

表2 不同Cys浓度对绒山羊次级毛囊体外生长的影响
2.3 不同浓度Met对次级毛囊体外生长的影响
由图3和表3可知,添加Met对绒山羊次级毛囊体外生长具有促进作用,随着浓度增加,促生长效果越明显。添加10、15、20、25 μg·mL-1Met组次级毛囊累计生长长度和生长速度均极显著高于对照组(P<0.01),其中20 μg·mL-1Met组次级毛囊体外生长效果最好,7 d后累计长度和生长速度达到了103.12 μm和14.59 μm·d-1;30 μg·mL-1Met 7 d后累计生长长度和生长速率与对照组相比差异不显著(P>0.05),因此,20 μg·mL-1Met对次级毛囊体外生长效果最好。

“★”、“#”、“*”、“&”分别表示10、15、20、25 μg·mL-1 Met组与对照组相比差异显著(P<0.05)“★”、“#”、“*”and“&” indicate that 10, 15, 20 and 25 μg·mL-1 Met groups are significantly different from the control group (P<0.05)

表3 不同Met浓度对绒山羊次级毛囊体外生长的影响
2.4 DPCs分离培养及生长曲线
分离出单个毛囊,其结构完整,DPCs清晰可见(图4A),分离出的DPCs培养至第5天有DPCs迁出,DPCs呈梭形或者梨形(图4B);在培养至第10天可明显看到DPCs迁出,细胞逐渐从毛乳头向外迁出(图4C),呈放射状增长,培养至第20天左右,培养瓶中有大量DPCs(图4D)。随着DPCs不断向外增殖,细胞凝集成毛乳头状形态(图4E),距生长中心越近的位置DPCs较小,细胞聚集的数量越多,呈现出多层聚集特征。由中心向外细胞间距逐渐增大,细胞则会显著变大,细胞逐渐由开始的三角形变为长梭形,形态与成纤维细胞相似。纯化后将DPCs培养至第3代(图4F)、第5代(图4G)时,仍能观察到其细胞形态,并能正常生长、增殖。

A为毛囊毛球内部DPCs;B、C、D、E分别为DPCs第5、10、20、22天;F、G分别为DPCs第3、第5代A shows the internal DPCs in the hair follicle bulb; B, C, D, E are day 5,10,20 and 22 of DPCs, respectively; F, G are the generation 3 and 5 of DPCs, respectively
图5为DPCs生长曲线,由图中可以看出,DPCs的生长过程可以分为几个阶段,第1天左右,细胞逐渐贴壁;到第2天,细胞开始缓慢增殖;而2~5天,细胞增殖速度逐渐加快;第6天,细胞进入快速增殖时期,呈现出对数增长;在第9天,细胞进入了平稳期,此时细胞的增殖速度开始减缓,并逐渐进入衰退期。绒山羊DPCs的生长曲线呈现出典型的 “S” 型,符合细胞生长曲线形态。

图5 DPCs生长曲线Fig.5 Growth curve of DPCs
2.5 添加不同浓度Cys、Met对DPCs增殖的影响
由图6A可见,培养DPCs 2 h,细胞增殖活性随着Cys浓度增高呈现出先升高后降低的趋势,其中,添加40 μg·mL-1Cys组细胞增殖活性显著高于对照组和其它浓度组(P<0.05),添加20 μg·mL-1Cys组显著高于对照组、80和100 μg·mL-1Cys组(P<0.05),但与添加60 μg·mL-1Cys组差异不显著(P>0.05)。80、100 μg·mL-1Cys组与对照组差异不显著(P>0.05)。说明添加40 μg·mL-1Cys培养细胞2 h细胞增殖活性最高。
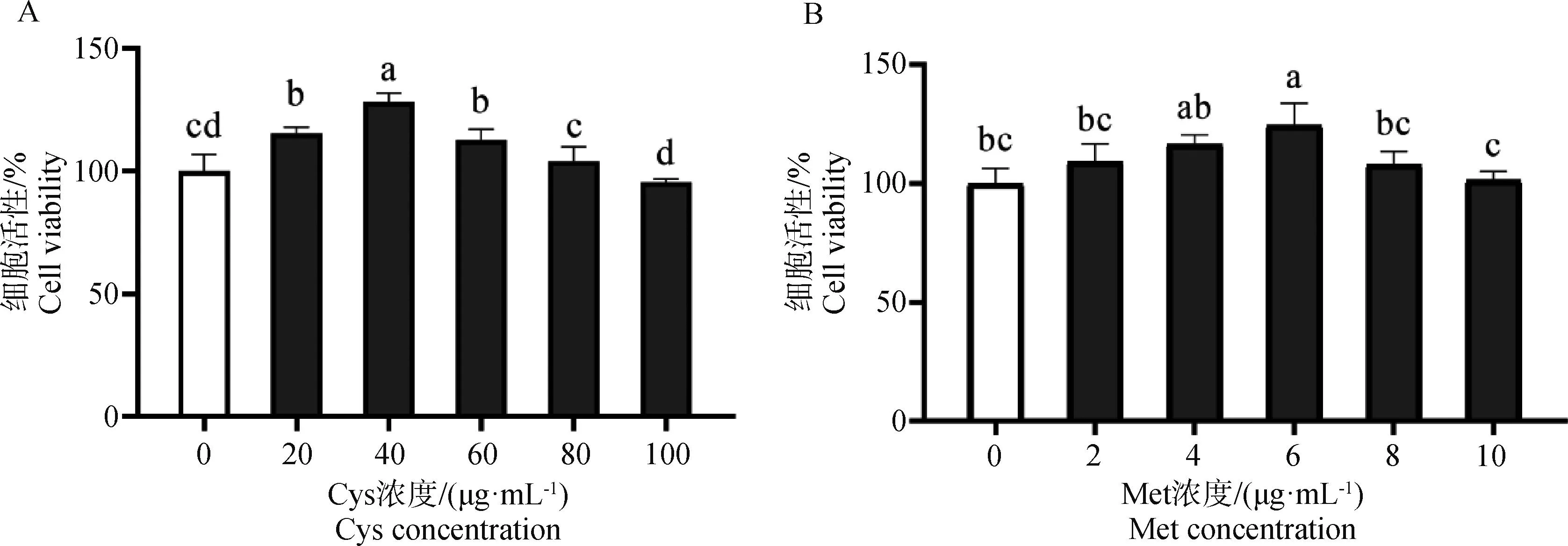
数据柱标注相同小写字母表示差异不显著(P>0.05),数据柱标注不同小写字母表示差异显著(P<0.05)The same lowercase letter on columns indicate no significant difference (P>0.05), different lowercase letters on columns indicate the significant difference (P<0.05)
2.6 添加不同浓度Cys对毛乳头细胞增殖分化相关基因mRNA表达量的影响
由表4可知,随着Cys浓度升高,PCNA、CCND1、CDK4、Bcl-2、mRNA表达量呈先上升后下降的趋势;基因CDC42、P21、P53、Bax、Caspase-3等基因mRNA表达量呈先下降后上升的趋势;K10、K14、IVL等基因mRNA表达量呈逐渐上升趋势。与对照组相比,不同浓度Cys组DPCs增殖分化及相关基因PCNA、CCND1、CDC42、CDK4、P53、P21、Bax、Bcl-2、Caspase-3、K10、K14、IVLmRNA的表达量差异显著(P<0.05);添加40 μg·mL-1Cys,显著上调PCNA、CCND1、CDK4、Bcl-2、K14、IVL等基因mRNA表达量,显著下调CDC42、P21、P53、Bax、Caspase-3等基因mRNA表达量,与细胞增殖活力检测的结果一致,表明40 μg·mL-1Cys通过调节PCNA、CCND1、CDC42、CDK4、P53、P21、Bax、Bcl-2、Caspase-3、K10、K14、IVL等基因的表达来促进细胞增殖抑制细胞凋亡。
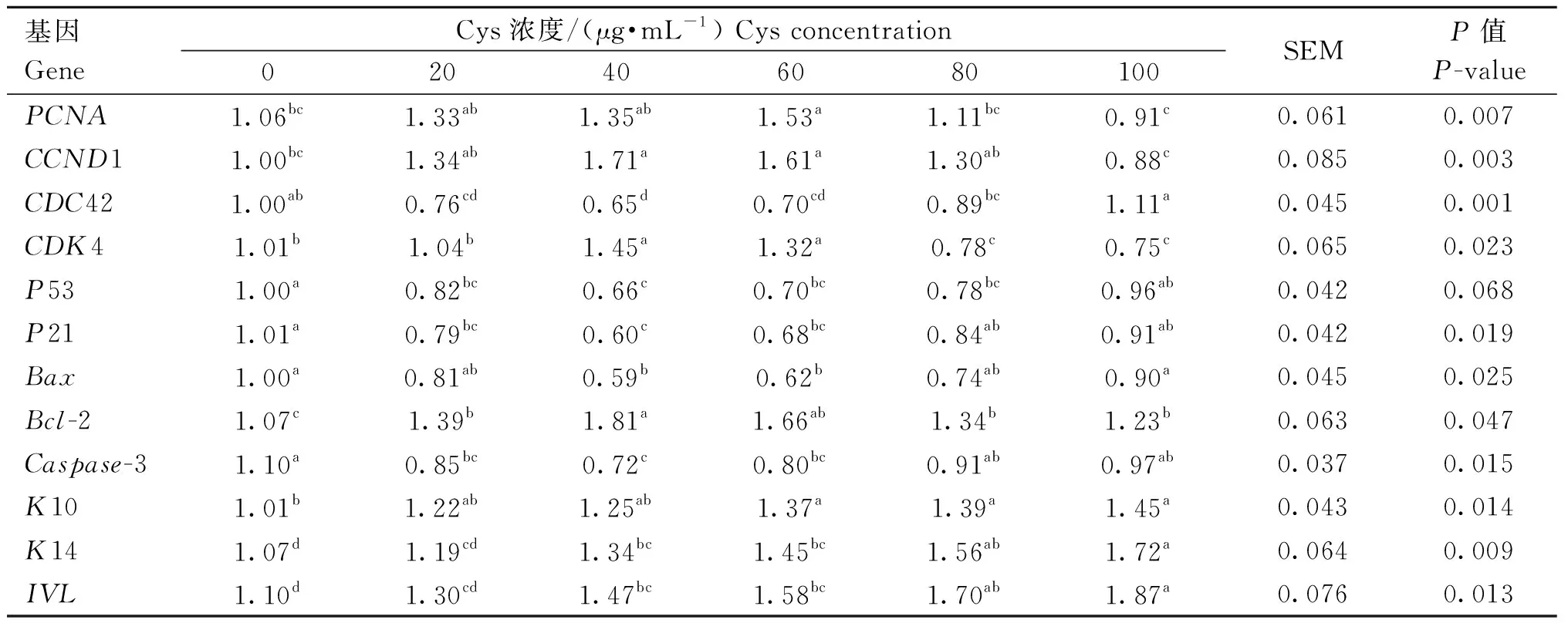
表4 不同浓度Cys对毛乳头细胞增殖分化相关基因mRNA表达量的影响
2.7 添加不同浓度Met对毛乳头细胞增殖分化相关基因mRNA表达量的影响
由表5可知,随着Met浓度升高,PCNA、CCND1、CDK4、P21、Bcl-2、K10、IVLmRNA表达量呈现出先上升后下降的趋势;Bax、Caspase-3等基因mRNA表达量呈先下降后上升趋势;K14、P53等基因mRNA表达量呈逐渐上升趋势。与对照组相比,不同浓度Met组DPCs增殖分化及相关基因PCNA、CCND1、CDC42、CDK4、P21、Bax、Bcl-2、Caspase-3、K10、K14、IVLmRNA的表达量差异显著(P<0.05);添加6 μg·mL-1Met,显著上调PCNA、CCND1、CDK4、P21、Bcl-2、K10、K14等基因mRNA表达量,显著下调Bax、Caspase-3等基因mRNA表达量,与细胞增殖活力检测的结果一致,表明6 μg·mL-1Met通过调节PCNA、CCND1、CDC42、CDK4、P21、Bax、Bcl-2、Caspase-3、K10、K14、IVL等基因的表达来促进细胞增殖抑制细胞凋亡。

表5 不同浓度Met对毛乳头细胞增殖分化相关基因mRNA表达量的影响
3 讨 论
3.1 添加Cys、Met对体外培养绒山羊次级毛囊的影响
毛囊作为绒山羊的皮肤附属器官,控制着羊绒的生长与品质,具有独特且复杂的结构形态[15]和周期性生长的特点[16]。在绒山羊毛囊生长期,毛囊由真皮层向下发育,其内部间质细胞起到信号调节作用,在这个过程中DPCs起到核心作用[17-18]。本试验采用机械分离法[19]和酶消化法[20]提取绒山羊次级毛囊,成功分离纯化出毛乳头细胞,此方法可以保留次级毛囊完整性,且分离速度较快。在分离毛囊时发现毛囊位于绒山羊皮肤真皮层,包含初级毛囊与次级毛囊,通过毛囊形态较易区分。本试验中次级毛囊生长速度(7.64 μm·d-1)高于辽宁绒山羊(4.53 μm·d-1)[21],低于苏格兰绒山羊(10.62 μm·d-1)[22]。次级毛囊生长状态和生长速度的差异可能与绒山羊品种有关[23],同品种绒山羊也会受到年龄、性别、自身营养条件以及周围环境等诸多因素影响[24]。
Cys和Met是重要的含硫氨基酸,缺乏Cys和Met会影响绒山羊毛囊生长发育以及绒毛纤维品质。Galbraith[25]通过体外培养次级毛囊发现,添加Met使羊绒纤维产量和直径均得到提高,表明蛋氨酸有助于体外培养次级毛囊以及绒毛纤维的生长发育。宋玲玲[26]研究发现,日粮中单独添加或同时添加过瘤胃半胱氨酸与过瘤胃蛋氨酸均可显著提高辽宁绒山羊次级毛囊活性、毛囊密度和羊绒品质。本试验结果表明,培养基中添加Cys(120 μg·mL-1)和Met(20 μg·mL-1)均显著促进次级毛囊生长,所有添加Met组毛囊生长长度均高于Cys组和对照组;与对照组相比,添加Cys和Met可更长时间维持次级毛囊毛球部完整性,增加毛囊累计生长长度。这与Souri等[27]在体外培养绒山羊次级毛囊时添加不同浓度Met和Cys能够促进毛干伸长和增加毛囊活力的研究结果一致。因此体外培养次级毛囊时,添加Cys和Met可以提高次级毛囊的活性和生长长度。
3.2 添加Cys、Met对DPCs增殖的影响
次级毛囊毛球部含有大量增殖和未分化的细胞,包括毛囊干细胞、内(外)根鞘细胞、成纤维细胞等[28]。本试验研究发现,细胞增殖活性随着Met添加浓度的增加呈先上升后下降的趋势,与张婧婧[29]对内根鞘细胞增殖活性的研究结果趋势基本一致。谢贝[30]研究表明,在一定条件下能够诱导成纤维细胞向毛乳头细胞转化,进而促进毛囊生长发育。李萌萌[31]研究表明,不同浓度Cys对成纤维细胞增殖活性有促进作用,且随着Cys浓度增加,成纤维细胞的增殖活性呈现出上升趋势,而本试验中,添加不同浓度Cys后DPCs增殖活性呈先上升后下降的趋势,可能是由于细胞类型及添加浓度不同;另外,该试验单独添加不同浓度Met,成纤维细胞增殖活性呈现出先升高后下降的趋势,与本试验添加不同浓度Met对DPCs增殖率结果趋势一致。本试验结果表明,在培养基中添加40 μg·mL-1Cys、6 μg·mL-1Met可以提高DPCs细胞活力、抑制细胞凋亡;添加120 μg·mL-1Cys和20 μg·mL-1Met可促进次级毛囊生长。次级毛囊与DPCs细胞添加Cys与Met的最适浓度不同,可能是由于次级毛囊与DPCs接受Cys、Met两种氨基酸的能力不同。
3.3 添加Cys、Met对DPCs增殖、分化及相关基因mRNA表达量的影响
PCNA在DNA复制过程中充当DNA聚合酶活动的夹子,在细胞增殖中发挥着重要的作用,可作为细胞增殖的标记物。宗波[32]的研究表明,在初级毛囊DPCs添加褪黑素提高PCNAmRNA表达量;CCND1和CDK4是细胞周期调控机制的重要组成部分[33],且CCND1-CDK4复合物水平的升高会促进细胞增殖,缩短细胞增殖周期[34]。P53可诱导CCND1和CDK4抑制剂P21的可变表达,而P21可调节正常细胞增殖和加速衰老细胞凋亡并能够与CCND1和CDK4结合,对CCND1-CDK4活性进行抑制[35]。本试验与前人研究结果一致,添加6 μg·mL-1Met显著上调PCNA、CCND1、CDK4、P21基因mRNA表达量,添加40 μg·mL-1Cys显著上调PCNA、CCND1、CDK4基因mRNA表达量,表明添加Cys、Met可以通过上调细胞增殖相关基因促进DPCs维持稳定的细胞增殖周期并避免异常增殖。CDC42作为细胞信号传导因子,在成纤维细胞和上皮细胞形状变化中具有调节功能[36]。本试验中,添加Met对CDC42基因mRNA表达量呈现先升高后下降的趋势,添加Cys对CDC42基因mRNA表达量呈现出先下降后升高的趋势,这表明添加Cys、Met能通过调控CDC42基因表达量来调节DPCs细胞形态变化。
Bcl-2与Bax共属于Bcl-2家族,通过控制线粒体膜的通透性来调节凋亡激活物[37]。而caspase-3属于半胱天冬酶家族,在caspase通路中具有执行凋亡的功能[38-39],Bcl-2和Bax是caspase-3的上游信号[40],本试验中分别添加40 μg·mL-1Cys、6 μg·mL-1Met均显著上调Bcl-2基因mRNA表达量,显著下调Bax、Caspase-3基因mRNA表达量;Bcl-2水平的升高和Bax的降低表明DPCs抗凋亡作用增强,而caspase-3基因mRNA表达量下降,说明添加Cys、Met可能依赖caspase通路中caspase-3来控制DPCs凋亡。K10、K14属于KRT角蛋白基因家族,可作为毛囊的标志物,K10存在于角质化的终端角质细胞中,K14主要存在于表皮基底层的DPCs区域中,K10与K14起到维持DPCs结构稳定并参与维持毛囊的结构和功能[41]。Fratini等[42]的研究表明,静脉注射半胱氨酸或蛋氨酸,Cys的角蛋白及相关蛋白的mRNA表达量增加,与本研究结果一致,本试验中分别添加Cys及Met均显著上调角蛋白相关基因K10、K14 mRNA的表达量,说明添加Cys、Met能够促进角蛋白合成。Ma等[43]构建体外细胞模型,发现上调IVL基因的表达,可促进DPCs持续增殖和分化,导致毛囊快速生长,本试验添加40 μg·mL-1Cys显著上调IVL基因mRNA表达,表明添加Cys可促进DPCs持续增殖分化,进而影响次级毛囊生长。综上,Cys、Met可能通过调控毛囊中DPCs细胞增殖来影响次级毛囊生长。
4 结 论
在本试验条件下,添加Cys和Met可以显著促进长绒期燕山绒山羊次级毛囊生长,最适添加量分别为120 μg·mL-1和20 μg·mL-1;添加Cys和Met可通过上调细胞增殖、分化、角蛋白等基因mRNA、下调细胞凋亡基因mRNA表达,促进毛乳头细胞增殖、抑制细胞凋亡进而促进燕山绒山羊次级毛囊生长。
