基于MEK/ERK通路研究桂枝茯苓丸改善慢性阻塞性肺疾病小鼠气道重塑的作用与机制*
2024-03-01邓秀娟杨亿然谭宇军胡学军
邓秀娟,杨亿然,张 真,谭宇军,刘 雨,黄 乐,胡学军
(1.湖南省中医药研究院附属医院,湖南 长沙 410006;2.湖南中医药大学,湖南 长沙 410208)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种常见的肺系疾病,病理特征为不可逆的气流受限,表现为反复发作的咳嗽、咳痰和呼吸困难[1]。气道重塑(airway remodeling)是COPD发生发展过程中重要的病理特征,源自于气道组织的反复损伤-修复过程,是导致患者气流受限和激素抵抗的主要原因[2-3]。常规的抗感染、止咳化痰、解痉平喘等治疗手段可在一定程度上缓解COPD症状,但不能有效地阻止和(或)逆转气道重塑的病理改变,同时也存在药物不良反应等问题[4]。
丝裂原活化细胞外信号调节蛋白激酶(mitogen-activated extracellular signal regulated kinase,MEK)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路介导了多种细胞反应,包括诱导靶细胞的增殖、分化和凋亡等过程[5-6]。该通路参与哮喘气道重塑过程[6-9],但在COPD气道重塑方面研究较少。
中医学认为,COPD气道重塑以内生痰瘀之毒痹阻肺络、肺络癥瘕结聚为主要病理特征[10]。桂枝茯苓丸(Guizhi Fuling Pill,GFP)出自《金匮要略》,是治疗癥瘕积聚的经典名方,具有活血化痰、消癥通络的功效。研究[11]表明,桂枝茯苓丸可通过抑制MEK/ERK信号通路,减少子宫内膜异位病灶中细胞的增殖与侵袭。基于以上分析,本研究基于MEK/ERK通路探讨桂枝茯苓丸改善COPD小鼠气道重塑的作用机制。
1 材料
1.1 实验动物 SPF级雄性C57BL/6小鼠40只,体质量(19.9±1.43)g,由湖南中医药大学动物实验中心提供,动物生产许可证号:SCXK(湘)2019-0004,质量合格证号:43072721100875058。饲养室温度为22~24 ℃,相对湿度为50%~60%,昼夜12 h交替照明,自由进食和饮水。本实验经湖南中医药大学动物实验伦理委员会批准(批准号:LLBH-202203140006)。
1.2 香烟 金圣牌香烟(江西中烟工业有限责任公司),焦油含量8 mg,烟气烟碱量0.8 mg,CO含量9 mg。
1.3 药物与试剂 桂枝茯苓丸(批号:220801)购自九芝堂金鼎药业有限公司;PD98059(批号:167869-21-8)购自美国APExBIO公司;4%多聚甲醛固定液(批号:22242687)购自北京兰捷柯科技有限公司;兔单抗COL3A1(批号:00022739)、小鼠单抗β-actin(批号:10004156)均购自武汉三鹰生物技术有限公司;兔单抗COL1A1(批号:GR236382-6)、兔单抗MEK1(批号:GR3154382-4)、兔单抗p-MEK1(批号:GR232892-8)、兔单抗ERK(批号:GR3215675-8)、兔单抗p-ERK(批号:GR3368531-4)均购自英国Abcam公司;苏木素染液(批号:20210507002)、伊红染液(批号:20210727003)、HRP标记羊抗小鼠二抗(批号:01A221228)、HPR标记羊抗兔二抗(批号:02B221228)均购自长沙艾碧维生物科技有限公司。
1.4 主要仪器 PFT-MR型小动物肺功能检测仪购自上海塔望智能科技有限公司;TS-1型摇床、GL-88B型旋涡混合器均购自江苏海门市其林贝尔仪器制造有限公司;H1650R型台式冷冻离心机购自湖南湘仪科教仪器有限公司;JB-13型磁力搅拌器、PHS-3C型精密PH计购均自上海精密科学仪器有限公司;DYY-60型电泳仪、DYCZ-24DN型电泳槽、DYCZ-40D型转膜仪均购自北京六一生物科技有限公司;BioPrep-24型生物样品均质仪购自杭州奥盛仪器有限公司;ChemiScope6100型化学发光成像系统购自上海勤翔科学仪器有限公司。
2 方法
2.1 中药药液制备 桂枝茯苓丸按每100丸(15 g)配450 mL蒸馏水溶解,保证每30 mL药液内含1 g药物,现配现用。
2.2 造模与分组 造模方法参考梅晓峰等[12]方法,采用被动吸烟的方式造模,每天熏烟2次,每次使用20支香烟,时间持续60 min,中途间隔4 h,每熏烟6 d,休息1 d,总计60 d。肺功能检测是目前公认评估COPD动物造模成功与否的重要方法。肺功能检测相关指标,如每分钟通气量(minute ventilation volume,MV)、吸气峰流量(peak inspiratory flow,PIF)和呼气峰流量(peak expiratory flow,PEF)反映了气道的阻塞程度,对COPD的诊断、分期、疾病进展、预后和治疗等均有重要意义[13-14]。造模完成后,观察造模小鼠的外在表现,并分别随机抽取6只造模小鼠和未烟熏小鼠行肺功能检测。结果显示,造模小鼠表现为精神萎靡,毛发无光泽并发生脱落,少动,呼吸急促,并出现明显咳嗽症状,并伴随着肺功能指标MV、PIF和PEF的显著下降,提示造模成功。采用随机数字表法分组,将造模成功小鼠分为模型组、桂枝茯苓丸组、PD98059组(MEK inhibitor,MEKi)和桂枝茯苓丸+PD98059组,每组8只。同时,另取8只未烟熏的小鼠作为空白组。
2.3 给药方法 小鼠给药剂量参考人和动物体表面积折算的等效剂量比率表[15],小鼠每千克体质量给药量按人(70 kg)的等效量换算,小鼠中药灌胃量为273 mg/(kg·d)。依据文献方法[16],PD98059予以10 mg/kg腹腔注射。桂枝茯苓丸组小鼠予桂枝茯苓丸溶液灌胃,273 mg/(kg·d);PD98059组小鼠予PD98059(10 mg/kg)腹腔注射;桂枝茯苓丸+PD98059组小鼠予桂枝茯苓丸溶液灌胃[273mg/(kg·d)],同时予PD98059(10mg/kg)腹腔注射。空白组和模型组小鼠予等量生理盐水灌胃,8.19 mL/(kg·d)。各组均于第61天开始灌胃或(和)腹腔注射,1次/d,连续14 d。给药过程中,模型组死亡2只,桂枝茯苓丸组死亡1只,PD98059组死亡1只。
2.4 观察指标
2.4.1 肺功能 小鼠腹腔注射1%戊巴比妥钠(40 mg/kg)麻醉后,分离暴露气管,进行气管插管固定,使用小动物肺功能检测仪测定MV、PIF和PEF。肺功能测定过程中,空白组失败2只,模型组失败1只,桂枝茯苓丸+PD98059组失败2只。
2.4.2 肺组织病理 各组取小鼠左肺组织于4%多聚甲醛溶液中固定24 h,经脱水、渗透和石蜡包埋后切片。HE染色评估肺组织病理学变化,Masson染色观察肺组织纤维化改变。
2.4.3 MEK/ERK通路相关蛋白 采用Western blotting检测肺组织Ⅰ型胶原α1链(collagenⅠα1,COL1A1)、Ⅲ型胶原α1链(collagenⅢα1,COL3A1)、MEK1、p-MEK1、ERK(1/2)和p-ERK(1/2)蛋白相对表达量。称取25mg新鲜肺组织,加入300 μL RIPA裂解液,在生物样品均质仪中研磨为组织匀浆,冰上裂解10 min,12000 r/min离心15 min(离心半径12 cm),提取上清液,BCA试剂盒检测蛋白浓度。配置SDS-PAGE凝胶,电泳,转膜,封闭,一抗孵育(见表1),二抗孵育(1∶5000),ECL显影,凝胶成像系统成像,Image J(v1.53)软件测定各条带OD值,以β-actin为内参。

表1 一抗孵育信息
2.5 统计学方法 使用SPSS 26.0软件进行统计学分析,数据以“均数±标准差”(±s)表示。多组间比较采用单因素方差分析,若不符合正态分布或(和)方差齐性时,使用非参数检验,P<0.05为差异有统计学意义。
3 结果
3.1 各组小鼠肺功能比较 模型组小鼠MV、PIF和PEF水平均低于空白组(P<0.05);桂枝茯苓丸组、PD98059组和桂枝茯苓丸+PD98059组小鼠MV、PIF和PEF水平均高于模型组(P<0.05);桂枝茯苓丸+PD98059组小鼠MV、PIF和PEF水平高于桂枝茯苓丸组和PD98059组(P<0.05);桂枝茯苓丸组小鼠MV、PIF和PEF水平与PD98059组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组小鼠肺功能比较 (±s)

表2 各组小鼠肺功能比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与桂枝茯苓丸组比较,cP<0.05;与PD98059组比较,dP<0.05。
组别n MV/mLPEF/(mL/s)PIF/(mL/s)空白组648.62±3.214.95±0.343.77±0.29模型组519.32±5.12a2.09±0.39a2.06±0.24a桂枝茯苓丸组730.62±4.07b3.51±0.42b2.54±0.22b PD98059组731.25±3.94b3.66±0.33b2.68±0.31b桂枝茯苓丸+PD98059组638.43±4.48bcd 4.21±0.29bcd 3.12±0.27bcd F 178.20173.013184.627 P 0.0000.0030.000
3.2 小鼠肺组织HE染色 空白组小鼠肺组织未见明显炎症,肺泡壁无缺损,支气管形态完整规则,管腔无明显分泌物。模型组小鼠肺组织有明显炎症表现,可见部分肺泡壁破裂、融合,支气管形态改变,气道壁可见大量炎症细胞浸润,提示小鼠COPD模型成功建立。与模型组比较,枝茯苓丸组、PD98059组和桂枝茯苓丸+PD98059组小鼠病理改变减轻,其中以桂枝茯苓丸+PD98059组最为明显。(见图1)
3.3 小鼠肺组织Masson染色 Masson染色可使组织中胶原纤维呈蓝色,平滑肌呈红色。空白组小鼠仅见少量蓝色沉淀物堆积,红染区主要见于支气管周围。模型组小鼠气道周围的蓝染区和红染区明显增多,提示存在大量蓝色胶原沉积和平滑肌增生。与模型组比较,枝茯苓丸组、PD98059组和桂枝茯苓丸+PD98059组小鼠蓝染区和红染区范围明显缩小,其中桂枝茯苓丸+PD98059组最显著。(见图2)

图2 各组小鼠肺组织Masson 染色 (×100)
3.4 各组小鼠肺组织COL1A1和COL3A1蛋白相对表达量比较 模型组小鼠肺组织COL1A1和COL3A1蛋白相对表达量高于空白组(P<0.05);桂枝茯苓丸组、PD98059组和桂枝茯苓丸+PD98059组小鼠肺组织COL1A1和COL3A1蛋白相对表达量均低于模型组(P<0.05);桂枝茯苓丸组小鼠肺组织COL1A1和COL3A1蛋白相对表达量低于PD98059组(P<0.05),高于桂枝茯苓丸+PD98059组(P<0.05);PD98059组小鼠肺组织COL1A1和COL3A1蛋白相对表达量高于桂枝茯苓丸+PD98059组(P<0.05)。(见图3、表3)

图3 小鼠肺组织COL1A1 和COL3A1 蛋白表达Western blotting 图
表3 各组小鼠肺组织COL1A1 和COL3A1 蛋白相对表达量比较 (±s)

表3 各组小鼠肺组织COL1A1 和COL3A1 蛋白相对表达量比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与桂枝茯苓丸组比较,cP<0.05;与PD98059组比较,dP<0.05。
组别nCOL1A1COL3A1空白组80.10±0.010.20±0.04模型组60.75±0.04a0.59±0.05a桂枝茯苓丸组70.49±0.04b0.50±0.03b PD98059组70.58±0.04b c0.56±0.05b c桂枝茯苓丸+PD98059组 80.28±0.02b c d0.33±0.04b c d F 62.82649.170 P 0.0010.000
3.5 各组小鼠肺组织MEK/ERK通路相关蛋白相对表达量比较 模型组小鼠肺组织p-MEK1、p-ERK(1/2)、p-MEK1/MEK1和p-ERK(1/2)/ERK(1/2)高于空白组(P<0.05);桂枝茯苓丸组、PD98059组、桂枝茯苓丸+PD98059组小鼠肺组织p-MEK1、p-ERK(1/2)、p-MEK1/MEK1和p-ERK(1/2)/ERK(1/2)均低于模型组(P<0.05);桂枝茯苓丸组小鼠肺组织p-MEK1、p-ERK(1/2)、p-MEK1/MEK1和p-ERK(1/2)/ERK(1/2)低于PD98059组(P<0.05),高于桂枝茯苓丸+PD98059组(P<0.05);PD98059组小鼠肺组织p-MEK1、p-ERK(1/2)、p-MEK1/MEK1和p-ERK(1/2)/ERK(1/2)高于桂枝茯苓丸+PD98059组(P<0.05)。(见图4、表4)
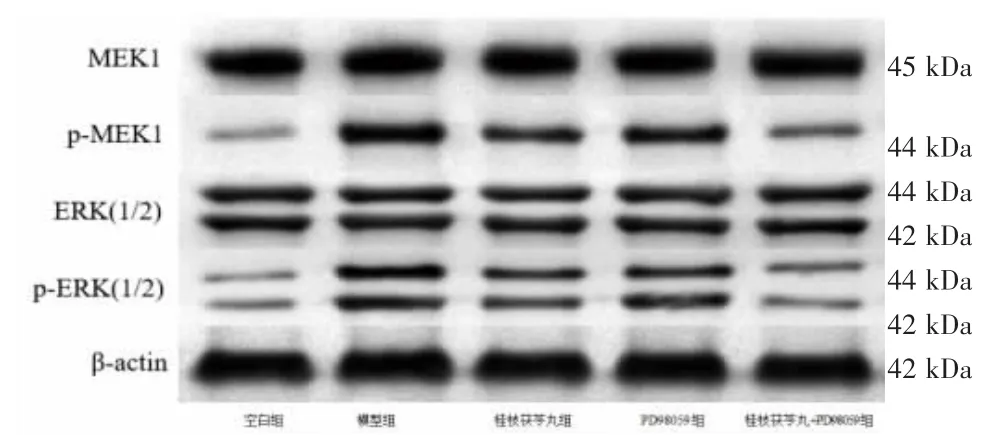
图4 小鼠肺组织MEK/ERK 通路相关蛋白表达Western blotting 图
表4 各组小鼠肺组织MEK/ERK 通路相关蛋白相对表达量比较 (±s)

表4 各组小鼠肺组织MEK/ERK 通路相关蛋白相对表达量比较 (±s)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与桂枝茯苓丸组比较,cP<0.05;与PD98059组比较,dP<0.05。
组别n p-MEK1 p-MEK1/MEK1 p-ERK(1/2)p-ERK(1/2)/ERK(1/2)空白组80.09±0.030.15±0.030.12±0.020.34±0.06模型组60.55±0.04a 0.92±0.12a 0.49±0.03a1.05±0.14a桂枝茯苓丸组70.34±0.03b 0.48±0.08b 0.31±0.03b0.66±0.05b PD98059组70.44±0.02bc 0.68±0.11bc 0.39±0.02bc0.81±0.10bc桂枝茯苓丸+PD98059组80.15±0.03bcd 0.24±0.05bcd 0.19±0.01bcd0.40±0.03bcd F 148.39078.41453.941198.297 P 0.0000.0020.0010.000
4 讨论
COPD属中医“肺胀”“喘证”等范畴,咳、喘、悸、肿、绀为主要临床表现。其病位在肺,以肺、脾、肾三脏虚损为本,痰饮瘀毒之邪互结为标[17]。肺气不足,宣降失司,气行不畅,津液停滞,聚而成痰。痰为有型之邪,深伏于肺,阻滞气血畅行,发为瘀滞。痰瘀既成,蕴化成毒,积伏肺络,发为癥瘕积聚。病久正气耗散,形成COPD气道重塑的病理状态,故治疗应在化痰除饮祛瘀的基础上,重视解毒通络,调气活血[18]。桂枝茯苓丸出自张仲景的《金匮要略》,由桂枝、茯苓、赤芍、牡丹皮及桃仁组成。方中桂枝通血脉,消瘀滞,助气化而行津液,调气通络,为君药;茯苓甘淡平,祛痰行气,有利于瘀化下行;甘草解毒调气,调和诸药;桃仁味苦甘平,可活血祛瘀,“止咳逆上气”;赤芍活血消瘀;牡丹皮清热凉血,化瘀通络。全方共奏活血化痰、消癥通络之效,可使瘀祛痰消,毒除络通,气道通畅[19-20]。
COPD气道重塑与炎症反应、氧化应激和蛋白酶/抗蛋白酶失衡等密切相关,主要发生在小气道(内径<2 mm)。气道重塑涉及上皮细胞增生、网状基底膜增厚、胶原蛋白沉积、支气管周围纤维化、纤毛功能障碍和平滑肌细胞增生等过程,可导致COPD患者出现不可逆性的气流受限[21]。Ⅰ型和Ⅲ型胶原蛋白是细胞外基质(extracellular matrix,ECM)的主要成分。本实验结果表明,模型组小鼠肺组织COL1A1和COL3A1蛋白表达明显增加,存在炎症细胞浸润、平滑肌增生和蓝色胶原沉积等病理改变,同时伴有各项肺功能指标下降,提示COPD小鼠模型造模成功,并存在气道炎症和气道重塑。这与前期研究一致[22]。经桂枝茯苓丸干预后,小鼠肺部炎症、气道重塑和肺功能等指标均得到明显改善,提示桂枝茯苓丸可缓解肺部炎症、气道重塑,改善肺功能。研究表明,桂枝茯苓丸治疗COPD痰瘀互结证具有良好的疗效,可明显改善肺通气功能和肺部炎症[17,23-24]。
MEK/ERK通路是众多丝裂素活化蛋白激酶(mitogen-activated protein kinases,MAPK)通路中的一个[25]。在膜受体发出信号传导后,大鼠肉瘤(rat sarcoma,RAS)蛋白被激活,随后募集并活化加速纤维肉瘤(rapidly accelerated fibrosarcoma,RAF)蛋白家族。活化的RAF进一步磷酸化下游MEK,最后双重磷酸化ERK,促使其易位到细胞核以激活多种转录因子和其他核底物[26]。研究表明,ERK(1/2)是COPD气道平滑肌细胞(airway smooth muscle cell, ASMCs)增殖信号传导的主要途径[27],阻断MEK/ERK通路能有效干预COPD-ASMCs增殖的分子信号调节[28]。MEK/ERK参与了哮喘动物模型的气道炎症、ASMCs增殖和ECM沉积等过程,并可被多种中药或复方所抑制[6-9]。本实验结果显示,模型组小鼠肺组织p-MEK和p-ERK(1/2)蛋白表达明显增加,提示COPD小鼠肺组织存在MEK/ERK通路的激活。
PD98059是一种高效的非ATP竞争型MEK抑制剂,能特异地抑制MEK介导的MAPK活化,从而抑制MEK/ERK通路[29]。本实验结果显示,PD98059组小鼠肺组织p-MEK和p-ERK(1/2)蛋白表达减少,气道重塑病理改善,肺功能好转,提示PD98059可通过抑制MEK/ERK通路来改善COPD气道重塑。桂枝茯苓丸效果与PD98059相似,提示桂枝茯苓丸治疗COPD气道重塑的机制可能也与MEK/ERK通路有关。并且两者合用的疗效优于单用桂枝茯苓丸或PD98059,提示桂枝茯苓丸的治疗机制可能涉及多种途径,还需进一步探索。
综上所述,MEK/ERK通路参与了COPD气道重塑,而桂枝茯苓丸和PD98059可以显著改善以上过程,为COPD机制研究及临床药物治疗靶点的选择提供了实验依据。
