小儿风热清合剂抗炎解热镇痛药理作用研究*
2024-03-01秦小静刘兴超殷苗苗王梦蕾刘会云郭秋红
丁 哲,秦小静,刘兴超,殷苗苗,王梦蕾,刘会云,郭秋红
(1.河北中医药大学药学院,河北 石家庄 050200;2.河北省高校中药开发与产业化应用技术研发中心,河北 石家庄 050200;3.河北省中药大品种培育技术创新中心,河北邯郸 056000;4.邯郸制药股份有限公司,河北邯郸 056000)
小儿急性上呼吸道感染是小儿常见病、多发病,居儿科门诊病例首位,通常由病毒感染引起。主要症状为发热、咽喉肿痛、头痛、全身痛、鼻塞流涕等,临床上主要根据症状进行对症治疗[1-2]。发热、疼痛是小儿急性上呼吸道感染的常见临床症状。儿童发热、疼痛症状出现时,极易哭闹,整体精神状态差,若不及时干预,容易向下呼吸道进展。炎症属于多种临床疾病中最为常见的一种症状表现,在整个致炎过程中,由炎症细胞所产生和释放的一系列炎症介质参与并引发连锁的病理生理过程[3]。一直以来,炎症始终伴随着多种疾病的发生和发展而存在,属于部分疾病病理变化的一个基本过程,并且在一些疾病的临床治疗过程中,往往需要通过抗炎类药物来阻止炎症所带来的机体性损伤[4]。
中药具有整体调节、多靶点治疗的特点,在治疗急性上呼吸道感染方面具有独特疗效,能在退热、消炎、抗病毒的同时调节人体免疫功能,比单一抗炎药物减轻上呼吸道症状更具优势[5]。有效性及安全性高的儿科中成药可以更好地适应临床需求,满足家长的期望,同时可降低抗生素的使用率[6]。小儿风热清合剂(下文简称“小儿风热清”)由金银花、连翘、板蓝根、薄荷、柴胡、牛蒡子、荆芥穗、石膏、黄芩、栀子、桔梗、赤芍、芦根、炒苦杏仁、淡竹叶、枳壳、炒六神曲、僵蚕、防风、甘草20味药经煎煮后浓缩、沉淀、过滤,再历经灌装、灭菌等现代化制药先进工艺制成,具有辛凉解表、清热解毒、止咳利咽之功效,适用于发热、咳嗽、咳痰、鼻塞流涕、咽喉红肿疼痛等症状[7]。小儿风热清为临床常用中成药,对于小儿急性上呼吸道感染(风热感冒)[8]等亦具有良好的治疗效果。目前尚未见有关针对该药抗炎解热镇痛药理作用研究的报告。本研究采用二甲苯致耳肿胀构建小鼠急性炎症模型,评价小儿风热清对耳廓肿胀度、胸腺指数和脾脏指数,以及血清中炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)含量的影响,研究小儿风热清抗炎药理作用;同时本研究通过建立干酵母致大鼠发热模型、小鼠冰醋酸致痛扭体模型、热板致痛模型,研究小儿风热清解热及镇痛药理作用,以期为临床应用提供药理学依据。
1 材料与方法
1.1 实验动物 昆明小鼠,雄性,SPF级,体质量(20±2)g。SPF级雄性SD大鼠,体质量(190±10)g。实验动物均由北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2021-0006。动物饲养条件:恒温(20~26 ℃)、恒湿(50%~65%)的屏障环境,照明设定为12 h/12 h明暗交替。饲予灭菌维持饲料、纯净水。动物伦理审批单位:维通利华实验动物技术有限公司机构实验动物管理和使用委员会。伦理审查号:P2021096。
1.2 药物与试剂 小儿风热清药液为市售小儿风热清合剂体积浓缩至1/2。小儿风热清合剂[规格:每瓶装60 mL(每1 mL相当于饮片2.0 g),批号:S03520001]购自邯郸制药股份有限公司;醋酸地塞米松片(批号:M1046)购自天津太平洋制药有限公司;二甲苯(批号:10023418)购自国药集团化学试剂有限公司;罗通定片(批号:190901)购自四川迪菲特药业有限公司;冰醋酸(批号:20200918)购自天津市风船化学试剂科技有限公;干酵母(批号:13/05/2021/F2-1)购自安琪酵母股份有限公司;阿司匹林肠溶片(批号:BJ53379)购自拜耳医药保健有限公司;0.9%氯化钠溶液(批号:SD20010306)购自山东华鲁制药有限公司;盐酸纳洛酮注射液(批号:1911007)购自国药集团国瑞药业有限公司;大鼠IL-1β酶联免疫吸附测定试剂盒(批号:20210809)、TNF-α酶联免疫吸附测定试剂盒(批号:20210801)、IL-6酶联免疫吸附测定试剂盒(批号:20210805)均购自泉州市九邦生物科技有限公司;乙醚(批号:20181009)购自国药集团化学试剂有限公司。
1.3 主要仪器 酶标仪[赛默飞世尔(上海)仪器有限公司,型号:Multiskan FC];电子天平(深圳市飞亚衡器有限公司,型号:LQ-C100001);小型高速冷冻离心机(艾本德中国有限公司,型号:5418R);净化单人单面净化工作台(苏州净化设备有限公司,型号:SW-CJ-1D);医用电子体温计(江苏鱼跃医疗设备股份有限公司,型号:YT318);电子天平(上海浦春计量仪器有限公司,型号:FA2204);数显恒温水浴锅(常州智博瑞仪器制造有限公司,型号:HH-2);计时器(拜杰电器有限公司,型号:YS-12)。
1.4 造模与分组
1.4.1 二甲苯致小鼠耳肿胀模型的建立 健康SPF级雄性昆明小鼠30只,体质量18~22 g,按体质量随机分为模型组、小儿风热清低剂量组、小儿风热清中剂量组、小儿风热清高剂量组、阳性对照组(地塞米松),每组6只,末次给药后1 h,用微量移液器吸取二甲苯30 μL,快速定点推注于小鼠左耳前、后两面(每面15 μL),制备耳肿胀模型。
1.4.2 干酵母致大鼠发热模型的建立 为了减少在体温测量中对大鼠造成的应激,连续3 d将大鼠置于实验环境中模拟捉拿、固定、安放温度计等实验操作,使其适应实验条件。具体操作:每日固定时间(09:30:00)用体温计测量肛温1次。固定大鼠,电子温度计探头涂以凡士林插入大鼠直肠3 cm,待电子体温计发出蜂鸣声后继续停留40 s读数。选取连续2 d体温在36.5~38.3 ℃之间,且体温变化不超过0.5 ℃的大鼠,并以2 d体温的平均值作为大鼠基础体温。随后,将筛选的60只大鼠按体质量随机分为正常对照组、模型组、阳性对照组(阿司匹林)、小儿风热清低剂量组、小儿风热清中剂量组、小儿风热清高剂量组,每组10只。第3天灌胃后,除正常对照组外,各组大鼠背部皮下注射15%干酵母混悬液(10 mL/kg)建立发热模型,正常对照组注射等体积0.9%氯化钠溶液。
1.4.3 小鼠冰醋酸致痛扭体模型的建立 健康SPF级雄性昆明小鼠40只,体质量18~22 g,按体质量随机分为模型组、小儿风热清低剂量组、小儿风热清中剂量组、小儿风热清高剂量组、阳性对照组(罗通定),每组8只。末次给药后1 h,各组小鼠按10 mL/kg腹腔注射0.6%冰醋酸,记录注射冰醋酸后5~30 min内各组小鼠的扭体次数(腹部内凹收缩,身体扭曲,后肢与躯干伸张,臀部抬高)。
1.4.4 小鼠热板致痛模型的建立 SPF级雌性昆明小鼠,体质量18~22 g,取小鼠,置于(55.0±0.5)℃水浴中的铝板上,用秒表记录小鼠自投入热板后第一次出现舔后足或抬后足的时间(s)作为该鼠的痛阈值。间隔5 min,平行再测一次痛阈值。挑选两次痛阈值在5~30 s之间反应稳定(不频繁跳跃)的小鼠48只。将48只小鼠按体质量随机分为正常对照组、阳性对照组(罗通定)、小儿风热清低剂量组、小儿风热清中剂量组、小儿风热清高剂量组、小儿风热清中剂量+纳洛酮组,每组8只。
1.5 实验给药
1.5.1 二甲苯致小鼠耳肿胀实验 依据小儿风热清合剂说明书,小儿风热清合剂临床用量为1.19 mL/kg,采用体表面积换算法折合成小鼠临床等效剂量为10.80 mL/kg,设为中剂量,低、高剂量分别为5.41、21.6 mL/kg。小儿风热清低、中、高剂量组分别按照5.41、10.80、21.6 mL/kg的剂量给予小儿风热清药液灌胃;阳性对照组(地塞米松)给予地塞米松灌胃,5 mg/kg,模型组给予等量蒸馏水灌胃。1次/d,连续5 d。
1.5.2 干酵母致大鼠发热实验 小儿风热清合剂临床用量为1.19 mL/kg,大鼠临床等效剂量为7.50 mL/kg,设为中剂量,低、高剂量分别为3.75、15.00 mL/kg。小儿风热清低、中、高剂量组分别按照3.75、7.50、15.00 mL/kg的剂量予小儿风热清药液灌胃;阳性对照组(阿司匹林)按照200 mg/kg的剂量予阿司匹林灌胃;模型组给予等量蒸馏水灌胃。1次/d,连续3 d。第3天灌胃后,除正常对照组外,各组大鼠背部皮下注射15%干酵母混悬液(10 mL/kg)建立发热模型,正常对照组注射等体积0.9%氯化钠溶液。大鼠在造模后4 h分别再次灌胃给药。
1.5.3 小鼠冰醋酸致痛扭体实验 小鼠给药剂量同“1.5.1”。小儿风热清低、中、高剂量组分别按照5.41、10.80、21.6 mL/kg的剂量给予小儿风热清药液灌胃;阳性对照组(罗通定)按照30 mg/kg的剂量予药罗通定灌胃;模型组给予等量蒸馏水灌胃。1次/d,连续5 d。
1.5.4 小鼠热板致痛实验 小鼠给药剂量同“1.5.1”。小儿风热清低、中、高剂量组分别按照5.41、10.80、21.6 mL/kg的剂量给予小儿风热清药液灌胃;阳性对照组(罗通定)按照30 mg/kg的剂量予药罗通定灌胃;正常对照组予等量蒸馏水灌胃;小儿风热清中剂量+纳洛酮组按照10.80 mL/kg给予小儿风热清药液灌胃,末次给药时,灌胃小儿风热清药液30 min后,腹腔注射盐酸纳洛酮注射液(2 mg/kg)。1次/d,连续5 d。
1.6 观察指标
1.6.1 二甲苯致小鼠耳肿胀实验 致炎40 min后,各组小鼠乙醚麻醉,摘眼球取血,全血置于2500 r/min离心机中(离心半径为7.7 cm),4 ℃离心15 min,分离上层血清,置于-20 ℃冰箱中保存备用。剪取小鼠双耳,用8 mm打孔器钻孔取左右耳对称部位耳片,用电子天平称量质量,小鼠左右两侧耳片质量差即为肿胀度(公式1),计算各组小鼠耳肿胀抑制率(公式2)。公式1:肿胀度=致炎后左耳片质量-未致炎右耳片质量。公式2:肿胀抑制率=(模型组平均肿胀度-给药组平均肿胀度)/模型组平均肿胀度×100%。
小鼠血清中炎症因子TNF-α、IL-6、IL-1β的含量:按照试剂盒说明书检测血清中炎症因子TNF-α、IL-6、IL-1β含量。
取血后处死小鼠,固定,解剖,取小鼠胸腺和脾脏称重,计算小鼠脾脏指数和胸腺指数。胸腺指数(mg/g)=胸腺质量/体质量;脾脏指数(mg/g)=脾脏质量/体质量。
1.6.2 干酵母致大鼠发热实验 造模后每1 h测量一次各组大鼠的体温,共测量10次。
1.6.3 小鼠冰醋酸致痛扭体实验 记录注射冰醋酸后5~30 min内各组小鼠的扭体次数(腹部内凹收缩,身体扭曲,后肢与躯干伸张,臀部抬高)。
1.6.4 小鼠热板致痛实验 于末次给药后30、60、90、120 min,将小鼠放在预热至(55.1±0.1)℃的铝板上,观察其舔后足或抬后足的反应时间,测定各小鼠的痛阈值,痛阈值若超过60 s则以60 s计。
1.7 统计学方法 所有数据均采用SPSS 25.0统计软件进行分析,计量资料以“均数±标准差”(±s)表示,组间比较分析采用单因素方差分析(One-way ANOVA),结合最小显著性差异法(LSD)多重比较分析;重复测量计量资料采用重复测量资料方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 小儿风热清对二甲苯致小鼠耳肿胀的影响 各组小鼠饮食饮水量基本稳定,无精神萎靡或死亡。模型组小鼠在给予二甲苯致炎后,左耳明显肿胀。阳性对照组、小儿风热清中剂量组、小儿风热清高剂量组小鼠耳廓肿胀度低于模型组,差异均有统计学意义(P<0.01)。表明小儿风热清对二甲苯所致小鼠耳肿胀模型有抗炎消肿的作用。(见表1)
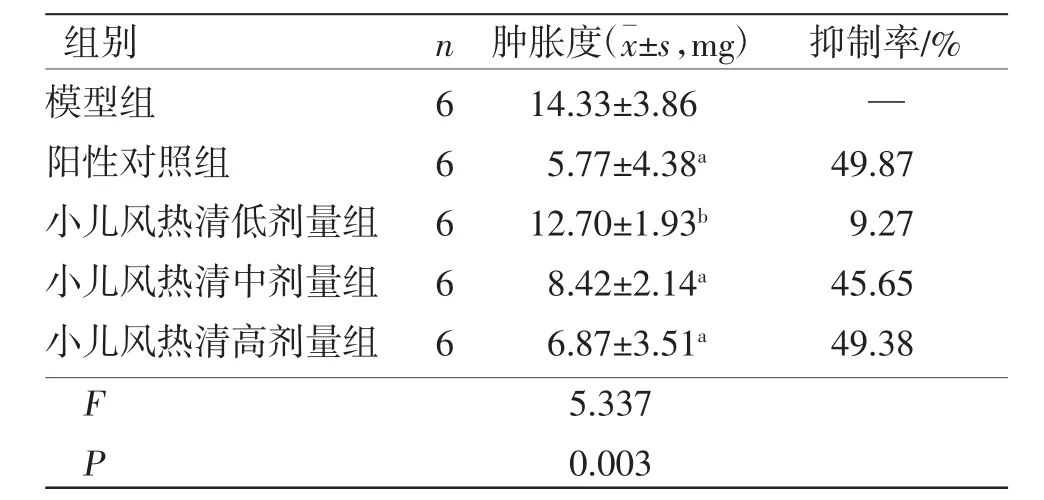
表1 各组小鼠耳肿胀度及抑制率比较
2.2 小儿风热清对小鼠血清炎症因子的影响 阳性对照组小鼠血清TNF-α、IL-1β、IL-6含量与模型组比较,差异均无统计学意义(P>0.05);小儿风热清低、中、高剂量组小鼠血清TNF-α含量低于模型组,差异均有统计学意义(P<0.01或P<0.05);小儿风热清高剂量组小鼠血清IL-6含量低于模型组(P<0.05);小儿风热清低、中、高剂量组小鼠血清中IL-1β含量与模型组比较,差异均无统计学意义(P>0.05)。(见图1)这可能是小儿风热清发挥抗炎作用的原因之一。
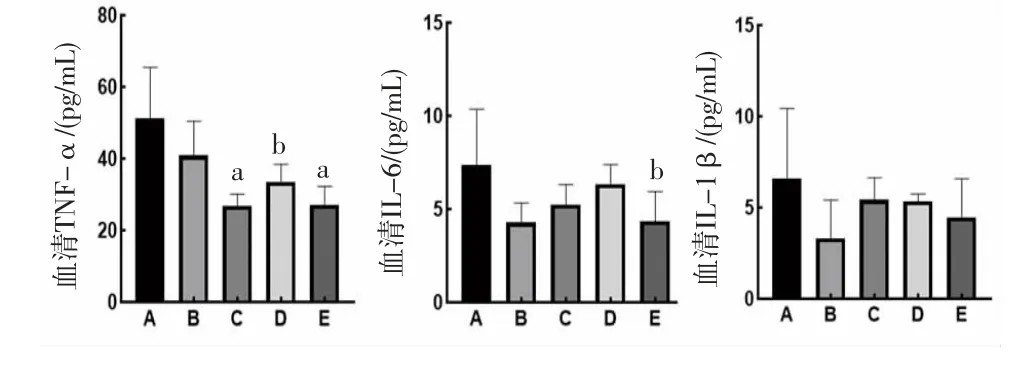
图1 各组小鼠血清TNF-α、IL-1β、IL-6 含量比较(±s,n=6)
2.3 小儿风热清对小鼠脾脏指数和胸腺指数的影响 阳性对照组小鼠脾脏指数和胸腺指数均低于模型组,差异均有统计学意义(P<0.01);小儿风热清高剂量组小鼠的脾脏指数低于模型组(P<0.05);小儿风热清低、中、高剂量组小鼠胸腺指数与模型组比较,差异均无统计学意义(P>0.05)。表明小儿风热清不是通过免疫抑制发挥抗炎作用的。(见图2)
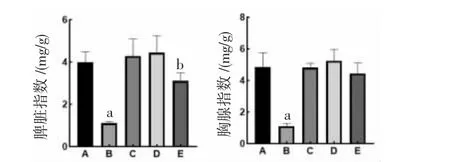
图2 各组小鼠脾指数、胸腺指数比较 (±s,n=6)
2.4 小儿风热清对干酵母所致发热大鼠体温的影响 造模4 h,模型组大鼠体温高于正常对照组,差异有统计学意义(P<0.01),说明干酵母致热模型造模成功。所有大鼠不同时间点体温比较,差异有统计学意义(P<0.01),即存在时间效应。6组大鼠体温总体比较,差异有统计学意义(P<0.01),即存在分组效应。阳性对照组、小儿风热清低剂量组、小儿风热清中剂量组、小儿风热清高剂量组大鼠体温均低于模型组,差异均有统计学意义(P<0.01或P<0.05)。给药5、6、7、8、9、10 h后,模型组大鼠的体温显著高于正常对照组(P<0.01);给药6 h后,小儿风热清低、中、高剂量组大鼠体温均低于模型组,且呈现剂量依赖性,差异均有统计学意义(P<0.01或P<0.05);给药8、9、10 h后,小儿风热清高剂量组大鼠体温均低于模型组,差异有统计学意义(P<0.01或P<0.05)。时间因素和分组因素存在交互效应(P<0.05),表明各组大鼠体温变化幅度不一致。(见表2、图3)小儿风热清可抑制干酵母导致的大鼠体温升高,表明小儿风热清具有解热作用,且解热作用呈剂量依赖性关系。
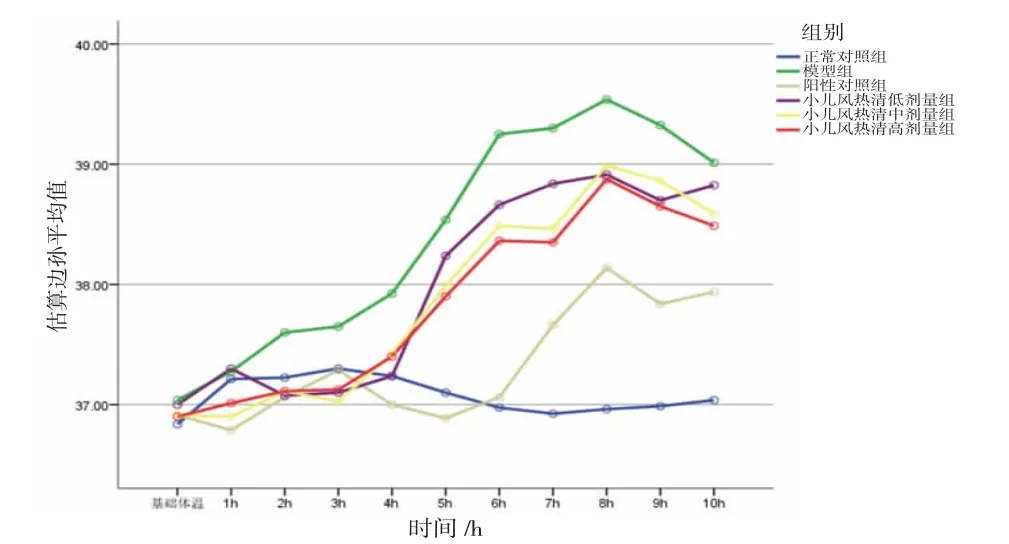
图3 大鼠体温交互效应轮廓图
表2 各组大鼠体温比较 (±s)
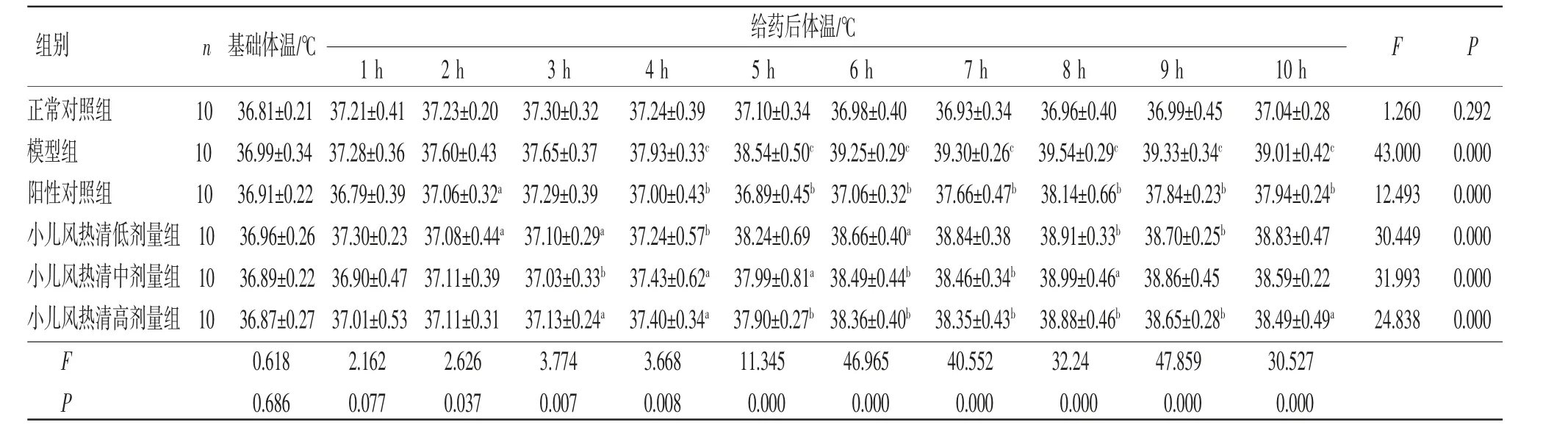
表2 各组大鼠体温比较 (±s)
注:F时间主效应=127.678,P时间主效应=0.000;F分组主效应=56.151,P分组主效应=0.000;F交互效应=10.206,P交互效应=0.000。与模型组比较,aP <0.05,bP<0.01;与正常对照组比较,cP<0.01。
给药后体温/℃1 h2 h3 h4 h5 h6 h7 h8 h9 h10 h正常对照组1036.81±0.2137.21±0.4137.23±0.2037.30±0.3237.24±0.3937.10±0.3436.98±0.4036.93±0.3436.96±0.4036.99±0.4537.04±0.281.2600.292模型组1036.99±0.3437.28±0.3637.60±0.4337.65±0.3737.93±0.33c 38.54±0.50c 39.25±0.29c 39.30±0.26c 39.54±0.29c 39.33±0.34c 39.01±0.42c43.0000.000阳性对照组1036.91±0.2236.79±0.3937.06±0.32a 37.29±0.3937.00±0.43b 36.89±0.45b 37.06±0.32b 37.66±0.47b 38.14±0.66b 37.84±0.23b 37.94±0.24b12.4930.000小儿风热清低剂量组 1036.96±0.2637.30±0.2337.08±0.44a 37.10±0.29a 37.24±0.57b 38.24±0.6938.66±0.40a 38.84±0.3838.91±0.33b 38.70±0.25b 38.83±0.4730.4490.000小儿风热清中剂量组 1036.89±0.2236.90±0.4737.11±0.3937.03±0.33b 37.43±0.62a 37.99±0.81a 38.49±0.44b 38.46±0.34b 38.99±0.46a 38.86±0.4538.59±0.2231.9930.000小儿风热清高剂量组 1036.87±0.2737.01±0.5337.11±0.3137.13±0.24a 37.40±0.34a 37.90±0.27b 38.36±0.40b 38.35±0.43b 38.88±0.46b 38.65±0.28b 38.49±0.49a24.8380.000 F 0.6182.1622.6263.7743.66811.34546.96540.55232.2447.85930.527 P 0.6860.0770.0370.0070.0080.0000.0000.0000.0000.0000.000 FP组别n 基础体温/℃
2.5 小儿风热清对小鼠冰醋酸扭体反应的影响 阳性对照组、小儿风热清中剂量组、小儿风热清高剂量组小鼠扭体次数低于模型组(P<0.01)。结果表明,小儿风热清具有镇痛作用。(见图4)
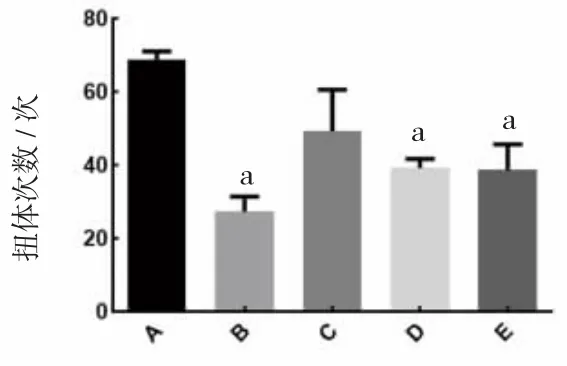
图4 各组小鼠扭体次数比较 (±s,n=8)
2.6 小儿风热清对热刺激致小鼠疼痛反应的影响 所有小鼠不同时间痛阈值比较,差异有统计学意义(P<0.01),即存在时间效应。小儿风热清中、高剂量组在给药后30 min即可发挥镇痛作用,60 min镇痛作用最强。各组小鼠痛阈值总体比较,差异有统计学意义(P<0.01),即存在分组效应。给药后60、90、120 min,小儿风热清低、中、高剂量组小鼠痛阈值高于正常对照组,且小儿风热清镇痛作用呈现剂量依赖性,差异均有统计学意义(P<0.01或P<0.05);高剂量小儿风热清的镇痛作用优于中、低剂量。小儿风热清中剂量+纳洛酮组小鼠痛阈值高于正常对照组,可正常发挥镇痛作用。时间因素和分组因素不存在交互效应(P>0.05),即各组小鼠不同时间痛阈值变化幅度一致。(见表3、图5)结果表明,小儿风热清低、中、高剂量组均有镇痛作用。小儿风热清具有镇痛作用,可提高热板实验小鼠的痛阈值。随着小儿风热清剂量升高,小鼠痛阈值呈正相关提高,且纳洛酮并未拮抗小儿风热清的镇痛作用。
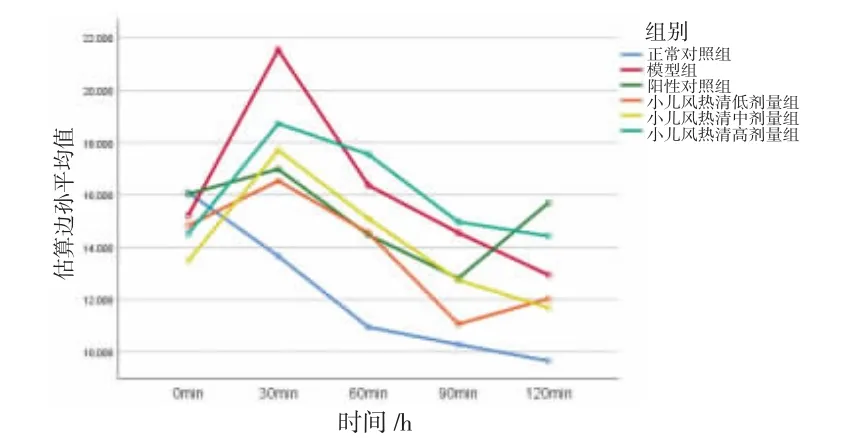
图5 小鼠痛阈值交互效应轮廓图
表3 各组小鼠痛阈值比较 (±s,s)
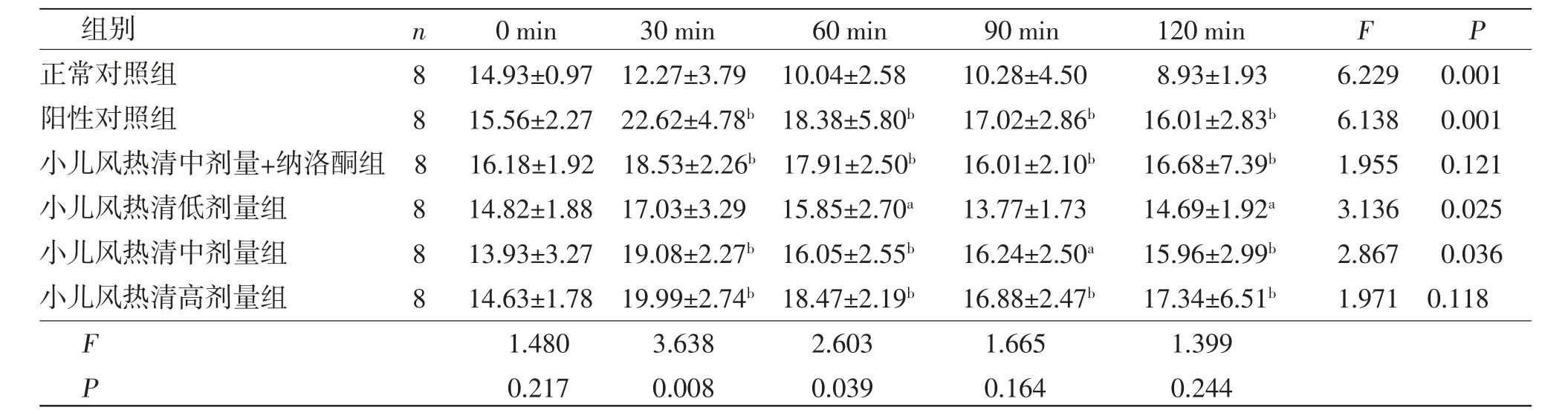
表3 各组小鼠痛阈值比较 (±s,s)
注:F时间主效应=12.688,P时间主效应=0.000;F分组主效应=5.039,P分组主效应=0.001;F交互效应=1.217,P交互效应=0.246。与正常对照组比较,aP<0.05,bP<0.01。
组别n0 min30 min60 min90 min120 minFP正常对照组814.93±0.9712.27±3.7910.04±2.5810.28±4.508.93±1.936.2290.001阳性对照组815.56±2.2722.62±4.78b 18.38±5.80b17.02±2.86b16.01±2.83b6.1380.001小儿风热清中剂量+纳洛酮组 816.18±1.9218.53±2.26b 17.91±2.50b16.01±2.10b16.68±7.39b1.9550.121小儿风热清低剂量组814.82±1.8817.03±3.2915.85±2.70a13.77±1.7314.69±1.92a3.1360.025小儿风热清中剂量组813.93±3.2719.08±2.27b 16.05±2.55b16.24±2.50a15.96±2.99b2.8670.036小儿风热清高剂量组814.63±1.7819.99±2.74b 18.47±2.19b16.88±2.47b17.34±6.51b1.9710.118 F 1.4803.6382.6031.6651.399 P 0.2170.0080.0390.1640.244
3 讨论
炎症是一种常见的病理过程,是具有血管系统的活体组织对损伤因子的防御性反应,可使机体出现“红、肿、热、痛”,甚至引起局部组织功能障碍[9-11]。
小儿急性上呼吸道感染是儿科临床常见病,系指自鼻孔至环状软骨下缘包括鼻腔、咽或喉部急性炎症的总称。主要的病原体为病毒,少数为细菌。小儿风热清中金银花为治疗流感常用清热解毒药。金银花中所含有的槲皮素、木犀草素、山柰酚等成分,可改善流感病毒导致的炎症反应[12-13]。连翘具有清热解毒、消痈散结的功效,常与金银花配伍用于外感风热或热病初起。连翘与金银花配伍使用,主要针对炎症性疾病[14]。柴胡主要含有挥发油和柴胡皂苷类成分。柴胡挥发油、柴胡皂苷对外感、内伤所致高热效果显著[15]。防风中分离得到香豆素类如花椒毒素、东茛菪素、欧前胡素、香柑内酯等具有抗菌、抗炎、止痛和祛痰等活性[16]。同时,小儿风热清也是治疗小儿新冠病毒感染的有效药物。2022年12月《新冠病毒感染者居家中医药干预指引》[17],将小儿风热清列入儿童新冠病毒感染的治疗方案。
本研究选择二甲苯为致炎因子,使小鼠耳廓局部毛细血管通透性增加,诱导耳肿胀,炎症细胞浸润。该模型操作简单,且易复制成功[18]。结果表明,中、高剂量小儿风热清能明显降低小鼠耳肿胀度,且呈现剂量依赖性,提示小儿风热清具有抗炎作用。
TNF-α、IL-6、IL-1β是目前研究较多的炎症因子,在炎症发展中起主要作用。TNF-α是机体发生炎症反应最初分泌的一种重要的细胞因子,参与全身或局部炎症反应[19]。它可诱导参与炎症反应过程的其他细胞因子(如IL-6)的释放,并可不同程度调节这些细胞因子。释放出来的白细胞介素反过来又能增强组织细胞对TNF-α的敏感性,加重炎症反应[20]。IL-1β是一种损伤因子,主要由激活的单核巨噬细胞产生。在炎症发生时,IL-1β可募集中性粒细胞,诱导细胞黏附分子表达,加重组织或细胞的损伤[21]。本实验结果显示,小儿风热清低、中、高剂量组小鼠血清TNF-α、IL-6、IL-1β含量均低于模型组。小儿风热清具有抗炎消肿作用,同时能改善血清中炎症因子水平,发挥抗炎作用。
脾是机体最大的免疫器官。脾脏和胸腺是免疫反应的主要场所,可以制造免疫球蛋白等免疫物质,直接反映机体的免疫功能[22]。本研究结果表明,小儿风热清高剂量组小鼠脾脏指数低于模型组(P<0.05);小儿风热清低、中、高剂量组小鼠胸腺指数与模型组比较,差异无统计学意义(P>0.05)。说明小儿风热清不是通过免疫抑制发挥抗炎作用的。
本实验通过干酵母诱导大鼠发热模型。结果表明,低、中、高小儿风热清均可抑制干酵母导致的大鼠体温升高,表明小儿风热清具有解热作用,且解热作用呈剂量依赖性。冰醋酸可通过诱导组织释放致痛因子,如组胺、缓激肽、前列腺素、5-羟色胺[23]等,刺激腹膜疼痛受体,在游离神经末梢产生痛觉传入冲动。冲动传至高级中枢引起痛觉。冰醋酸扭体法是非特异性模型,适用于外周镇痛药的筛选[24-26]。而热板反应有高位的中枢参与,故小鼠热板致痛模型常用于研究药物发挥作用的部位。通常中枢镇痛药可相对延长刺激反应时间,而外周镇痛药则不具有上述作用。小鼠热板致痛模型是一种经典快痛实验模型,是筛选中枢镇痛药的有效方法[27-29]。纳洛酮是吗啡的结构类似物,是一种经典而强大的阿片类受体抑制剂[30]。阿片类受体激动剂类镇痛药具有显著的镇痛效果,但因其在镇痛过程中会引起成瘾性及依赖性,一直是难以解决的问题[31]。冰醋酸扭体法实验结果证实,小儿风热清可降低冰醋酸导致的小鼠疼痛扭体次数,表明小儿风热清具有外周镇痛作用;热板法实验结果表明小儿风热清可提高热板实验小鼠的痛阈值,且随着小儿风热清剂量升高,小鼠痛阈值呈正相关提高,表明小儿风热清具有中枢镇痛作用,而镇痛作用不是通过作用于阿片类受体产生的。
综上所述,小儿风热清具有良好的抗炎解热镇痛作用,但其具体作用机制有待进一步研究。
