产气糟辣椒的微生物与挥发性风味物质研究及相关性分析
2024-03-01付为艺苏伟母应春陈添艳尹学东
付为艺,苏伟,2,3*,母应春,陈添艳,尹学东
1(贵州大学 酿酒与食品工程学院,贵州 贵阳,550025) 2(贵州大学贵州省农畜产品储藏加工技术重点实验室,贵州 贵阳,550025) 3(贵州大学辣椒产业技术研究院,贵州 贵阳,550025)4(贵三红食品有限公司,贵州 遵义,563099)
糟辣椒是一种备受消费者喜爱的传统发酵制品,其以新鲜辣椒为原料,生姜、大蒜为辅料,剁碎后添加食用盐和其他调味料拌匀,装罐密封发酵,形成特有的香、辣、鲜、酸、咸等风味。随着人们对食品安全的重视,糟辣椒的研究不仅体现在加工方式的优化上[1-2],其有害成分[3]、微生物污染[4]、生花[5-6]、产气[7-8]等情况也受到业界的广泛关注。市面上大多数糟辣椒产品为延长其贮存时间并稳定风味,通常添加适当的盐和防腐剂抑制有害微生物的生长[9-10]。但夏季温度下,糟辣椒品质不稳定,易出现产气胀罐等现象,使风味发生改变。因此,探究30 ℃贮存条件下糟辣椒的产气和风味变化的原因十分必要。
高通量测序(high-throughput sequencing,HTS)作为新一代分子生物学技术,区别于传统培养分离方法,可以快速全面地反映样品微生物群落的组成情况[11],已广泛用于多种发酵食品的微生物多样性、群落结构变化以及功能微生物的研究。母应春等[12]通过高通量技术对贵州3种酒曲的优势细菌和真菌进行分析,揭示了酒曲中微生物组成种类的复杂程度;NIU等[13]也通过此技术对红辣椒酱中细菌群落进行动态分析,发现乳酸菌是腌制辣椒的核心细菌。顶空固相微萃取气相色谱-质谱联用(headspace solid-phase microextraction gas chromatography-mass spectrometry,HS-SPME/GC-MS)也广泛应用于挥发性风味物质的定性和定量分析,例如四川泡菜[14]和铜仁糟辣椒[15]。目前,将高通量技术和GC-MS进行结合,探究特色发酵食品中微生物群落结构与挥发性风味之间的关系是代谢组学的常见方法。母雨等[16]从盘县腐败火腿中发现肠杆菌科微生物是造成腐败的菌群,也是火腿挥发性风味的主要贡献者;XIAO等[17]发现,在传统发酵蔬菜中,乳酸杆菌占很大比例,与20多种风味化合物密切相关。
本研究对正常、微产气、产气胀罐的3种样品进行研究,并将微产气样品置于30 ℃贮存,加速发酵产气,跟踪指标变化;采用高通量测序技术,揭示糟辣椒中微生物群落结构及其多样性变化,并利用HS-SPME/GC-MS对其挥发性风味物质进行检测,通过主成分分析和正交偏最小二乘判别筛选出重要风味物质。最后,通过相关性分析挖掘特征产气微生物,探究微生物与挥发性风味物质之间的潜在相关性,以期为解决夏季糟辣椒产气问题提供参考。
1 材料与方法
1.1 材料与试剂
糟辣椒由贵州省贵三红食品有限公司提供,辣椒品种为遵义线椒。生产工艺流程如下:
新鲜辣椒→清洗→剁碎→添加盐、辅料拌匀→发酵→水洗脱盐(无菌水)→配料装罐→检测→成品
对正常、微产气和产气胀罐样品进行取样,分别标记为ZC、LW、CQ,并将微胀气样品置于30 ℃培养箱发酵加速产气过程,跟踪其指标变化至其破罐,分别在5、12、18 d样品进行取样,标记为L5、L12、L18。上述样品均设置3个生物学重复,在无菌条件下进行取样,并立即置于-80 ℃冰箱贮存待分析。
氢氧化钠,重庆川东化工有限公司;酚酞,成都金山化学试剂有限公司;E.Z.N.A.®soil试剂盒,美国Omega Bio-Tek;2%琼脂糖凝胶,西班牙Biowest;FastPfuDNA聚合酶,中国TransGen;AxyPrep DNA凝胶提取试剂盒,美国Axygen Biosciences;99.5%色谱级环己酮,中国上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
FA1004 N电子分析天平,上海精密科学仪器有限公司;FieldScout SoilStik pH计,美国Spectrum公司;ABI GeneAmp®9700 PCR仪,美国ABI公司;NanoDrop2000超微量分光光度计、Trace1300-TSQ8000 HS-SPEM/GC-MS,美国Thermo Fisher Scientific公司;QuantiFluorTM-ST微型荧光剂,美国Promega公司;Illumina Miseq测序仪,美国Illumina公司;DYY-6C电泳仪,中国北京市六一仪器厂。
1.3 实验方法
1.3.1 产气及理化性质
产气高度测定:瓶口到封口膜顶点的高度;pH测定:参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》处理样品,利用便携式pH计测定;总酸测定:参考GB 12456—2021《食品安全国家标准 食品中总酸的测定》中的酸碱滴定法。
1.3.2 DNA提取和PCR扩增
根据E.Z.N.A.®soil试剂盒说明书提取糟辣椒样品的总DNA,利用NanoDrop2000检测DNA浓度和纯度,1%琼脂糖凝胶电泳检测DNA提取质量。细菌使用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物对16SrRNA基因的V3-V4可变区进行PCR扩增;真菌用ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2(5′-GCTGCGTTCTTCATCGATGC-3′)引物对ITS1-ITS2区进行扩增。扩增程序为:95 ℃预变性3 min,细菌27个循环,真菌35个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。扩增体系为20 μL,4 μL 5×FastPfu缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶;10 ng DNA模板。
1.3.3 高通量测序和生物信息学处理
使用2%琼脂糖凝胶回收PCR产物,采用AxyPrep DNA Gel Extraction Kit对回收产物进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测后,利用QuantusTM荧光仪对回收产物进行检测定量。根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库。利用Illumina公司Miseq PE300平台进行测序。数据处理使用QIIME2 dada2插件对序列进行质量控制、修剪、去噪、拼接、去嵌合体后,形成最终特征序列表格[18]。基于序列数据进行丰度、多样性指数等分析,并对物种注释在各个分类水平上进行群落结构的统计分析。
1.3.4 GC-MS测定挥发性风味物质
参照陈添艳等[19]方法。称取2.5 g样品置于20 mL顶空瓶,加入7.5 mL饱和食盐水和20 μL环己酮(20 μg/mL,以色谱级无水乙醇作为溶剂),用PTFE硅胶隔膜密封。样品在60 ℃下孵育10 min,将50/30 μm(DVB/CAR/PDMS)涂层纤维导入SPME装置,插入顶空瓶并在60 ℃振摇提取40 min以吸附挥发性风味物质。色谱条件:毛细管柱为DB-5MS(30 m×0.25 mm×0.25 μm),氦气(99.999%)为载气,流速为1 mL/min,无分流模式。升温程序:初始温度40 ℃保持5 min,以5 ℃/min升至150 ℃,保持3 min,然后以5 ℃/min上升至240 ℃,保持5 min。质谱条件:电子轰击离子源,电子能量70 eV,离子源温度230 ℃,传输线温度240 ℃,在50~450 amu进行数据采集。
1.3.5 挥发性风味物质的数据处理
定性分析:将实验结果与NIST数据库对比,保留匹配度大于700的化合物。
定量分析:采用内标法对挥发性风味化合物进行定量,计算如公式(1)所示:
(1)
式中:Ci为任一组分的质量分数,μg/kg;Cis为内标的质量分数,μg/kg;Ai为任一组分的色谱峰面积;Ais为内标的色谱峰面积;20为内标物体积,μL;2.5为待测样品质量,g。
1.4 数据处理与分析
所有数据至少测量3次,结果用平均值±标准差表示;Excel 2020用于统计试验数据;IBMSPSS Statistics 26进行单因素方差分析(ANOVA),确定差异显著性(P<0.05);通过SIMCA 160软件进行主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)模型分析;绘图使用Origin 2020bC;R软件进行相关性分析,并用Cytoscape软件可视化。
2 结果与分析
2.1 糟辣椒的产气、pH和总酸变化
对糟辣椒样品进行产气、pH和总酸的测定,结果如表1所示。微产气样品置于30 ℃培养箱加速发酵产气,其产气状况用产气高度进行表征,各阶段均差异显著(P<0.05)。pH和总酸是确定发酵产品质量的重要指标。ZC和CQ样品的pH和总酸存在显著差异(P<0.05),CQ总酸可达(12.42±0.2) g/kg,约为ZC和LW的3倍。ZC与LW的pH并无显著差异(P>0.05),总酸略有升高。随贮存时间延长,LW的pH和总酸呈现先慢后快的变化的趋势,总酸持续上升至(5.29±0.12) g/kg,但与CQ相比还是有显著差异(P<0.05)。大多数发酵食品在贮存期间都会发生pH降低和总酸升高的现象,如剁椒山笋和剁椒姜丝[19-20],最终都会趋于平缓,但30 ℃下,糟辣椒样品的pH和总酸持续变化,没有平缓的趋势,可能导致产品变质。
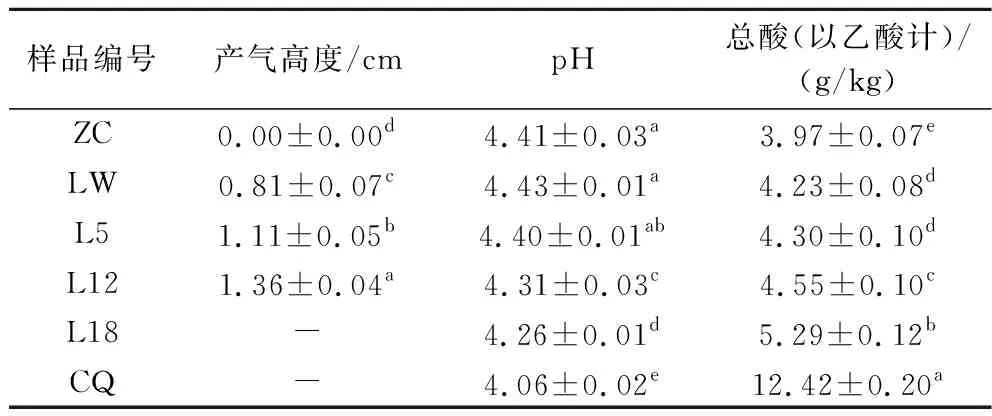
表1糟辣椒的产气、pH和总酸变化Table 1 Changes in gas production, pH and total acidity of fermented peppers
2.2 糟辣椒中微生物的α多样性分析
糟辣椒微生物的α多样性指数如表2所示。Chao1指数反映物种丰富度,指数随着菌群丰富度的升高而增加,Simpson和Shannon指数评估样本的物种多样性,指数越高,表明多样性越复杂[21]。样品产气过程中,细菌的Chao1指数表明其丰富度随时间呈现降低趋势,真菌变化则相对平缓。此外,Simpson指数和Shannon指数表明细菌群落多样性也呈现下降趋势,真菌群落多样性仅有较小波动,说明糟辣椒贮存过程中细菌的多样性变化较真菌更为显著,这与YANG等[22]对6种不同的萝卜泡菜中微生物多样性研究结果一致。综上所述,微生物丰富度和多样性随时间不断降低,且所有阶段细菌丰富度都高于真菌。稀释曲线和香农曲线(附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.034865)趋于平缓代表当前测序数据量足够大,可信度高,可进行后续分析。
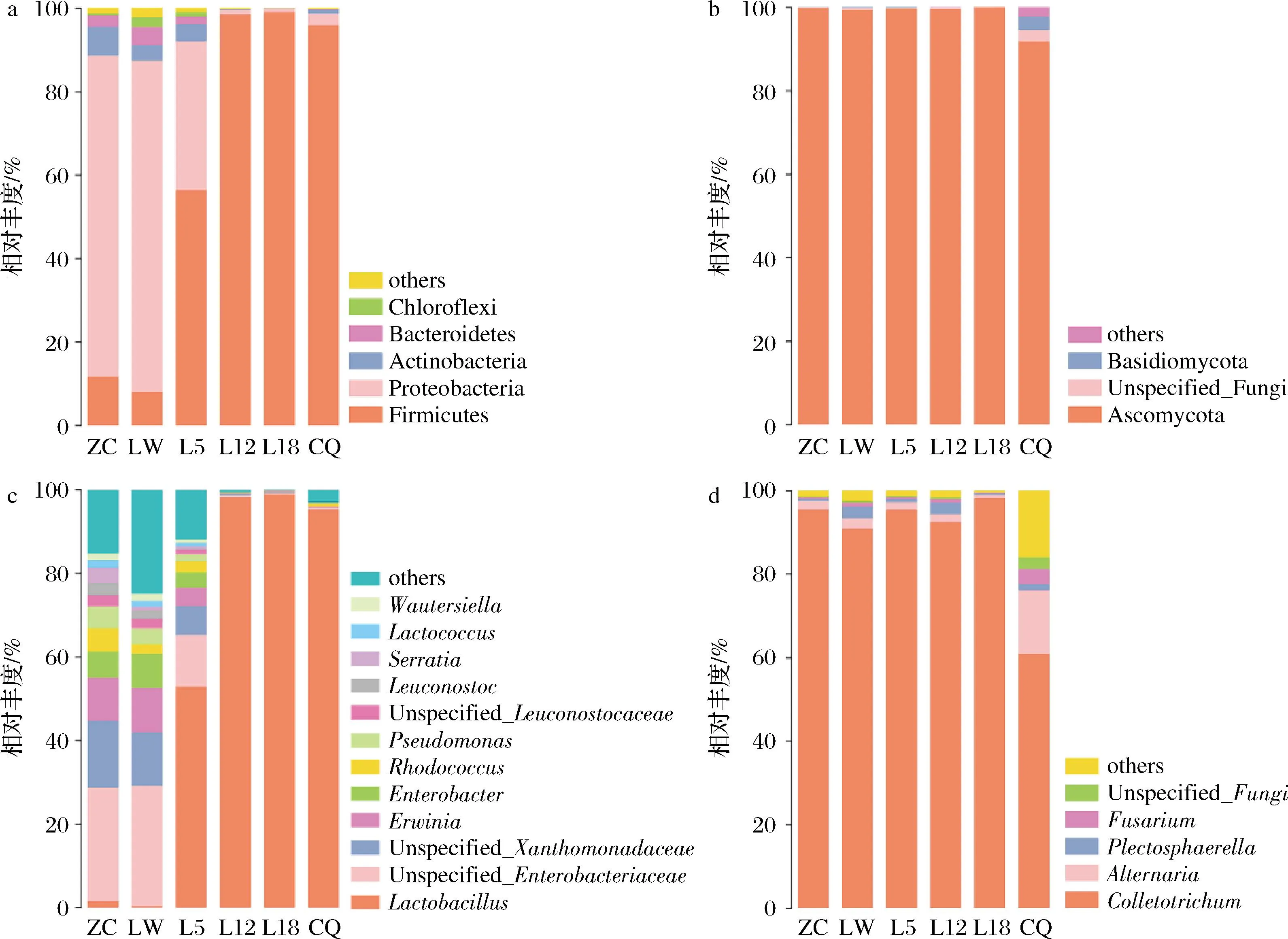
a-细菌门水平;b-真菌门水平;c-细菌属水平;d-真菌属水平图1 糟辣椒中细菌门水平、真菌门水平、细菌属水平、真菌属水平的相对丰度

表2 糟辣椒中微生物α多样性分析Table 2 Analysis of alpha diversity of microorganisms in fermented peppers
2.3 糟辣椒中微生物群落组成变化
图1显示了样品的细菌和真菌群落组成情况,展示相对丰度大于0.01的优势门和属,其余归为others。由图1-a可知,细菌门水平共鉴定出5个细菌门,分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和绿菌门(Chloroflexi)。CHEN等[23]研究表明,厚壁菌门和变形菌门在不同盐度的剁辣椒中均为优势菌。在ZC和LW中变形菌门为优势菌群,分别占总数的77%和79%,而在CQ中优势菌门为厚壁菌门,占总数的96%。微产气样品在30 ℃条件下贮存,产气过程中厚壁菌门逐渐占据优势,L12、L18中占总数的98%和99%。糟辣椒产气过程中优势菌门由变形菌门转变为厚壁菌门。由图1-c可知,共检出12个细菌属,ZC、LW中Unspecified_Enterobacteriaceae和Unspecified_Xanthomonadaceae分别占总数的27%和29%,Unspecified_Xanthomonadaceae和欧文氏菌属(Erwinia)的比例都大于或等于总数的10%,而在CQ中优势菌属为乳酸杆菌,占总数的95%。L5中乳酸杆菌属(Lactobacillus)逐渐占据优势(53%),在L12、L18中分别为98%、99%。糟辣椒等发酵蔬菜体系中,发酵前期以异型发酵菌株如肠膜明串珠菌、短乳杆菌占主导地位,启动发酵;发酵中后期植物乳杆菌等同型发酵菌株占据优势,完成发酵[24]。在其他泡萝卜、泡菜等[25-26]发酵食品中均发现乳酸杆菌属为优势菌株,在剁辣椒中其相对丰度可达45.52%[23]。RHEE等[27]提出韩国泡菜发酵过程中乳酸菌会迅速繁殖并发展成优势菌群,抑制其他微生物的生长。乳酸杆菌属微生物相对丰度过高,在贮存过程中过度产酸,产气,使产品发生酸化和胀罐的情况。例如:乳酸杆菌属的短乳杆菌耐酸能力强,是异型乳酸杆菌,能利用葡萄糖产酸、产气。顾双等[28]对泡菜中的乳酸菌及其产气特性进行研究,发现短乳杆菌具有产气特性。王向阳等[29]对胖袋的真空包装萝卜干中微生物进行分离鉴定,发现短乳杆菌是引起胖袋的原因之一。
由图1-b所示子囊菌门(Ascomycota)是真菌门水平中的优势菌门,在每个样品中都约占总数的99%,Unspecified_Fungi和担子菌门(Basidiomycota)均主要在CQ中出现。图1-d显示真菌属水平共检出5种真菌属,其中优势菌株为刺盘孢属(Colletotrichum),在ZC-L18中均占总数的91%~98%,CQ中链格孢霉属(Alternaria)也有明显升高,占总数的15%。刺盘孢属是十大植物病原真菌类群之一,会引起农林作物的炭疽病及水果采后腐烂,造成严重的经济损失。辣椒炭疽病是辣椒栽培中一种常见的真菌性病害,主要危害果实和叶片,也可侵染茎部[30]。链格孢霉属也是一类可能引起植物发生病变的病原菌,所以,样品中的这类真菌可能是由辣椒原料污染所致。
2.4 糟辣椒挥发性风味化合物变化情况
通过GC-MS对糟辣椒挥发性风味物质及含量进行检测,共检测出39种挥发性风味物质(附表1,https://doi.org/10.13995/j.cnki.11-1802/ts.034865),醇类8种、烷烃类8种、酚类5种、醛类4种、酸类6种、酯类5种、其他类3种。图2分别是挥发性风味物质相对含量、数量、PCA、OPLS-DA和投影变量重要性因子(variable importance factor,VIP)>1的物质聚类分析。由图2-a可知,挥发性风味物质中酸类物质含量为85%以上,L12和L18中可达90%,酸类物质随时间延长逐渐增多,醇类和酚类的相对含量存在减少的趋势。由图2-b可知,ZC中的挥发性风味物质为25种,样品产气过程中风味物质逐渐增多,CQ中增加到29种。主成分结果如图2-c所示,第一主成分(PC1)为48.2%,第二主成分(PC2)为14.7%,总贡献度为62.9%,产气过程中糟辣椒风味差异显著。为了更准确地体现各样品间的差异,采用有监督的OPLS-DA建立代谢物表达量与样本类别之间的关系模型,来实现对样本类别预测分析。如图2-d模型的自变量拟合指数(R2X)为0.927,因变量拟合指数(R2Y)为0.955,模型预测指数(Q2)为0.61,R2和Q2超过0.5表示模型拟合结果可接受[31]。通过VIP发现共有14种重要风味物质(VIP>1)可能反映出产气糟辣椒的风味变化情况,其聚类分析如图2-e所示。
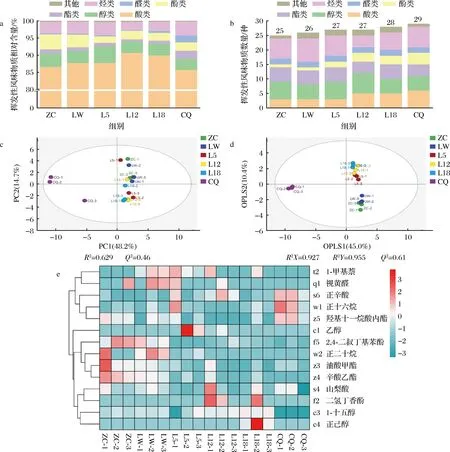
a-挥发性风味物质相对含量;b-数量;c-主成分分析;d-正交偏最小二乘判别分析;e-VIP>1的风味物质聚类分析图2 糟辣椒挥发性风味物质相对含量、数量、主成分分析、正交偏最小二乘判别分析和VIP>1的风味物质聚类分析
由于糟辣椒为开放式自然发酵,不同批次样品的风味不稳定,挥发性风味物质组成存在差异,但物质变化趋势相同,可分为四类。正辛酸、正十六烷、羟基十一烷酸内酯聚为一类,在CQ中含量较高;2,4-二叔丁基苯酚、正十二烷、油酸甲酯、辛酸乙酯聚为一类,含量随产气逐渐降低;1-甲基萘和视黄醛在产气前期含量较高,山梨酸、二氢丁香酚、1-十五醇、正己醇主要集中产气后期。
酸类物质中山梨酸的含量最高,作为一种国际上广泛使用的防腐剂,山梨酸具有较高抗菌性能,能有效抑制霉菌、酵母菌和好氧性细菌的活性,但对厌氧芽孢菌与嗜酸乳杆菌等有益微生物几乎无效[32]。乙酸、反式-2-甲基-2-戊烯酸和正辛酸在贮存过程中含量显著上升(P<0.05),其中乙酸和反式-2-甲基-2-戊烯酸仅在产气的中后期(L12、L18)和CQ中检测到,ZC及产气初期(LW、L5)并未检测到,乙酸等物质的增多会给糟辣椒带来刺激性酸味[33]。除酸类物质,LW及其产气过程中存在的1-甲基萘是一种阈值极低的多环芳烃类化合物,具有“刺鼻、酸味”的气味特征[34]。
醇类和酯类是构成糟辣椒风味的主要物质[15]。本次样品中共检测出8种醇类,其中含量最高的物质是芳樟醇,具有铃兰等花香味[35],XU等[36]发现,芳樟醇是发酵辣椒中关键香味物质之一。ZC中芳樟醇含量为(44.06±1.65) μg/kg而在CQ中含量减少至(36.9±12.16) μg/kg,LW的产气过程也证实芳樟醇含量具有减少的趋势。此外,具有清甜玫瑰花香的苯乙醇含量在LW、L12、L8中逐渐减少,丰富糟辣椒滋味的乙醇含量在此过程中先升高,后减少。酯类化合物大多数都具有水果香味,气味阈值较低。样品中多数酯类物质含量呈现下降趋势,如油酸甲酯、辛酸乙酯和2-甲基丁酸丁酯。2-甲基丁酸丁酯是泡椒中散发花香、果香的酯类之一[37],其含量在ZC中为(5.83±3.32) μg/kg,CQ中为(1.96±0.9) μg/kg,具有菠萝的水果香气的辛酸乙酯[38]在ZC中含量为(1.06±0.21) μg/kg,CQ未检出,2种风味物质含量在LW产气过程中逐渐减少。
糟辣椒中烃类主要有烯烃和饱和烷烃两类,其中饱和烷烃大多数由于脂肪酸烷氧自由基的断裂形成,阈值较高,对整体风味贡献不大,而烯烃类物质阈值较低,会影响整体风味[39]。异松油烯呈现木香味和微微的柑橘甜味,α-萜品烯具有柑橘和柠檬似香气,2-蒈烯有植物香味。酚类物质阈值较低,对糟辣椒风味有较大贡献,RAO等[25]发现2,4-二叔丁基苯酚是四川泡菜中的主要化合物之一,比较各阶段发现,其含量随产气逐渐降低,ZC中含量为(56.29±12) μg/kg,CQ中含量为(22.6±5.2) μg/kg。醛类的主要来源是脂肪酸氧化和氨基酸降解,阈值较低,能带来清香或果香味。ZHONG等[40]发现视黄醛是由蔬菜中的β-胡萝卜素在微生物作用下水解产生的挥发性风味物质。CQ中出现的壬醛具有柑橘香味,2-乙基丁烯醛具有可可香气,在榨菜和莴笋等其他发酵蔬菜制品[14]中发现醛类物质主要来源于原料本身。
2.5 微生物属间及其与重要挥发性风味化合物的相关性分析
探究产气糟辣椒中微生物群落相关性及其与挥发性风味物质之间的潜在相关性可以为两者提供调控指南,改善产品品质。基于Pearson相关性分析对微生物属间和微生物属与VIP>1的14种重要挥发性风味物质进行相关性分析,并使用Cytoscape可视化。由图3-a可知,16个微生物属间共有6个相关性(|r|>0.8,P<0.05),乳酸杆菌属(Lactobacillus)作为优势细菌属与其他细菌存在负相关关系,刺盘孢属(Colletotrichum)也与其他真菌微生物属为负相关关系,细菌属与真菌属间并无相关性。
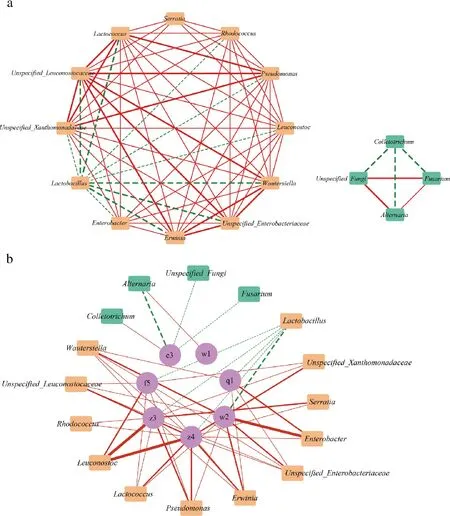
a-微生物属间的相关性分析;b-微生物属和重要挥发性风味物质的相关性分析图3 微生物属间的相关性分析、微生物属和重要挥发性风味物质的相关性分析
微生物属与重要挥发性风味物质之间共51个相关性(|r|>0.8,P<0.05)。如图3-b所示,在微生物与挥发性风味物质之间共有43个正相关(红色实线)和8个负相关(绿色虚线)。12种细菌属和4种真菌属对7种挥发性风味物质的影响较大。YE等[41]在腌制辣椒中也发现,与真菌群落相比,细菌群落与风味的相关性更强。51个相关性关系中,23个都是酯类物质和细菌之间产生的,如明串珠菌属(Leuconostoc)与油酸甲酯和辛酸乙酯存在强正相关性(|r|>0.95),优势细菌属乳酸杆菌属(Lactobacillus)与这2种酯类存在负相关,这表明糟辣椒中细菌群落的变化对酯类物质的影响最大。此外,乳酸杆菌属与挥发性风味物质的5种相关性都属于负相关,这表示在贮藏过程中乳酸杆菌属的生长使大多数风味物质都有减少的趋势。MONTANARI等[42]研究发现,乳酸杆菌通过分解碳水化合物产生乳酸,从而影响碳水化合物向酯类或其他途径的转化。其余3种负相关都发生在正己醇与真菌微生物之间,表明醇类的减少可能是多种真菌共同作用的结果。
3 结论
综上所述,糟辣椒产气过程中总酸显著上升,pH呈下降趋势。优势细菌门由变形菌门转变为厚壁菌门,优势细菌属为乳酸杆菌属;优势真菌门为子囊菌门,优势真菌属为刺盘孢属。贮存过程中乳酸杆菌属微生物迅速繁殖并发展成优势菌群,相对丰度过高,并快速产酸,产气,使产品发生酸化和胀罐的情况。通过HS-SPME/GC-MS检测到39种挥发性风味物质,包括醇类8种、烷烃类8种、酚类5种、醛类4种、酸类6种、酯类5种、其他类3种。贮存前后化合物由25种增加到29种,酸类物质种类增加,酯类物质和醇类物质种类减少,使糟辣椒产生刺鼻的酸味,花香、果香味减弱,对风味的影响较大。Pearson相关性分析发现乳酸杆菌属与其他细菌属为负相关关系,刺盘孢属也与其他真菌微生物属存在负相关关系。微生物属与14种重要挥发性风味物质的相关性中,细菌演替对酯类物质的影响最大,真菌的演替对醇类物质的影响较大;乳酸杆菌属与5种风味物质都呈现负相关关系。此研究为糟辣椒夏季产气胀罐的微生物变化和风味改变提供参考,并可结合产气糟辣椒有害微生物、生物胺等食品安全指标,为后续糟辣椒质量安全控制提供依据。
