国际食品法典委员会抗微生物药耐药性管理研究
2024-02-29肖玉花陈云霞郝海红
肖玉花 黎 畅 陈云霞 李 刚 郝海红,4
(1. 华中农业大学, 农业农村部畜禽产品质量安全风险评估实验室, 武汉 430070; 2. 农业农村部农产品质量安全中心, 北京 100020; 3. 内蒙古自治区农畜产品质量安全中心, 呼和浩特 010013; 4.石河子大学动物科技学院, 新疆石河子 832000)
抗微生物药耐药性 (Antimicrobial resistance,AMR) 指细菌、 真菌、 病毒等微生物对抗微生物药物的耐受性增强, 从而导致治疗失败的能力。AMR 的产生是耐药基因自然选择的结果, 然而农业生产系统中抗微生物药物的误用、 长期低剂量使用甚至是滥用对微生物造成的“选择压力” 则严重加剧了AMR 的产生和蔓延。 据2016 年发布的全球应对耐药感染报告显示[1], 若AMR 问题不能得到解决, 耐药性感染将在未来35 年给全球造成100 亿美元的损失。 由AMR 所引发的食源性疾病是AMR 造成的严重公共卫生问题之一, 耐药微生物可通过农业生产、 食品加工等环节直接或间接暴露于食物链中, 将耐药微生物(抗性基因) 传递给人类, 严重危害食品安全和公共卫生安全[2]。 控制整个食物链环节中的AMR 需要食品行业、 农业和相关工业部门联合采取复杂的综合战略, 如何在食用动物、 作物中正确使用抗微生物药物以及如何遏制和减少食品生产加工过程中出现的耐药微生物已成为各国政府和国际广泛关注与磋商的主题。
国际食品法典委员会 (Codex Alimentarius Commission, CAC) 是联合国粮食及农业组织(Food and Agriculture Organization of the United Nations, FAO) 和世界卫生组织 (World Health Organization, WHO) 于1963 年共同建立的一个制定国际食品标准、 指南和操作规范的政府间组织, 其宗旨是保护消费者健康和确保食品贸易公平[3]。 CAC强调, 需从整个食物链(初级生产到最终消费) 来考虑耐药性问题, 并采取措施预防和控制AMR 引发的食源性疾病。 本文对CAC 食源性AMR 管理机构和策略进行了详细阐述, 重点讨论了CAC 制修订的3 个最新AMR 相关核心法典文本, 旨在追踪国际标准动态, 提升各界对AMR 的认识, 并为我国食源性AMR 管理政策的制定提供参考。
一、 CAC 管控AMR 的机构概况
CAC 现有188 个成员国、 1 个成员组织 (欧盟) 以及235 个法典观察员 (60 个政府间组织、159 个非政府组织、 16 个国际联合组织)。 CAC 下设执行委员会, 由主席、 副主席和另外7 名来自不同区域的委员组成。 附属机构包括综合主题委员会和商品委员会等2 类专业分委会, 6 个FAO/WHO协调委员会以及政府间特设工作组等20 余个标准委员会或工作组, 负责编写标准草案提交至CAC。其中, 食品卫生法典委员会 (Codex Committee on Food Hygiene, CCFH) 与兽药残留食品法典委员会 (Codex Committee on Residues of Veterinary Drugs in Food, CCRVDF) 等考虑了在食用动物(作物) 中使用抗微生物药物以及食品加工环节中存在的耐药微生物对公共卫生的影响, 并从其专业角度出发制定标准, 以规范抗微生物药物的使用和实施良好食品卫生操作规范。 CAC 还设立了政府间抗微生物药耐药性特设工作组 (Ad hoc Codex Intergovernmental Task Force on Antimicrobial Resistance, TFAMR) 以专门应对食源性AMR 问题。此外, 农药残留法典委员会 (Codex Committee on Pesticide Residues, CCPR)、 鱼类及渔业产品食品法典委员会 (Codex Committee on Fish and Fishery Products, CCFFP) 等委员会的工作在一定程度上也有涉及AMR 问题。
(一) CCFH: 设立卫生标准以限制耐药微生物传播CCFH 建立于1864 年, 负责:(1) 起草适用于所有食品的食品卫生基本规定;(2) 审议、 修改(必要时) 并认可由商品委员会拟定且包含在法典商品标准中的卫生规定;(3) 审议、 修改 (必要时) 并认可商品委员会拟定且包含在法典操作规范中的卫生规定;(4) 起草适用于特定的食品或食品组的卫生规定;(5) 审议由CAC 指定的特别卫生问题;(6) 建议在国际层面需要进行微生物危险性评估的优先领域, 并提出需要危险性评估者解决的问题;(7) 审议与食品卫生相关的微生物危险性管理和与FAO、 WHO 危险性评估的相关事项[4]。 针对食物中存在的耐药微生物, CCFH 在FAO/WHO 微生物风险评估联合专家会议 (FAO/WHO Joint Expert Meeting on Microbiological Risk Assessment,JEMRA) 的协助下评估食品中耐药微生物存在的风险, 通过CXC 21-1997 《食品微生物标准制定与实施原则和准则》 指导成员国设定食品中微生物限量标准等指标, 并制定肉类、 乳制品、 新鲜蔬菜水果等食品的卫生操作规范 (见表1), 以尽量减少食品在生产、 加工、 流通及销售环节中的微生物污染, 遏制耐药性的产生和蔓延。
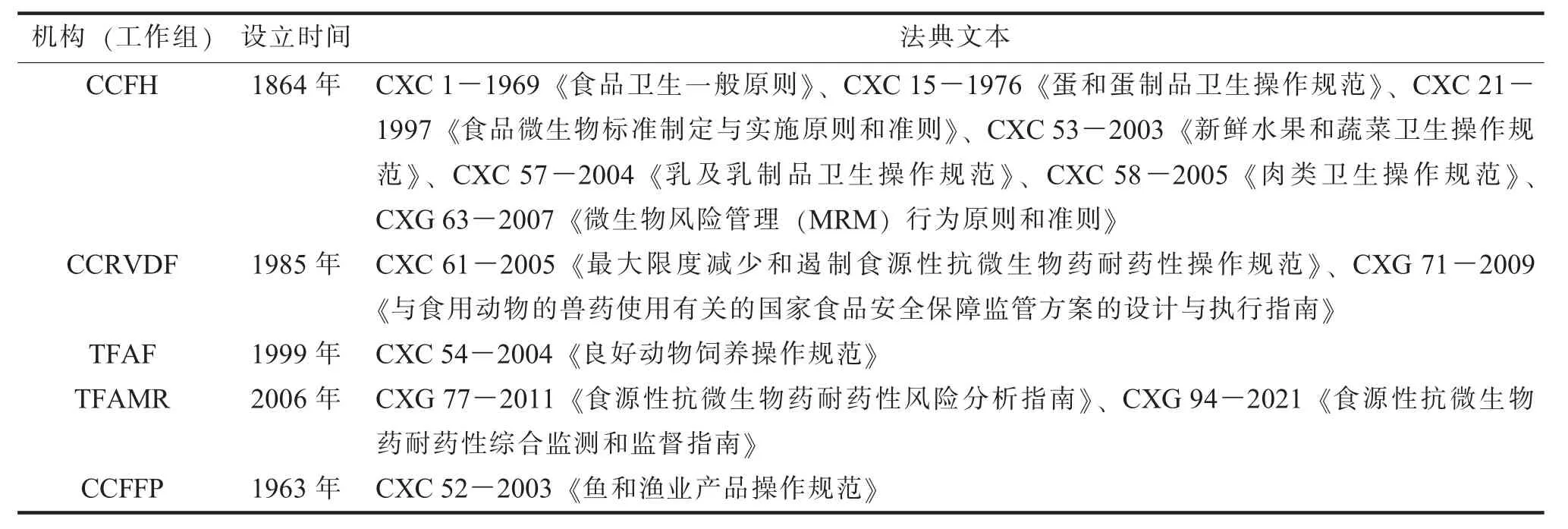
表1 与抗微生物药耐药性相关的部分法典文本
(二) CCRVDF: 限制残留以降低耐药选择压力1985 年, CAC 第16 届大会同意设立CCRVDF以应对国际贸易中日益严重的动物源食品中兽药残留问题, 其职责包括[5]:(1) 确定食品中兽药残留审议重点;(2) 推荐兽药的最大残留限量 (Maximum Residue Limit, MRL);(3) 根据需要制定操作规范;(4) 审议测定兽药残留的采样和分析方法。从历届CCRVDF 会议讨论的残留限量标准所涉及的兽药种类来看, CCRVDF 主要关注抗寄生虫药、抗微生物药物等兽药的残留限量问题[6]。 CCRVDF从兽用抗微生物药物在食用动物中残留所造成的耐药性出发, 由FAO/WHO 食品添加剂联合专家委员会 (Joint FAO/WHO Expert Committee on Food Additives, JECFA) 为其提供风险评估资料, 通过风险评估与风险管理限定兽用抗微生物药物的MRL 以减少耐药性发展的选择压力。 CCRVDF 与世界动物卫生组织 (World Organization for Animal Health, WOAH) 密切协作, 制定了CXC 61-2005 《最大限度减少和遏制食源性抗微生物药耐药性操作规范》(以下简称 “COP 标准”), 以规范食用动物用抗微生物药物的审批、 生产、 销售和流通、 处方开具和使用。
(三) TFAMR: 全链条监测和管控食源性AMR 问题为确保动物源食品的质量与安全,CAC 于1999 年设立了家畜饲养规范政府间特设工作组 (Ad hoc Codex intergovernmental task forces,TFAF), 其制修订的CXC 54-2004 《良好动物饲养操作规范》[7]定义了含药饲料, 并指出在没有公共卫生安全评估的情况下, 不应将抗微生物药物用于促进生长的饲料中。 2006 年, CAC 设立TFAMR,旨在评估食品和饲料 (包括水产品及水产饲料在内) 中含有的耐药微生物以及耐药基因通过食品和饲料的传播对人类健康造成的风险, 并在此基础上制定适当的风险管理建议, 以减少此类风险[8]。2007 年至2011 年间, TFAMR 完成了CXG 77-2011 《食源性抗微生物药耐药性风险分析指南》(以下简称“《指南》”)的制定。 2016 年, 为响应WHO发布的 《抗微生物药耐药性全球行动计划》[9],CAC 重新启动了TFAMR 的工作, 并赋予其更广泛的职权范围以便能够实现在整个食物链上对AMR 问题的协调一致管理。 其职权范围包括[10]:(1) 根据CAC 授权, 审查并酌情修订COP 标准以涵盖整个食物链;(2) 考虑制定AMR 综合监测准则, 同时考虑WHO 抗微生物药耐药性综合监测咨询小组(Advisory Group on Integrated Surveillance of Antimicrobial Resistance, AGISAR) 编制的指南及WOAH 的相关文件。
二、 CAC 制定的AMR 法典文本
法典文本是指按照CAC 制修订流程形成的国际食品标准、 操作规范和准则等, 适用于各类领域、 食品类型和流程, 涉及食品卫生操作、 标签、添加剂、 检验和认证、 营养及兽药和农药残留等方面。 截至2023 年9 月, CAC 共发布235 个标准、85 个准则、 56 个操作规范和1 个食品中兽药MRL风险管理建议[11]。 2007 年至2021 年间, TFAMR制定并修订了法典关于AMR 的3 个核心文本, 即COP 标准、《指南》 和CXG 94-2021 《食源性抗微生物药耐药性综合监测和监督指南》(以下简称“CLIS 标准”)。 这3 个核心文本与WOAH 等其他国际标准制定组织发布的标准共同为全球解决AMR 问题提供重要参考。 其他关于兽医药品及其残留物、 食品卫生、 动物饲料等的法典文本中也有涉及AMR 问题 (见表1), 例如CXC 54-2004《良好动物饲养操作规范》、 CXC 15-1976 《蛋和蛋制品卫生操作规范》 和CXC 52-2003 《鱼和渔业产品操作规范》 等。
(一) COP 标准COP 标准充分参考了WOAH《抗微生物药耐药性和审慎使用指南》 及其他相关文件, 于2005 年被CAC 采纳。 2021 年, 在 “同一健康” 方针指导下由TFAMR 完成了对COP 标准的修订, 使得该标准涉及整个食物链环节(包括食品初级生产、 加工、 贮藏、 运输以及批发和零售流通环节) 中的抗微生物药物使用问题。 COP 标准旨在为制定食源性AMR 风险管理措施提供框架, 以便最大限度预防、 降低和遏制食源性AMR对人类健康造成的风险[12]。 COP 标准的主要内容包括: 简介, 适用范围, 定义, 减少和遏制AMR 的一般原则, 负责任和谨慎使用抗微生物药物, 食品生产、 加工、 贮藏、 运输以及批发和零售流通环节规范, 消费者行为和消费者宣传等7 部分。
COP 标准主要侧重于农场层面初级生产环节中抗微生物药物的使用, 明确了在食用动物中批准上市、 生产、 批发和零售、 开具处方以及使用抗微生物药物的相关部门和人员的具体责任。 (1) 主管部门: 应从立法层面确保批准上市的抗微生物药物的质量、 药效、 标签信息完整和回收处理途径, 并对其进行耐药性风险评估, 严厉打击药物流通、 授权使用和广告监管环节的非法行为; 应贯彻“同一健康” 方针, 实施国家战略行动计划, 积极与动物、 植物和公共卫生领域专业人员合作, 鼓励研发和空白领域研究并进行专题培训和宣传, 以促进抗微生物药物的负责任和谨慎使用; 应建立食源性AMR 和抗微生物药物使用监测和监控制度, 以及兽用抗微生物药物的疑似不良反应警戒计划, 为综合战略的制定提供数据来源。 (2) 生产商和上市许可持有人: 应向国家主管部门提供确定抗微生物药物质量、 安全性和有效性所需的所有信息, 且保障信息的质量; 应仅通过官方经销系统上市和出口官方授权的抗微生物药物, 并有责任提供上市数量、用途、 目标动物以及注册所需数据等信息供主管部门研究使用; 应按照谨慎使用原则和国家规定发布广告, 并为主管部门耐药性主题培训提供支持。(3)经销商: 应仅凭处方或授权人员指示经销抗微生物药物, 适当标准说明经销产品; 应留存所供应的所有抗微生物药物的记录, 并应酌情为食源性AMR和负责任使用抗微生物药物的培训提供支持。 (4)兽医和植物(作物) 健康专业人员: 应与主管部门合作, 发现新发和复发性疾病并制定预防、 控制和治疗传染病的对策; 应确保仅在必要时以适当的方式开具处方, 超出适应症范围用药应遵循国家法律规定; 应酌情协助主管部门开展监测、 监控计划和培训。 (5) 食用动物和植物(作物) 生产者: 应在专业人员协助下实施健康计划, 完善饲养卫生管理和废弃物管理, 以预防、 应对疾病暴发和耐药性的传播, 并仅在必要时按照批准用途负责任和谨慎使用抗微生物药物; 应适当留存抗微生物药物的使用记录和微生物诊断、 药敏试验记录, 必要时提供给专业人员以优化用药; 应酌情协助相关部门开展监测、 监控计划以及参与培训。
COP 标准指出食物链后续环节应参照 《微生物风险管理(MRM)行为原则和准则》《食品卫生总则》 和WHO 《食品安全五大要点》 等原则和良好卫生规范, 以减少微生物的引入、 携带、 生长及食源性AMR 的传播。 此外, COP 标准还从消费者层面入手, 鼓励食物链各环节利益相关方对消费者进行宣传教育, 以提高消费者对食源性AMR 的认识。
(二) 《指南》风险分析是当前国际社会普遍应用的食品安全宏观管理模式, 也是进行食品安全宏观管理的有效工具[13]。 2011 年, CAC 首次发布《指南》, 2021 年修订版本融合了COP 标准和CLIS标准, 从“同一健康” 的角度出发解决全球耐药性威胁, 这标志着CAC 对食源性AMR 的风险分析迈出了重要一步[14]。《指南》 旨在评估耐药微生物与耐药性决定簇在食品和饲料(包括水产品及水产饲料) 中的存在水平, 并评估通过食品和饲料传播对人类健康造成的风险, 从而提出适当的风险管理措施以降低此类风险[15]。
《指南》 界定了食源性AMR 风险分析的一般原则和基本框架, 并按照食源性AMR 风险分析程序的时间顺序, 描述了食源性AMR 初步风险管理措施、 食源性AMR 风险评估、 食源性AMR 风险管理等3 方面内容。 此外,《指南》 还提出建立“监测抗微生物药物的使用及AMR 微生物和决定簇计划” 以及“食源性AMR 风险交流机制” 作为贯穿风险分析全过程的重要工具。
食源性AMR 风险分析框架[16](见图1) 旨在帮助风险管理人员识别关键决策点, 并将各风险分析环节相互关联。《指南》 中描述的风险分析环节包括:(1) 风险管理前期活动的步骤及顺序;(2) 风险评估的步骤;(3) 识别、 评价、 选择、 实施、 监测和审核风险管理备选方案的程序;(4) 贯穿整个风险分析程序的工作, 包括风险交流、 抗微生物药物使用和AMR 监测。
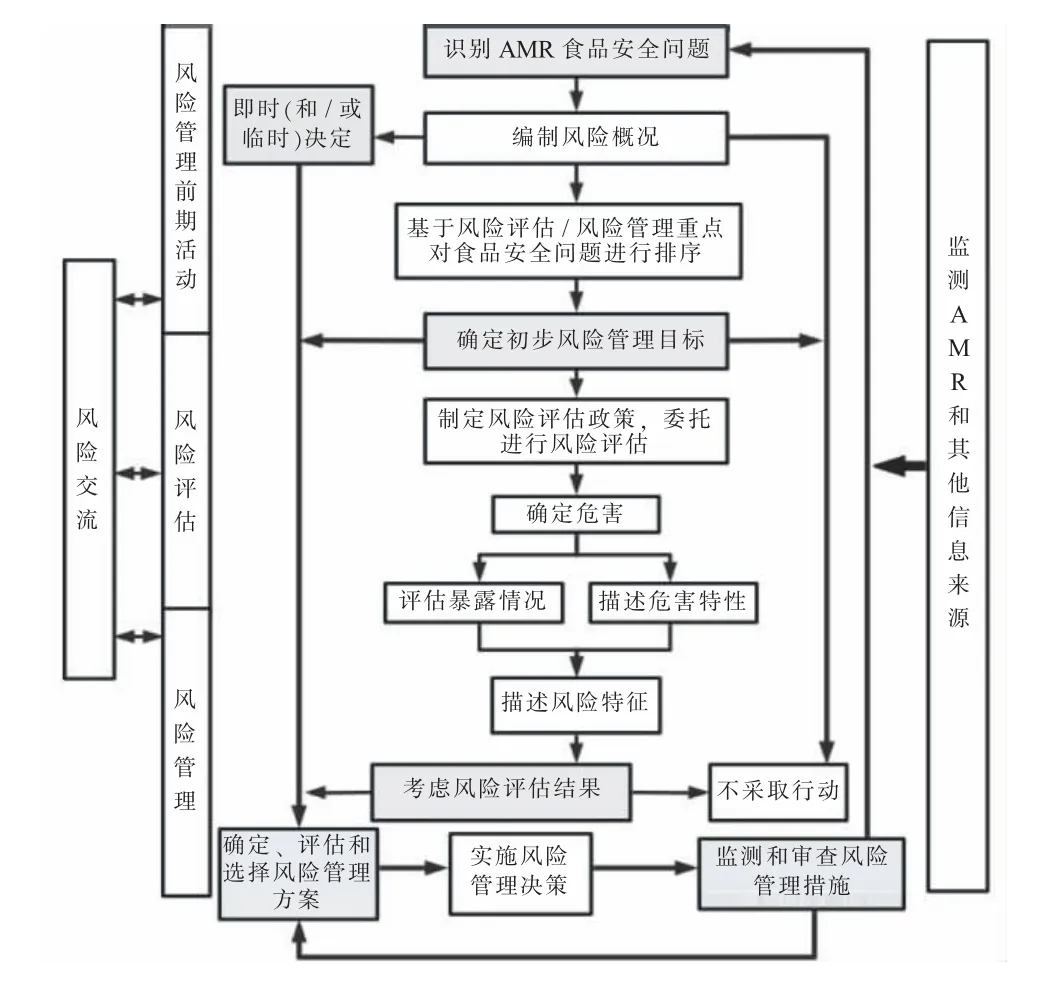
图1 食源性AMR 风险分析框架
食源性AMR 前期风险管理活动是风险管理者启动风险管理程序的初始步骤, 通过识别AMR 食品安全问题、 编制食源性AMR 风险概况、 基于风险评估/ 风险管理重点对食品安全问题进行排序等程序, 来评价食品安全问题的范畴和严重性。 之后, 风险管理者在前期工作的基础上确定初步风险管理目标和制定风险评估政策。 最后, 由风险管理人员委托进行食源性AMR 风险评估。
Codex Risk Analysis System (Codex 系统) 提供的风险评估方法用于识别和评估人类通过食物链接触到的AMR 微生物一系列问题 (频率、 数量等问题), 并用于描述人类接触微生物而导致不良健康影响的大小和严重程度。《指南》 指出, 风险评估者首先应在评估开始前考虑风险概况、 风险评估过程中的有关信息和风险评估政策, 要进行初步调查以确定和部署需要在AMR 风险评估框架内进行的工作。 《指南》 介绍了食源性AMR 风险评估过程的4 个构成部分, 并说明了风险评估过程中可能依靠的各种数据信息来源。 构成部分具体包括 (1) 危害识别: 目的是描述相关食源性AMR 的危害。 (2)暴露评估: 用于估计食源性AMR 危害的暴露水平。 (3) 危害特性确定: 考虑危害、 组成食品的原料和成分以及宿主的特征, 以确定危害暴露后人类患病的可能性。 (4) 风险特性确定: 考虑危害识别、暴露评估和危害特性确定的结果以估计实际风险。
《指南》 风险管理部分就如何管理与非人类使用抗微生物药物相关的食源性AMR 微生物风险向风险管理人员提出建议, 要求在食品从农场到餐桌的全过程全面实施相关食品法典操作规范。 同时,《指南》 鼓励使用国际标准化检测方法和统一解释标准建立抗微生物药物使用与抗微生物药物耐药微生物及决定簇的监测计划, 以便收集数据信息用于科学研究、 风险分析、 风险评估, 以及衡量干预措施的效果并确定耐药性趋势。《指南》 还强调了风险交流的重要性, 建议尽早建立机制促进各利益相关方的沟通, 并整合到风险分析的全过程中。
(三) CLIS 标准CLIS 标准于2021 年正式通过, 提供了食物链各环节和食品生产环境中的食源性AMR 和抗微生物药物使用的综合监测和监督计划的基本框架, 以耐药性风险分析为基础的同时为耐药性风险评估提供了数据来源。 其目的在于协助各国政府设计和实施食源性AMR 综合监测和监督计划, 同时考虑到各国国情的差异, 为综合监测和监督计划的设计、 实施和拓展提供了灵活选择。CLIS 标准介绍了设计、 实施及持续改进综合监测和监督计划的初步规划, 包括依据各国国情开展试点研究和测试、 确立监测和监督目标、 确定监测和监督的优先次序以及考虑实现目标所需的基础设施、 技术能力和资源等。
根据CLIS 标准, 食源性AMR 综合监测和监督计划应在初步规划的基础上确定最初范围和设计, 计划框架应包含采样设计、 采样计划、 样本来源、 目标微生物和耐药性决定簇、 待测试的抗微生物药物、 实验室测试方法和质量保证体系、 耐药性数据的收集和报告。 随着计划的发展可依据监测和监督结果、 现有耐药微生物流行病学情况、 风险分析和风险评估结果以及对计划的评估等一个或多个因素调整计划的设计和范围。 用于食品动物或植物(作物) 的抗微生物药物使用综合监测和监督计划应包括: 数据来源、 食用动物抗微生物药物使用数据的收集和报告。 同时, CLIS 标准详细阐述了以上两个计划各组成部分的具体内容、 考虑因素、 注意事项和参考标准等, 各国可根据实际情况制定符合本国国情的综合监测和监督计划。
对于食源性AMR 和抗微生物药物使用综合监测和监督结果的综合分析和报告, CLIS 标准建议各国制定数据管理政策对综合数据进行集中或协调管理, 如建立数据库、 保密制度和验证机制等。 结果的分析可按照《指南》 所述的方法进行, 鼓励定期报告结果并公开发布, 以实现不同区域数据的沟通。 CLIS 标准指出, 对综合监测和监督计划的评估可确保报告数据和信息的可靠性, 此外还可以指导以最优的方式收集可靠数据。 此外, CLIS 标准提及了培训和能力建设的重要性, 主管部门应当予以支持。
三、 CAC 支持AMR 法典文本实施的举措
2021 年7 月, FAO 启动了 “支持实施抗微生物药耐药性相关法典文本的行动”(Action to support implementation of Codex AMR Texts, ACT), 对CAC 来说这是第一个直接支持各国执行法典文本的项目。 该项目计划于2021 年至2026 年间在全球和地方层面开展工作, 以支持食源性AMR 相关法典文本的实施, 有效遏制和减少食源性AMR[16]。在全球层面, ACT 项目支持开发使用法典文本的工具和技术, 并为数据收集、 分析和使用提供支持, 为食源性AMR 的风险管理提供数据信息。 在地方层面, ACT 项目与各国合作, 从亚洲和南美洲的6 个重点国家 (玻利维亚、 柬埔寨、 哥伦比亚、 蒙古国、 尼泊尔和巴基斯坦) 开始, 评估其遏制食源性AMR 的优先事项和需求, 支持各国实施食源性AMR 和抗微生物药物使用的综合监测和监督计划及AMR 风险管理措施。 预计通过该项目实现3 个目标:(1) 提高各国对食源性AMR 和AMR相关法典文本的认识;(2) 为数据收集和分析提供支持, 协助各国实施食源性AMR 及抗微生物药物使用综合监测和监督计划;(3) 协助各国评估食源性AMR 管理优先事项, 建立监管框架, 加强各国控制食源性AMR 产生和蔓延的能力。
2023 年9 月召开的第三届全球食源性AMR 会议[17]报告了ACT项目进度: FAO 已完成InFARM( The International FAO Antimicrobial Resistance Monitoring) 信息技术平台的开发, 计划与重点国家合作试点测试InFARM 系统, 此后将进行全球推广和拓展, 以支持各国建立或加强其国家粮食和农业AMR 监测系统; 同时, CAC 积极参与世界粮食安全日和世界抗微生物药耐药性宣传周的宣传活动, 出版了ACT 项目宣传小册子[18]和食源性AMR法典文本概要[19]; 参与该项目的6 个重点国家已完成了政策及优先事项评估, 正积极建立食源性AMR 监管框架。
四、 总结与展望
综上所述, 针对食源性AMR 问题, CAC 早期主要就食品卫生及微生物污染和兽药的使用两方面开展工作, 相关法典文本的制定主要是通过CCFH、 CCRVDF 和TFAF 的活动。 随着耐药性问题日益突出, CAC 成立专门应对食源性AMR 问题的TFAMR, 并在 “同一健康” 理念指导下先后完成了3 个AMR 相关核心法典文本的制修订, 即《指南》、 COP 标准和CLIS 标准。 ACT 项目则是CAC 第一个直接为各国提供援助以执行法典文本的项目。 在法典文本制定过程中, FAO、 WHO 与WOAH 组成的三方联盟就动物源食品安全问题加强交流, 以减少标准制定工作中的差距和重复, 确保了食源性AMR 相关法典文本的普适性与科学性。 2022 年, 联合国环境规划署 (United Nations Environment Programme, UNEP) 加入三方联盟,形成了人类、 动植物和生态系统健康协调四方联盟, 发布 “同一健康联合行动计划 (2022-2026年)”, 确保抗微生物药物的审慎使用, 促进AMR的全球治理。 上述提到的AMR 相关核心法典文本也存在不足, TAYLOR 等[20]指出, 不同区域抗微生物药物使用政策产生的AMR 风险差异可能影响国际贸易, 这种区域风险差异必须通过风险评估来衡量, 但《指南》 中提供的风险分析框架缺乏评估和比较不同区域抗微生物药物使用政策差异所造成的AMR 风险的灵活性。
CAC 制修订的食源性AMR 相关法典文本在一定程度上为努力遏制AMR 风险的国家提供了指导, 但鉴于AMR 问题的重要性及对食品安全的严重危害性, 建议CAC 联合各部门和组织提升CLIS标准和《指南》 的灵活性与适用性, 并对已有数据进行分析总结, 纳入更多的经验性评估方法进行风险评估, 以便实现各区域因政策不同所造成的AMR 风险差异的比较; 依据风险分析经验对食物链环节中AMR 问题突出的 “抗微生物药物或耐药微生物或商品组合” 进行耐药性风险评估, 必要时可制定国际标准以应对这些风险。
目前, 我国已初步建立食源性AMR 监测和管理体系, 但基于“同一健康” 方法建立贯穿整个食物链生产环节的AMR 综合监测和监督体系、 风险评估系统、 数据共享平台等还需进一步努力。 CAC处理AMR 问题的国际经验对我国食源性AMR 管理具有重要参考价值, 应将法典文本与我国国情结合研究, 在对我国耐药性管理优先事项评估的基础上, 积极探索建立跨部门、 多学科共同参与的食源性AMR 风险分析、 综合监测和监督合作平台和工作机制。
