hsa-miR-181a-5p靶基因预测及生物信息学分析
2024-02-29王艳阳张隆泽余丽梅何志旭
王艳阳,刘 婵,周 雪,张隆泽,余丽梅,何志旭,4
(1.遵义医科大学附属医院 贵州省细胞工程重点实验室,贵州 遵义 563099;2.遵义医科大学组织损伤修复与再生医学省部共建协同创新中心,贵州 遵义 563099;3.遵义医科大学 基础医学院免疫学教研室,贵州 遵义 563099;4.贵州省儿童医院,遵义医科大学附属医院 小儿内科,贵州 遵义 563099)
miRNA是一类非编码RNA,是一种内源性、高度进化保守的单链RNA,可作为基因表达的调节因子来发挥关键作用[1]。1993年,Lee等[2]在对秀丽隐杆线虫的研究中,第1次报道了miRNA。迄今为止,已鉴定出超过2 000种miRNA,miRNA在大多数生物过程的调节中发挥关键作用,其中包括细胞分化、增殖以及细胞周期调节和代谢[3],miRNA现被用于多种临床诊断标志以及疾病治疗靶点[4]。超过60%的人类蛋白质编码基因在其3' 非翻译区含有miRNA靶位点[5],miRNA在转录和翻译水平上调控目的基因的表达,可以通过与启动子区域中的反向互补序列结合来调节靶基因的转录,核miRNA通过转录基因激活(TGA)和转录基因沉默(TGS)来发挥作用[6],成熟的miRNA被加载到RNA诱导的沉默复合体中,引导复合体靶向mRNA,导致翻译抑制和靶向mRNA降解[4]。每个miRNA可调控数个靶基因,而同一个靶基因也可以被多个miRNA调控[6],因此miRNA对靶基因表达的调控作用在人类组学中具有庞大而复杂的系统,近年来许多科学研究已经在特定的miRNA改变和疾病之间建立、验证了它们之间的联系,miRNA已经逐渐成为国内外学者研究的重点。
miR-181a可通过参与细胞的增殖、凋亡和分化调节各种各样的生物过程,包括T细胞分化的调控[7],血小板活化的调节[8],精子的形成[9],也可以作为癌基因或肿瘤抑制因子参与各种癌症的发病机制[10]等,这些研究结果提示miR-181a在多种生物学过程中发生作用,因此对其功能的深入探索尤为重要。
本研究根据现有生物信息学分析系统对hsa-miR-181a-5p进行了全面的分析[11],首先对hsa-miR-181a-5p的染色体基因定位及miR-181a-5p的物种保守性进行分析,根据其结果验证其是否有重要生物学功能。在这些基础上,对hsa-miR-181a-5p在人类各组织以及不同疾病发生中的表达丰度进行分析,为进一步对现有实验所验证结论进行整理概述提供充分的理论支持,最后对其靶基因进行预测并对其靶基因进行GO功能分析、KEGG信号转导通路富集分析以及靶基因之间蛋白质相互作用,并在细胞水平验证靶基因及其富集通路,为预测结果提供理论支撑,同时在讨论部分结合现有实验研究进一步相互佐证,为hsa-miR-181a-5p在生物学过程中所起到的的调控机制提供理论支持。
1 材料与方法
1.1 hsa-miR-181a-5p的基因组信息和物种序列保守性的预测分析 使用在线数据库UCSC(http://genomea-sia.ucsc.ed)检索hsa-miR-181a-5p的基因组信息;采用miRBase(https://www.mir-base.org/)在线数据库下载物种成熟序列并对hsa-miR-181a-5p的成熟序列进行物种保守性分析。
1.2 hsa-miR-181a-5p在人类各组织以及不同疾病中的表达水平分析 采用miGator v3.0 数据库(http://mirgator.obic.re.kr/)对hsa-miR-181a-5p进行分析,检索hsa-miR-181a-5p在人类不同的组织器官中、不同疾病发生过程的表达水平。
1.3 hsa-miR-181a-5p的靶基因预测 采用miRWALK( http://mirwalk.umm.uniheidelberg.de/)、miRDB(http: //www.mirdb.org/)和Target Scan(http://www.target-scan.org/vert71/)靶基因数据库分析预测hsa-miR-181a-5p的靶基因,预测结果用Venny2.1.0 ( https://bioinfogp.cnb.csic.es/to-ols/venny/ )绘制韦恩图,取其交集靶基因用于后续分析。
1.4 hsa-miR-181a-5p预测靶基因的GO和KEGG富集通路 将交集靶基因使用SangerBox数据库(http://sangerbox.com/home.html)进行GO功能注释分析和KEGG信号通路富集分析。将483个交集基因作为目的基因输入,GO功能注释包括细胞组分(CC)、分子功能(MF)、生物功能(BP)3大应用部分;对靶基因进行KEGG富集分析,找出差异显著的信号转导通路,P<0.05为差异具有统计学意义。
1.5 hsa-miR-181a-5p靶基因编码蛋白质之间相互作用分析 将交集靶基因数据集导入String 11.0 数据库(http://www.string-db.org),选择显示选项为hide disconnected nodes in the network,交互分数为highest confidence,构建靶基因编码的蛋白间相互作用网络图。
1.6 主要仪器及试剂 逆转录仪型号为东胜龙ETC-811,基因扩增PCR仪、荧光定量PCR仪型号为美国伯乐bio-rad cfx96实时荧光定量PCR仪;miR-181a-5p agomir、agomir NC及antagomir、antagomir NC购于上海吉玛基因;Trizol购于Takara有限公司;Gibco F12/DMEM细胞培养基、Gibco胎牛血清以及LIPO 2000(L7800)购于thermo赛默飞有限公司;miRNA 第一链 cDNA 合成 (加尾法)、miRNA 荧光定量 PCR 试剂盒 (染料法)购于上海生工生物有限公司;A549细胞(肺癌人类肺泡基底上皮细胞)购于中国科学院昆明细胞库。
1.7 细胞转染 实验共有5组:A549细胞空白组,miR-181a-5p agomir A549细胞组,miR-181a-5p antagomir A549细胞组。分别按照说明书将50 nmol/L miR-181a-5p agomir、agomir NC,100 nmol/L miR-181a-5p antagomir、miR-181a-5p antagomir NC(序列见表1)转染入A549细胞中,转染48 h后检测miR-181a-5p在不同组细胞中的相对表达量, 转染步骤按照试剂说明书严格进行,细胞在37 ℃细胞培养箱中孵育。

表1 转染RNAoligo序列及RT-qPCR 引物序列
1.8 转染效率验证 提取细胞总RNA后,转染效率采用miRNA第一链cDNA合成(加尾法)及miRNA荧光定量PCR试剂盒(染料法)进行验证,逆转录体系及反应条件严格按照说明书进行,将得到的cDNA反应液稀释50倍后点板。miRNA扩增反应体系以及miRNA扩增条件严格按照说明书进行,引物根据上海和元公司提供的引物序列由上海生工生物有限公司合成(表1),内参使用U6,结果采用2-ΔΔCt的方法来统计miRNA的相对表达水平。
1.9 转录组测序 将A549细胞空白组、miR-181a-5p agomir A549细胞组、miR-181a-5p antagomir A549细胞组进行转录组测序,按照武汉华大基因技术服务有限公司高通量实验室所提供的标准步骤执行,使用BGISEQ平台检测对比基因集,测序长度为PE150。参考物种名为HOMO_SAPIENS,来源为NCBI,参考基因组版本为GCF_000001405.39_GRCH38.P13。测序得到的RAW DATA使用SOAPNUKE (V1.5.6)进行过滤,得到CLEAN DATA。后续使用Dr. Tom多组学数据挖掘系统(https://biosys.bgi.com)进行数据分析、绘图及挖掘。TPM是根据测序深度归一化后的表达量度量,根据 kegg_pathway 注释分类,使用 R 软件中的 phyper 函数进行富集分析,计算 Pvalue,然后对 Pvalue 进行 FDR 校正得到 Qvalue。在系统中筛选反映差异倍数,log2(处理组表达量 / 对照组表达量),大于0表示相对于对照组,处理组基因表达量上调,小于0表示下调。计算用的表达量一般是归一化后的 read counts。以上下1.5倍差距为标准,筛选log2(处理组表达量 / 对照组表达量)差异表达的转录组基因后进一步进行KEGG通路富集。结合前期预测以及现有文献,选择通路,筛选基因集做热图分析,标准化方法为:z-score (row direction)。

2 结果
2.1 hsa-miR-181a-5p的基因定位及成熟序列的保守性分析 检索UCSC数据库发现 hsa-miR-181a-5p基因定位于人类基因组chr1:198859109-198859130,chr9:124692481-124692502之间(图1)。对miR-181a-5p成熟序列进行分析,结果显示miR-181a-5p的成熟序列在物种间基本一致,该序列在36种物种进化过程中具有高度保守性(表2)。
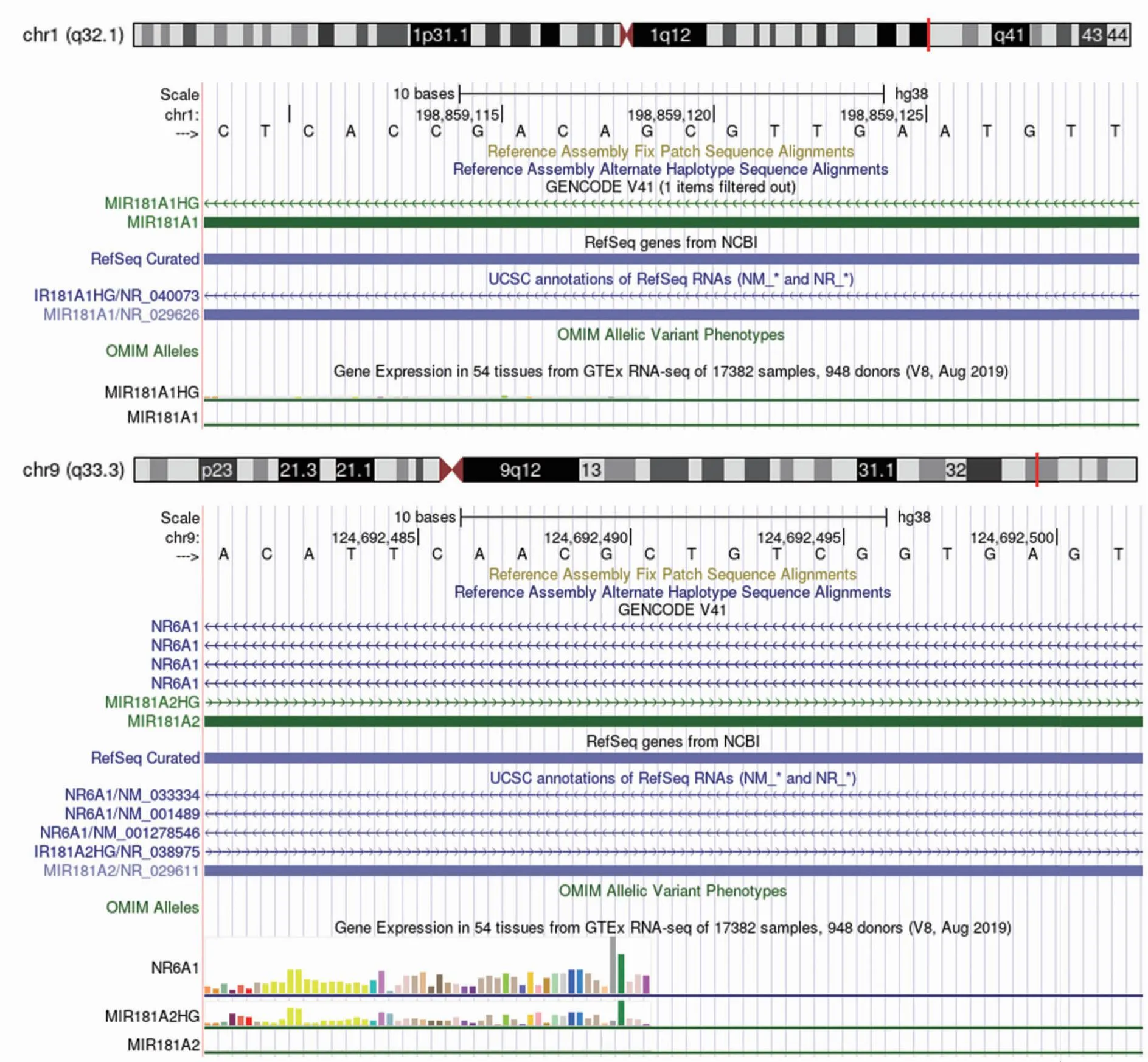
图1 hsa-miR-181a-5p在人类基因组chr1、chr9的定位

表2 不同物种中 miR-181a-5p 的成熟序列
2.2 hsa-miR-181a-5p在人体各器官及不同疾病中的表达分析 通过定位人类1号染色体的miR-181a-5p,图2结果结果显示,其分布器官的优先排名为中枢神经系统、扁桃体、淋巴细胞、肺部、乳房;图3结果显示位于人类9号染色体的hsa-miR-181a-5p的优先排名为中枢神经系统、扁桃体、淋巴细胞、乳房、色素细胞。通过分析hsa-miR-181a-5p在不同疾病发生的表达情况,图4结果显示,位于1号染色体的hsa-miR-181a-5p在急性髓系白血病的表达丰度最高,其次是卵巢浆液性癌以及前列腺癌等生殖系统癌症,乳腺浸润性导管癌等乳腺癌,以及多种白血病与淋巴瘤等血液系统疾病;图5结果显示位于9号染色体的hsa-miR-181a-5p在鼻咽癌、银屑病的表达丰度排在前列,同时也在多种乳腺癌以及多种血液系统疾病中丰度呈现显著增加。
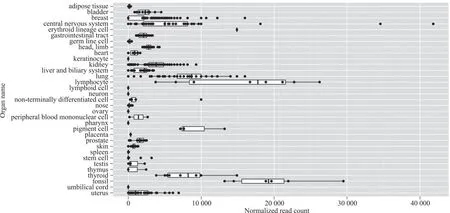
图2 位于人类1号染色体的hsa-miR-181a-5p在人各个组织器官中的表达情况
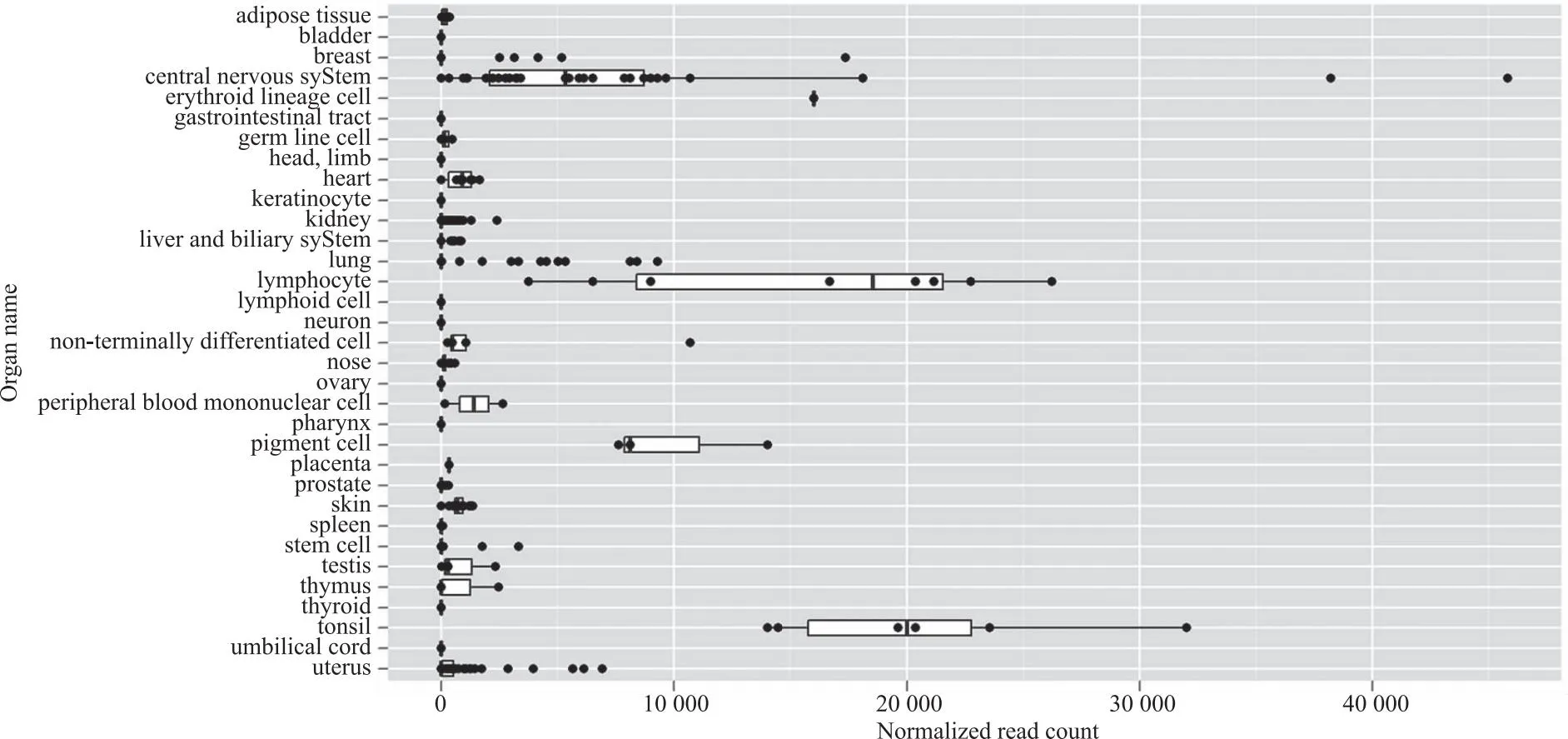
图3 位于人类9号染色体的hsa-miR-181a-5p在人各个组织器官中的表达情况
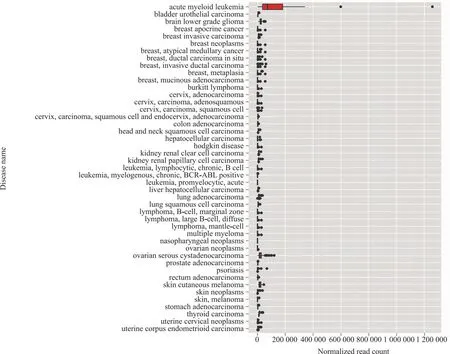
图4 位于人类1号染色体的hsa-miR-181a-5p在不同疾病中的表达丰度

图5 位于人类9号染色体的hsa-miR-181a-5p在不同疾病中的表达丰度
2.3 hsa-miR-181a-5p的靶基因预测结果 miRWALK预测靶基因为8 112个,miRDB预测靶基因为1 408个,Target Scan预测靶基因为1 371个,交集靶基因有483个用于后续分析(图6)。
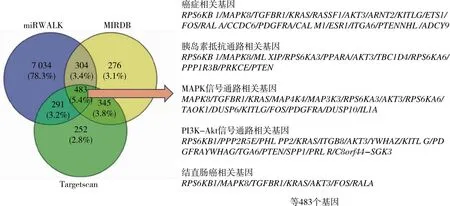
图6 MIRDB、miWALK 、TargetScan 数据库预测hsa-miR-181a-5p的靶基因韦恩图
2.4 hsa-miR-181a-5p预测靶基因的 GO功能分析 对3个数据库交集靶基因进行GO功能分析,结果显示hsa-miR-181a-5p的交集靶基因参与多种细胞组分,排名前十的有胞浆、细胞质、细胞核、核质、质膜、细胞膜、染色质、高尔基体、粘着斑、大分子复合物;hsa-miR-181a-5p的交集靶基因执行多种分子功能,排名前十的包括蛋白质结合、金属离子结合、RNA结合、异丙肾上腺素结合、DNA结合、RNA 聚合酶Ⅱ核心启动子近端区域序列特异性 DNA 结合、RNA聚合酶Ⅱ转录因子活性、序列特异性DNA结合、蛋白质结合、锌离子结合、转录因子活性,序列特异性DNA结合;hsa-miR-181a-5p的交集靶基因参与多种生物学过程,排名前十的包括RNA聚合酶Ⅱ启动子转录的调控、RNA聚合酶Ⅱ启动子转录正调控、信号转导、RNA聚合酶Ⅱ启动子转录的负调控、转录调节、DNA模板化、转录正性调控、DNA 模板化、细胞内信号转导、蛋白质磷酸化、细胞粘附、神经系统发育(图7)。
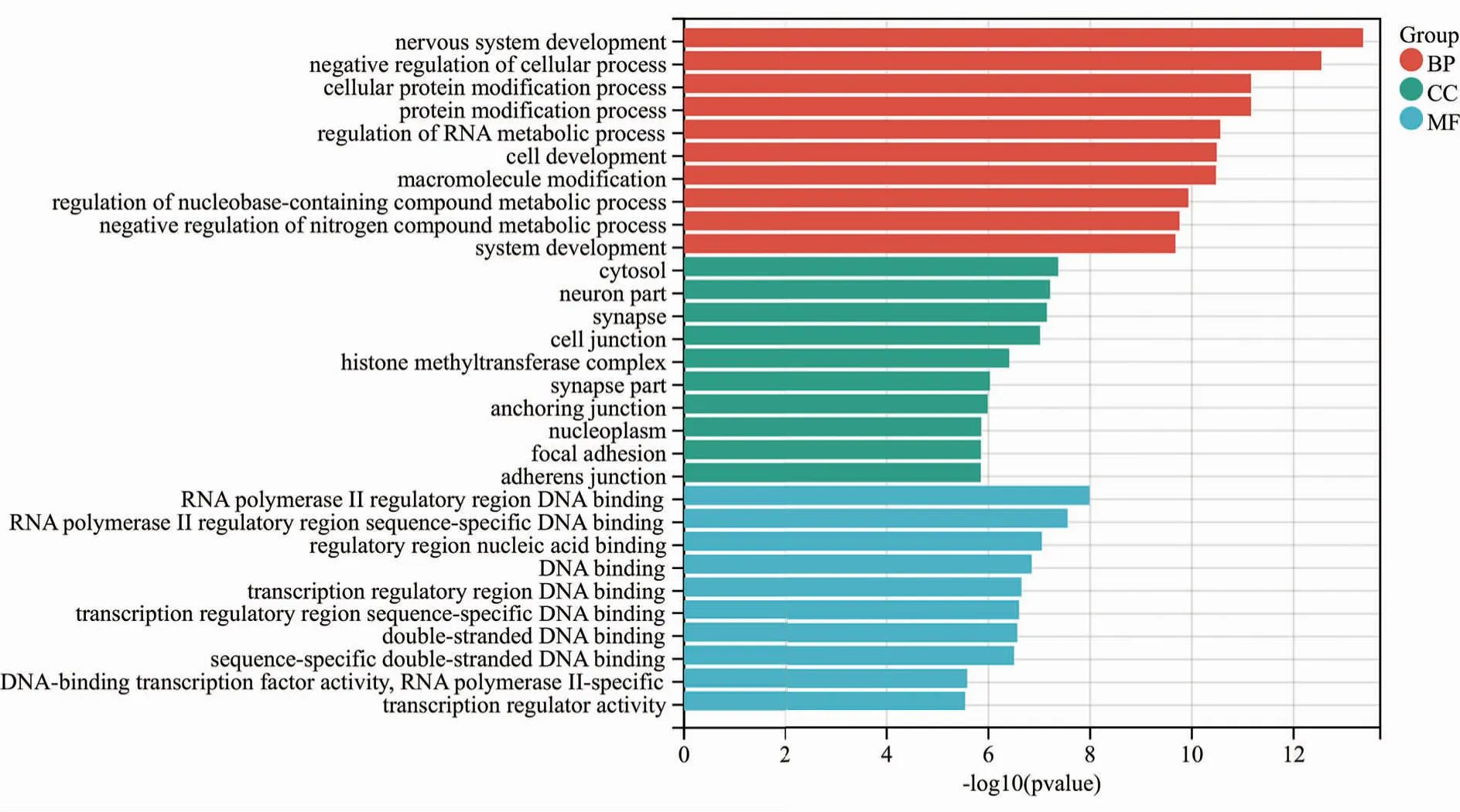
图7 hsa-miR-181a-5p预测靶基因的GO功能分析
2.5 hsa-miR-181a-5p预测靶基因的KEGG信号通路分析 对hsa-miR-181a-5p的3个数据库交集靶基因 KEGG 通路富集分析发现,排名前十的涉及MAPK、Ras、Pap1、PI3K-Akt等多个信号通路,还涉及癌症的发生过程,富集通路所涉及的关键靶基因有MAPK1、KRAS、AKT3、RAP1B、MAPK8等,见图8、9。这些结果提示我们hsa-miR-181a-5p的重要功能,也为后续实验进行靶标通路的选择提供了理论基础。同时,本研究的多个预测结果均提示hsa-miR-181a-5p与癌症发生发展的重要关联。
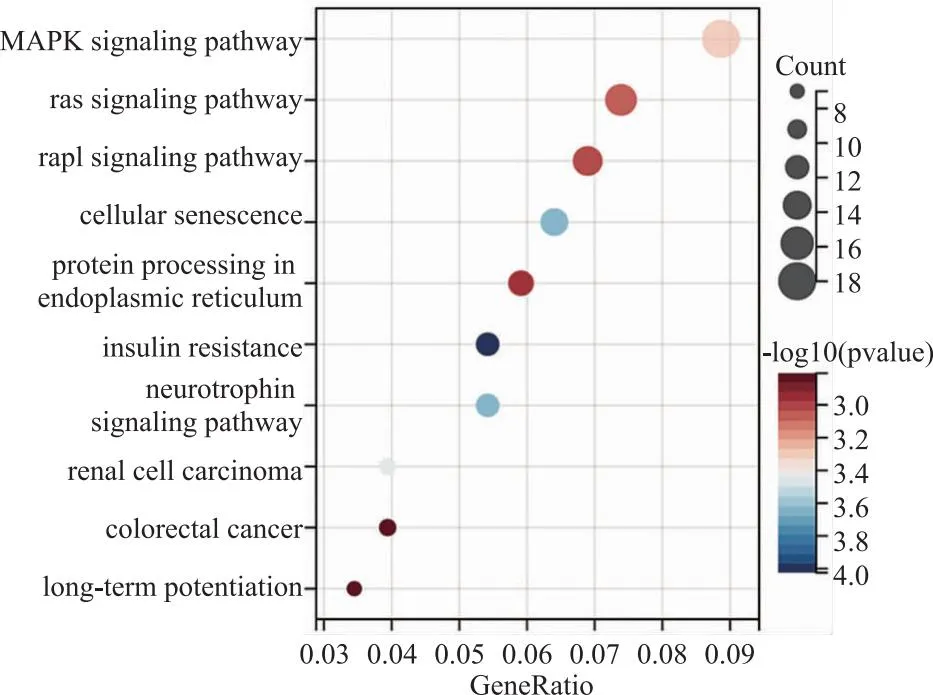
图8 hsa-miR-181a-5p预测靶基因的KEGG信号通路分析气泡图
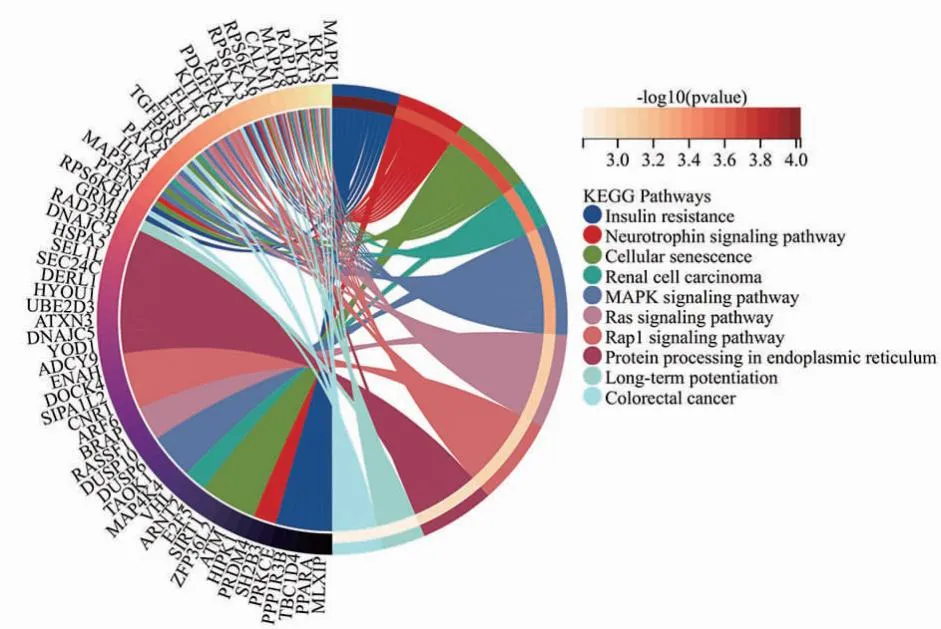
图9 hsa-miR-181a-5p预测靶基因的 KEGG 信号通路分析
2.6 hsa-miR-181a-5p预测靶基因的蛋白质之间相互作用分析 hsa-miR-181a-5p预测靶基因编码蛋白质之间相互作用分析结果显示,编码蛋白之间存在较强作用关系的靶基因为MAPK1、MAPK8、TGFBR1、KRAS、RBBP7等(图10)。MAPK1、MAPK8都是MAPK信号通路的关键分子,MAPK是信号从细胞表面传导到细胞核内部的重要传递者,又涉及多种生物学过程;TGFBR1更是参与炎症发生与上皮间质转化等生物过程的重要分子;KRAS基因是GDP/GTP结合蛋白,活化后的KRAS可以激活下游如控制细胞生成的PI3K-AKT-mTOR信号通路,以及控制细胞增殖的RAS-RAF-MEK-ERK信号通路。以上这些都可以表明hsa-miR-181a-5p的生物重要性,也为hsa-miR-181a-5p后续实验研究靶标的确认提供了一些理论支持。
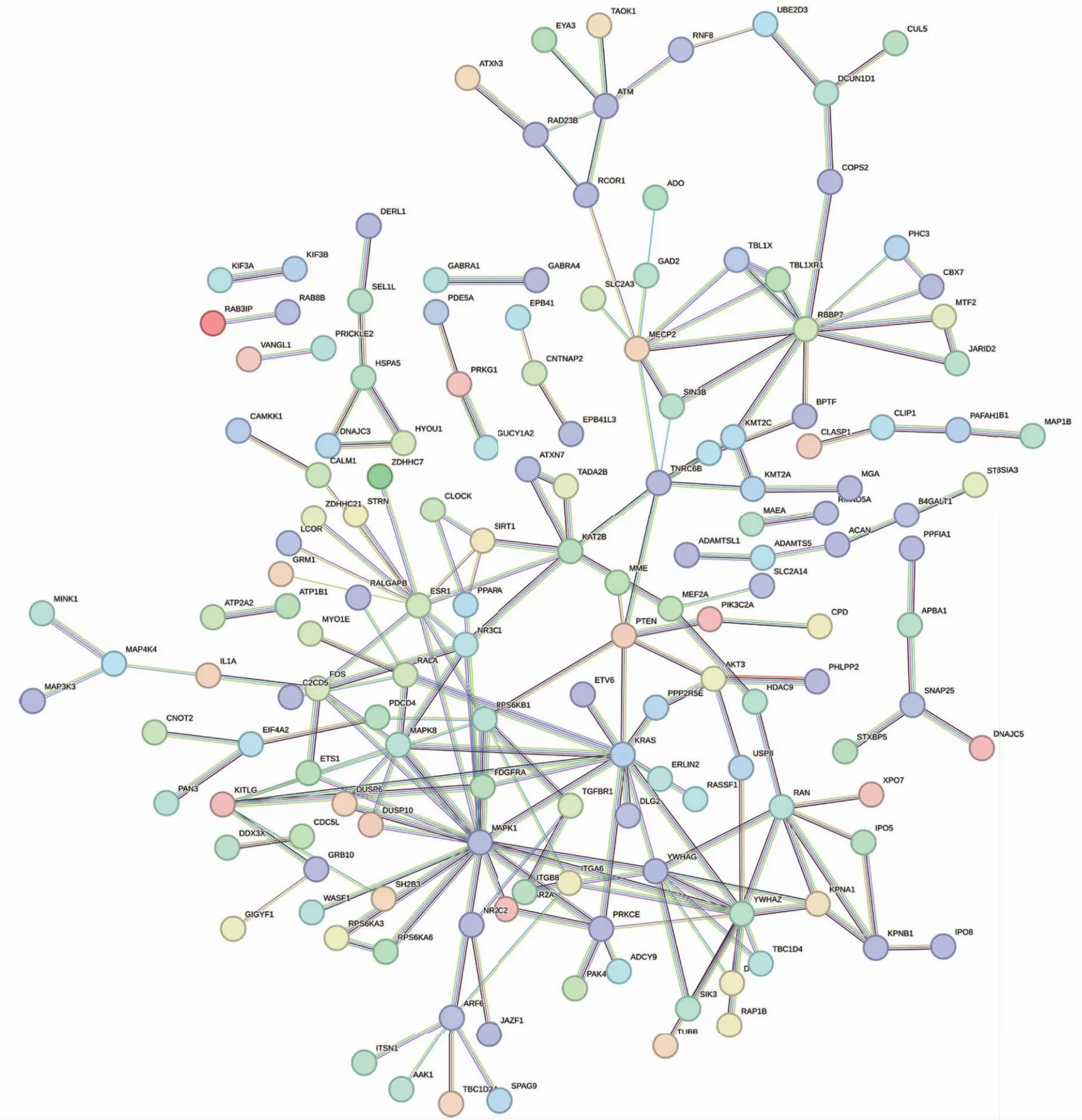
图10 预测靶基因所编码蛋白质之间的相互作用分析
2.7 转染结果 为了进一步观察miR-181a-5p对基因表达的影响,转染后对细胞中miR-181a-5p的相对表达量进行检测,统计学结果显示,miR-181a-5p agomir 组中miR-181a-5p的表达量显著高于control、agomir NC组 (P<0.01),如图11A。miR-181a-5p antagomir 组中miR-181a-5p的表达量显著低于control、antagomir NC 组 (P<0.001),如图11B。

A:miRNA-181a-5p Agomir组;B:miRNA-181a-5p Antagomir组;*、**:P<0.01、P<0.001;ns:无差异。
2.8 转录组测序结果 在Dr. Tom系统中筛选反映差异倍数,同时筛选log2(处理组表达量 / 对照组表达量)差异表达的转录组基因,差异倍数数据选为1.5,对这2 234个基因进行了KEGG通路富集,如图12A。结果显示显著差异基因富集于癌症相关通路:胰腺癌、癌症中的miRNAs、结直肠癌、癌症通路、肾细胞癌、乳腺癌;代谢相关通路:胰岛素抵抗、非酒精性脂肪肝、胰岛素信号通路;神经系统相关通路:长寿调节途径、神经营养因子信号通路、长程增强效应;细胞周期相关信号通路:细胞循环途径;还涉及炎症相关通路:TNF信号通路、TGF-beta信号通路;以及前期生物信息学预测的PI3K-AKT信号通路、Ras信号通路、Rap1信号通路、MAPK信号通路,如图12B。结合前期预测以及现有研究,选择了胰岛素抵抗(图13A)、结直肠癌(图13B)、PI3K-AKT信号通路(图13C)、细胞循环途径(图13D)、Ras信号通路(图13E)5个通路,将显著差异详细基因集做热图分析,如图13,其中涉及MAPK10、PTEN、TGFB3等基因。
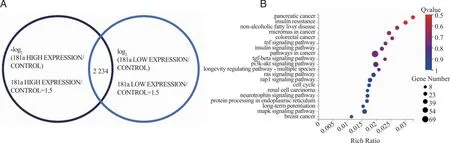
A:在Dr.Tom系统中筛选反映差异倍数,同时筛选log2(处理组表达量/对照组表达量)差异表达的转录组基因,差异倍数数据选为1.5,对这2 234个基因进行了KEGG通路富集;B:KEGG通路富集气泡图。

A:胰岛素抵抗;B:结直肠癌;C:PI3K-AKT信号通路;D:细胞循环途径;E:Ras信号通路。
3 讨论
研究表明,miRNA可以实现生物学过程代谢和功能的调节,涉及许多蛋白质-蛋白质和蛋白质-RNA相互作用的机制[12]。miRNA表达丰度与许多疾病发生发展有关,但是因为miRNA种类和数量较多, 并且其表达具有时序性和组织特异性,其涉及的相关生物学过程以及发挥的具体作用还有待研究。生物信息学能够快速预测miRNA的靶基因,可以实现将数据库预测的靶基因取交集后进行生物功能相关分析,对后续研究奠定了一定的理论基础,本研究对相关数据资源进行了整合分析。
miR-181a-5p可以通过参与细胞的增殖、凋亡和分化调节各种各样的生物过程,但其具体作用机制、靶基因及其靶基因相关功能还未明了,在现有研究中,没有对hsa-miR-181a-5p潜在靶点和相关功能通路的全面分析。本研究通过生信分析,发现miR-181a-5p在36个物种中具有高度保守性,表明其可能参与编码了重要的生命过程相关蛋白质。
通过对miR-181a-5p的生物信息学分析,并结合现有的文献研究,发现miR-181a-5p可以通过其靶向基因在神经系统、血液免疫系统、骨骼系统疾病以及癌症的发生发展中发挥重要作用。本研究通过对hsa-miR-181a-5p在人体组织中的表达分析,发现hsa-miR-181a-5p在人体神经系统中表达水平最高。hsa-miR-181a-5p预测靶基因的GO功能生物过程结果也显示,hsa-miR-181a-5p参与神经系统发育过程。miR-181a-5p的异常表达在神经系统疾病发生中发挥着重要作用。有研究表明miR-181a-5p和miR-181a-3p在动脉粥样硬化斑块和血浆中的表达均降低,它们都是抗动脉粥样硬化的miRNA,可以通过靶向NF-κB信号通路抑制血管炎症来限制动脉粥样硬化病变的发展,恢复miR-181a-5p和miR-181a-3p可能是治疗动脉粥样硬化的新治疗方法[13]。还有研究表明miR-181a在神经母细胞瘤细胞中的表达增加,在miR-181a潜在调控的基因中,有几个已知基因是神经发育所必需的,包括Engrailed1(En1),Engrailed2(En2),Lmx1a和Brn2[14]。miR-181a-5p还在癫痫的发生和进展中起关键作用,miR-181a-5p的高表达会促进癫痫的发展,miR-181a-5p的抑制可以通过靶基因SIRT1减弱癫痫引起的空间学习和记忆功能障碍[15]。miR-181a-5p在健康人与阿尔兹海默症患者、新生儿缺氧缺血性脑病模型的血清中的表达也有差异出现[16-17]。通过对hsa-miRNA-181a-5p 的交集靶基因进行KEGG通路富集,本研究发现 hsa-miRNA-181a-5p的交集靶基因多数富集于MAPK信号通路。miR-181a可以通过抑制MAPK/JNK信号通路来调节帕金森病中细胞的凋亡和自噬过程[18],这与我们预测到的结果相符。综上所述,hsa-miR-181a-5p或可成为神经系统多种疾病防治的新靶点,值得进一步的研究。
在血液免疫系统相关疾病中,本研究预测结果显示hsa-miRNA-181a-5p在多种血液系统相关疾病中高度表达,例如白血病与淋巴瘤。现在一些实验对临床样本进行分析,结果也表明了hsa-miRNA-181a-5p在血液系统的重要性,Egyed 等[19-20]通过对临床样本微阵列分析得到结论:miRNA-181a可以作为小儿急性淋巴细胞白血病中枢神经系统受累的新型液体活检标志物,miRNA-181a也可以作为T细胞白血病和淋巴瘤的生物标志物,这与肿瘤细胞化学耐药性有关,miR181a可能是治疗T细胞恶性肿瘤的潜在治疗靶点。本研究生信结果显示hsa-miR-181a-5p在急性髓系白血病的表达丰度最高。现有研究发现,miR-181a本身的表达及活性水平发生改变都可以对白血病的发生发展进行调节,沉默miR-181a可被视为增强泼尼松龙治疗白血病效果的策略[21]。如前所述,本研究通过生信预测得知,miR-181a靶基因多数富集于MAPK 信号通路,现在也有研究证实,miR-181a的下调可以通过调节MAPK级联过程中靶基因SOS1在白血病生成中起主要作用[22], miR-181a表达的上调可通过靶向MAP2K1表达和ERK/MAPK信号通路抑制白血病细胞增殖,诱导细胞凋亡,降低耐药性[23],miR-181a本身的活性水平也可直接下调NRAS,KRAS和MAPK1,对急性髓系白血病进行调节[24]。还有研究表明,供体T细胞中的miR-181a表达可以调节同种异体骨髓移植后移植物抗宿主病[25]。miR-181a还可以通过调节 ERK-MAPK 信号传导维持 DC-SIGN (单核细胞来源的树突状细胞)的表达并限制单核细胞来源树突状细胞的活化[26]。生信分析结果显示,hsa-miRNA-181a-5p的交集靶基因也富集于Ras信号通路, RalA是一种Ras下游信号分子和小GTP酶,在白血病生成中起重要作用,但确切的机制仍然难以捉摸,研究表明miR-181a可通过靶向RalA酶,激活Ras相关信号通路来促进慢性粒细胞白血病转化和进展[27],现在miR-181a-5p靶基因通过靶向Ras信号通路调节生物学过程相关研究还较少,本研究可以为后续的靶向研究进展提供一定的理论支持。
在骨骼系统相关疾病,现有一些临床样本研究与本研究预测到的结果相符,在骨关节炎研究中,Chang等[28]对临床样本进行分析,结果显示膝关节骨关节炎相关的关键miRNA包括miR-181a。Svitlana等[29]观察到健康人软骨组织中miR-181a表达水平在骨关节炎中被破坏,miR-181a在多发性骨髓瘤患者外周血和骨髓中的表达量增加,与多发性骨髓瘤的临床病理指标密切相关[30],miR-181a还可以通过靶向RASSF1A促进骨肉瘤细胞的增殖和转移[31]。在机制通路研究方面,miR-181a/b-1 过表达可通过调节 PI3K/AKT 信号传导和线粒体代谢来增强成骨作用,这些发现对治疗骨折或异位骨化等骨骼疾病有重要作用,Dong等[32]发现miR-181a-5p介导的GAS1下调可以通过PI3K-Akt信号传导促进骨关节炎中滑膜成纤维细胞的增殖,这为后续膝关节骨关节炎的研究提供了新思路。还有研究表明,miR-181a-5p可通过调控Sirt1/PI3K/AKT信号通路调控人骨髓间充质干细胞的凋亡和分化[33]。以上研究提示hsa-miR-181a-5p与骨骼系统疾病密切相关,但其具体机制还需要进一步实验验证。
通过靶基因通路富集与相关文献调研,发现hsa-miR-181a的异常表达与各种癌症的发病机制有关,可作为癌基因或肿瘤抑制因子[10]。本研究对hsa-miR-181a-5p与疾病相关的生信分析中也可以得到结论:hsa-miR-181a与卵巢癌、鼻咽癌的发生密切相关。hsa-miR-181a的异常表达与多种癌症相关,例如纹肌肉瘤、宫颈癌、皮肤鳞状细胞癌。Pozzo 等[34]发现,miR-181a的上调通过减少癌细胞增殖可以改善小鼠融合阴性横纹肌肉瘤。GRP78的高表达是宫颈癌的肿瘤促进因子,miR-181a还可以通过下调GRP78抑制宫颈癌的发展[35]。miR-181a还可以通过靶向KRAS在皮肤鳞状细胞癌中起着至关重要的肿瘤抑制作用[36]。在通路相关研究中,胃癌肿瘤组织中miR-181a-5p的高表达与癌症增殖和转移呈正相关,在机制研究上,miR-181a-5p可以通过激活RASSF6/MAPK信号通路在体外和体内促进胃癌细胞的增殖、侵袭、转移和上皮到间充质转化(EMT)[37]。RASSF1作为一种MAPK信号因子,miR-181a通过下调RASSF1表达诱导肝癌细胞索拉非尼耐药[38]。Cai等[39]发现PGRMC1/EGFR-PI3K/Akt/mTOR信号通路的激活是炔诺酮对人乳腺上皮MCF10A细胞促肿瘤发生作用的主要机制,miR-181a可通过此信号通路抑制炔诺酮促进乳腺癌发生。miR-181a不仅可以直接调节下游分子,还可以作为靶分子对癌症过程进行调控,LncRNA SNHG12通过激活非小细胞肺癌中的miR-181a的MAPK/Slug通路,促进其耐药性[40]。综上所述,miR-181a-5p与多种肿瘤的增殖与侵袭密切相关,其对肿瘤细胞的调控作用取决于癌症类型,还需要进一步的探索与研究,miR-181a-5p有望成为肿瘤诊断、治疗预后的生物标志物和靶点。
实验组差异表达的转录组基因KEGG通路富集结果与预测靶基因的KEGG通路富集结果相似,均提示hsa-miR-181a-5p与结直肠癌、乳腺癌等多种癌症发生发展的重要关联,同时与胰岛素抵抗、非酒精性脂肪肝等代谢途径相关,以及与PI3K-AKT信号通路、Ras信号通路、细胞周期循环等涉及细胞增殖、凋亡等周期调节途径显著相关,还涉及神经营养因子等神经系统方面信号通路,这与现有许多研究结果保持一致,进一步印证了生信预测的准确性。
根据生信分析及转录组验证,miR-181a-5p可能通过靶向PTEN调控PI3K-AKT信号通路。PTEN的磷酸酶活性负责将磷脂酰肌醇三磷酸(PIP3)转化为磷脂酰肌醇二磷酸(PIP2)。而PIP3是PI3K的产物,它激活AKT,进而影响下游效应蛋白的活性。当PTEN表达正常时,它通过抑制PI3K-AKT信号通路来调节细胞生物学过程。PTEN通常被认为是一种抑制肿瘤发展的蛋白质,因为它抑制PI3K-AKT信号通路,防止异常细胞增殖和生存。PTEN的突变或缺失会导致PI3K-AKT信号通路的异常活化,促进癌细胞的生长和存活,这被认为是多种癌症的发生和发展的驱动力之一。miR-181a-5p通过靶向PTEN调控PI3K-AKT信号通路也在现有的实验结论中得到了验证,其中涉及增殖调控相关癌症的发展[41-44]。
miR-181a-5p可能通过靶向PPARA调控胰岛素抵抗信号通路。PPARA(过氧化物酶体增殖激活受体-α)是核受体超家族中的一员,主要参与调控脂质代谢和能量平衡[45]。与胰岛素抵抗之间存在一些复杂的相互作用,涉及脂质代谢、糖代谢和炎症等多个生物学过程[46-47]。PPARA在肝脏中的表达被激活时,可以促进脂质的氧化,尤其是脂肪酸的氧化。这有助于降低血浆中的脂质水平,减少脂质堆积,有利于改善胰岛素敏感性。通过调控脂质代谢,PPARA可能影响胰岛素的敏感性。脂质过多的堆积可能导致胰岛素抵抗,而PPARA的激活可能有助于减少这种抵抗。总体而言,PPARA通过调节脂质代谢、抑制炎症以及对葡萄糖代谢的影响,可能在一定程度上影响胰岛素的敏感性,从而对胰岛素抵抗产生一定的影响。miR-181a-5p调控胰岛素抵抗信号通路影响代谢相关疾病研究该领域仍在积极研究中[48-49],以助于更全面地理解这些分子之间的复杂关系。
综上所述,本研究利用生物信息学技术并结合现有文献对has-miR-181a-5p进行分析讨论,miR-181a-5p可以通过其靶向基因在神经系统、血液免疫系统、骨骼系统疾病以及癌症的发生发展中发挥重要作用,为后续将miR-181a-5p作为新靶点研究疾病发生和防治机制提供了理论支持。
