基于CT影像组学预测高血压性脑出血患者的临床结局
2024-02-29刘小清赵纯风刘文村
谢 立,刘小清,赵纯风,刘文村,刘 衡
(1.遵义医科大学附属医院 放射科,贵州 遵义 563099; 2.重庆市九龙坡区妇幼保健院 放射科,重庆 九龙坡 400050;3.重庆市九龙坡区人民医院 放射科,重庆 九龙坡 400050)
高血压性脑出血(hypertensive intracerebral hemorrhage,HICH)发病凶险,其短期死亡率约30%~40%[1],因其发病率、病死率及致残率长期居高不下,给患者、家庭和社会带来严重威胁[2]。早期准确的预测HICH患者临床结局,制订恰当的个体化治疗方案,改善患者预后并降低致死、致残率,已成为临床实践中最迫切需要解决的问题。
颅脑CT平扫(noncontrast computed tomography,NCCT)是急性脑出血的首选检查手段[3-4]。影像医生一般凭借自身的肉眼直观和经验对病变进行诊断,这样由于每个人经验不同会存在一定的差异。影像资料包含大量的客观潜在信息,通过提取组学特征来反映病变内部的异质性,这样基于组学特征的诊断可达到较好的一致性。CT图像的影像组学分析能实现对血肿异质性的量化评价[5],在患者风险分层和预后评估等方面有重要的临床应用价值[6],且影像组学与机器学习算法的结合能提高模型的预测能力,已逐渐应用于脑出血的病情评估和预后预测[7-8]。列线图被认为是一种简单有效的可视化工具,预测模型通过列线图可视化后成为量化个体风险的一种方便可靠的方法[9-10],可以帮助医生早期快速识别哪些患者能够恢复神经功能独立,这将改善临床医生对患者的治疗效果,以获得更多的净收益。
以往学者主要是对HICH患者临床病史、实验室检查及NCCT征象与临床结局关系的研究,但其对临床结局的影响大小和预测价值结果不一。此外,这些NCCT征象不能定量评估血肿异质性对脑出血患者预后不良的风险。因此,本研究构建一项结合影像组学特征的列线图预测模型,以评估患者入院时30 d的临床结局情况。
1 对象与方法
1.1 对象 根据患者纳入与排除标准收集病例(图1),分析筛选出的HICH患者入院时的数据(n=539例)。遵义医科大学附属医院为中心1(n=431例),中心1的患者按时间顺序进行分组,2019年1月至2021年9月患者为训练队列(n=305例),2021年10月至2022年9月患者为内部验证队列(n=126例);重庆市九龙坡区人民医院为中心2,中心2的2022年1月至2023年3月患者作为外部验证队列(n=108例)。本研究已通过遵义医科大学附属医院伦理委员会批准(批件号:KLLY-2022-138),所有研究对象免签知情同意书,且已在中国临床试验注册中心注册(注册号:ChiCTR2300074607)。

图1 患者选择流程
患者纳入标准:(1)HICH患者;(2)年龄≥18岁;(3)首次NCCT检查在发病24 h内;(4)患者采用相同的治疗准则及公认标准。患者排除标准:(1)原发性脑室出血;(2)多发性脑出血;(3)血肿体积小于1 mL;(4)NCCT图像质量差,严重伪影存在;(5)首次NCCT扫描前接受了手术治疗;(6)既往有脑血管病且遗留神经功能缺失症状者;(7)病历材料残缺。
1.2 资料收集 患者人口统计学特征及实验室结果通过电子病历系统查询。所有患者均接受从颅底到颅顶的NCCT检查,将扫描的图像传输至后处理工作站,图像以DICOM格式导出。患者30 d的临床结局状况用改良RANKIN量表(modified rankin scale,mRS)衡量[11],mRS≤3 为预后良好,mRS>3为预后不良,通过住院记录、患者复查或标准化随访等方式获得。
1.3 图像分析和特征提取 由工作经验有5年以上的2名医师独立分析NCCT图像并提取影像组学特征,当意见不同时协商决定。患者NCCT图像导入到3Dslicer(version 4.11)软件中进行分析,在横断面上连续勾画感兴趣区域(血肿),依照阈值半自动勾画,其阈值设定为50~110 HU。组学特征提取使用PyRadiomics 3.0.1插件工具,从中提取851个影像组学特征(一阶特征、纹理特征、形态特征及小波特征)。计算影像组学特征的ICC,对其提取的可重复性进行评估, ICC>0.75被认为具有较好的一致性[12-13]。使用R(version 4.0.0)软件进行影像组学特征筛选,先用Z-score方法将特征数据标准化,再用Corr.test函数进行差异性分析,然后用LASSO回归和十折交叉验证进行降维筛选特征,降维过程中惩罚系数lambda选择lambda.1se标准,选出最有价值的特征集并计算影像组学评分(Radscore)[6, 14]。
1.4 模型构建和评价 训练队列临床预测因素应用随机森林(random forest,RF)筛选出重要因素,重要因素纳入多因素Logistic回归分析,采用逐步回归法找出独立危险因素构建临床模型。Radscore构建影像组学模型。临床独立危险因素联合Radscore构建临床影像组学模型,并将模型可视化形成列线图模型。接受者操作特性(ROC)曲线下面积(AUC)评价模型的区分性能,根据Youden 指数最大值计算其敏感度和特异度,用校准曲线评估模型的拟合度,决策曲线分析(DCA)判断模型的适用性。

2 结果
2.1 患者一般资料 中心1患者共431例,训练队列患者305例,其中预后不良143例(46.9%),内部验证患者126例,其中预后不良67例(53.2%),中心2外部验证队列患者108例,其中预后不良53例(49.1%),训练队列患者一般资料单因素分析结果(表1、2)。
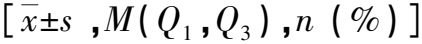
表1 训练队列和验证队列患者一般资料
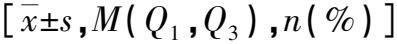
表2 训练队列患者一般资料单因素分析
2.2 临床模型独立危险因素筛选结果 训练队列患者临床病史、实验室结果及NCCT征象应用RF筛选出11个重要因素(图2),即血肿部位、血肿体积(mL)、破入脑室、中线移位、脑积水、白细胞(109/L)、血红蛋白(g/L)、D二聚体(mg/L)、收缩压、GCS评分及手术史。重要因素纳入多因素Logistic回归分析,显示血肿部位、血肿体积、破入脑室、中线移位及GCS评分为患者预后不良的独立危险因素(表3)。

表3 训练队列患者独立危险因素Logistic回归分析
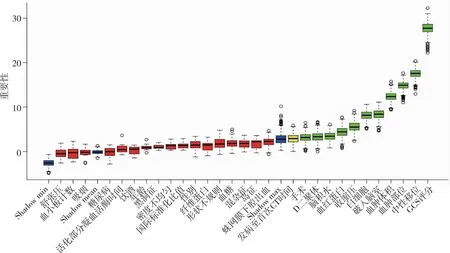
图2 随机森林选择重要性因素
2.3 影像组学模型特征筛选结果 从提取的851个影像组学特征中进行筛选,有254个具有较高的稳定性和差异性(ICC>0.75),再通过LASSO回归和十折交叉验证筛选,最终选出9个最有价值的特征组成最优特征集(图3、图4)。

A:利用Lasso回归进行特征降维过程的系数曲线;B:利用Lasso回归和10折交叉验证进行的特征筛选。

图4 最优影像组学特征集及其系数
2.4 模型构建及评价 临床模型由血肿部位、血肿体积、破入脑室、中线移位及GCS评分建立,影像组学模型由Radscore建立,临床独立危险因素联合Radscore建立临床影像组学列线图模型,即列线图模型(图5)。

图5 列线图模型
ROC曲线分析(图6),临床模型、影像组学模型和列线图模型在训练队列中AUC分别为0.87(95%CI:0.83~0.91)、0.79(95%CI:0.74~0.84)、0.89(95%CI:0.85~0.93),在内部验证队列AUC分别为0.84(95%CI:0.78~0.90)、0.71(95%CI:0.62~0.80)、0.86(95%CI: 0.79~0.92),在外部验证队列AUC分别为0.79(95%CI: 0.73~0.86)、0.68(95%CI: 0.58~0.78)、0.82(95%CI: 0.74~0.90)。列线图模型根据Youden 指数最大值计算其敏感度和特异度(表4)。

表4 列线图模型区分效能比较
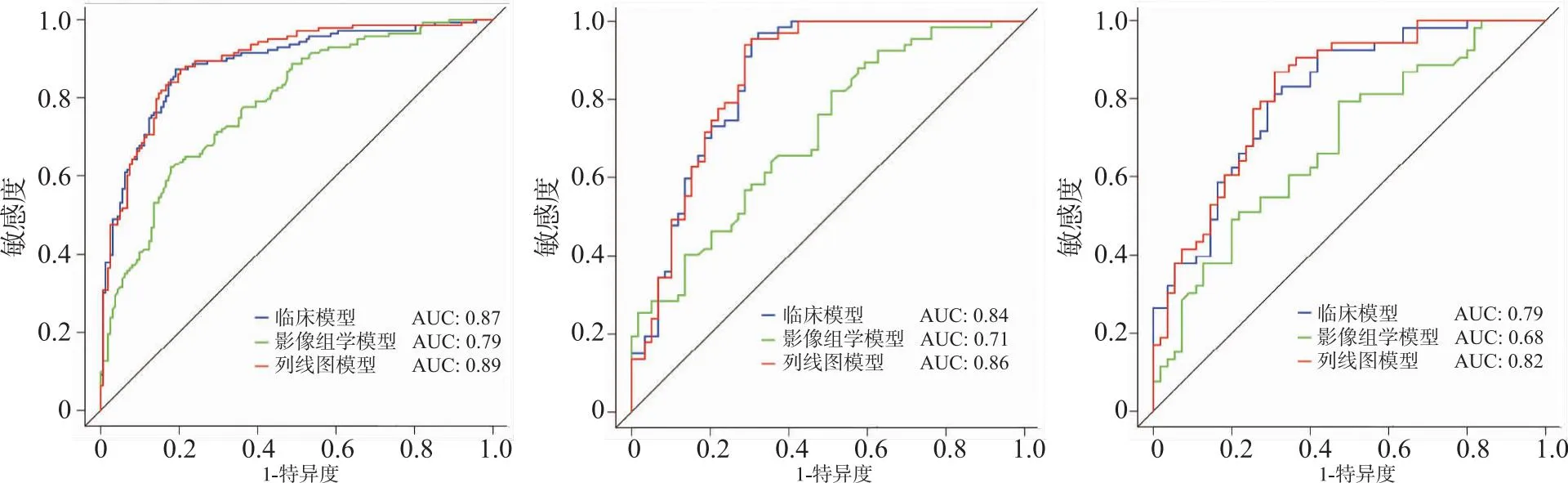
图6 3种模型分别在3队列中的ROC曲线分析
列线图模型的校准曲线分析表现良好(图7),在训练队列中P=0.944,在内部验证队列中P=0.540,在外部验证队列中P=0.171。
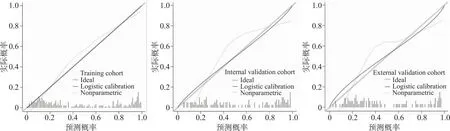
图7 列线图模型在3队列的校准曲线分析
DCA分析显示列线图模型阈值概率在(0.10~0.90)有较高的临床适用价值,且比临床模型和影像组学模型具有更高的总体净获益(图8)。

图8 临床模型、影像组学模型及列线图模型的DCA分析
列线图模型与临床模型比较,净重分类改善度(NRI)为0.058,综合区分改善度(IDI)为 0.035(95%CI: 0.015~0.055),模型综合区分效能提高3.5%。列线图模型与影像组学模型比较,NRI为0.279,IDI为0.223(95%CI: 0.177~0.269),模型综合区分效能提高22.3%。列线图模型最佳截断概率为0.33,在训练队列和内部及外部验证队列的预测准确率分别为81.0%、75.4%和71.3%。
3 讨论
结合影像组学与机器学习方法构建不同的预测模型,使用了相对较大样本量对模型进行双中心验证,且绘制列线图将模型可视化易于临床医生使用。构建的列线图模型在HICH急性期对患者30 d 临床结局做出评估,可以帮助一线医生快速识别哪些患者有可能发生预后不良。
基底节或丘脑出血属于脑深部出血,神经细胞容易受损伤,预后一般较差。脑叶出血(OR=0.202,P=0.002)预后相对较好,可能与侧枝循环容易建立,神经细胞损伤较少有关。一般认为小脑出血(OR=0.641,P=0.453)易于引流,加之小脑出血对神经功能的影响相对较小,如果治疗规范及手术及时,预后可能更好。脑干出血(OR=24.842,P=0.004)一般发病凶险,出血容易影响呼吸循环中枢,患者常伴有严重的意识障碍,短期预后极其不佳[15-16]。血肿体积与HICH患者的临床结局密切相关,较大血肿占位效应重,且血肿毒素含量高,容易导致严重的继发脑损伤,有研究报道称[17-18],血肿体积与神经功能评分有关,可反映脑出血的病情严重程度,其不仅和神经功能结局有关,而且与短期死亡有关。血肿破入脑室作为脑出血的严重并发症之一,与神经功能预后不良相关[19],血液进入脑室系统容易刺激上皮细胞产生炎症反应,导致患者意识模糊,且行脑室积血引流术会引起感染发生率上升,而且脑室积血易伴发机体水电解质紊乱对临床结局产生影响,若引起脑室积水扩张甚至形成脑疝,会导致短期预后不佳[20]。中线结构偏移会挤压正常脑组织,脑组织内压力增高,常伴发意识障碍、昏迷或抽搐,且易伴发应激性高血糖、应激性溃疡和消化道出血,从而导致预后较差,既往有研究表明[21-22],中线结构偏移可用于预测脑出血患者的功能预后,这与我们的研究结果一致。GCS评分是早期神经系统检查的常用工具,其评分与神经功能呈正相关,有研究证实[23-24],早期临床重要的神经系统改变与脑出血患者的预后有关,入院时GCS评分较低可预测脑出血不良预后,这与我们的研究结果相同。既往研究得知[18, 25-26],血肿形状和异质性与脑出血患者预后密切相关,本研究中,我们对血肿影像组学特征分析后,851个特征中有9个与患者30 d临床结局密切相关,表明Radscore能评价血肿本身内在的特征。多项研究报道证实影像组学特征可以将血肿的异质性客观量化,并对预测脑出血患者预后有重要价值[8, 27-28]。房彩云等[29]建立基于CT的临床影像组学列线图模型预测HICH患者预后情况,在训练集和验证集的AUC分别为0.94和0.93,这表明临床危险因素联合Radscore建立的列线图具有良好的预测效能。Han等[30]把血肿位置、血肿体积和GCS评分作为预测变量,可以为脑出血患者提供30 d功能结局的个性化风险评估。Zhou等[31]进行的一项深部脑出血的30 d临床结局研究,将中线移位、GCS评分和Radscore作为不良预后的预测指标具有较高的区分度,与我们研究结果一致。
本研究用血肿部位、血肿体积、破入脑室、中线移位及GCS评分建立的临床模型,在训练队列的AUC为0.87,在内部和外部验证队列中AUC分别为0.84和0.79,结果表明临床模型实现了较好的区分性能,所选用的预测因子具有较高的预测价值。虽然该临床模型可用于区分预后不良的HICH患者,但必须注意没有结合血肿本身内在的细微差异进行分析。在临床模型的基础上,我们通过加入血肿的Radscore构建了一项临床影像组学列线图模型,它相当于在临床特征的基础上增加了血肿本身内在的细微特征,该模型在训练队列的AUC为0.89,在内部和外部验证队列中AUC分别为0.86及0.82,这一结果表明列线图模型实现了更佳的区分性能。Delong检验表明,列线图模型与影像组学模型AUC比较有显著差异(P<0.001),列线图模型在训练队列和内部及外部验证队列中,AUC均高于临床模型和影像组学模型,且临床模型加入Radscore后,模型的NRI和IDI都有一定正向改善作用,这说明增加血肿Radscore能够提高模型区分效能,所以我们相信列线图模型要更优于临床模型和影像组学模型,实现了对HICH患者临床结局更佳的预测准确性。
本研究具有一定局限性。(1)此研究是一项回顾性观察研究,有待未来前瞻性更大样本研究来进一步印证。(2)列线图模型在三级医院进行了内部验证和二级医院进行了外部验证,但是否适用于基层医院和其它地区医院,需要更多医疗中心来验证,这也为未来我们的研究提供了参考方向。(3)HICH部分患者提前出院或放弃治疗,可能会影响我们结果的稳定性。尽管研究有其局限性,但该列线图模型还是能相对可靠的提供患者30 d临床结局评估。相信随着HICH预后研究的不断进展,新的预测因素和分析方法也将可能出现,通过不断完善改进预测模型,更有助于全面准确地评估患者预后不良的风险。
