CypA/CD147在SARS-CoV-2感染性心血管疾病诊疗中的作用研究进展
2024-02-29马明仁王菲蔡晓庆刘燕马凌
马明仁,王菲,蔡晓庆,刘燕,马凌
解放军联勤保障部队第940医院心血管内科,甘肃兰州 730050
随着全球新型冠状病毒感染(corona virus disease 2019,COVID‐19)疫苗接种的普及和新药、特药的更新迭代,COVID‐19 疫情的传播得到了有效遏制,然而其相关并发症仍是当前关注的焦点[1‐3]。新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS‐CoV‐2)感染会累及心血管系统,引发心肌损伤、心律失常、心肌炎等心血管疾病(cardiovascular diseases,CVD)等[4‐6]。据统计,15.0%~27.8%的重症COVID‐19患者存在心肌损伤[7],COVID‐19住院患者中急性心肌炎(acute myocarditis,AM)发生率为(2.4~4.1)/‰[8]。SARS‐CoV‐2 表面的囊膜突起是由无跨膜区的刺突蛋白(S)三聚体组成,属于Ⅰ型病毒融合糖蛋白,负责识别并结合受体,完成病毒感染细胞的起始步骤,是病毒侵入细胞的关键蛋白[9‐11]。既往研究已证实,SARS‐CoV‐2 S 蛋白通过结合细胞表面受体血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)入侵宿主细胞[12],但肾素‐血管紧张素转换酶‐血管紧张素Ⅱ‐血管紧张素Ⅱ 1 型受体(ACE‐Ang Ⅱ‐AT1R)轴的过度激活,以及肾素‐血管紧张素转换酶2‐血 管 紧 张 素(1‐7)‐血 管 紧 张 素(1‐7)MasR 受 体[ACE2/Ang‐(1‐7)/MasR]轴的抑制均可导致肺血管通透性增加、炎症反应等病理改变,以ACE2为靶点研发的疫苗、药物在目前的临床应用中仍存在诸多不足[13‐14]。亲环素A(cyclophilin A,CypA)是一种细胞溶质蛋白,主要存在于内皮细胞、血管平滑肌细胞、心肌成纤维细胞等多种细胞内[15],CD147 是最主要的CypA 细胞表面受体,在CypA 介导的信号转导中发挥重要作用[16‐17],CypA/CD147 信号通路参与了CVD 的发生、发展过程[18]。最新研究发现,CypA/CD147 可作为SARS‐CoV‐2 S 蛋白入侵宿主的细胞表面受体[19‐23]。本课题组研究证实,SARS‐CoV‐2 靶向CypA/CD147信号通路可诱导心肌细胞凋亡增加,且以心肌细胞晚期凋亡为主(结果未发表)。基于上述研究证据,并结合本课题组研究的基础,本文综述了SARS‐CoV‐2 通过CypA/CD147 入侵心血管系统引发CVD 的相关机制,以期为COVID‐19 并发CVD 的诊疗及研究提供新策略。
1 CypA/CD147的结构与功能
CypA属于亲环素家族成员,是Fischer等[24]从牛胸腺中分离的分子质量为18 kD的细胞溶质蛋白。在所有原核和真核生物中,CypA是进化高度保守且普遍存在的蛋白质家族[25]。CypA具有肽基脯氨酰基顺反异构酶(peptidyl‐prolyl cis‐trans isomerase,PPIase)活性,在脯氨酰残基处催化肽键从反式异构成为顺式异构,作为分子伴侣可促进蛋白质折叠及T 细胞活化[26]。CD147 也称为细胞外金属蛋白酶诱导剂(extracellular matrix metalloproteinase inducer,EMMPRIN),属于免疫球蛋白超家族成员,是一种分子量为50~60 kD 的Ⅰ型跨膜糖蛋白受体,具有2 个免疫球蛋白样结构域,在诸多类型的细胞(如癌细胞、造血细胞、内皮细胞等)和血小板上表达[27],主要参与炎症、病毒感染和肿瘤侵袭等病理过程[28]。CD147 是迄今为止研究最为广泛的CypA 受体之一,CypA/CD147 可通过激活CD147 介导的细胞内下游信号通路在多种疾病的进展中发挥关键的调控作用[29]。CypA是冠状病毒复制所需的重要蛋白质,已证实CypA/CD147 在SARS‐CoV‐2 进入宿主细胞时起着重要作用[30]。因此,以CypA/CD147 作为靶点来诊疗SARS‐CoV‐2感染引发了广泛关注。
2 CypA/CD147信号通路在CVD中的作用
心肌细胞外基质微环境的变化在CVD发生发展中扮演重要角色,CD147作为跨膜分子与CypA相互作用后可介导各类CVD 的发生[31]。值得关注的是,这种相互作用会诱发炎性趋化因子的表达和血小板活化[32],而活化的血小板可大量表达CypA 及CD147,并通过影响PI3K/Akt 信号通路而导致血小板形态改变及多种促炎因子释放[33]。Wang等[34]在探讨脑梗死患者的颈动脉粥样硬化斑块稳定性、狭窄程度,炎性因子、基质金属蛋白酶‐9(matrix metalloproteinase‐9,MMP‐9)的表达情况,以及血管内皮功能与CD147 的相关性时发现,CD147 水平明显升高,且与炎症反应密切相关,CypA/CD147的表达上调可能参与了颈动脉粥样硬化斑块的发病机制[35]。纤 维 化 在 糖 尿 病 心 肌 病(diabetic cardio‐myopathy,DCM)中起重要作用,Liu 等[36]证实,CD147 是促进糖尿病心脏纤维化的关键因素,N‐糖基化介导的CD147 积聚活化Ⅰ型转录生长因子β(type Ⅰ transcription growth factor β,TGF‐β)受 体ALK5,可诱导糖尿病心肌纤维化。
心脏重塑是心力衰竭(heart failure,HF)发生的决定性机制及病理基础,Su 等[37]系统综述了CypA/CD147 在心脏重塑中的潜在作用,为预防和介入治疗HF提供了新思路;张雁斌等[38]也证实在动脉粥样硬化兔血管重构中CypA/CD147 的表达水平明显升高。在急性肺栓塞治疗方面,CypA/CD147被认为是最具潜力的靶点之一,细胞外信号调节激酶1/2(extracellular signal‐regulated kinase 1/2,ERK1/2)在心脏损伤的发病机制中起关键作用。SP‐8356是一种新型CypA/CD147 抑制剂,有研究发现,其可明显抑制CypA诱导的大鼠原代心肌细胞凋亡,且可通过剂量依赖的方式下调心脏损伤中高表达的MMP‐9、p‐ERK1/2和p‐P56,从而抑制细胞凋亡和炎症反应[39]。心肌炎的发展与自身免疫性、药物诱导性及病毒感染等多种因素相关,炎症反应的发生可导致心肌损伤,随后发展为心脏重构和纤维化[40]。CD147 作为促炎因子参与了心肌炎的发生发展过程,Seizer等[41]发现,CypA/CD147在炎症性心肌病患者中的表达水平明显升高;在柯萨奇病毒B3(coxsackievirus B3,CVB3)诱导的小鼠心肌炎模型中,CypA 对巨噬细胞和T细胞的募集可有效防御病毒的攻击,应用CypA抑制剂NIM811 可有效防止心肌纤维化。在肌钙蛋白Ⅰ诱导的自身免疫性心肌炎小鼠模型中,细胞外CypA 抑制剂MM284 可有效抑制CypA 诱导的单核细胞迁移和黏附,提示细胞外CypA在自身免疫性心肌炎中对心肌损伤和纤维化起重要作用[42]。陈慧玲等[43]检测了86例呼吸道感染并发心肌炎患者的血清降钙素原(PCT)、单核细胞趋化蛋白1(MCP‐1)、核因子κB(NF‐κB)水平,并探讨CypA/CD147信号通路的作用时发现,随着病情加重,CypA、CD147 水平逐渐升高,且CypA/CD147联合PCT、MCP‐1、NF‐κB对呼吸道感染并发心肌炎的诊断效能更高。已有研究证实,CypA/CD147 信号通路在CVD 中起关键调控作用[44],但其具体机制仍不清楚。随着COVID‐19疫情并发心血管系统损伤及当前疫苗接种带来的隐患,CypA/CD147 作为SARS‐CoV‐2 入侵心血管系统受体途径已引起了研究者浓厚的兴趣。
3 SARS-CoV-2靶向CypA/CD147信号通路引发CVD
SARS‐CoV‐2 S 蛋白S1 亚基含有一个受体结合结构域(receptor‐binding domain,RBD),是SARS‐CoV‐2识别宿主细胞表面受体的主要蛋白[45]。ACE2 是SARS‐CoV‐2 S 蛋白入侵宿主细胞的主要表面受体,也是当前药物及疫苗研发的关键靶点[46]。其他受体还包括酪氨酸蛋白激酶受体UFO(tyrosine‐protein kinase receptor UFO,AXL)、CD147、葡萄糖调节蛋白78(glucose‐regulated protein 78,GRP78)、去唾液酸糖蛋白受体1(asialoglycoprotein receptor 1,ASGR1)及KREMEN1等[47]。
SARS‐CoV‐2 仅依赖于ACE2 受体似乎不足以解释其极强的传染性、对多器官的损害及感染后出现多样的并发症。陈志南院士团队致力于冠状病毒的研究,最早在细胞和动物模型水平证实了SARS‐CoV‐2 可通过CD147 入侵宿主细胞的新途径,但该研究以Vero E6 和BEAS‐2B 细胞为研究对象,CD147敲除小鼠模型仅验证了肺组织的病理改变,而未涉及心血管系统[48]。Avolio等[49]发现,SARS‐CoV‐2 S蛋白从急性COVID‐19 患者中的病毒颗粒上裂解下来后,从呼吸系统释放到血液中,分离的S 蛋白通过血液循环到达全身所有器官;S蛋白与心脏周细胞上CypA/CD147 受体的相互作用触发了ERK1/2 信号通路,引起周细胞的功能障碍。此外,S蛋白与CypA/CD147 相互作用可促使心脏周细胞释放促凋亡因子及促炎细胞因子,这些细胞因子可损害邻近的心肌细胞并激活内皮细胞,潜在地触发了血液凝固,并增加了血管通透性,循环中的SARS‐CoV‐2 S 蛋白可导致独立于病毒感染的心血管系统疾病[50]。CypA/CD147 受体在心肌细胞表面也有表达[51],因此,从SARS‐CoV‐2裂解的S蛋白也可靶向CypA/CD147受体而入侵心肌细胞。值得注意的是,CD147 在左心室肥厚的心肌细胞中表达水平升高,从而增加了肥厚性心肌病(hypertrophic cardiomyopathy,HCM)患者发生心脏损伤的风险[18]。上述研究证据充分证明,循环中的S 蛋白可通过靶向心脏周细胞及心肌细胞表面CypA/CD147 受体,从而引发炎症反应及细胞损伤。
SARS‐CoV‐2 感染已成为动脉粥样硬化的一个重要 危 险 因 素,Liu 等[52]发 现,SARS‐CoV‐2 可 通 过CD147介导的病毒入侵途径,感染低表达ACE2的巨噬细胞、T 淋巴细胞等免疫细胞,因此,CD147 可能参与了SARS‐CoV‐2 诱导的过度炎症反应,具有潜在的促动脉粥样硬化作用。一项关于SARS‐CoV‐2 导致心脏小血管内皮炎症的研究指出,与对照组相比,COVID‐19患者的毛细血管中有较多的CD147炎性细胞,CD147 与心脏炎症密切相关,因而阻断CD147可抑制SARS‐CoV‐2的复制及入侵宿主细胞[53]。SARS‐CoV‐2 通过CD147 受体途径入侵宿主细胞启动JAK‐STAT 信号通路,诱导CypA 的表达,CypA 结合CD147 后可触发MARK 信号通路,从而调节细胞因子和趋化因子的表达,最终促进了细胞因子风暴的发展。当前用于阻断或降低CD147 受体表达的药物包括人源化CD147 抗体、他汀类药物和阿奇霉素等[23,54],这些药物在临床治疗SARS‐CoV‐2 感染中取得了良好的效果,也佐证了CypA/CD147 是SARS‐CoV‐2入侵宿主细胞的受体之一。本课题组的研究也证实,SARS‐CoV‐2可通过靶向CypA/CD147信号通路诱导心肌细胞凋亡(结果未发表),并在此基础上深入探讨了SARS‐CoV‐2感染引发心肌炎的相关机制。
SARS‐CoV‐2 入侵宿主细胞对机体造成损伤是个复杂的病理过程,当前研究证据表明SARS‐CoV‐2对不同类型细胞的亲和力存在差异,对于心肌细胞而言,CypA/CD147 信号通路是SARS‐CoV‐2 入侵的可能途径,该通路的启动会引发线粒体损伤、炎性因子释放等下游胞内事件的发生,但具体机制尚待进一步探究。
4 总结与展望
SARS‐CoV‐2 及其关键蛋白入侵宿主细胞是感染发生的始动环节,针对SARS‐CoV‐2 多种突变株(variants of concern,VOC),全球科研人员对其入侵途径及致病机制进行了大量研究且取得了满意的结果。S 蛋白作为SARS‐CoV‐2 表面关键蛋白被广泛研究[55‐56],ACE2 在多种细胞表达,是SARS‐CoV‐2 S 蛋白的主要受体之一,当前使用的抗COVID‐19药物及疫苗也主要以S‐ACE2 为靶点。然而,SARS‐CoV‐2 VOC 将增加开放S 蛋白构象的动力学稳定性作为一种进化策略[57],当前5 种VOC S 基因区域的快速变异进化降低了其对中和抗体的敏感性,增加了免疫逃逸的风险,导致疫苗的有效性大幅降低[58]。随着临床随访资料的积累及COVID‐19并发症及疫苗增强性疾病(vaccine‐enhanced disease,VED)的潜在风险增加,研究者对SARS‐CoV‐2 仅通过ACE2 受体途径入侵宿主细胞提出了质疑,并开始关注其他受体途径。CypA/CD147 作为跨膜糖蛋白受体在CVD 进展中发挥重要作用,前期研究也已证实,CypA/CD147可作为SARS‐CoV‐2入侵宿主细胞表面受体途径,其人源化抗CD147 抗体meplazeumab 能够阻断SARS‐CoV‐2及 其VOC Alpha、Beta、Gamma、Delta[59],但 在COVID‐19并发CVD中的相关性却鲜有报道。
本文总结当前研究证据并结合前期研究基础对SARS‐CoV‐2 通过CypA/CD147 入侵心血管系统引发CVD的相关机制进行探讨发现,SARS‐CoV‐2入侵心肌细胞的方式有两种,一是SARS‐CoV‐2 S 蛋白直接与受体CypA/CD147 结合入侵,二是SARS‐CoV‐2 裂解的游离S蛋白与CypA/CD147结合。目前,仅依赖于ACE2 受体不足以解释SARS‐CoV‐2 极强的感染力和传播力,SARS‐CoV‐2 的其他受 体还包括AXL、CD147、GRP78、ASGR1、KREMEN1,这些受体之间是否存在相互作用,以及其关键作用结构域如何定位[46],深入研究这种互作关系将为后期的抗COVID‐19药物、疫苗研发以及临床合理用药提供新思路。此外,心肌炎被认为是SARS‐CoV‐2 感染和COVID‐19 mRNA疫苗接种导致的一种罕见但严重的并发症[60]。SARS‐CoV‐2 对心肌细胞造成的直接损害,以及mRNA 疫苗触发机体强烈的免疫反应是心肌 炎 发 病 的 关 键 机 制[61],Toll 样 受 体(Toll‐like receptors,TLRs)是先天免疫系统的关键调节因子[62],SARS‐CoV‐2 复制或转录的中间产物dsRNA 被TLR3识别并驱动β干扰素TIR结构域衔接蛋白(TRIF)介导的NF‐κB 等炎症信号,可促进促炎基因的转录和翻译[61]。TLR3 可能作为识别SARS‐CoV‐2 的配体,通过TLR3、NF‐κB信号通路在心肌细胞凋亡和炎症反应中发挥关键调控作用[63]。因此,推测COVID‐19患者体内游离的SARS‐CoV‐2 S 蛋白可通过血液循环进入心血管系统,靶向心肌细胞表面CD147 受体,通过CyPA/CD147 途径入侵心肌细胞,激活下游TLR3信号通路,释放细胞因子诱发心肌炎(图1)。此科学假说也是本课题组下一步聚焦研究的工作。
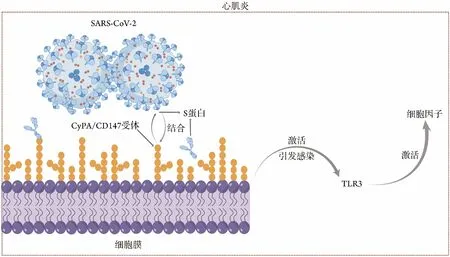
图1 SARS‐CoV‐2通过CyPA/CD147激活TLR3信号通路诱发心肌炎Fig.1 SARS‐CoV‐2 induces myocarditis by activating the TLR3 signaling pathway through CyPA/CD147
自2019年COVID‐19疫情爆发至今,SARS‐CoV‐2易发生突变的特性及COVID‐19并发症的多样性迫切需要研究者从不同维度去阐明致病机制,而SARS‐CoV‐2 VOC 免疫逃逸能力的增强也对当前疫苗及药物研发提出了新的挑战。因此,深入探讨SARS‐CoV‐2 复制周期中的入侵途径,完善SARS‐CoV‐2 致病的分子机制,对于COVID‐19的诊疗意义深远。
