西达本胺联合PD-1抑制剂对结直肠癌小鼠CD8+ T细胞抗肿瘤功能的影响
2024-02-29董亮李祥高志涛贾慧婕赵铁锁
董亮,李祥,高志涛,3,贾慧婕,赵铁锁*
1新乡医学院基础医学院免疫学系,河南新乡 453003;2解放军总医院第一医学中心生物治疗科,北京 100853;3新乡医学院检验学院,河南新乡 453003
结直肠癌是威胁人类健康的恶性肿瘤之一。统计显示,2022年中国预计新发癌症病例4 796 996例,其中结直肠癌占12.3%,居第2位[1‐2],其带来的健康威胁日趋严重。随着肿瘤免疫治疗的兴起,以程序性死亡受体‐1(programmed death receptor‐1,PD‐1)及其配体(programmed cell death ligand 1,PD‐L1)为代表的 免 疫 检 查 点 抑 制 剂(immune checkpoint inhibitors,ICIs)在临床广泛应用[3‐4],可恢复效应T 细胞的活性,增强抗肿瘤免疫应答反应,在多种恶性肿瘤的研究和治疗中取得了重大进展[5‐8]。然而研究显示,PD‐1 抑制剂在实体瘤中的应答率仅为10%~30%,对大多数癌症仍然无效[9‐10]。因此,采用合理的联合治疗策略优化结直肠癌ICIs 的治疗效果是临床和科研工作者亟待解决的问题。表观遗传改变在结直肠癌的发生发展中起着关键作用,DNA甲基化、组蛋白修饰及非编码RNA调节等是表观遗传修饰的主要方式[11‐15]。组蛋白乙酰化与组蛋白去乙酰化过程由组蛋白乙酰化转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)共同调控并处于动态平衡,而肿瘤细胞中HDACs的活性异常增强或HAT表达降低,导致组蛋白去乙酰化作用异常,抑癌基因的转录表达受到抑制,从而诱发或促进了肿瘤的生长。HDAC 抑制剂可提高染色质组蛋白的乙酰化水平,调控肿瘤细胞相关基因的表达,抑制肿瘤细胞增殖、诱导其凋亡等[12,16‐17]。除直接抗肿瘤作用外,HDAC 抑制剂还可作为免疫调节剂发挥抗肿瘤效应。研究显示,HDAC‐6 去乙酰化可促进T 细胞耗竭并抑制PD‐1 抑制剂介导的T 细胞效应功能,而乙酰化则可增强PD‐1 抑制剂介导的T细胞效应功能[18]。西达本胺作为我国自主研发的苯甲酰胺类HDAC 抑制剂,已被批准用于治疗复发难治的外周T 细胞淋巴瘤,具有较好的耐受性、安全性,对多种恶性肿瘤均具有显著疗效[19]。既往研究发现,Ⅰ类HDAC 抑制剂恩替诺特(MS‐275)可促进CD8+T细胞的增殖和杀伤活性,增强其对肿瘤细胞的识别能力,抑制肿瘤细胞增殖[20]。由此推测,西达本胺联合PD‐1 抑制剂治疗肿瘤可能具有协同作用。为此,本研究通过结直肠癌小鼠移植瘤模型及体外细胞实验,探讨了西达本胺联合PD‐1抑制剂对CD8+T细胞抗肿瘤功能的影响。
1 材料与方法
1.1 主要试剂及仪器 RMPI 1640培养基、PBS缓冲液、0.25%胰酶、FBS胎牛血清(美国Gibco公司);流式 细 胞 术anti‐CD45‐BV510、anti‐CD3‐PerCP、anti‐CD8α ‐FITC、 anti‐IFN‐ γ ‐PE、 anti‐CD11b‐BV421、anti‐F4/80‐AF‐488、anti‐Gr1‐DZ594、anti‐CD25‐PC7、anti‐CD4‐APC、anti‐FOX‐p3‐PC5.5、anti‐CD107a‐APC、anti‐Ki‐67‐FITC 抗体及5(6)‐羧基二乙酸荧光素N‐琥珀酰亚胺酯(CSFE) (美国BioLegend 公司);T‐Select H‐2Kb OVA Tetramer‐SIINFEKL‐APC(日本MBL 公司);Cell Stimulation Cocktail(美国Ebioscience 公司);小鼠肿瘤组织解离试剂盒、小鼠Naive CD8+T 细胞分选试剂盒(德国美天旎公司);Annexin V:FITC Apoptosis Detection Kit(美 国BD 公 司);西 达 本 胺(美 国MedChemExpress 公司);anti‐PD‐1(美国Bio‐X‐Cell 公司)。Beckman‐DxFLEX 流 式 细 胞 仪(美 国Beckman公司)。
1.2 实验动物及细胞 雄性C57BL/6 小鼠80 只,5周龄,体重20 g,购自北京斯贝福实验动物技术有限公司[动物合格证编号:SCXK(京)2019‐0010];OT‐1 转 基 因 小 鼠(C57BL/6‐Tg[TcraTcrb]1100Mjb/J)10只,5周龄,由清华大学药学院张永辉教授惠赠。MC38‐OVA结肠癌细胞株[表达卵清蛋白(OVA)]由解放军总医院第一医学中心生物治疗科实验室保存。
1.3 动物实验
1.3.1 小鼠结直肠癌移植瘤模型的建立 将MC38‐OVA结肠癌细胞接种于C57BL/6小鼠背部皮下(接种量2×105个/只),接种体积为100 µl。将MC38‐OVA荷瘤小鼠随机分为对照组、西达本胺组、anti‐PD‐1组与西达本胺+anti‐PD‐1组,每组20只,荷瘤第5天开始给药。西达本胺组灌胃给予西达本胺10 mg/kg[西达本胺悬浮于0.5%羧甲基纤维素钠(CMC‐Na)中],100 µl/只,连续给药3 d,间隔2 d,共3 次;anti‐PD‐1 组腹腔注射anti‐PD‐1,200 µg/只,第10 天开始给药,每周2 次,共4 次;西达本胺+anti‐PD‐1组灌胃给予西达本胺10 mg/kg(100 µl/只,连续给药3 d,间 隔2 d,共3 次),并 腹 腔 注 射anti‐PD‐1(200 µg/只,第10 天开始给药,每周2 次,共4 次)。对照组给予安慰剂(0.5%羧甲基纤维素钠,PBS)治疗。给药方式见图1。本研究通过解放军总医院动物福利伦理委员会审查(2018‐X14‐81),实验过程符合国家和单位有关实验动物的管理和使用规定。

图1 小鼠给药模式图Fig.1 Schedule of mouse treatments
1.3.2 肿瘤生长情况观察 每天观察荷瘤小鼠肿瘤生长情况,当小鼠肿瘤最长径≥20 mm,减重超过总体重15%时,脱颈处死,计算肿瘤体积。肿瘤体积(mm3)=长度(mm)×宽度(mm)2/2。
1.3.3 生存分析 各组取10 只小鼠,观察生存期,观察终点为荷瘤后第50天。每天随时观察,记录小鼠死亡时间(以天为单位)。计算各组小鼠存活率。
1.3.4 肿瘤组织解离及检测 荷瘤第22天取各组小鼠肿瘤组织,使用小鼠肿瘤组织解离试剂盒制备单细 胞 悬 液,加 入Cell Stimulation Cocktail 于 孵 箱(37 ℃、5% CO2)中 处 理4~6 h,加 入anti‐CD45‐BV510、anti‐CD3‐PerCP、anti‐CD8α‐FITC、anti‐IFN‐γ‐PE、T‐Select H‐2Kb OVA Tetramer‐SIINFEKL‐APC、anti‐CD11b‐BV421、anti‐F4/80‐AF‐488、anti‐Gr1‐DZ594、anti‐CD25‐PC7、anti‐CD4‐APC、anti‐FOX‐p3‐PC5.5 抗体标记后,采用流式细胞仪检测CD8+T 细胞(CD45+CD3+CD8+)、调节性T细胞(Treg,CD45+CD4+CD25+FOX‐p3+)、 髓 系 衍 生 抑 制 细 胞(MDSC,CD45+CD11b+Gr1+)、肿瘤相关巨噬细胞(TAM,CD45+CD11b+F4/80+)的比例及功能。
1.4 细胞实验
1.4.1 CD8+T 细胞的分离与培养 采用小鼠Naive CD8+T 细胞分选试剂盒分离OT‐1 转基因小鼠脾脏CD8+T 细胞并计数,以RMPI 1640 培养基(含10%FBS、100 U/ml 青 霉 素 与100 µg/ml 链 霉 素)按 照3×106个/孔重悬后,铺于anti‐CD3ε抗体(10 µg/ml)与CD28 抗体(10 µg/ml)包被的24 孔板中,加入小鼠重组白细胞介素‐2(rIL‐2,500 U/ml)进行扩增培养。
1.4.2 流式细胞仪检测CD8+T 细胞及MC38‐OVA 结肠癌细胞凋亡情况 CD8+T 细胞或MC38‐OVA 结肠癌细胞经0、10、25、50、100、200 nmol/L西达本胺处理48 h(5% CO2、37 ℃)后,1500 r/min 离心5 min,PBS洗涤2次;加入100 µl结合缓冲液重悬细胞,避光加入5 µl Annexin‐V‐FITC 和7‐ADD‐PE,室温避光孵育15 min;加入400 µl结合缓冲液重悬,采用流式细胞仪检测细胞凋亡情况。
1.4.3 细胞计数法及Ki‐67 抗体标记法流式检测CD8+T细胞和MC38‐OVA结肠癌细胞凋亡情况CD8+T 细胞和MC38‐OVA 结肠癌细胞经0、10、25、50、100、200 nmol/L 西 达 本 胺 处 理24、48、72、96 h 时,采用细胞计数法及Ki‐67 抗体标记法流式检测CD8+T细胞和MC38‐OVA细胞的增殖情况。
1.4.4 流式细胞仪检测CD8+T 细胞对MC38‐OVA 结肠癌细胞的杀伤能力 CD8+T细胞经0、100 nmol/L西达本胺处理48 h 后,加入25 µg/ml anti‐PD‐1,与CSFE标记的肿瘤细胞按预定效靶比于96孔板中共培养24 h。设置对照组、西达本胺组、anti‐PD‐1 组与西达本胺+anti‐PD‐1 组,效靶比为CD8+T 细胞(E:效应细胞)∶MC38‐OVA(T:靶细胞) (E∶T=5∶1、2∶1、1∶1、1∶2),并设置单独的MC38‐OVA结肠癌细胞为背景组。共培养24 h 后,采用流式细胞仪检测杀伤能力(处理方式如图2)。OT‐1小鼠T细胞杀伤率(%)=[1-实验组活细胞数量(CSFE+)/背景组活细胞数量(CSFE+)]×100%。

图2 OT‐1小鼠CD8+ T细胞体外活化及MC38‐OVA细胞共培养模式图Fig.2 Treatment schedule for in vitro activation of OT‐1 mice CD8+ T cells with MC38‐OVA cells as indicated
1.4.5 流式细胞仪检测CD8+T 细胞中CD107a 的表达 CD8+T 细胞(E:效应细胞)经0、100 nmol/L 西达 本 胺 处 理48 h 后,取 相 同 数 量 的CD8+T 细 胞、MC38‐OVA 肿瘤细胞(T:靶细胞)(E∶T=1∶1)于96 孔板中,加入3 µl anti‐CD107a 抗体孵育30 min,随后加入高尔基体阻断剂共培养4~6 h,采用流式细胞仪检测CD107a的表达情况。
1.5 统计学处理 采用SPSS 22.0 软件进行统计分析,GraphPad Prism 5.0软件作图。计量资料以x±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD‐t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组荷瘤小鼠肿瘤生长情况 MC38‐OVA 荷瘤小鼠肿瘤生长曲线显示,与对照组、西达本胺组、anti‐PD‐1组比较,西达本胺+anti‐PD‐1组肿瘤生长明显延缓,荷瘤第22 天肿瘤体积减小(P<0.05),但西达本胺组、anti‐PD‐1 组与对照组荷瘤第22 天肿瘤体积差异无统计学意义(P>0.05,图3)。

图3 各组MC38‐OVA荷瘤小鼠肿瘤生长情况Fig.3 Tumor growth of MC38‐OVA tumor‐bearing mice in each group
2.2 各组MC38‐OVA 荷瘤小鼠生存分析 生存分析结果显示,对照组荷瘤小鼠第17 天开始出现死亡,西达本胺+anti‐PD‐1 组第28 天开始出现死亡;对照组、西达本胺组、anti‐PD‐1 组、西达本胺+anti‐PD‐1组50 d 存活率分别为0、20%、30%、50%;与对照组、西达本胺组、anti‐PD‐1 组比较,西达本胺+anti‐PD‐1组荷瘤小鼠存活率最高;西达本胺+anti‐PD‐1组与对照组存活率差异有统计学意义(P<0.01,图4)。
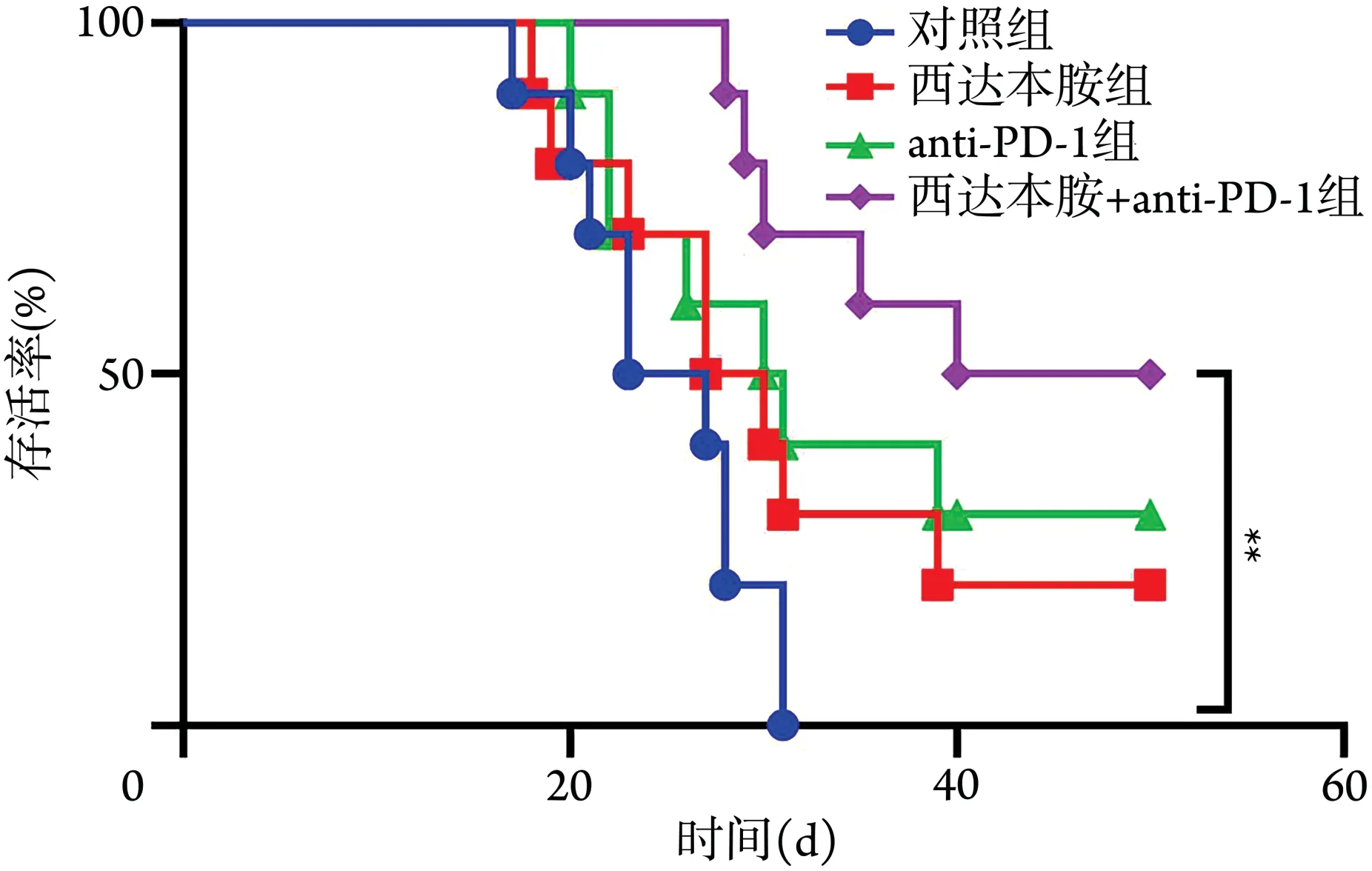
图4 各组MC38‐OVA荷瘤小鼠生存曲线(n=10)Fig.4 Survival curves of MC38‐OVA tumor‐bearing mice in each group (n=10)
2.3 各组MC38‐OVA荷瘤小鼠CD8+T、Treg、MDSC、TAM细胞检测结果 流式细胞仪检测结果显示,西达本胺组、anti‐PD‐1组、西达本胺+anti‐PD‐1组肿瘤浸润CD3+CD8+T 细胞比例较对照组明显增高(分别为30.15%±2.12%、 34.33%±1.22%、 35.64%±1.51%vs.18.26%±1.56%,P<0.05),每1×106个细胞中CD8+T细胞数量较对照组明显增加[(29 119±3902)个、(31 363±3312) 个、 (33 661±2012) 个vs.(21 495±3139) 个,P<0.05];西达本胺+anti‐PD‐1 组肿瘤浸润CD3+CD8+T 细胞比例及CD8+T 细胞数量与西达本胺组、anti‐PD‐1组比较差异无统计学意义(P>0.05)(图5A、B)。
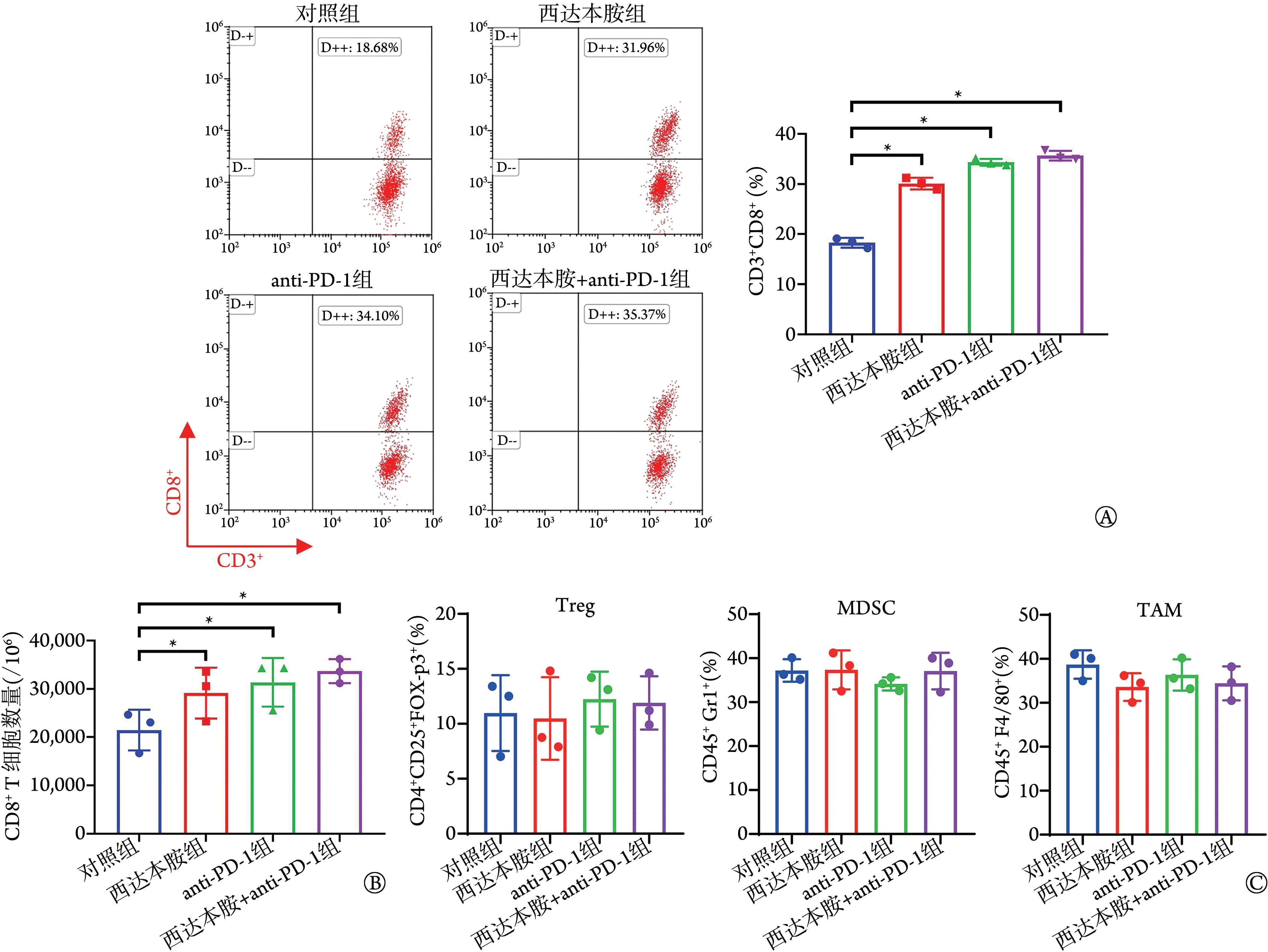
图5 各组MC38‐OVA荷瘤小鼠CD8+ T、Treg、MDSC、TAM细胞检测结果(n=3)Fig.5 Expression of CD8+ T, Treg, MDSC and TAM in MC38‐OVA tumor‐bearing mice in each group (n=3)
与对照组比较,西达本胺组、anti‐PD‐1 组、西达本胺+anti‐PD‐1组荷瘤小鼠肿瘤组织中免疫抑制相关细胞Treg、MDSC、TAM 的比例差异无统计学意义(P>0.05,图5C)。
与对照组比较,西达本胺组、anti‐PD‐1 组、西达本胺+anti‐PD‐1组CD8+IFN‐γ+T细胞比例及数量均增加(P<0.05),西达本胺+anti‐PD‐1 组CD8+IFN‐γ+T细胞比例及数量均明显高于西达本胺组、anti‐PD‐1组(P<0.05,图6)。
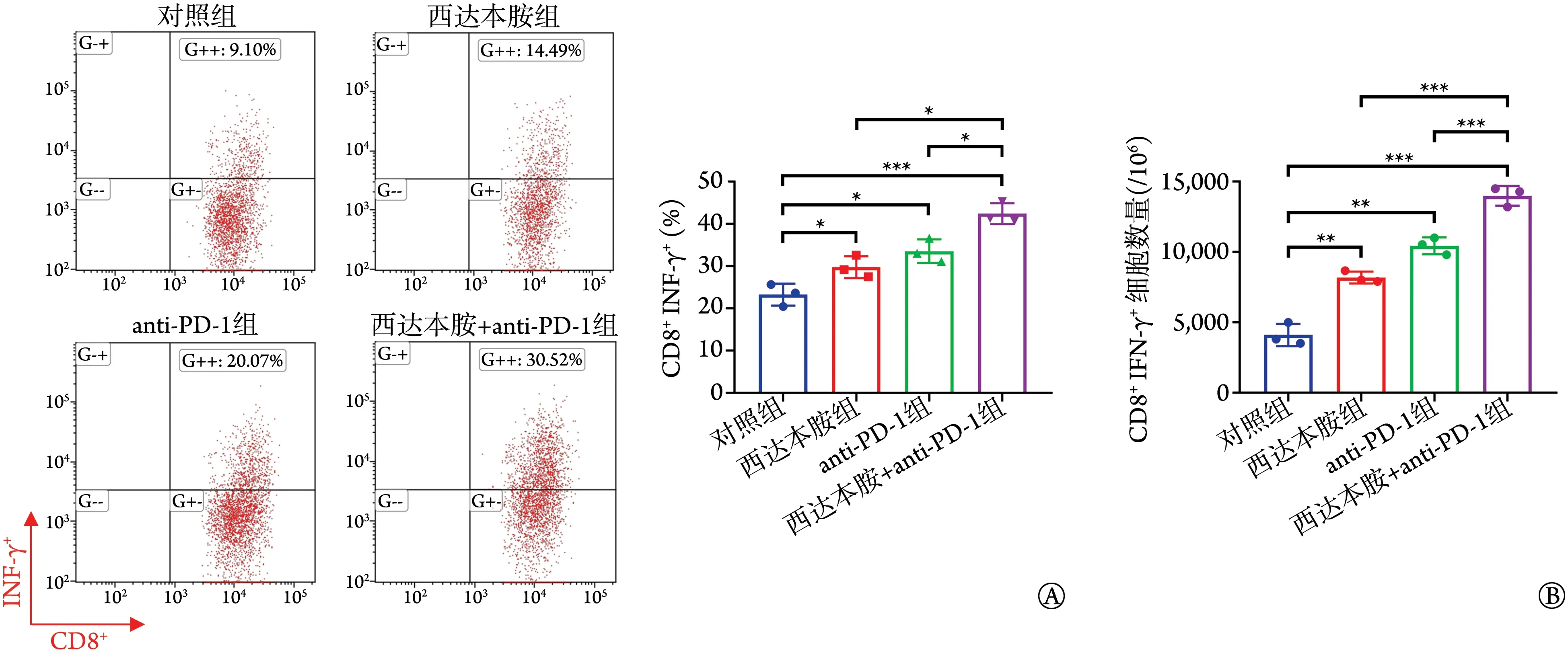
图6 各组荷瘤小鼠肿瘤浸润CD8+ T细胞IFN‐γ检测结果(n=3)Fig.6 IFN‐γ of tumor infiltrating CD8+ T cells of tumor‐bearing mice in each group (n=3)
与对照组比较,西达本胺组、anti‐PD‐1 组、西达本胺+anti‐PD‐1 组OVA 抗原特异性CD8+Tetramer+T细胞比例及数量均明显增加(P<0.001),西达本胺+anti‐PD‐1 组OVA 抗原特异性CD8+Tetramer+T 细胞比例及数量均明显高于西达本胺组、anti‐PD‐1 组(P<0.001,图7)。
2.4 西达本胺对CD8+T细胞活力及功能影响的体外实验
2.4.1 西达本胺对CD8+T 细胞及MC38‐OVA 细胞增殖及凋亡的影响 流式细胞仪检测结果显示,0、10、25、50、100、200 nmol/L 组CD8+T 细胞凋亡率分别 为5.66%±0.23%、5.53%±0.31%、5.80%±0.27%、5.76%±0.31%、 5.76%±0.48%、 6.46%±0.24%, 与0、10 nmol/L 组比较,200 nmol/L 组CD8+T 细胞凋亡率明显增高(P<0.05,图8A)。为了避免西达本胺对CD8+T 细胞活力的影响,选择100 nmol/L 西达本胺进行后续实验。

图8 西达本胺对CD8+ T细胞及MC38‐OVA细胞体外增殖及凋亡的影响(n=3)Fig.8 Effect of chidamide to proliferation and apoptosis of CD8+T cells and MC38‐OVA cells in vitro (n=3)
细胞计数法及Ki‐67抗体标记法流式检测CD8+T细胞的增殖情况,结果显示,与0 nmol/L 组相比,100 nmol/L西达本胺组CD8+T细胞数量及Ki‐67的表达在共培养24、48、72、96 h 差异均无统计学意义(P>0.05,图8A)。
流 式 细 胞 仪 检 测0、 10、 25、 50、 100、200 nmol/L 西达本胺对MC38‐OVA 细胞凋亡的影响,结果显示,各组细胞凋亡率差异均无统计学意义(P>0.05,图8B)。细胞计数法及Ki‐67抗体标记法流式检测MC38‐OVA细胞的增殖情况,结果显示,0 nmol/L组与100 nmol/L 西达本胺组MC38‐OVA 细胞数量及Ki‐67 的表达在共培养24、48、72、96 h 差异均无统计学意义(P>0.05,图8B)。
2.4.2 西达本胺联合PD‐1抑制剂对CD8+T细胞杀伤功能的影响 流式细胞仪检测西达本胺对CD8+T细胞中CD107a表达的影响,结果显示,与0 nmol/L 组比较,100 nmol/L西达本胺组CD8+T细胞的CD107a+表 达 率 明 显 增 高[19.04%±0.24%vs.14.64%±0.353%,P<0.05,图9A)。
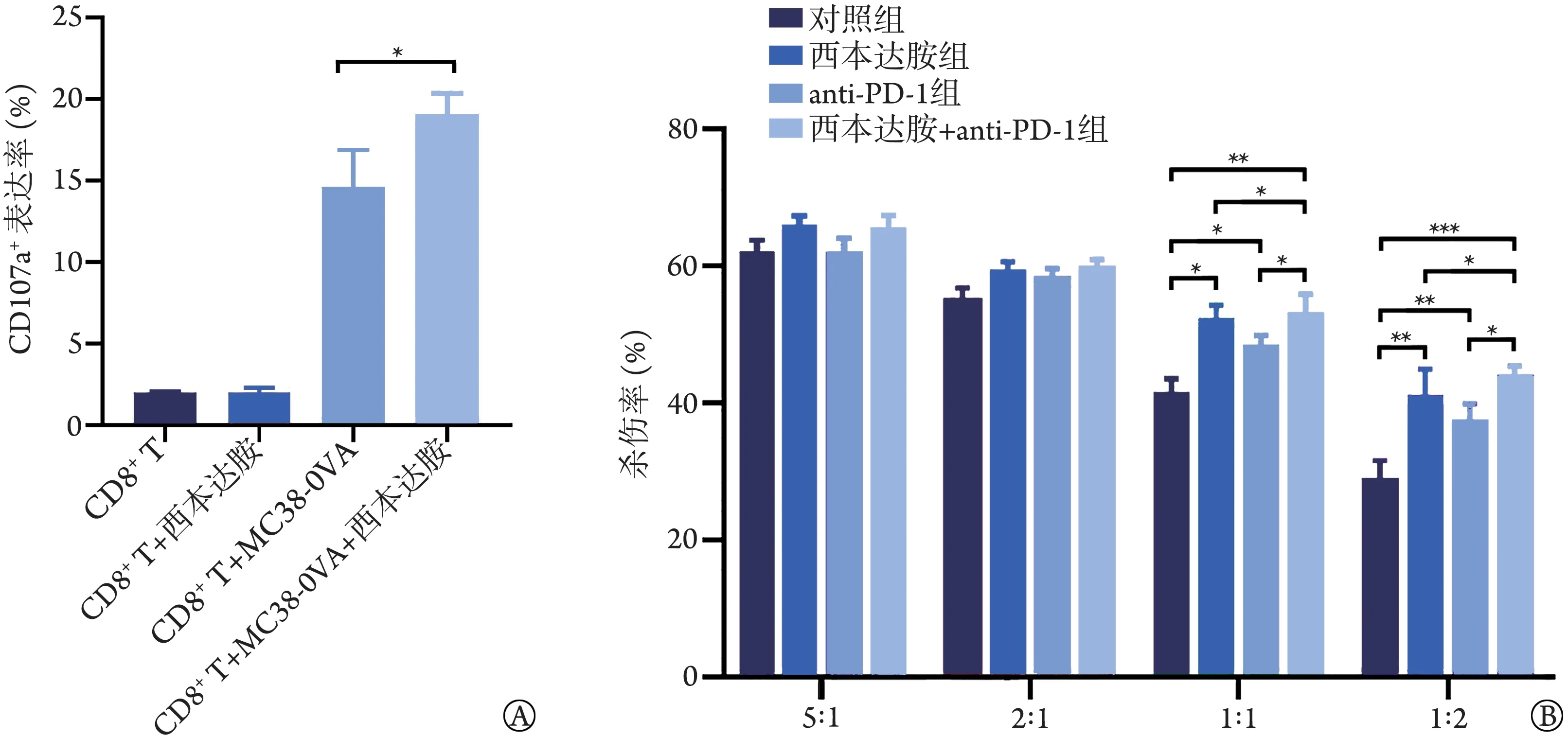
图9 西达本胺联合PD‐1抑制剂对CD8+ T细胞体外杀伤功能的影响(n=3)Fig.9 Effect of chidamide combined PD‐1 inhibitor with on CD8+ T cells function in vitro (n=3)
流式细胞仪检测西达本胺联合PD‐1 抑制剂对CD8+T细胞杀伤能力的影响,结果显示,与对照组比较,西达本胺组、anti‐PD‐1 组、西达本胺+anti‐PD‐1 组在E∶T=1∶1、1∶2 条件下杀伤效果明显增加(P<0.05);西 达 本 胺+anti‐PD‐1 组 较 西 达 本 胺 组、anti‐PD‐1 组杀伤率进一步增高[E∶T=1∶1:53.31%±1.93%vs.52.46%±2.04%vs.48.60%±1.12%,P<0.05;E∶T=1∶2:44.21%±1.26%vs.41.21%±2.82%vs.37.68%±1.78%;P<0.05,图9B]。表明西达本胺可增加CD8+T 细胞CD107a的表达,西达本胺联合PD‐1抑制剂对肿瘤细胞的杀伤能力具有协同作用。
3 讨 论
免疫检查点是一系列调控免疫激活程度的信号分子,包括PD‐1、PD‐L1、细胞毒性T淋巴细胞相关蛋 白4(cytotoxic T‐lymphocyte associated protein 4,CTLA‐4)、淋巴细胞活化基因3(lymphocyte activation gene 3, LAG‐3)、 T 细 胞 免 疫 球 蛋 白3(T cell immunoglobulin 3,TIM‐3)等。作为CD28家族中的抑制性受体,PD‐1与位于抗原呈递细胞表面的配体结合后,可抑制T 细胞的激活,起到免疫“刹车”的作用。然而,肿瘤细胞可利用这一机制,在其表面表达PD‐L1,抑制T 细胞的功能,从而实现免疫逃逸。PD‐1/PD‐L1 抑制剂则可通过结合抑制PD‐1 或PD‐L1而抑制该通路,解除对T细胞的抑制,激活免疫系统,进而发挥抗肿瘤作用。尽管以PD‐1抑制剂为代表的免疫疗法取得了瞩目的治疗效果,但原发性与继发性抵抗仍是为PD‐1抑制剂等免疫疗法的巨大阻碍[21‐22]。研究发现,诸多因素可导致肿瘤对PD‐1 抑制剂的原发性与继发性抵抗,包括PD‐L1 表达、T 细胞耗竭、浸润T 淋巴细胞减少、肿瘤突变负荷、介导免疫的关键信号通路受损(如IFN‐γ 信号通路)、肿瘤介导免疫抑制和耐药基因表达、肿瘤表观遗传特征异常(如DNA 甲基化、组蛋白调节、核小体重塑、非编码RNA表达异常等)、肠道微生物菌群以及代谢水平(如胆固醇代谢、鞘糖脂代谢)改变等[23]。有研究发现,联合疗法是克服PD‐1抑制剂抵抗、提高PD‐1抑制剂反应性的重要策略,通过联合化疗、靶向药物、表观遗传药物、细胞因子(如IL‐2),以及其他ICIs 可克服PD‐1 抑制剂治疗抵抗,从而增强治疗效果[24‐25]。本研究结果显示,HDAC抑制剂西达本胺联合PD‐1抑制剂能够明显增加小鼠结直肠癌模型中肿瘤浸润CD8+T 细胞及抗原特异CD8+T 细胞的数量,并提高CD8+T 细胞中IFN‐γ 的表达,从而抑制肿瘤细胞增长。生存分析发现,西达本胺+anti‐PD‐1组与西达本胺组、anti‐PD‐1组小鼠的存活率无明显差异,即使西达本胺+anti‐PD‐1组较西达本胺组、anti‐PD‐1 组CD8+T 细胞浸润及抑制肿瘤生长的效果强。分析原因可能与观察时间过短有关,因此后续实验可延长观察时间,完善西达本胺联合PD‐1抑制剂在小鼠结直肠癌中的相关研究。
表观遗传基因调控异常是癌症的重要标志。肿瘤抑制基因或生长调节基因启动子区域低乙酰化和高甲基化致使基因沉默,导致肿瘤生长失控。组蛋白乙酰化状态是调控基因转录的关键因素,HDAC作为表观药物靶点,有可能重新激活沉默的基因。HDAC 抑制剂(如罗米地辛、伏瑞斯特、帕比斯他等)作为抗肿瘤药物已被广泛应用,其作用主要体现在抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、恢复耐药细胞对放化疗药物的敏感性等方面[26‐27]。西达本胺是我国自主研发合成的首个泛HDAC口服抑制剂,通过提高组蛋白乙酰化水平引发染色质重塑,重新激活肿瘤细胞中由于组蛋白去乙酰化异常而表达受阻的基因,诱导肿瘤细胞凋亡[28]。本研究结果显示,0、10、25、50、100 nmol/L 西达本胺对MC38‐OVA结肠癌细胞和CD8+T 细胞凋亡无明显影响,而200 nmol/L 西达本胺对MC38‐OVA 结肠癌细胞凋亡无影响,但可影响CD8+T 细胞的凋亡。随后采用100 nmol/L 西达本胺处理CD8+T 细胞与肿瘤细胞,结果发现西达本胺处理后CD8+T 细胞对MC38‐OVA结肠癌细胞的杀伤作用明显增强,CD107a的表达明显增加,进一步证实了西达本胺可增强CD8+T细胞的抗肿瘤功能,且与PD‐1抑制剂联合使用时可起到协同作用,发挥更显著的抗瘤活性。
既往研究发现,表观遗传药物HDAC 抑制剂可诱导肿瘤微环境中NK 细胞和CD8+T 细胞的数量和功能增强[29],同时可增加肿瘤相关抗原的表达,活化免疫相关通路,导致T 淋巴细胞的抗肿瘤反应增强。近年来关于免疫疗法联合表观药物治疗已开展了大量基础研究及临床试验,并取得了较好的结果[14]。本研究结果显示,单纯使用西达本胺即可增加CD8+T细胞中IFN‐γ的表达,而联合PD‐1抑制剂可进一步增加CD8+T 细胞中IFN‐γ 的表达。体外实验证实,100 nmol/L 西达本胺可诱导CD8+T 细胞的杀伤能力增强,但不影响T 细胞及肿瘤细胞的凋亡和增殖;而anti‐PD‐1在体外虽然增强了CD8+T细胞对肿瘤细胞的杀伤能力,但不如西达本胺效果显著,可能是由于体外不能模拟肿瘤微环境中T 细胞的耗竭状态。
本研究存在一定局限性。首先,不同肿瘤细胞系间存在较大的异质性,对药物的敏感性有所不同,本研究只采用了一种细胞进行实验,西达本胺联合PD‐1抑制剂的治疗效果是否具有普遍性仍需进一步探讨;其次,未能在体外实验中对西达本胺增强CD8+T细胞杀伤功能的作用机制进行深入研究,后续可进一步探索西达本胺增强T 细胞功能的作用机制,为表观药物增效免疫治疗的策略提供依据。
综上所述,本研究结果显示,西达本胺联合PD‐1抑制剂可协同作用于结直肠癌模型中CD8+T细胞,进而增强抗肿瘤效应,该结果为西达本胺联合ICIs的临床应用提供了理论依据。
