β淀粉样蛋白受体PirB对小鼠星形胶质细胞增殖及反应性增生的影响
2024-02-29赵沅杰拓振杰尚培骏杨锦雯张晓华
赵沅杰,拓振杰,尚培骏,杨锦雯,张晓华
1西安医学院公共卫生学院,陕西西安 710021;2厦门大学神经科学研究所/福建省神经退行性疾病及衰老研究重点实验室,福建厦门 361005
阿尔茨海默病(Alzheimer's disease,AD)是一种神经退行性疾病,以渐进性记忆障碍、失语、失用、人格行为改变等症状为主要表现[1‐3]。AD 病程缓慢,呈进行性发展,随着患病时间增加,疾病严重程度也不断加深[4‐5]。AD的典型病理特征主要为β淀粉样蛋白(amyloid β,Aβ)沉积引起的细胞外老年斑、Tau蛋白过度磷酸化导致的神经原纤维缠结、神经元突触丢失和星形胶质细胞反应性增生等[4]。AD的发病机制尚不明确,也缺少有效的治疗和预防手段。随着人口老龄化的加重,AD逐渐成为威胁老年人身心健康的疾病之一[6]。星形胶质细胞在中枢神经系统分布广泛[7‐9],在中枢神经系统发生损伤时常反应性增生[7‐10]。反应性增生的星形胶质细胞可能对神经元产生“保护”或“毒性”两种不同效应[9,11],调节其增生过程可能成为治疗AD的潜在路径。成对免疫球蛋 白 样 受 体B(paired immunoglobulin‐like receptor B,PirB)属于I 型跨膜糖蛋白,是Aβ1‐42寡聚体的受体。既往研究显示,PirB 可抑制神经元轴突再生和树突棘修剪[12];PirB 过表达可在 LPS 诱导的大鼠脑内炎症中导致突触减少,损害学习记忆功能[13]。上述研究提示PirB可能成为AD的潜在治疗靶点,但其在星形胶质细胞中的作用尚不清楚。本研究观察PirB 对小鼠星形胶质细胞增殖和反应性增生的影响,旨在为探索PirB作为AD潜在治疗靶点提供理论依据。
1 材料与方法
1.1 主要试剂及仪器 D‐Hanks 液(无Ca2+、无Mg2+)、甘氨酸溶液(G8200,北京索莱宝科技有限公司);4%多聚甲醛(G1101‐500 ml,武汉赛维尔生物);异丙醇溶液(天津天力化学试剂有限公司);DEPC水(B501005‐0500,上海生工生物工程);DMEM‐高糖培养基(美国HyClone公司);DMEM/F12完全培养基(美国Gibco 公司);聚‐D‐赖氨酸氢溴酸盐(PDL,美国Sigma‐Aldrich 公司);兔抗神经胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP) 多 克 隆 抗 体(ab68428)、兔抗GFAP 单克隆抗体、山羊抗兔辣根过氧化物酶(horseradish peroxidase,HRP)抗体(英国Abcam 公司);山羊抗兔Fluo488 抗体(SA00003‐1,美国Proteintech 公司);4',6‐二脒基‐2‐苯基吲哚(DAPI)(BD5010,美国Bioworld 公司);无水二甲亚砜(DMSO)(D2650‐100ml,美 国Sigma 公 司);重 组 人Aβ1‐42、HFIP(AG968‐1MG)、化 学 发 光HRP 底 物(WBKLS0100)(美国Millipore 公司);Trizol、限制性内切酶NdeⅠ和Hind Ⅲ、TaKaRa 反转录试剂盒、TaKaRa qPCR 试剂盒(日本Takara公司);EdU试剂盒[Cell‐Light EdU Apollo567 In Vitro Kit(100T),广州锐博生物];0.1 ml 八连管(KG2541,美国Kirgen 公司);10%磷酸酶抑制剂(4906845001,德国Roche 公司);1%蛋白酶抑制剂(36978,美国赛默飞世尔科技公司);RIPA裂解液(P0013B,上海碧云天);H‐7650透射电子显微镜(日本日立公司);eStain2.0蛋白快染仪(美 国GenScript 生 物 科 技 公 司);RTCA 分 析 仪(xCElligence RTCA DP,杭州艾森生物);SDS‐PAGE胶电泳(蛋白marker)、NanoDrop One(ND‐ONEC‐W)、PCR 仪 (Veriti96 PCR)、 Real‐Time PCR 仪(StepOnePlus) ( 美国赛默飞世尔科技公司);ChemiDoc Touch 化 学 发 光 成 像 系 统(美 国Bio‐Rad公司)。
1.2 方法 选用小鼠星形胶质细胞,采用PirB 抑制剂氟司必林(Fluspirilene)[14]或可溶性的PirB 胞外段PirBex(PEP)[15]抑制PirB与Aβ的结合,并采用慢病毒转染纯化的星形胶质细胞、过表达PirB基因,观察PirB对小鼠星形胶质细胞增殖和反应性增生的影响。本研究经西安医学院伦理审查委员会审核(20180309)。
1.2.1 细胞分组与给药 将小鼠星形胶质细胞分为对 照 组、 Aβ 组、 Aβ +0.2 µmol/L PEP 组、 Aβ+0.4 µmol/L PEP 组、Aβ+Fluspirilene 组、Aβ+GFP‐LV组和Aβ+mPirB‐LV 组。(1)Aβ 组,当细胞融合率达60%时给予2 µmol/L Aβ 处理。(2)Aβ+0.2 µmol/L PEP组、Aβ+0.4 µmol/L PEP 组和Aβ+Fluspirilene 组,分别在Aβ 给 药 前1 h 加 入0.2、0.4 µmol/L 的PEP 或2 µmol/L Fluspirilene。(3)Aβ+GFP‐LV 组和Aβ+mPirB‐LV 组,当细胞融合率达到50%时将培养基换液至原来体积的一半,加入10 µl/ml 慢病毒进行转染,4 h后更换新鲜培养基,24 h 后加入2 µmol/L Aβ。(4)对照组给予相同体积的DMSO 处理。病毒为汉恒生物科技(上海)有限公司包装,滴度为108TU/ml。
1.2.2 小鼠星形胶质细胞的培养、纯化和传代 原代星形胶质细胞取自C57BL/6 新生小鼠的大脑皮层和海马(出生24 h 以内)。培养的小鼠星形胶质细胞融合率达到90%后进行摇床纯化。将细胞悬液接种于若干PDL包被的T25培养瓶或培养皿,传代培养。采用GFAP 免疫荧光法鉴定小鼠星形胶质细胞的纯度。选 取10 个 视 野,采 用Image Pro Plus 软 件 对GFAP和DAPI阳性细胞分别计数,计算细胞GFAP阳性率。
1.2.3 Aβ1‐42寡聚体的制备 将Aβ1‐42配成1 mmol/L的DMSO 溶 液。加 入0.01 mol/L PBS 缓 冲 液 制 成0.1 mmol/L Aβ1‐42储存液。置于22 ℃孵育16 h,4 ℃孵育24 h,12 000 r/min 离心10 min,取上清即为Aβ储备液。储备液分装冻存于-20 ℃。BCA 法定量并在透射电镜下观察。Aβ1‐42寡聚体采用非变性SDS‐PAGE 胶电泳,eStain2.0 蛋白快染仪进行考马斯亮蓝染色。
1.2.4 PirB 胞外段原核表达与纯化 (1) PirB 胞外段基因扩增及引物设计。采用PAS(PCR‐based Accurate Synthesis)方法,根据PirB 胞外段序列(mPirB)设计全长拼接引物,正义序列:5'‐ATCGCCGAAAGGCACA CTTA‐3';反义序列:5'‐GCAGGGATCTTAGATTCT GTGCT‐3'。引物序列由西安迈博睿生物技术有限公司合成。(2)重组质粒的构建。使用两个限制性内切酶对NdeⅠ(酶切位点CATATG)和Hind Ⅲ(酶切位点AAGCTT)分别对pCZN1载体和PCR回收产物进行酶切处理。(3)重组质粒载体转化至大肠杆菌。(4)IPTG 诱导重组菌融合蛋白的表达。(5)包涵体蛋白的变性。(6)融合蛋白的Ni柱亲和纯化。
1.2.5 RTCA 实验检测细胞生长率 取10 µl 细胞悬液进行细胞计数,并按照1∶1.5 接种于16 孔板(每孔约2000 个细胞),置于RTCA 分析仪内。18 h 后,细胞给药处理,置于RTCA 仪内继续检测细胞生长情况。
1.2.6 EdU 检测细胞增殖情况 采用EdU 试剂盒检测细胞增殖情况。随机选择荧光显微镜下10 个视野,计算EdU 阳性细胞率。EdU 阳性细胞率(%)=EdU 阳性细胞数/Hoechst33342 标记的总细胞数×100%。
1.2.7 Real‐time PCR 检 测S‐100 钙 结 合 蛋 白B(S‐100β)、波形蛋白(vimentin)、巢蛋白(nestin)、淀粉样前体蛋白(amyloid precursor protein,APP)的mRNA表达水平 Trizol 法提细胞RNA。用TaKaRa 反转录试剂盒将mRNA 反转录为cDNA。采用TaKaRa qPCR试剂盒进行扩增。以小鼠GAPDH为内参,引物及引物序列见表1。

表1 qPCR引物序列Tab.1 Primer sequences for qPCR
1.2.8 Western blotting 检测小鼠星形胶质细胞 GFAP蛋白表达水平 细胞给药后48 h 提取总蛋白,BCA法测定蛋白浓度。以肌动蛋白(β‐actin)为内参蛋白。配置SDS‐PAGE 胶,12%分离胶,5%浓缩胶,每个梳孔上20 µg蛋白样品,80 V电泳30 min,110 V电泳1.5~2.0 h。恒流180 mA湿转120 min。5%脱脂奶粉封闭60 min。采用兔抗GFAP多克隆抗体 4℃孵育过夜。次日,37 ℃孵育30 min。1×TBST 溶液漂洗3 次,每次10 min。采用山羊抗兔HRP 抗体室温摇床孵育2 h。1×TBST 溶液漂洗3 次,每次10 min。最后加入Immobilon Western 化学发光HRP 底物反应液进行化学发光。
1.3 统计学处理 采用SPSS 20.0 软件进行统计分析。计量资料符合正态分布以xˉ±s表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD‐t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 小鼠星形胶质细胞形态观察 在光学显微镜下观察培养的小鼠原代(P0)和P1代星形胶质细胞,P0代星形胶质细胞胞体呈多边形或三角形,胞体呈暗背景,周围有光晕。相较原代细胞,P1代星形胶质细胞胞体扁平,分枝明显,细胞之间建立了更加密切的联系(图1)。
2.2 小鼠星形胶质细胞纯度鉴定 免疫荧光法检测结果显示,小鼠显形胶质细胞GFAP 阳性率>98%(图2)。

图2 免疫荧光法检测小鼠星形胶质细胞GFAP阳性率Fig.2 Immunofluorescence assay for GFAP positive rate of mouse astrocytes
2.3 Aβ1‐42寡聚体形态观察和分子量验证 电镜下观察结果显示,大部分Aβ1‐42寡聚体直径<100 nm(图3)。采用梯度SDS‐PAGE 胶对Aβ1‐42寡聚体进行电泳、考马斯亮蓝染色和脱色处理,最终得到清晰的蓝色条带(图4)。大部分Aβ1‐42寡聚体分子量为50~75 kD,少部分>75 kD。

图3 Aβ1‐42寡聚体电镜图Fig.3 Transmission electron microscopy observation of Aβ1‐42 oligomer

图4 Aβ1‐42寡聚体蛋白电泳后考马斯亮蓝染色Fig.4 Coomassie blue staining of Aβ1‐42 oligomer protein
2.4 PirB 胞外段原核表达与蛋白纯化 为得到大量的目的蛋白,将编码PirB 胞外段蛋白的核酸序列导入大肠杆菌表达系统中进行原核表达、纯化和鉴定。经SDS‐PAGE 电泳分析和Western blotting 检测,PirB胞外段蛋白分子量为69.9 kD,与其理论分子量一致(图5)。

图5 PirB胞外段蛋白的原核表达、纯化与鉴定Fig.5 Prokaryotic expression, purification and identification of PirB extracellular protein
2.5 PEP 对小鼠星形胶质细胞生长速率的影响 采用RTCA 法72 h 实时监测星形胶质细胞标准化细胞指数(normalized cell index,NCI)值。18 h 时分别给药,给药后的起始阶段,各组的NCI值表现为骤降,再逐步升高;随着细胞孵育时间增加,细胞的增殖曲线趋于平稳(图6)。
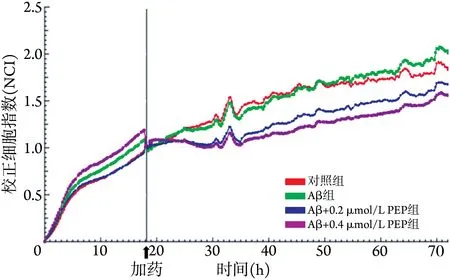
图6 PEP 对给予Aβ 的小鼠星形胶质细胞增殖影响的RTCA检测结果Fig.6 RTCA detection of the effect of PEP on the proliferation of mouse astrocytes given Aβ
2.6 不同药物处理对星形胶质细胞增殖的影响 EdU染色法检测结果显示,与对照组比较,Aβ组细胞增殖活性明显增强(P<0.05);与Aβ 组比较,Aβ+0.2 µmol/L PEP 组(P=0.0037)、Aβ+0.4 µmol/L PEP 组(P=0.0002)和Aβ+Fluspirilene 组(P=0.0021)细胞增殖活性均明显降低(P<0.01或P<0.001,图7)。
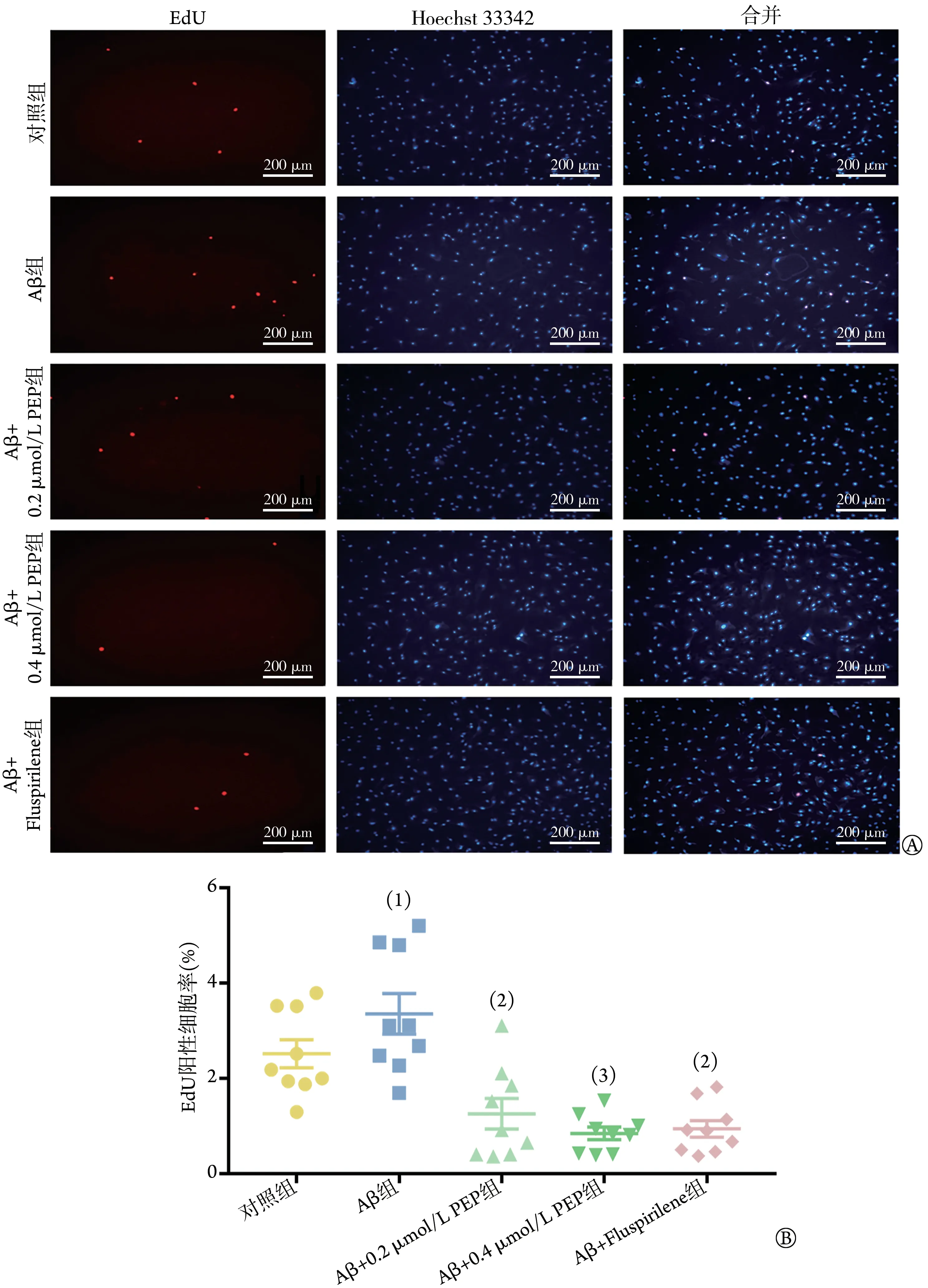
图7 不同给药情况下小鼠星形胶质细胞增殖的EdU检测结果Fig.7 Proliferation of mouse astrocytes detected by EdU under different drug conditions
2.7 各组小鼠星形胶质细胞反应性增生相关基因GFAP、S-100β、Vimentin、Nestin、APP表达水平比较 Real‐time PCR 检测结果显示,与对照组比较,Aβ 组GFAP(P=0.0060)、S-100β(P=0.0339)、Vimentin(P=0.0282)、Nestin(P=0.0004)、APP(P=0.0080)和PirB(P=0.0091)mRNA 相对表达量均明显增高;与Aβ 组比较,Aβ+0.4 µmol/L PEP 组GFAP(P=0.0084)、S-100β(P=0.0024)、Vimentin(P=0.0064)、Nestin(P=0.0014)、APP(P=0.0012)和PirB(P=0.0239)mRNA 相对表达量均明显下降(图8)。
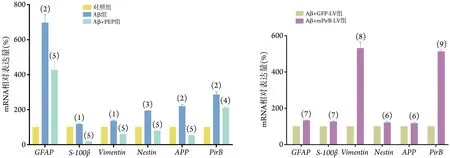
图8 各组小鼠星形胶质细胞GFAP、S-100β、Vimentin、Nestin、APP、PirB的mRNA表达水平比较(Real‐time PCR)Fig.8 Comparison of mRNA levels of GFAP, S-100β, Vimentin, Nestin, APP and PirB in each group of mouse astrocytes (Real‐time PCR)
与Aβ+GFP‐LV 组比较,Aβ+mPirB‐LV 组GFAP(P=0.0015)、S-100β(P=0.0043)、Vimentin(P=0.0003)、Nestin(P=0.0374)、APP(P=0.0424) 和PirB(P<0.0001)mRNA相对表达量均明显增高(图8)。
2.8 PirB 对小鼠星形胶质细胞 GFAP 蛋白表达的影响 Western‐blotting 检测结果显示,与对照组比较,Aβ 组GFAP 表达明显增高(P<0.05);与Aβ 组比较,Aβ+0.4 µmol/L PEP 组GFAP 表达明显下降(P<0.05,图9)。
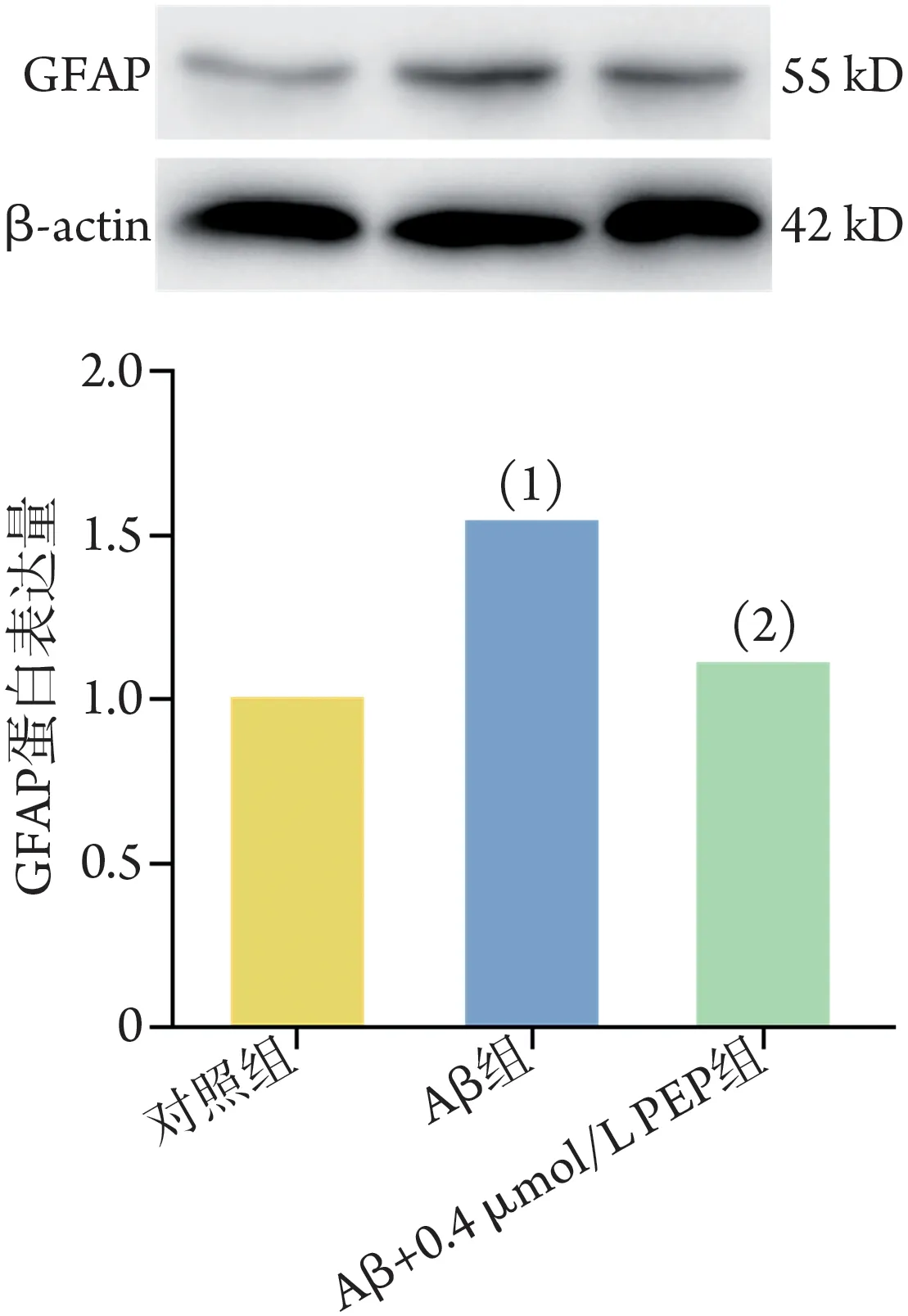
图9 各组小鼠星形胶质细胞GFAP表达水平比较(Western blotting)Fig.9 Comparison of GFAP expression in each group of mouse astrocytes (Western blotting)
3 讨 论
星形胶质细胞是中枢神经系统分布广、数量多、高度分化的细胞,对神经系统正常功能起重要作用,包括参与突触传递、维持血脑屏障的稳定性、分泌神经营养因子和离子缓冲等[7‐9]。中枢神经系统发生损伤时星形胶质细胞会产生一系列变化,表现为细胞胞体变肥大,周围突起增多、延展、胞浆丰富,细胞生长率显著提高,这一过程即为反应性星形胶质细胞增生[10]。神经炎症和缺血会诱导出两种不同类型的反应性星形胶质细胞,分别称为A1 型和A2型[9,11]。A1 型反应性星形胶质细胞分泌炎性因子,如白细胞介素(interleukin,IL)‐1α、肿瘤坏死因子(tumor necrosis factor,TNF)和补体C1q,对神经突触有破坏作用,可诱导神经元和少突胶质细胞死亡;而A2反应性星形胶质细胞可分泌抗炎性的神经营养因 子, 如 脑 源 性 神 经 营 养 因 子(brain‐derived neurotrophic factor,BDNF)、神 经 生 长 因 子(nerve growth factor,NGF)和胶质细胞源性神经营养因子(glialcellline‐derived neurotrophic factor,GDNF),对神经元的存活和生长有促进作用[16‐18]。但近期也有研究指出,反应性星形胶质细胞很难通过简单的二元表型来描述,其可能根据不同的外界环境拥有多种状态[19]。反应性星形胶质细胞的“保护”和“毒性”两种不同的效应,往往与其分泌的物质有密切关系,如何调节星形胶质细胞反应性增生使之对疾病治疗有益至关重要[20]。
星形胶质细胞活化状态的重要标志是GFAP 高表达[9,19,21],同时,细胞中其他蛋白质(如S‐100β、Vimentin、Nestin、APP 等)的表达也有所改变[18,22]。S‐100β 是重要的炎症调节因子,S‐100β 阳性的星形胶质细胞常聚集于神经炎症斑块周围,参与AD病理过程的发展。作为重要的中间丝蛋白,GFAP、Vimentin、Nestin 上调均是反应性胶质细胞增生的重要表现[10,16,23]。有研究显示,星形胶质细胞能合成和分泌大量Aβ,是AD淀粉样斑块的重要组成部分[24]。此外,反应性星形胶质细胞中合成Aβ的3种成分增加:淀粉样蛋白‐β 前体蛋白(AβPP)、β 分泌酶(β‐secretase)和γ 分 泌 酶[25‐26]。APP 是 一 种 跨 膜 蛋白[27],在AD 中其被β 分泌酶和γ 分泌酶水解产生Aβ,主要包括可溶性Aβ1‐40和不可溶性Aβ1‐42两种类型[28],其中Aβ1‐42可促进具有神经毒性的Aβ1‐42寡聚体形成[29]。反应性星形胶质细胞增生广泛参与神经系统疾病的病理发展,有研究显示,在AD中,反应性星形胶质细胞数量的增加程度与记忆和认知功能的减弱程度有关,是神经斑块的重要组成部分[25]。ALzData 数 据 库 查 阅 结 果 显 示,GFAP、S‐100β、Vimentin、Nestin、APP 等星形胶质细胞反应性相关标志物在AD患者大脑内嗅皮层、海马、额叶皮层和颞叶皮层中的表达量较健康对照高。因此,调节星形胶质细胞反应性相关标志物的表达可能是治疗AD的潜在方法。寻找星形胶质细胞反应性增生标志物的上游分子非常关键。
PirB 及其人类直系同源蛋白白细胞免疫球蛋白样 受 体B2(leukocyte immunoglobulin‐like receptor B2,LilrB2)均是Aβ1‐42寡聚体的受体,二者功能相似,具有高度的序列同源性,且在神经元和星形胶质细胞中均有表达[30‐33]。PirB 蛋白属于I 型跨膜糖蛋白,包含由6 个免疫球蛋白样结构域(D1-D6)的胞外段、1个疏水的跨膜段、3个免疫受体酪氨酸依赖的抑制序 列(immunoreceptor tyrosine based inhibitory motifs,ITIMs)和1个ITIMs样序列组成的胞内段。以往研究显示PirB 可抑制神经元轴突再生和树突棘修剪[34],参与神经元突触可塑性调节,且可抑制神经干细胞再生和分化[35]。PirB 过表达可能在LPS 诱导的脑内炎症中导致突触丢失,学习记忆功能受损[36],提示PirB可能是AD的潜在靶点。目前PirB在星形胶质细胞中的作用尚不清楚,笔者推测Aβ可能作用于星形胶质细胞上的PirB 受体,进而调节星形胶质细胞反应性增生相关标志物的表达。本研究通过离体实验观察Aβ受体PirB对星形胶质细胞反应性增生和增殖的影响。结果显示,小鼠星形胶质细胞的Aβ 受体PirB 能够调节星形胶质细胞反应性增生,给予星形胶质细胞PirB 可溶性胞外段PEP 或PirB 抑制剂Fluspirilene 处理,能够抑制Aβ 诱导的星形胶质细胞增殖和反应性增生;相反,在星形胶质细胞过表达PirB基因后给予Aβ处理,星形胶质细胞的反应性增生明显增强。
星形胶质细胞反应性增生是AD重要的病理学特征[35]。在病理状态下,反应性星形胶质细胞过度增生,会在损伤部位形成胶质瘢痕,抑制轴突再生,阻碍神经元形态和功能的修复;释放大量炎性因子,加重炎症反应,进一步损伤轴突;降低谷氨酸转运体活性,谷氨酸盐加重神经元毒性,促进神经元坏死[16,36‐37]。本研究采用Aβ1‐42寡聚体处理小鼠星形胶质细胞,在体外构建星形胶质细胞AD 模型;Aβ 的分子量为4514.2 D,根据图4中条带分子量大小,笔者认为所制备的Aβ1‐42寡聚体主要为十四聚体或十五聚体。本研究结果显示,星形胶质细胞出现反应性增生现象,表现为细胞生长率增高,反应性星形胶质细胞增生相关标志物表达量上升。GFAP是星形胶质细胞重要的中间丝蛋白[38‐39],S‐100β 参与星形胶质细胞增殖过程,二者是星形胶质细胞反应性增生常用的标志物。有研究显示,S‐100β 表达阳性的细胞在炎症斑块周围聚集,密度较高,与AD的病理过程关系密切[40]。在反应性星形胶质细胞中APP 的表达量也处于较高水平[41]。本研究结果显示,Aβ处理后星形胶质细胞GFAP、S-100β、Vimentin、Nestin、APP表达均增高,且细胞增殖增强;提示星形胶质细胞过表达PirB基因后,与反应性增生相关的基因表达活跃。综上可以推测,Aβ受体PirB能够调节星形胶质细胞的反应性增生相关标志物的表达,抑制PirB受体可能抑制星形胶质细胞的反应性增生。
PirB 与其人类同源物LilrB2 是Aβ 的受体,表达于神经元与星形胶质细胞中,调节损伤后突触可塑性,包括抑制轴突再生和树突棘修剪[28,30,42]。树突棘是神经元间形成突触连接的部位,代表可塑性位点,敲除PirB可显著增加视觉皮层树突棘的稳定性和密度,促进长时程增强(long‐term potentiation,LTP),控制长时程抑制(long‐term depression,LTD),提示PirB参与调节突触可塑性[42‐43]。另有研究显示,髓磷脂相关抑制剂 包括Nogo‐A、髓磷脂相关糖蛋白(MAG)和少突胶质细胞髓磷脂糖蛋白(OMgp),可通过PirB 受体抑制神经元轴突的再生[28,44‐48];PirB 还可通过PI3K/Akt/mTOR 通路对轴突的生长产生抑制作用[47]。PirB 拮抗剂Fluspirilene 能够降低神经元凋亡,可溶性PirB 胞外段PEP 能够透过血脑屏障促进神经再生,增强小鼠的记忆能力[33‐34];但星形胶质细胞上的PirB 受体的作用尚不清楚。本研究采用PEP 或Fluspirilene抑制星形胶质细胞的PirB受体,观察星形胶质细胞反应性增生和增殖的变化,结果显示,当采用PEP抑制Aβ与内源性PirB蛋白结合时,星形胶质细胞反应性增生相关标志物GFAP、S-100β、Vimentin、Nestin及APP的表达量均下降;而当过表达PirB基因时,星形胶质细胞反应性增生相关标志物的表达量显著上升。这提示 PirB 能够促进星形胶质细胞反应性增生。RTCA和EdU检测显示,PirB能够调节星形胶质细胞的增殖,抑制PirB 时星形胶质细胞增殖和生长率显著降低。这提示PirB 能够促进星形胶质细胞增殖和反应性增生,从而加重AD的病理学症状。
综上所述,本研究结果显示,PirB 与反应性星形胶质细胞增生和增殖密切相关,可作为进一步探究AD发生机制的关键环节;PirB是调节星形胶质细胞反应性增生和增殖的上游分子,抑制PirB 能够抑制Aβ引起的星形胶质细胞反应性增生和增殖,可作为AD治疗的潜在靶点。由于本研究仅在细胞层面进行了观察,在AD动物模型中,PirB是否能够调节星形胶质细胞反应性增生尚不清楚,后续可在APP/PS1AD 动物模型中检测敲除或过表达PirB对星形胶质细胞反应性增生及AD相关病理学症状的影响。
