靶向FOLR1的脱氧核酶提高鼻咽癌移植瘤对紫杉醇的敏感性
2024-02-28张杰苏雪萍杨子飞吴贤敏李和清
张杰,苏雪萍,杨子飞,吴贤敏,李和清
1.温州医科大学附属第一医院 耳鼻咽喉头颈外科,浙江 温州 325015;2.广西中医药大学第一附属医院 耳鼻咽喉头颈外科,广西 南宁 530023;3.中南大学湘雅三医院 耳鼻咽喉头颈外科,湖南 长沙 410013
鼻咽癌好发于我国南方地区,其中90%以上的病理类型为低分化鳞癌。对于大多数鼻咽癌患者来说,治疗方法首选放疗,因为低分化鳞癌对放疗十分敏感,但对于中晚期鼻咽癌患者而言,这种以单纯放疗为主,甚至是化疗为主的治疗手段,作用十分有限[1-2]。紫杉醇(Taxol/Paclitaxel)是目前最有效的头颈鳞癌治疗药物之一,也是治疗鼻咽癌的常用药物[3]。然而,随着紫杉醇的广泛应用,很多患者因产生了抗药性而出现化疗不成功的情况[4],因此,研究鼻咽癌对紫杉醇耐药的机制,并逆转其耐药性是必须要解决的问题。
已有研究显示,与正常细胞相比,肿瘤细胞中叶酸受体FOLR1具有更高的表达水平,并且在耐药性肿瘤细胞中具有更高的表达能力[5]。早期研究发现,正常的鼻咽部上皮细胞中并无FOLR1的表达,但在鼻咽部癌细胞,以及紫杉醇耐药细胞中,FOLR1的表达明显增多,且表达水平与抗药性指标呈正相关[6]。“10-23”脱氧核酶(DrzE)作为一种RNA剪切酶,在动脉粥样硬化、感染、肿瘤等方面已被广泛应用,在基因治疗上发挥着重要作用[7-8]。本课题组早期研究以FOLR1的mRNA碱基序列为基础设计合成了一种可以剪切FOLR1的DrzE,发现CNE-1/taxol耐药细胞转染DrzE后,FOLR1基因表达明显减少,耐药细胞对紫杉醇的敏感性明显增强[6]。笔者进一步通过靶向FOLR1的DrzE干扰鼻咽癌动物移植瘤体内FOLR1的表达,探讨其能否提高鼻咽癌对紫杉醇的敏感性。
1 材料和方法
1.1 主要材料
本研究所需要的人鼻咽癌CNE-1 细胞株及紫杉醇耐药CNE-1/taxol细胞株由湘雅三医院谭国林教授课题组赠送。RPMI-1640培养基和OPTI-MEM细胞培养液(美国Gibco公司),胰蛋白酶消化液(美国Hyclone公司),Lipofectamine 2000(美国Invitrogen公司),紫杉醇注射剂(北京四环医药科技股份有限公司),SDS-PAGE凝胶配制试剂盒(美国Bio-Rad公司),ECL显色液(美国Abcam公司),FOLR1一抗和二抗(美国Sigma公司),RIPA裂解缓冲液和TRIzol试剂(北京康为世纪生物科技有限公司),PrimeScriptTMII 1st Strand cDNA Synthesis Kit(日本Takara公司),THUNDERBIRD SYBR qPCR Mix(日本TOYOBO公司),FOLR1和β-actin引物(上海生工生物工程有限公司),DrzE(上海生工生物工程有限公司)。
本实验所需BALB/c亚系的裸鼠购于湖南斯莱克景达实验动物有限公司,数量40只,雄性,年龄6~8周,体质量约20 g。动物许可证号:SCXK(湘)2009-0004,SPF级饲养。
1.2 方法
1.2.1 细胞复苏及培养 取冻存的CNE-1 细胞及CNE-1/taxol细胞,37 ℃水浴箱内轻摇使其解冻。常温下在超净台内将解冻的细胞悬液移至离心管,再各加入6 mL含胎牛血清的RPMI-1640培养液,并进行离心(1 000 r/min,5 min)。弃上清液,各离心管内加入5 mL新鲜培养液重悬后移入250 mL培养瓶,并加入10 mL培养液。最后在恒温培养箱中放入培养瓶进行培养。定期更换培养液,并在细胞覆盖整个培养瓶壁时进行传代并继续培养。
1.2.2 裸鼠成瘤 当细胞生长处于对数期时将其消化,经过离心(1 000 r/min,5 min)和漂洗,再次离心(1 000 r/min,5 min)并加入5 mL培养液重悬。用适量Hank’s液调整细胞浓度至1×107/mL置于冰上。取4只裸鼠用于细胞悬液成瘤,使用注射器将两种细胞悬液注射到同一只裸鼠的皮下,每个部位注射约0.2 mL。裸鼠按照左为CNE-1细胞,右为CNE-1/taxol细胞的标准分批次、多部位接种。隔日记录两种细胞接种后成瘤的情况及其大小变化情况。当移植瘤体直径到8 mm左右时用断椎法将裸鼠杀死,并浸泡于75%的乙醇溶液中。在无菌超净台上使用无菌手术剪和无齿钳,解剖瘤体后将其在适量培养液中浸泡。选择生长良好且没有坏死的肿瘤组织,并将其剪碎至直径约1 mm的小块,浸泡在培养基中备用。使用1%戊巴比妥注射液腹腔注射麻醉裸鼠,背部移植区域予络合碘多次消毒。选择相对松弛的皮肤作为移植点,并用手术剪在两侧各开一个直径约2 mm的小口,使用无齿镊钝性分离皮肤和皮下组织。将小块瘤体放入皮下,轻轻挤压以排出间隙气体,最后缝合伤口。根据上述方法,在36只裸鼠的左侧背部皮下接种CNE-1小瘤块,右侧背部皮下接种CNE-1/taxol小瘤块[9]。接种瘤块后第2天开始记录裸鼠的瘤情。此外,在标本瓶中放入两种细胞的瘤块样本并置入液氮冷冻,用于后续检测FOLR1 mRNA和蛋白在给药前的表达量。
1.2.3 分组给药及数据测量 除去3只成瘤效果不佳和1只意外死亡的裸鼠,余32只成瘤的裸鼠随机分成4组,每组8只。14 d后当肿瘤直径长至约5 mm时,开始统一给药。具体的分组、给药方式和剂量见表1。在每次隔日给药之前,测量肿瘤的体积(V),V=0.5ab2(a和b分别代表移植瘤体的长径和短径),并绘制肿瘤生长曲线。每组连续给药7 d后观察3 d,最后手术取出移植瘤体,测量肿瘤体积,并计算移植瘤体的增长倍数及其抑制率。移植瘤体的增长倍数=给药后第10天瘤体体积/给药前瘤体体积;移植瘤体抑制率(%)=(1-实验组瘤体增长倍数/对照组增长倍数)×100%。
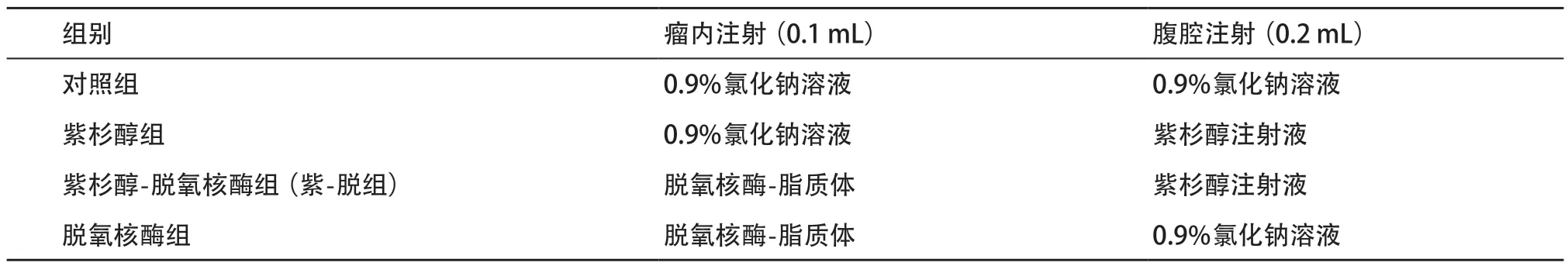
表1 实验分组及给药方式、剂量(1次/d,共7次)
1.2.4 RT-qPCR检测给药前后FOLR1 mRNA的表达变化 取液氮罐中冻存的给药前及给药后各组鼻咽癌CNE-1及CNE-1/taxol瘤块,切成约0.5 cm×0.5 cm大小,放入离心管用匀浆钻头制备组织匀浆。小瘤块的总RNA由TRIzol试剂提取,cDNA合成试剂盒反 转录得到。Applied Biosystems CFX96实时PCR系 统用THUNDERBIRD SYBR qPCR Mix试剂盒进行RTqPCR。FOLR1的靶向mRNA的引物(正向:5’GAATGCCTG CTGTTCTACCA3’;反向:5’TGCGACAATCTTCCCACC3’)已反复验证。qRT-PCR反应条件设置为:预变性温度95 ℃,15 s,1个循环;变性温度95 ℃,15 s,退火温度60 ℃,60 s,延伸温度72 ℃,20 s,40个循环。用β-actin对各mRNA表达量标准化。ΔΔCt法用于计算结果。
1.2.5 Western blot检测给药前后FOLR1蛋白的表达变化 制备各组瘤体的组织匀浆,加入到RIPA裂解缓冲液中裂解,蛋白质浓度用BCA法进行测量。将蛋白样本用10% SDS聚丙烯酰胺凝胶进行分离,后转移到PVDF膜上。室温下用含5%脱脂奶粉和0.1% Tween 20的TBS封闭缓冲液进行封闭1 h,在4 ℃冰箱内于TBST中与一抗孵育约20 h。TBST洗膜3次,置于HRP偶联的二抗溶液(1:5 000)中孵育1 h,用TBST洗膜3次,最后用ECL显色液对样品进行显色。实验重复3次。
1.3 统计学处理方法
2 结果
2.1 两种方法裸鼠移植瘤生长情况
裸鼠接种0.2 mL的CNE-1和CNE-1/taxol细胞悬液后,其生命力和生活习性基本同前。裸鼠在接种后7 d内,接种的地方会形成略呈粉色、质地稍软的粟粒大小结节,见图1A。后期结节逐渐消退,并进入潜伏期,其时间在28~36 d不等。一般情况下,接种后30 d左右,会再次出现粟粒大小的结节,其颜色同周围肤色,质地坚韧,见图1B,后结节迅速增大。移植瘤体的生长时间约为45 d,其平均长径可长到约8 mm,其形状可呈椭圆形或呈分叶状。此外,CNE-1细胞的成瘤率为62.5%(16个成瘤点中成功成瘤10个),CNE-1/taxol细胞的成瘤率为50%(16个成瘤点中成功成瘤8 个)。新鲜小瘤块移植成功 后,36只裸鼠全部出现肿瘤生成,且无明显潜伏期,见图1C。瘤体逐天增大,约14 d见圆球形或椭球形肿瘤,直径约5 mm,见图1D。

图1 裸鼠成瘤情况
2.2 给药前后裸鼠移植瘤生长状况
给药前32只裸鼠CNE-1和CNE-1/taxol移植瘤体都表现为局灶结节状,且速度相似。瘤块移植14 d测量瘤体体积,其中CNE-1为(80.13±24.50)mm3,CNE-1/taxol为(59.10±18.72)mm3,CNE-1瘤体体积显著大于CNE-1/taxol瘤体(t=3.82,P=0.004)。给药后,各组的移植瘤体生长速度有所差异,其中CNE-1瘤体中紫-脱组及紫杉醇组的生长速度较对照组及脱氧核酶组减慢,而CNE-1/taxol瘤体中紫-脱组的生长速度较其他组速度明显减慢,见图2。
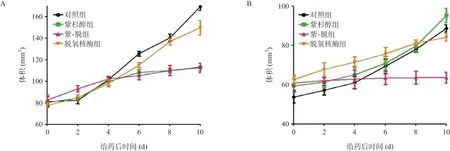
图2 各组移植瘤体的生长曲线
在CNE-1移植瘤体中,3组实验组分别与对照组相比,瘤体体积增长倍数都有明显下降(P<0.05或P<0.01),可以认为单独或联用紫杉醇和脱氧核酶都可有效抑制鼻咽癌CNE-1细胞增长。对比CNE-1/taxol移植瘤体中的3个实验组和对照组,发现脱氧核酶组和紫-脱组的瘤体体积增长倍数显著低于对照组(P<0.05或P<0.01),表明脱氧核酶单用或与紫杉醇联用可以抑制CNE-1/taxol瘤体的生长。然而,紫杉醇组单用后,瘤体体积增长倍数与对照组比差异无统计学意义(P>0.05),这表明鼻咽癌耐药细胞CNE-1/taxol对紫杉醇具有耐药特性。见表2。
表2 各组裸鼠皮下移植瘤体增长倍数比较(每组n=8,±s)

表2 各组裸鼠皮下移植瘤体增长倍数比较(每组n=8,±s)
与对照组比:aP <0.05,bP <0.01。
?
由于不同的瘤体体积和生长速度都不一样,为了减少这种差异,采用比较瘤体生长抑制率的方法对不同细胞间及不同药物间的差异做进一步比较,结果发现,单独使用紫杉醇时,CNE-1/taxol组的瘤体抑制率低于CNE-1组(P<0.01);单独使用DrzE时,CNE-1/taxol组的瘤体抑制率高于CNE-1组(P<0.05);当紫杉醇和脱氧核酶联合使用时,两种瘤体均呈现出明显的抑制作用,但两组的抑制率差异无统计学意义(P>0.05)。在同一类型的瘤体内比较,CNE-1和CNE-1/taxol移植瘤体中,联合使用紫杉醇和脱氧核酶的瘤体抑制率均显著高于单药组(P<0.05或P<0.01)。见表3。
表3 各组裸鼠皮下移植瘤体的生长抑制率比较(每组n=8,±s,%)

表3 各组裸鼠皮下移植瘤体的生长抑制率比较(每组n=8,±s,%)
与紫-脱组比:aP<0.05,bP<0.01;与CNE-1移植瘤体比:cP<0.05,dP<0.01。
?
2.3 RT-qPCR检测药物处理前后FOLR1 mRNA表达的变化
RT-qPCR检测结果显示,给药前CNE-1/taxol移植瘤中FOLR1的mRNA表达量为12.47±0.49,高于CNE-1移植瘤的1.00±0.02(t=65.72,P<0.001)。给药后紫杉醇组的FOLR1 mRNA在CNE-1和CNE-1/taxol瘤体中的表达量与对照组相比,差异无统计学意义(P>0.05),但紫-脱组、脱氧核酶组的FOLR1 mRNA表达量较对照组均显著下降(P<0.05),见图3。

图3 两种移植瘤FOLR1 mRNA相对表达量的比较
2.4 Western blot检测药物处理前后FOLR1蛋白表达的变化
Western blot检测结果显示,给药前CNE-1/taxol移植瘤细胞中FOLR1的蛋白表达量较CNE-1明显增加(P<0.01),见图4A、图4B。给药后紫杉醇组的FOLR1在CNE-1和CNE-1/taxol瘤体中的蛋白表达与对照组相比,差异无统计学意义(P>0.05),而单用脱氧核酶组和紫-脱组两种瘤体的FOLR1表达量较对照组有显著下降(P<0.05),见图4C-4F。

图4 给药前后两种移植瘤FOLR1蛋白相对表达量的比较
3 讨论
研究发现,鼻咽癌耐药性与FOLR1[6]、tau[12]、txr1[13]、peg10[14]、dlc1[14]、chfr[14]等基因存在相关性。虽然细胞学实验显示FOLR1靶向的DrzE可以提高CNE-1/Taxol对紫杉醇的敏感性,但尚未进行动物实验。因此,本研究的目标是通过动物实验建立鼻咽癌CNE-1及CNE-1/taxol的裸鼠移植瘤模型,并进一步探究靶向FOLR1的DrzE是否能够下调FOLR1的表达来增加CNE-1/taxol对紫杉醇的敏感性。
紫杉醇与微管蛋白结合后微管蛋白发生聚合而解聚受阻,导致细胞在有丝分裂过程中纺锤体形成受阻,细胞停滞于G2/M期,增殖速度减慢并最终死亡[15]。前期研究用紫杉醇大剂量冲击并逐渐加量的方法诱导并逐步筛选出耐紫杉醇细胞—CNE-1/taxol细胞[16]。耐药机制考虑与细胞中微管蛋白表达异常并进一步引起微管蛋白结构异常有关[17]。微管蛋白的突变和相关蛋白比例的异常,可能会使纺锤体在细胞复制过程中形成障碍,导致肿瘤细胞G2/M期延长,从而减缓耐药性细胞的增殖速度[18-19]。 有研究发现,鼻咽癌耐药细胞株相对于亲本细胞,细胞倍增时间略有延长,其G0/G1期显著下降,而G2/M期则相对上升[20]。此外,瘤体生长依赖瘤内血管增生,其中VEGF发挥了重要的作用[21]。早期研究发现,鼻咽癌CNE-1移植瘤与CNE-1/Taxol移植瘤相比,VEGF表达量明显增加,导致其血管生成增多,肿瘤生长更快[10]。本研究发现,鼻咽癌CNE-1瘤体的生长速度比CNE-1/taxol瘤体更快,成瘤率也更高,这也进一步验证了鼻咽癌耐药细胞增生缓慢的特点。
叶酸参与许多生物过程,如基因合成和修复、细胞分裂和蛋白质代谢等。肿瘤细胞的增殖需要大量的叶酸,而叶酸受体FOLR1在这一过程中扮演着重要的角色,所以大多数肿瘤组织中FOLR1都会显著增加[5],并且研究发现在紫杉醇抗药细胞中,FOLR1的表达更多[22]。本研究通过靶向FOLR1的DrzE的特异性催化作用,对FOLR1的mRNA进行剪切,使FOLR1的表达受到进一步干扰。细胞吸收叶酸的能力在FOLR1数量减少的情况下减弱,造成细胞摄入叶酸的数量减少,使细胞内的RNA、DNA和蛋白质合成进一步受阻。细胞层面的变化包括细胞增殖速度的减缓,以及细胞死亡的增加,而体现在组织层面就会出现裸鼠移植瘤的生长变慢。
有研究发现,细胞凋亡相关基因Bcl-2和Bax的表达受FOLR1所调控,上调FOLR1会增加Bcl-2的表达,而降低Bax的表达,最终通过抑制Caspase信号通路来减弱化疗药物的促凋亡作用[23]。而紫杉醇等化疗药可以介导多种信号通路让Bcl-2 发生磷酸化而失去活性,进一步导致细胞微管损伤,最终引起细胞死亡[3]。但在FOLR1的作用下,因紫杉醇引起的Bcl-2 发生磷酸化明显减弱,导致紫杉醇的微管聚合作用减弱,进而引起紫杉醇耐药细胞的生成。此外,前期研究发现Tau蛋白的高表达与鼻咽癌紫杉醇耐药相关[12],且有研究发现Tau和FOLR1的表达互为促进[24]。我们通过实验比较CNE-1及紫杉醇耐药的CNE-1/taxol移植瘤的瘤体抑制率,发现相较于单用紫杉醇和DrzE,两药联用时其瘤体抑制率明显提高,且两药联合时,CNE-1/taxol的瘤体抑制率与CNE-1相比无显著差异,可能也预示靶向FOLR1的DrzE可以使耐药细胞CNE-1/taxol对紫杉醇的敏感性提高,逆转其耐药性,使其与亲本细胞CNE-1对紫杉醇的敏感性相当。但是,分子机制上否通过降低Tau、Bcl-2的表达或是否存在其他可能途径仍需进一步研究验证。
综上所述,本研究显示靶向FOLR1的DrzE可以成功转染裸鼠移植瘤体,使得移植瘤体生长减慢,并且增加鼻咽癌紫杉醇耐药移植瘤对紫杉醇的敏感性,为鼻咽癌紫杉醇耐药提供了一种可能的解决方案。
