Hsa_circ_0016600通过调控miR-149/PTK7轴促进甲状腺癌细胞迁移的机制
2024-02-28张毅李飞蕾董剑达朱少俊孙艺晗
张毅,李飞蕾,董剑达,朱少俊,孙艺晗
温州医科大学附属第二医院 颈部外科,浙江 温州 325027
甲状腺癌是常见的内分泌恶性肿瘤之一,发病率逐年上升[1-2]。尽管甲状腺癌的诊断和治疗已经取得了一些进展,但仍然存在着患者易于复发和远程转移的问题,因此总体生存率并不理想[3]。甲状腺癌的发病机制受多种因素的影响,包括遗传和环境等因素,癌基因和肿瘤抑制因子的失调是其中的重要原因之一[4]。环状RNA(circular RNA,circRNA)和微小RNA(microRNA, miRNA)同属于非编码RNA。circRNA可以通过与miRNA相互作用,从而调节互补信使RNA的表达,进而影响肿瘤的发生和发展[5]。先前的研究发现,hsa_circ_0016600可以通过与miR-298相互作用,促进肺腺癌的发生和发展[6]。此外,hsa_circ_0016600还表现出竞争性内源性RNA(competing endogenous RNA, ceRNA)的功能,能够吸附miR-495-3p,并导致miR-495-3p在肝癌肿瘤组织中的表达水平下调,从而提高E2F转录因子3(E2F transcription factor 3, E2F3)的表达水平[7]。miR-149在各种类型的癌症发展过程中被证实既可以充当肿瘤抑制因子,也可以作为癌症相关微小RNA(oncogenic microRNA, onco-miR)[8]。在肺腺癌中,miR-149通过调节ETS17的表达,促进肿瘤细胞的迁移、侵袭和增殖[9]。miR-149还可以通过PI3K/AKT信号通路来调控RNA结合蛋白Musashi 2 (MSl2),发挥抗卵巢癌的作用[10]。同时,PTK7在许多人类恶性肿瘤中高表达,被认为是癌症治疗的一个新靶点,且已有研究发现PTK7 参与了甲状腺癌的发展[11]。基于此,本研究主要探究hsa_circ_ 0016600 对甲状腺癌细胞迁移的影响及miR-149/PTK7在这一过程中的作用机制。
1 材料和方法
1.1 材料
1.1.1 组织样本 从温州医科大学附属第二医院接受手术治疗的甲状腺癌患者中收集了15例肿瘤组织及邻近的正常组织样本。所有组织样本均由3位病理学专家进行鉴定和确认,在液氮中冷冻并储存在-80 ℃以备进行后续实验。患者及患者家属知情同意,本研究已获得我院伦理委员会的批准(2021-K-331-01)。
1.1.2 实验动物 由北京斯贝福生物技术有限公司提供SPF级BALB/C雄性裸鼠15只,5周龄,体质量12~18 g,实验动物许可证:SCXK(京)2019-0010。在恒温环境下,进行12 h循环照明,进行为期7 d的自适应饲养,期间提供自由饮食。本研究所有实验操作均符合中国实验动物管理规定,研究方案经温州医科大学实验动物伦理委员会批准(批件号:xmsq2022-0942)。
1.1.3 主要材料与试剂 人甲状腺癌细胞BCPAP、TPC-1、IHH-4和HTH83以及人正常甲状腺细胞Nthy- ori 3.1 均购自于上海赛百慷生物技术股份有限公司;磷酸盐缓冲液(phosphate-buffered saline,PBS)购自于武汉塞维尔生物科技有限公司;胎牛血清(fetal bovine serum, FBS)和培养基购自于美国Gibco公司;TRIzol试剂盒和Lipofectamine 2000转染试剂盒均购自美国Invitrogen公司;PCR试剂盒购自于上海生工生物公司;CCK-8试剂盒和Fluorescence in Situ Hybridization Kit for RNA试剂盒购自于上海碧云天生物技术公司;引物序列、乱序无意义阴性序列(sh-NC)、hsa_circ_ 001660小干扰RNA(sh-circ_001600)、miR-149模拟物(mimic)、hsa_circ_0016600野生型质粒(hsa_circ_0016600-WT)和突变型质粒(hsa_circ_ 0016600-MUT)、PTK7野生型质粒(PTK7-3’UTR-WT)和突变型质粒(PTK7-3’UTR-MUT)均购自于上海吉凯基因医学科技股份有限公司。双荧光素酶报告基因检测试剂盒购自于上海Yeasen Biotechnology公司;FISH试剂盒购自于广州锐博生物科技有限公司;Matrigel基质胶购自于美国Corning公司。
1.2 方法
1.2.1 细胞培养 37 ℃水浴复苏人正常甲状腺细胞系Nthy-ori 3.1和人甲状腺癌细胞系BCPAP、TPC-1、IHH-4和HTH83。Nthy-ori 3.1、BCPAP、TPC-1和HTH83细胞系使用含10% FBS的RPMI 1640培养基培养,IHH-4细胞系使用含10% FBS的DMEM-H培养基进行培养。当细胞生长密度至80%时,进行传代培养。
1.2.2 细胞转染 取对数期的BCPAP细胞接种于6孔板中(5×105个/孔),使用Lipofectamine 2000试剂盒,分别转染sh-NC(sh-NC组)、sh-circ_0016600 (sh-hsa_circ_0016600组)、miR-149 mimic(miR-149 mimic组)和共转染sh-hsa_circ_0016600与miR-149 mimic(sh-circ_0016600+miR-149 mimic组)。转染6 h后,更换培养基。继续培养24 h后,收集细胞,进行后续BCPAP细胞增殖、迁移等指标的检测。
1.2.3 RT-qPCR检测 利用TRIzol试剂提取总RNA。按照反转录试剂盒与RT-qPCR试剂盒说明书进行操作,GAPDH作为hsa_circ_0016600、PTK7内参,U6作为miR-149内参。使用相对定量法2-ΔΔCT法计算细胞中hsa_circ_0016600、miR-149和PTK7的相对表达量,实验重复3次。hsa_circ_0016600引物序列为:F 5’-CATATGATCTTCAGGTAGTA-3’,R 5’-TCTTTCTGATAGCCATTCCA-3’;miR-149引物序列为:5’-UCUGCUCCGUGUCUUCACUCCC-3’;PTK7引物序列为:F 5’-CAGTTCCTGAGGATTTCCAAGAG-3’,R 5’-TGCATAGGGCC ACCTTC-3’;GAPDH引物序列为:F 5’-GGAGCGAGATCC CTCCAAAAT-3’,R 5’-GGCTGTTGTCATACTTCTCATGG-3’;U6引物序列为:F 5’-CTCGCTTCGGCAGCACATATACT-3’,R 5’-ACGCTTCACGAATTTGCGTGTC-3’。
1.2.4 CCK-8实验检测细胞增殖 将转染后的细胞接种于96孔板中,每孔滴加10 μL CCK-8试剂,并于37 ℃细胞培养箱中继续避光培养1 h后,酶标仪测量450 nm处的吸光度值,每孔重复3次。
1.2.5 Transwell实验检测细胞侵袭 使用无血清培养基将处理后BCPAP细胞制成浓度为3×105/mL的细胞悬液,接种于transwell小室的上室中,每孔300 μL(细胞侵袭检测时上室中预涂有Matrigel基质胶),下室加入含10% FBS的培养液700 μL/孔。置37 ℃培养箱中培养48 h,取出小室。使用1 mL 4%多聚甲醛固定细胞10 min后,加入1 mL 0.5%结晶紫染色30 min,洗去染色液,室温晾干,于显微镜下观察细胞侵袭数并拍照。
1.2.6 划痕实验检测细胞迁移 将转染成功后的BCPAP细胞接种于6孔板中(5×105/孔),待细胞生长密度为90%~100%时,使用200 μL移液枪枪头在每个孔内划痕,PBS洗涤3次,除去漂浮的细胞,加入无血清培养基,置于倒置显微镜下进行拍照后,将细胞放入37 ℃、5% CO2培养箱中进行培养24 h后再次置于倒置显微镜下进行拍照。
1.2.7 小鼠异种移植皮下瘤模型 取对数生长期的BCPAP细胞制成密度为1×107mL-1的细胞悬浮液。将BALB/C裸鼠随机分成Control组、sh-NC组和shcirc_0016600组,每组5只。Control组的小鼠于右侧背部皮下注射100 μL的BCAPA细胞悬浮液,sh-NC组和sh-circ_0016600组分别在相同位置皮下注射100 μL已转染sh-NC和sh-circ_0016600的BCPAP细胞悬浮液。连续饲养30 d,从第7天开始每3 d检测肿瘤体积,按照公式V(mm3)=0.5×肿瘤最大直径× 肿瘤最长直径的垂直直径2,计算肿瘤体积,并绘制生长曲线。30 d后处死小鼠,剥离肿瘤组织块,拍照标记后,将肿瘤组织样本制成常规石蜡切片,留后续进行实验。
1.2.8 荧光原位杂交(fluorescence in situ hybridization, FISH)实验 使用FISH试剂盒进行FISH实验。将人甲状腺癌组织石蜡切片脱腊后,放入不同浓度乙醇中分别浸泡10 mim,PBS清洗2次,每次清洗2 min。切片浸入已预热好蛋白酶工作液,37 ℃消化20 mim,枸橼酸钠缓冲液浸洗2次,每次1 mim,切片依次浸入不同浓度的乙醇溶液(70%的乙醇、85%的乙醇、100%的乙醇)中各2 mim,脱水风干。滴加变性后的探针混合物于切片上,置于湿盒中,37 ℃过夜孵化。弃盖玻片和探针液,滴水洗液于组织上,避光洗涤15 mim。弃水洗液,37 ℃枸橼酸钠缓冲液避光室温洗涤2次,每次10 mim,PBS清洗10 mim,滴加DAPI工作液,避光孵育20 mim,显微镜下观察并拍照。
1.2.9 RNA FISH实验 将BCPAP细胞在4%多聚甲醛中固定10 min后,将BCPAP细胞与circRNA-_0016600探针在37 ℃培养箱中避光孵育过夜。使用DAPI对BCPAP细胞避光染色5 min,显微镜下观察并拍照。
1.2.10 双荧光素酶报告基因实验 双荧光素酶报告基因实验检测miR-149分别与hsa_circ_0016600、PTK7 的靶向调控关系。构建野生型载体(hsa_circ_0016600-WT、PTK7-3’UTR-WT)和突变型载体(hsa_circ_0016600-MUT、PTK7-3’UTR-MUT)。采用Lipofectamine 2000试剂盒将所构建的野生型载体和突变型载体分别与NC mimic或miR-149a-5p mimic 共转染至BCPAP细胞中,转染48 h后通过双荧光素酶报告基因检测试剂盒检测检查荧光素酶活性。
1.2.11 血管生成实验 将预冷的24孔板铺上加入250 μL低生长因子的基底膜提取物,37 ℃、5% CO2培养箱放置30 min,待其固化基底膜提取物,加入细胞悬液(2×104/孔)每组设3个复孔,37 ℃培养箱孵育6 h后,于倒置显微镜下观察结果并拍照。
1.3 统计学处理方法
2 结果
2.1 hsa_circ_0016600在甲状腺癌组织和细胞系中的表达
与癌旁正常组织相比,甲状腺癌组织中hsa_circ_0016600 的表达水平显著升高(P<0.05)。 hsa_circ_001660在甲状腺癌细胞系BCPAP、TPC-1、IHH-4和HTH83中的表达水平也显著高于人正常甲状腺细胞Nthy-ori 3.1(P<0.01),见图1。

图1 hsa_circ_0016600在甲状腺癌组织和细胞中的表达
2.2 敲低hsa_circ_0016600对甲状腺癌细胞增殖、迁移和侵袭的影响
hsa_circ_0016600被敲低后,BCPAP细胞的增殖能力、侵袭细胞数、划痕愈合率均显著降低(P<0.01),说明敲低hsa_circ_0016600能够抑制甲状腺癌细胞的增殖、侵袭和迁移,见图2。
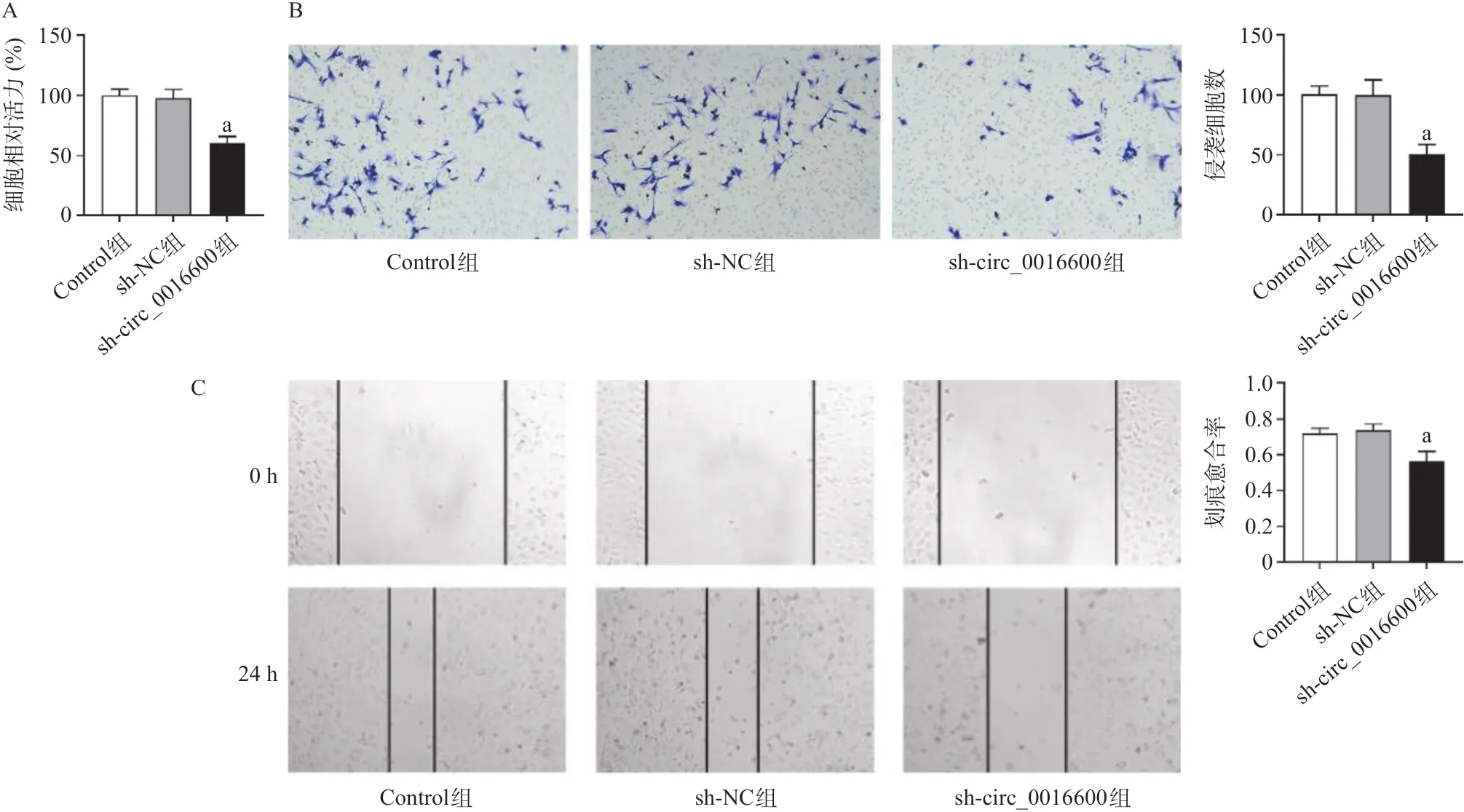
图2 敲低hsa_circ_0016600对甲状腺癌细胞的增殖、侵袭和迁移的影响
2.3 敲低hsa_circ_0016600对小鼠异种移植皮下瘤生长的影响
与Control组相比,sh-circ_0016600 组裸鼠的肿瘤体积显著减小(P<0.01),见图3A、图3B。FISH实验结果显示,与Control组相比,sh_circ-0016600组裸鼠肿瘤组织中hsa_circ_0016600的表达下调,见图3C。这些结果表明,敲低hsa_circ_0016600可在体内抑制甲状腺癌细胞的生长。
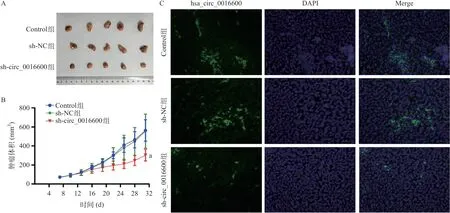
图3 敲低hsa_circ_0016600对小鼠异种移植皮下瘤生长的影响
2.4 hsa_circ_001660与miR-149的靶向关系
双荧光素酶报告实验结果显示,hsa_circ_ 0016600与miR-149存在结合位点,与NC mimic组相比,转染miR-149a-5p mimic可显著降低转染hsa_circ_0016600-WT的细胞相对荧光素酶活性(P<0.01),而对hsa_circ_0016600-MUT的细胞相对荧光素酶活性无显著影响(P>0.05),见图4A。RNA FISH实验结果显示,hsa_circ_0016600定位于细胞核和细胞质中,miR-149主要定位于细胞质中,见图4B。RT-qPCR实验结果表明,与癌旁正常组织相比,甲状腺癌组织中的miR-149表达水平显著下降(P<0.05),见图4C。在甲状腺癌细胞中miR-149表达也显著低于人正常甲状腺细胞Nthy-ori 3.1,见图4D,这些实验结果说明hsa_circ_0016600能够靶向调控miR-149。

图4 hsa_circ_0016600与miR-149的靶向关系
2.5 hsa_circ_001660靶向miR-149对甲状腺癌细胞增殖、迁移及血管形成的影响
与Control组相比,miR-149-mimic组甲状腺癌细胞的增殖能力(P<0.01)、划痕愈合能力(P<0.01)及血管生成能力(P<0.01)均显著降低。此 外,与miR-149-mimic组相比,sh-circ_0016600+ miR-149 mimic组甲状腺癌细胞的增殖能力(P<0.01)、划痕愈合能力(P<0.01)及血管生成能力均降低,见图5。
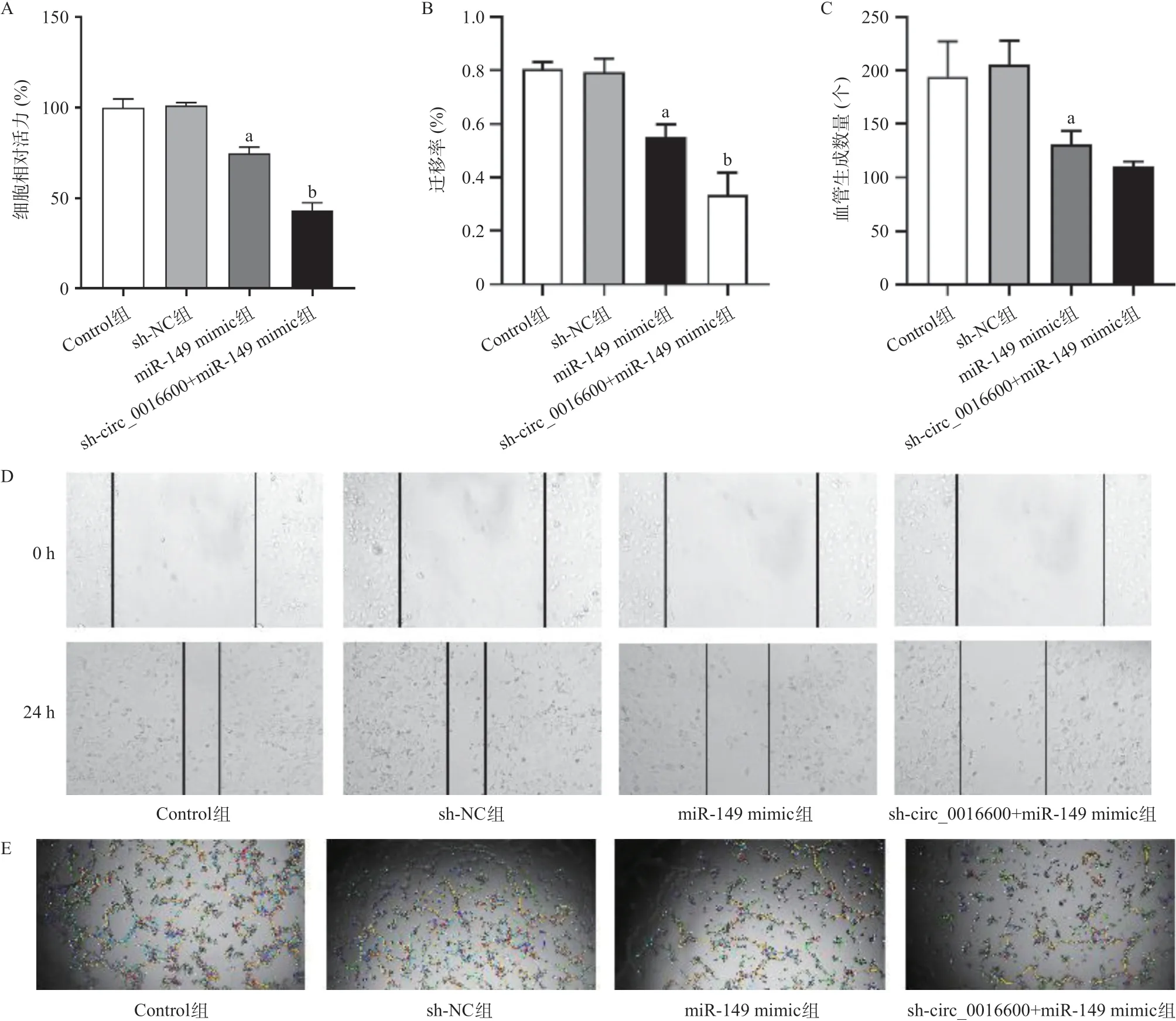
图5 hsa_circ_001660靶向miR-149对甲状腺癌细胞增殖、迁移和血管形成的影响
2.6 hsa_circ_0016600靶向miR-149对PTK7表达的影响
双荧光素酶报告实验结果显示,miR-149 与 PTK7存在连续结合位点(图6A)。与NC mimic组相比,转染miR-149a-5p mimic可显著降低转染PTK7-3’UTR-WT的细胞相对荧光素酶活性(P<0.05),而对PTK7-3’UTR-MUT的细胞相对荧光素酶活性无显著影响(P>0.05,图6A),说明miR-149能够与PTK7靶向结合。RT-qPCR实验结果显示,与正常组织相比,甲状腺癌组织中PTK7的表达水平显著升高(P<0.01,图6B);在甲状腺癌细胞中PTK7表达也显著高于人正常甲状腺细胞Nthy-ori 3.1(P<0.01,图6C)。与Control组相比,miR-149 mimic组甲状腺癌细胞的PTK7表达显著降低(P<0.01)。此外,与miR-149-mimic组相比,sh-circ_0016600+miR-149 mimic组甲状腺癌细胞中的PTK7表达显著下降(P<0.01,图6D)。

图6 hsa_circ_0016600靶向miR-149对PTK7表达的影响
3 讨论
甲状腺癌是最常见的内分泌相关性恶性肿瘤,病理类型包括甲状腺乳头状癌,滤泡状癌、恶性甲状腺癌和间变性甲状腺癌[12]。细针穿刺活检是鉴别良恶性相关甲状腺结节的金标准,但受到其侵袭性的限制[13-14]。尽管目前的常规治疗疗效显著,但10年内致命的复发和转移仍是不可避免的问题[12],因此寻找新的分子生物标志物作为诊断和治疗靶点势在必行。
circRNA是一类具有闭环结构的长非编码RNA,在控制甲状腺癌发生的复杂基因调控网络中发挥重要作用[14]。hsa_circ_0016600是近年来发现的一个新circRNA。有研究[6-7,15]表明,在肺腺癌和肝癌组织中,hsa_circ_0016600的表达水平上调,同时敲低后能够有效抑制肺腺癌和肝癌细胞的增殖、侵袭和迁移作用。本研究结果显示,在甲状腺癌组织和细胞系中,hsa_circ_0016600 表达显著升高。敲低hsa_circ_0016600后能够显著抑制甲状腺癌细胞的增殖、迁移和侵袭能力,且能够抑制甲状腺癌细胞的异种移植瘤的生长,故推测hsa_circ_0016600可能参与了甲状腺癌细胞的生长和转移过程。
miRNA在癌症中被发现调节异常,具有刺激细胞增殖和分化的致癌特征[16]。miR-149已被证明能够在多种癌症中发挥抑癌作用,如非小细胞癌[17]、乳腺癌[18]和胃癌[19]等。已有研究证明,在乳头状甲状腺癌组织中,miR-149表达显著降低,且miR-149能显著抑制肿瘤细胞的增殖、迁移和侵袭[20]。在本研究中,miR-149在甲状腺癌组织和细胞系中表达下降,且过表达miR-149能抑制甲状腺癌细胞的增殖、迁移和血管生成能力,这表明miR-149可能参与了甲状腺癌的发生和发展。同时,circRNA也在肿瘤的发生和发展中发挥重要作用。研究[21-22]表明,一些circRNA可以通过与miR-149结合,影响癌细胞的增殖和转移。本研究结果中,hsa_circ_0016600可以通过靶向结合miR-149并负向调控其表达。同时,敲低hsa_circ_0016600可增强过表达miR-149对甲状腺癌细胞增殖、迁移和血管形成能力的抑制作用。因此, hsa_circ_0016600 可能是通过调控miR-149促进甲状腺癌细胞的增殖和迁移。
PTK7 是酪氨酸激酶家族的成员之一,在食管鳞癌[23]、宫颈癌[24]、胃癌[25]等多种肿瘤中高度过表达,并能够促进肿瘤细胞的恶性增殖和转移。此外,在人甲状腺癌组织中也发现了PTK7的异常高表 达[11]。本研究结果显示,PTK7在甲状腺癌组织和细胞系中表达水平升高,与现有研究一致。PTK7是一种催化缺陷的受体蛋白酪氨酸激酶,抑制PTK7的功能可有效抑制血管生成[26]。在本研究中,过表达miR-149后,甲状腺癌细胞的血管生成能力下降,这可能与miR-149通过靶向结合PTK7并负调控PTK7的表达有关。此外,敲低hsa_circ_0016600能够进一步增强由miR-149过表达导致的PTK7表达降低,提示hsa_circ_0016600可能通过靶向调控miR-149/PTK7轴来促进甲状腺癌细胞的增殖和迁移。
综上所述,hsa_circ_0016600 在甲状腺癌组织和细胞系中高表达,其可能通过靶向调控miR-149/PTK7轴促进TC细胞的增殖和迁移。hsa_circ_ 0016600有望成为甲状腺癌未来的诊断与治疗的潜在靶点。
