达罗他胺ADE信号的挖掘与分析 Δ
2024-02-28乔丽娟陈金花郑州大学第一附属医院药学部郑州45005郑州大学附属肿瘤医院河南省肿瘤医院药学部郑州450008
乔丽娟 ,陈金花 ,康 建 (.郑州大学第一附属医院药学部,郑州 45005;.郑州大学附属肿瘤医院/河南省肿瘤医院药学部,郑州 450008)
前列腺癌是发生在前列腺的恶性上皮肿瘤,是男性泌尿生殖系统最常见的恶性肿瘤之一,在我国的发病率和死亡率逐年上升[1—2]。达罗他胺于2019年7月30日被美国FDA 批准上市,于2021 年2 月在中国获批上市,是一种新型的雄激素受体抑制剂(androgen receptor inhibitor,ARi),能够竞争性抑制雄激素与雄激素受体(androgen receptor,AR)结合,从而抑制AR 核转位和AR 介导的转录[3],目前主要用于治疗有高危转移风险的非转移性去势抵抗性前列腺癌(non-metastatic castrationresistant prostate cancer,nmCRPC)成年患者[4—5],具有直接、强效、三重抑制AR 活性的特点。目前,新型ARi 联合雄激素剥夺治疗(androgen deprivation therapy,ADT)已成为临床治疗nmCRPC 的主要方案[6],具体治疗方案需根据患者病情和药物特点进行个体化调整。由于达罗他胺上市时间短,中国报道其相关药物不良事件(adverse drug event,ADE)较少,因此,本研究使用美国FDA不良事件报告系统(FDA adverse event reporting system,FAERS)数据库分析其自上市后的相关ADE数据,以期为临床安全用药提供参考。
1 资料与方法
1.1 资料来源与筛选
本研究从FAERS 数据库中提取2019 年第3 季度至2022年第3季度达罗他胺的ADE资料,通过检索药物通用名“darolutamide”和商品名“Nubeqa”,并将其筛选为首要怀疑(primary suspect,PS)药物,从而获得该药的ADE报告。
1.2 研究方法
目前,国内外主要采用比例失衡法进行ADE信号检测与数据挖掘[7]。本研究使用OpenVigil 2.1 工具筛选ADE 数据,采用比例失衡法中的报告比值比(reporting odds ratio,ROR)法和比例报告比值(proportional reporting ratio,PRR)法进行数据挖掘[8—10]。ROR 法筛选风险信号的标准为目标药物的目标ADE 数量≥3,95%置信区间(confidence interval,CI)下限>1;PRR 法筛选风险信号的标准为目标药物的目标ADE 数量≥3,PRR 值>2,χ2值≥4[11]。
1.3 数据处理
本研究参照《监管活动医学词典》(MedicalDictionary forRegulatoryActivities,MedDRA)25.1版中的首选术语(preferred term,PT)和系统器官分类(system organ class,SOC)对筛选得到的达罗他胺ADE 信号进行汇总和分析,匹配其对应的汉语PT和SOC。
2 结果
2.1 纳入数据
本研究从FAERS 数据库中共提取到达罗他胺相关ADE 报告565 份,排除以达罗他胺为次要怀疑(secondary suspect)药物和伴随(concomitant)药物的情况,共得到以达罗他胺为PS药物的报告356份,涉及PT 38个。
2.2 纳入ADE报告的基本情况
纳入的356份ADE报告中,患者年龄主要集中在65岁以上(175 例,占比49.16%),上报年份主要在2021 年(147 例,占比41.29%)和2022 年(121 例,占比33.99%),上报国家主要是美国(197 例,占比55.34%),日剂量主要为1 200 mg(138例,占比38.76%),具体见表1。
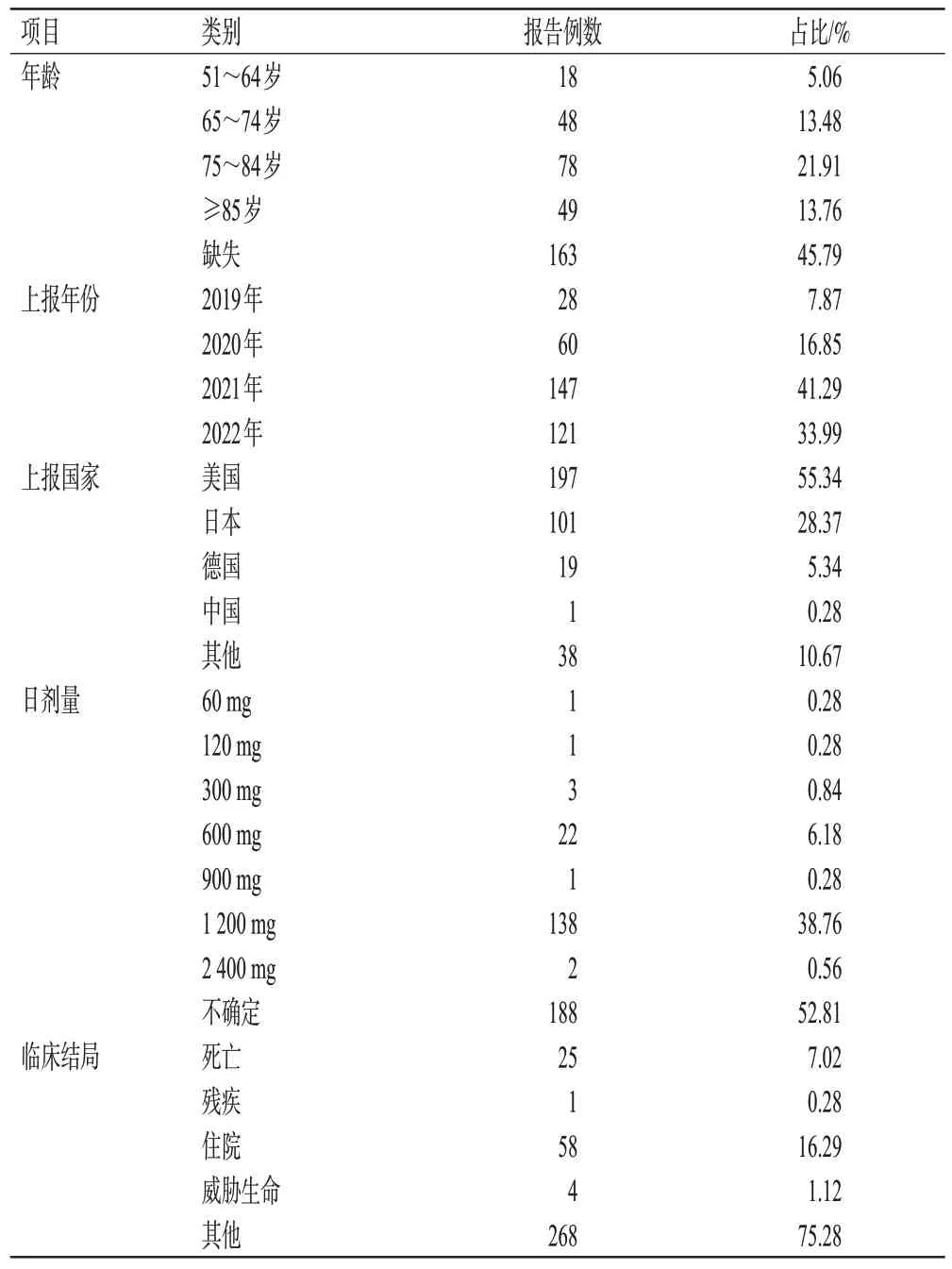
表1 达罗他胺ADE报告基本情况
2.3 纳入ADE信号的检测结果
本研究根据ROR 法和PRR 法设置的标准进行筛选,共得到43 个以达罗他胺为PS 药物的ADE 风险信号,排除产品漏用问题、超说明书使用、住院治疗、治疗中断等无关的信号后,得到38个ADE风险信号,并映射到15个SOC。信号数排名前4的SOC分别是各类检查,全身性疾病及给药部位各种反应,良性、恶性及性质不明的肿瘤(包括囊状和息肉状),肾脏及泌尿系统疾病,具体见表2。将38 个ADE 风险信号与达罗他胺的说明书进行比较,可得到13 个其说明书中未提及的ADE 风险信号,如前列腺特异性抗原升高、盆腔疼痛、血肌酐升高等,具体见表3。
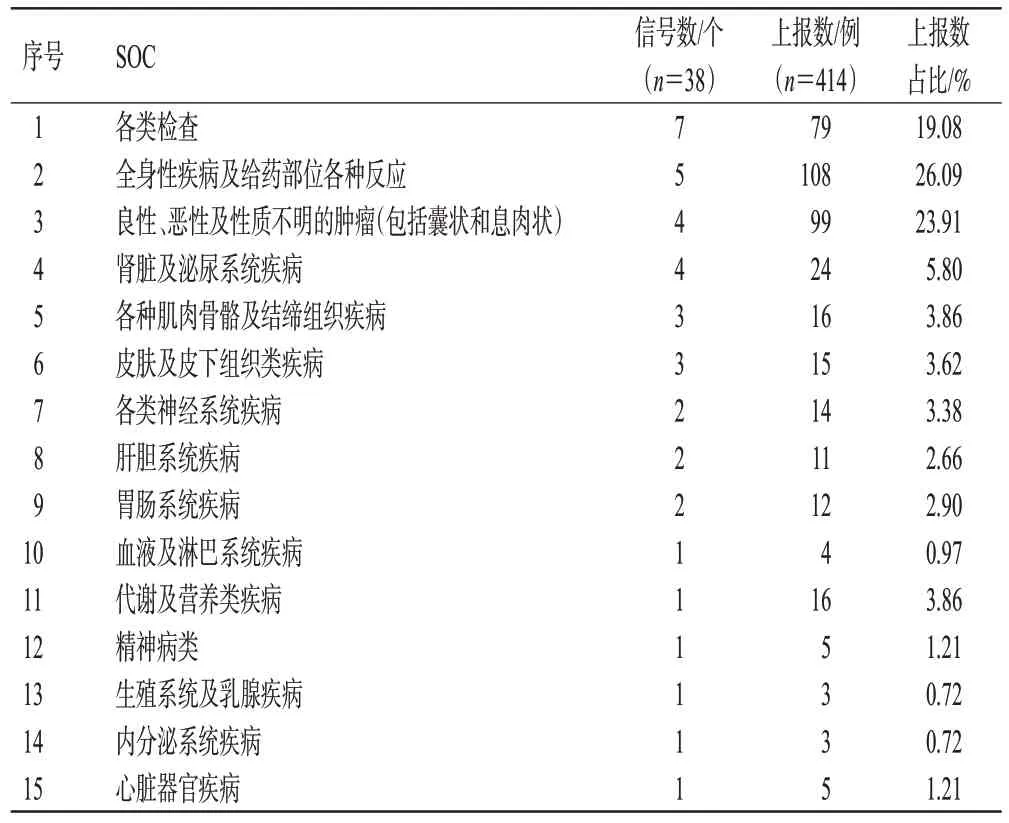
表2 达罗他胺ADE信号的SOC统计分析结果
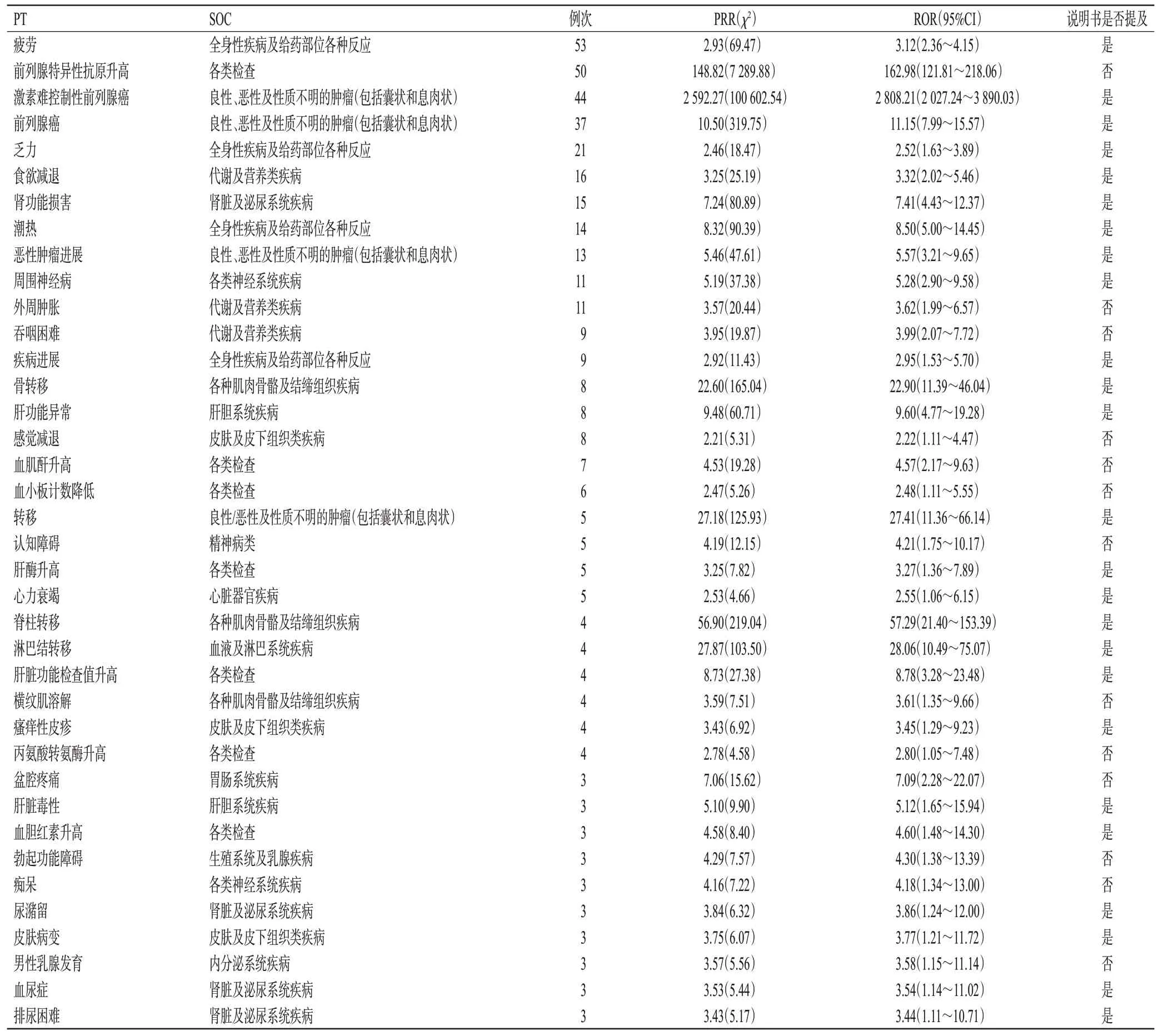
表3 达罗他胺ADE信号的PT分布结果
3 讨论
本研究共收集到以达罗他胺为PS药物的相关ADE报告356份。该药说明书中的推荐剂量为600 mg,每天2 次;如果患者出现3 级及以上级别毒性反应或不可耐受的ADE,可将剂量降至300 mg,每天2 次。笔者认为纳入报告的基本信息中日剂量60、120、2 400 mg可能存在上报信息错误。为减少假阳性并提高检测阈值,本研究采用ROR法和PRR法进行了2次筛选,并排除了产品漏用问题等无关信号,最终获得38个PT进行分析,涉及15个SOC。分析结果显示,多数PT为已知的ADE,主要为严重不良事件中与全身状况恶化相关的ADE,包括激素难控制性前列腺癌、脊柱转移、骨转移、转移、淋巴结转移、恶性肿瘤进展、疾病进展等。这与达罗他胺说明书中提到的该药严重ADE为全身状况恶化相关ADE一致,提示癌症转移和疾病进展仍为使用该药期间需重点监测的ADE。另外,本研究检测到的疲劳、乏力、潮热等ADE,也与说明书中提到全身反应相关的ADE一致。
本研究发现了达罗他胺13个新的风险信号,分别是前列腺特异性抗原升高、血肌酐升高、血小板计数降低、丙氨酸转氨酶升高、外周肿胀、吞咽困难、痴呆、横纹肌溶解、认知障碍、男性乳腺发育、感觉减退、勃起功能障碍、盆腔疼痛,涉及的SOC为各类检查、各类神经系统疾病、各种肌肉骨骼及结缔组织疾病、精神病类、内分泌系统疾病、皮肤及皮下组织类疾病、生殖系统及乳腺疾病、胃肠系统疾病。本研究发现达罗他胺可引起横纹肌溶解,但具体机制尚不明确,有可能与该药和其他药物的相互作用有关[12],故在临床使用过程中需对此加以关注。本研究还发现达罗他胺会引起男性乳腺发育,这是因为该药作为一种新型ARi,在与AR 结合后可能会引起雌激素浓度的相对增加,导致体内雌、雄激素比例的失衡[4],进而引起乳腺组织的增生和发育。另外,本研究还检测到该药可引起血小板计数降低,但骨髓增生异常、免疫功能异常、血小板消耗或破坏增多以及部分药物的使用均可引起血小板计数降低,而目前尚未见到达罗他胺引起血小板计数降低的文献报道,故还需进一步研究来评估该药与血小板计数降低的相关性,同时建议在临床使用中关注此ADE。考虑到该药于2021 年2 月在中国上市,国内临床使用经验有限,因此建议医生应严格按照其说明书使用。
综上所述,本研究通过FAERS数据库对达罗他胺进行数据挖掘与分析,得到13个在该药说明书中未提及的PT,建议在临床应用时除了严格遵循其说明书以外,还应密切关注这13个新的ADE信号,以避免因ADE引起的停药或器官损伤。此外,本研究仍存在一定的局限性:(1)FAERS为自发呈报数据库,可能存在漏报或错报情况,从而导致分析偏倚。(2)本研究检测到达罗他胺说明书中未提及到的ADE,包括勃起功能障碍、横纹肌溶解、男性乳腺发育等,由于缺乏相关文献资料,还需要更多的临床评估以明确药物与该类ADE的相关性。(3)该药上市时间较短,目前上报国家主要是美国和日本且上报数量有限,后续还需在临床应用中多关注其ADE,以获取更多的真实世界的安全数据。
