胃肠间质瘤靶向药物伊马替尼的个体化用药管理中国专家共识 Δ
2024-02-28中国药师协会精准药学工作委员会中国药师协会肿瘤专科药师分会胃肠间质瘤靶向药物伊马替尼的个体化用药管理中国专家共识编写组
中国药师协会精准药学工作委员会,中国药师协会肿瘤专科药师分会,《胃肠间质瘤靶向药物伊马替尼的个体化用药管理中国专家共识》编写组
胃肠间质瘤(gastrointestinal stromal tumor,GIST)是消化系统最常见的间叶源性肿瘤,其发病机制主要与基因突变有关,多数为KⅠT/PDGFRA基因突变[1]。随着靶向治疗药物的研发上市到现在的广泛应用,GIST 的治疗已进入外科手术联合靶向药物治疗的综合模式。
伊马替尼(imatinib,IM)(分子式为C29H31N7O,分子量为493.60)是一种小分子酪氨酸激酶选择性抑制剂,其作用机制是通过占据包括KⅠT和PDGFRA在内的几种酪氨酸激酶分子的三磷酸腺苷结合位点来阻止下游蛋白底物的磷酸化,以抑制肿瘤细胞增殖[2]。研究表明,超过80%的GIST 患者在使用IM 后取得了良好的临床疗效,GIST 患者的总生存时间(overall survival,OS)和无进展生存时间(progression-free survival,PFS)明显延长,为GIST 患者带来显著的生存获益[3]。IM 已成为复发转移性或不可切除的GIST 的一线治疗药物,也是GIST术前治疗及术后辅助治疗的重要药物之一。
然而IM 的药代动力学(pharmacokinetics,PK)参数存在显著的个体间差异,GIST患者服用相同剂量的IM,其个体间稳态血浆药物谷浓度(cmin)却大不相同。研究表明,IM 的cmin与药物效应密切相关,IM 体内药物暴露量不足可能影响药物治疗效果[4],导致耐药发生或疾病进展;而过高的体内药物暴露量可增加患者用药不良反应发生风险。临床联用的多种药物也可影响其体内代谢过程,进而影响IM 体内药物暴露量[5],而且部分患者因依从性不佳也可能导致体内药物浓度的波动。因此,将IM的血药浓度监测纳入GIST患者的管理,并在治疗期间和剂量调整后持续监测IM 的cmin非常有必要。此外,IM 疗效与GIST 患者基因突变位点和类型密切相关。我国《新型抗肿瘤药物临床应用指导原则》(2022版)明确指出,对拟行IM治疗的GIST患者,需进行基因检测,以更好地指导GIST 靶向药物治疗[6]。随着IM 在GIST患者中的广泛应用,GIST患者生存期明显延长,对GIST患者实行长期用药管理有着非常重要的意义。
当前,我国医疗机构收治的GIST 患者数量正逐年递增,但靶向药物治疗的整体疗效和安全性仍有待提高,规范化、同质化、个体化药物治疗管理理念亟待加强。目前有关GIST 的专家共识内容多集中在GIST 的临床诊断、治疗等方面,对于IM 在GIST 患者中的个体化用药管理,尤其是药学监测及长期用药管理尚未形成全面、系统的指导规范。因此,临床经验丰富的医师和药师共同合作,首次形成了IM用于GIST患者的个体化用药管理规范专家共识。本共识的发布可进一步解决IM 在GIST 领域的规范化用药问题,为医师、药师等医疗团队成员提供指导性用药参考,进而提高医务人员对GIST 患者个体化药物治疗的管理质量,延长患者生存时间,改善患者生活质量。
1 共识制定方法
本共识由中国药师协会精准药学工作委员会与肿瘤专科药师分会联合发起,南昌大学第一附属医院联合皖南医学院第一附属医院、中国医学科学院北京协和医学院肿瘤医院、四川大学华西第二医院作为共同牵头单位,组织国内23 家医院的56 名多学科医药专家编写和审定,并在国际实践指南注册与透明化平台完成注册(注册编号为PREPARE-2022CN809)。
本共识采用名义群体法,由多学科(临床、药学、循证)专家组成编写组,采用线上和线下相结合的会议形式共同讨论确定共识编写大纲。其主要内容包括IM在GIST 患者中的临床应用、药学监测及长期用药管理。编写组针对大纲涉及内容进行系统检索、分析、归纳,并根据我国现状、临床需求和研究证据制定相关共识。外审组也是由临床实践经验丰富的多学科专家组成。采用德尔菲法问卷方式,开放收集专家的外审意见,并对意见进行整理、归纳、分析、反馈、修订,最后由牵头单位医药专家召开定稿会进行讨论,并确立共识。
2 IM的临床应用
IM 广泛用于GIST 新辅助治疗、手术切除后具有明显复发风险的成人患者辅助治疗、复发转移性或不可切除患者的药物治疗。
2.1 适应证
IM 的适应证[7]包括:(1)用于KⅠT/PDGFRA突变的GIST新辅助治疗(术前评估难以达到R0切除、手术风险高、肿瘤部位特殊,手术可能损害重要脏器功能、需要联合脏器切除以及存在潜在破裂风险的GIST);(2)用于KⅠT(CD117)阳性GIST 完全切除后具有明显复发风险的成人患者的辅助治疗[8];(3)复发转移性/不可切除GIST。
2.2 治疗时机及疗程
IM治疗GIST的时机及疗程[7,9]详见表1。

表1 GIST患者IM治疗时机及疗程
2.3 用法用量
通常成人GIST 患者服用IM 剂量为400 mg/d,进餐时服用并饮水200 mL,以使胃肠道紊乱的风险降到最小。对于无法正常吞咽胶囊或片剂的患者,可将胶囊或片剂分散于水或苹果汁中。使用片剂时,可将药品分散于不含气体的水或苹果汁中(100 mg片约用50 mL,400 mg片约用200 mL),用勺子搅拌,待药片崩解完全后立即服用[8]。患者在治疗中如果未能获得满意的疗效,且没有出现严重的药物不良反应,可以考虑将给药剂量从400 mg/d增加到600~800 mg/d,用法为每日2 次,每次300~400 mg;若患者从本药持续获益,可持续接受本药治疗[6]。
特殊患者由于其特殊的生理病理等因素对IM 的PK存在影响,因此IM在特殊患者中的用法用量有所不同,详见表2。

表2 特殊患者IM剂量调整推荐
3 药学监测
IM为GIST患者提供了显著的生存益处,然而其PK参数受多种因素影响,不同患者服用相同剂量IM 时其血药浓度呈现显著差异[11],且GIST临床特征与酪氨酸激酶基因外显子位点的不同突变相关,可针对不同突变采取不同的药物治疗方案[12]。因此有必要开展IM 个体化给药方案设计,实施TDM,以调整、优化其治疗方案,提高IM疗效和安全性。
3.1 IM治疗方案设计
3.1.1 基本因素考量
(1)生理病理因素。需要考量的生理病理因素包括:①肝功能不全患者——IM主要经肝脏代谢,肝功能不全可影响IM 在体内的暴露,因此必要时需考虑调整给药剂量[8]。②肾功能不全患者——IM 药物排泄不经过肾脏,但肾功能不全可能影响患者IM体内的暴露[12],因此,轻、中度肾功能损害GIST 患者服用IM 时应减少给药剂量。有严重肾功能损害的患者应谨慎使用。③接受胃切除患者——手术切除后使用IM 辅助治疗时应监测其血药浓度,基于TDM 结果合理调整剂量[8,10](见表2)。
(2)基因突变因素。大多数GIST是由KⅠT(约75%)或PDGFRA(10%~15%)基因的激活突变驱动的[13—14],约10%~15%GIST患者缺乏酪氨酸激酶突变,被称为野生型GIST[15],IM 对GIST 的疗效显现需要KⅠT或PDGFRA突变的存在[16],因此野生型GIST 患者使用更高剂量的IM 并不能增加获益,反而可能引起严重不良反应,可选用舒尼替尼治疗。
IM对于KⅠT外显子11突变的GIST患者疗效最好,而对于KⅠT外显子9突变者疗效较差。PDGFRA外显子18 突变(包含D842V 突变)的GIST 患者通常对IM 无反应,此突变的患者接受阿伐替尼治疗获得的缓解率可达86%[17—18],推荐选用阿伐替尼,详见表3。

表3 基因突变因素
(3)药物相互作用。IM 在肝内主要经细胞色素P450(cytochrome P450,CYP)3A4代谢[21],因此,当IM与肝药酶的诱导剂或抑制剂联用时,可能对IM 的体内暴露量产生影响,造成由于代谢过快而降低疗效或代谢减慢而产生毒性。IM 还可通过抑制药物转运体和代谢酶,影响环孢素、辛伐他汀、美托洛尔、对乙酰氨基酚、香豆素和左旋甲状腺素等药物的体内暴露量[8](见表4)。

表4 IM药物相互作用
(4)饮食对药物的影响。高脂饮食可轻微降低IM的吸收,使其cmax和AUC 分别降低11%和7.4%,tmax延后1.5 h,但差异无统计学意义,食物与IM的生物利用度并无直接相关性[28],但为了使胃肠道紊乱的风险降低到最小,建议进餐时服用IM。此外,葡萄柚(西柚)等食物可能升高IM血药浓度,增加毒副作用,用药期间应避免食用葡萄柚(西柚)及其制品[8]。
3.1.2 耐药性
IM 耐药仍然是目前的难题。对IM 的耐药分为两种:一种是原发性耐药,即肿瘤在治疗的前6个月内出现进展;另一种是继发性耐药,即初始IM治疗有效,6个月后肿瘤出现进展[2]。据统计,约14%的GIST 患者对IM属于原发性耐药[29],近50%的患者在2 年内出现继发性耐药[30]。对于GIST患者而言,最常见的KⅠT突变发生在外显子11(约66%),而最常见的PDGFRA突变发生在外显子18(5.6%)[15],这些原发性突变相互排斥。然而,患者可能在同一基因上存在一个或多个突变,这主要是由于在治疗过程中可能出现继发性耐药突变[31]。对IM 耐药的GIST 患者其治疗方案可能包括改用舒尼替尼、增加IM剂量和外科干预以限制进展速度[32],但后两者证据有限。美国FDA 批准舒尼替尼用于治疗对IM 耐药的GIST[33]。在耐药后也可在IM 停用后再次使用IM 作为三线治疗,但是不如作为三线治疗的瑞戈非尼有效[34]。
3.1.3 药物耐受性
虽然IM 通常耐受性良好,但也可能因药物引起的不良反应需要减少剂量,甚至停药。有研究者对长期服用IM(400 mg/d)的GIST 患者进行了随访和统计,发现在5年内约有16.5%的患者因IM导致的不良反应停药,而需减少药物剂量的患者比例则高达28.5%[35],且这一现象在年龄较大的患者中更为明显[36]。对IM 标准剂量方案(400 mg/d)不耐受的患者,可将400 mg分早晚两次服用或将剂量减少至300 mg/d。国内一项研究显示,对IM 400 mg/d 不耐受的GIST患者,300 mg/d的剂量也能实现足够的血浆药物浓度和良好的疾病控制,并且能减轻不良反应对患者的影响[37]。
3.1.4 药物基因多态性
IM是外排转运蛋白P-糖蛋白(由ABCB1编码)和乳腺癌耐药蛋白[breast cancer resistance protein,BCRP(由ABCG2编码)]的底物。此外,包括有机阴离子转运蛋白家族在内的其他转运蛋白,如OATP1A2(由SLCO1A2编码)也参与了IM 的转运过程。IM 在肝内主要经CYP3A4和CYP3A5代谢为其活性代谢物CGP74588,具有高度多态性[21]。目前,对IM个体化治疗的研究主要集中在药物代谢酶和转运体的遗传多态性上[38]。
尽管研究者们针对药物基因多态性(CYP3A5rs776746、ABCB1rs1045642、SLCO1B3rs4149117 和SLCO1A2rs4148978 等)对IM 代谢转运的影响进行了大量研究[38—42],然而仍存在不少争议,因此目前暂无明确证据支持根据药物基因多态性进行个体化剂量的调整。
3.1.5 其他
GIST 主要发生在60~65 岁的成年人中[43],而60 岁以上的人由于代谢较慢,血药浓度相对稳定[44]。有PK模型描述了IM 清除率和体重之间的正相关关系[45]。性别也被报道可影响IM的代谢:在相同的剂量下,女性患者的cmin显著高于男性,产生这种现象的原因可能是男女之间体重指数、体表面积以及代谢水平的差异[46],但是这种差异暂不足以说明不同性别之间剂量调整的必要性[47]。
3.2 TDM
3.2.1 TDM的必要性
GIST 患者服用相同初始剂量的IM 后,患者PK 参数均呈现较大个体间及个体内差异。中国人群的研究数据亦表明,GIST患者服用400 mg/d初始剂量的IM,患者间cmin差异可高达7.06 倍[48]。研究表明,IM 的临床疗效、不良反应发生风险与cmin等指标密切相关[49],IM 的cmin维持在阈值以上的晚期GIST 患者其PFS 显著长于cmin未达到阈值的患者[50],且药物暴露量不足也是导致IM 耐药或疾病进展加快的重要原因;cmin与眶周和肢体水肿、贫血和皮疹等不良反应发生率相关,当患者服用IM引起严重不良反应时,应考虑是否因IM的cmin过高引起[20]。此外,IM 服药依从性不佳是中国GIST 患者辅助治疗中存在的一个显著问题,且依从性不佳的患者cmin显著低于依从性良好的患者[51],通过TDM可监测患者用药依从性问题,并及时干预。Lankheet等[52]的研究证明,在接受IM治疗的GIST患者中通过TDM可使95%的患者达到足够的治疗血浆浓度,开展TDM可作为GIST患者调整剂量和评估药物疗效的重要参考指标之一,因此将IM的血药浓度监测纳入GIST患者的管理,并在治疗期间和剂量调整后持续监测IM的cmin非常有必要。
3.2.2 分析技术
目前国内外对于IM浓度监测以液相色谱-串联质谱(liquid chromatography tandem mass spectrometry,LCMS/MS)法的运用较为广泛[53]。因LC-MS/MS兼具了液相色谱法良好的分离性能及串联质谱法高灵敏度、高特异性的优势,近年来已成为体内药物定量分析的推荐方法,因此推荐有条件的医疗机构可采用LC-MS/MS法监测IM 血药浓度[54]。此外,亦可采用高效液相色谱法或二维液相色谱法对人血浆中IM 的浓度进行定量监测[55—57]。
3.2.3 目标人群、监测指标和目标浓度
IM的TDM重点人群为[58]:(1)治疗期间肿瘤进展的晚期GIST患者;(2)发生较严重不良反应需要进行剂量调整的GIST 患者;(3)合并使用与IM 具有潜在相互作用药物的GIST患者;(4)伴肝肾功能损害的GIST患者;(5)服药依从性差的GIST 患者;(6)接受胃切除的GIST患者。
cmin为反映IM临床疗效的重要监测指标。一项西方人群Ⅱ期临床试验的分析结果显示,IM 的cmin可预测GIST患者的预后,其和疗效之间关系密切[59]。此研究指出,不可切除或转移性GIST 患者在治疗29 d 后,IM 的cmin水平低于1 110 ng/mL 的GIST 患者其肿瘤进展时间(11.3 个月)显著短于cmin水平高于该浓度的患者(大于30个月,P<0.01),且客观缓解率更低。
最新一项日本人群的真实世界研究表明,不可切除或复发的GIST 患者服药3 个月后,IM 的cmin高于阈值917 ng/mL的患者相比未达到该阈值的患者PFS显著延长(5.90年 vs.3.05年,P=0.01),且IM的cmin水平与任何级别的不良事件密切相关,而1 283 ng/mL可能是预测3级或更高级别不良事件风险的一个临界值[60]。
一项中国人群的研究表明,对于接受IM 辅助治疗的高危GIST 患者,cmin低于1 100 ng/mL 与高危GIST 患者的无复发生存率无关,cmin低于1 100 ng/mL 并不影响高危GIST患者的预后[61]。中国人群的IM确切治疗窗以及IM辅助治疗GIST患者的治疗窗还有待通过多中心、更大样本的研究进一步明确。
研究表明,患者体内IM 游离谷浓度(fcmin)也与患者的临床获益相关,对IM 有应答者的fcmin显著高于无应答者,且以fcmin20 ng/mL 作为截断值时具有最佳的灵敏度(86%)和特异性(100%)[62]。尽管已有研究表明血浆IMfmin监测具有一定的临床意义,但临床对于是否检测IMfmin的治疗靶点浓度缺乏统一共识,且游离药物浓度的测定相较于总浓度的测定需要更为复杂的处理方法,因此,推荐有检测条件者可选择监测血浆游离IM浓度,但不作为常规推荐。
3.2.4 监测时机和频率
推荐GIST患者连续每日规律服用IM至少28 d后,于第29 天距离上一次服药后22~26 h(下一剂次服药前)采集外周静脉血检测cmin为最佳[59,63],如出现严重不良反应则可尽早监测。推荐监测频率为前3个月每个月监测1次,其后每3~6个月监测1次,随后可根据患者实际情况适当延长监测周期[58]。
IM 口服生物利用度约为98%,几乎完全吸收,半衰期为18~20 h[28],其稳态血浆浓度应在持续给药1 周左右达稳态[64]。然而,有研究显示,在初次给药28 d 后IM生物利用度下降约17%,3个月后下降约30%,导致相同给药剂量下,血药浓度逐渐降低[45]。因此,为保障对患者用药的及时、有效干预,在每天口服1次的情况下,至少28 d后开始进行血药浓度检测,并于服药前采样[65]。
3.2.5 报告解读
(1)解读流程。在解读报告时,应梳理好患者信息和用药信息。首先排除采样时间、样品储存、实验分析操作等因素所致的异常结果,再根据患者生理病理状态、联合用药情况、遗传因素、饮食特点等,运用专业知识对检测结果进行分析、提出用药建议、出具解读报告。
(2)解读重点。出现如下情形应重点解读:(1)cmin检测值未达到阈值时;(2)监测结果处于目标范围内,但发生较严重不良反应或临床治疗效果不理想时;(3)检测结果超过实验室警戒浓度或需要通过遗传基因检测来指导用药时[66]。
3.2.6 个体化剂量调整
可基于群体药代动力学(population pharmacokinetics,PPK)模型参考设计IM初始给药剂量和调整给药剂量,TDM 结果结合患者的临床治疗效果可作为综合评估GIST 患者药物剂量调整的重要参考指标之一。在临床实践中,由于各种原因可能导致患者未按照检测cmin要求的时间点采血,患者监测到的是随机血药浓度,可考虑采用贝叶斯最大后验法(maximum a posteriori,MAP)、经典贝叶斯MAP、基于消除常数的线性外推法等预测cmin[67]。对于达稳态后处于消除相的IM随机血药浓度,可通过校正公式将其换算为cmin,该公式换算的准确度为75.9%[68]。具体公式如下:
cmin,pred=cmeasured×0.5(DI-TAD)/T
其中,cmin,pred表示预测的稳态血浆药物谷浓度,cmeasured表示测得的随机血药浓度,DI 表示给药时间间隔,TAD表示此次采血时间距离上次给药的时间间隔,T表示IM的消除半衰期(T为18 h)。
但校正公式外推cmin存在一定误差,且模型引导的用药专业性较强、临床推广受限,目前经验证的可靠模型尚较少,因此优先推荐患者进行cmin检测以指导其剂量调整。如患者只测得随机血药浓度,可根据校正公式换算为cmin后再进行剂量调整。
在临床实践中,患者使用IM 后应综合评估患者TDM 检测结果是否达到阈值、患者服药后的临床获益情况以及不良反应是否耐受等,再根据患者具体情况确定剂量调整方案,具体策略参见图1。
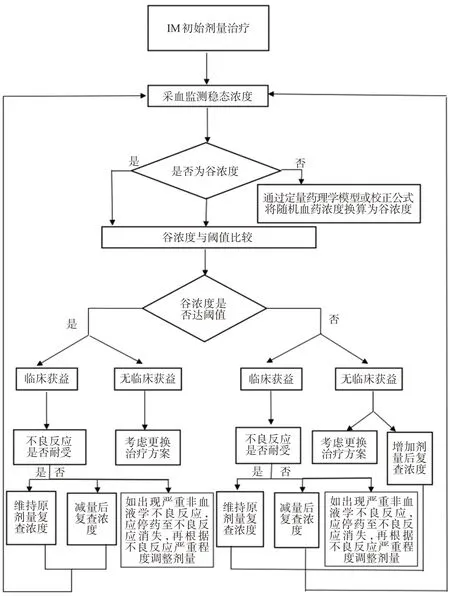
图1 IM剂量调整流程图
4 GIST患者长期用药管理
随着IM在GIST患者中的广泛应用,GIST患者生存期明显延长,对GIST 患者实行长期用药管理有着非常重要的意义[9]。定期随访、用药指导等长期用药管理工作的开展有利于提高患者生存质量,长期用药管理方式包括门诊随访、电话随访及微信随访等。临床医师与临床药师组成治疗团队,从不同专业角度充分发挥作用,医师工作主要是疾病的诊断、评估、并发症处理及治疗方案的拟定,而临床药师则侧重于关注患者的用药全过程,评估药物疗效、监测不良反应、TDM咨询、开展用药科普以及对患者进行用药教育等,提升患者用药依从性,减少用药风险。Zhou等[69]研究表明,加入GIST多学科医疗团队(multidisciplinary team,MDT)的药师可增加中国GIST 患者对IM 治疗的依从性,提高IM 治疗的有效性、安全性和经济性,MDT可通过GIST门诊、居家药学服务以及线上药学服务等其他方式进行IM长期用药管理,对患者进行信息收集、用药评估、用药建议、用药教育、随访指导并记录文书。GIST患者IM长期用药管理流程[70]可参考图2。
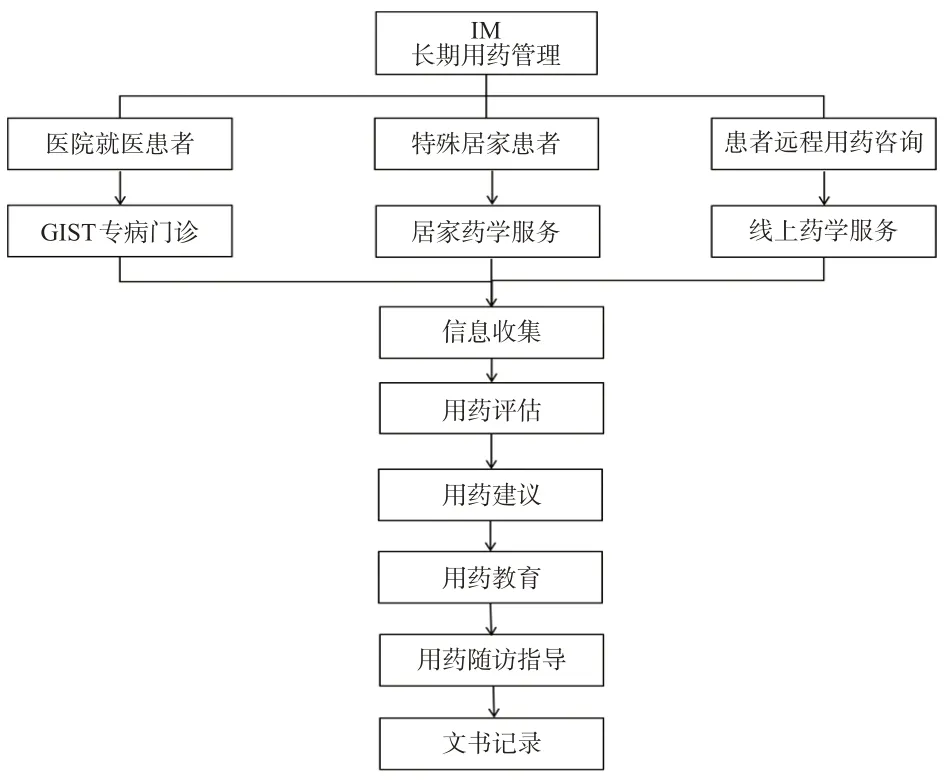
图2 GIST患者IM长期用药管理流程图
4.1 GIST专病门诊
随着GIST 诊治技术的日渐成熟与发展,IM 为更多GIST 患者带来显著的生存获益。该类药物个体差异大、体内药物浓度易受诸多因素影响,临床决策较为复杂,建议开设GIST专病门诊。GIST专病医师联合临床药师出诊,优化患者诊疗模式;药师可在GIST专病门诊对服用IM的GIST患者进行IM用药教育,准备IM用药知识宣传册或海报,及时更新和宣教GIST 诊治最新进展,提升患者对GIST 的认知、提高诊治依从性,提供更加完善的药学服务,改善患者就医体验。
4.1.1 信息收集
药师应全面收集GIST患者的信息(表5),明确患者此次就诊需求[70]。

表5 GIST患者信息收集内容
4.1.2 用药评估
药师可基于循证依据结合患者具体情况对患者使用IM的适应证、有效性、安全性、经济性、依从性等方面进行评估与分析。药师应重点关注GIST患者的治疗需求,解决患者个体化用药及其他合理用药相关问题,具体评估内容见表6。

表6 GIST患者用药评估内容
4.1.3 用药建议
药师应当对不适宜用药提出调整建议。在本医疗机构内,药师可通过协议处方权或与相关医师沟通等方式调整治疗方案。药师应和GIST专病医师就患者药物调整进行沟通协商并形成一致意见。
4.1.4 用药教育
(1)IM用药教育的主要内容包括用法用量、用药时机、用药频次、进食的影响,对相关注意事项、与食物的相互作用、药品特殊储存条件和可能发生的毒副作用及处理方法等的指导。在用药期间,临床应对患者用药依从性进行评估,提醒患者服用IM期间需注意以下几点:①每天固定时间服用药物(推荐餐中服用);②动态监测血常规及肝肾功能;③TDM的时间及频率(参见“3.2.4”部分);④有生育能力的妇女在用药期间及停药后至少15 d内需采取有效的避孕措施。此外,药师还需对GIST患者进行人文关怀和心理疏导,为患者缓解因疾病导致的焦虑不安等情绪,帮助患者增强战胜疾病的信心[72]。
(2)用药教育文书记录:记录内容应包括但不限于患者基本信息,IM给药方式、剂量、疗程等,用药教育的内容及依据、患者对用药教育的结果是否理解并接受。药师应签名并标注用药教育时间。可参见《GIST 患者IM用药教育记录表》[70](图3)。
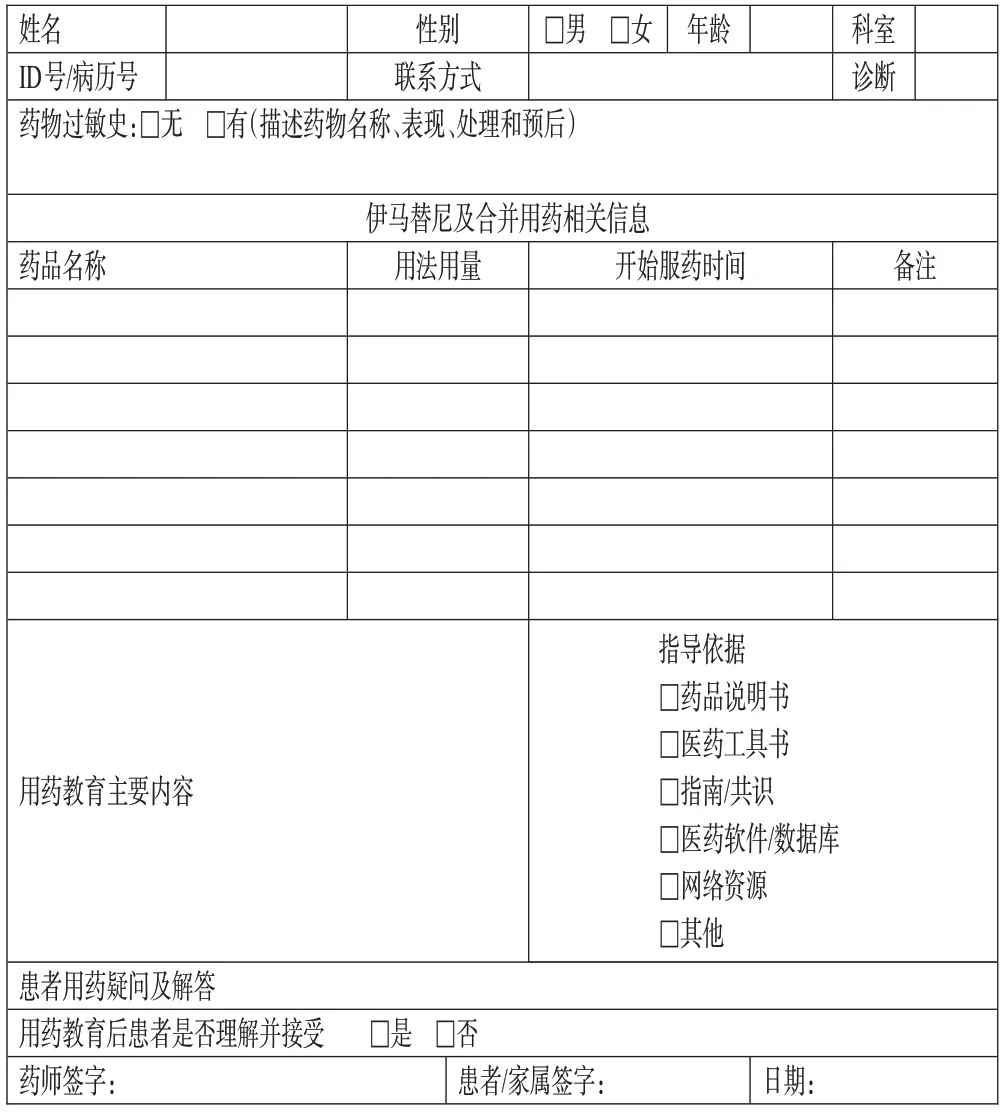
图3 GIST患者服用IM用药教育记录表示例
4.1.5 用药随访指导
对于正在服用IM的GIST患者,医疗机构应建立完整的患者健康档案,收集家庭住址、联系方式、影像学检查、手术信息、病理学诊断、原发肿瘤部位及基因检测等信息,叮嘱患者定期复查,医师、药师可根据患者随访细节评估IM 治疗效果、调整用药方案。随访信息详见表7。

表7 GIST患者随访信息
4.1.6 文书管理
药师提供GIST 门诊药学服务后应当书写医疗文书,文书内容包括但不限于患者基本信息、健康信息、需求信息、用药信息、相关主要检查指标、用药清单、用药建议、用药指导等,可参见《GIST 药学门诊工作记录表》[70](图4)。

图4 GIST患者药学门诊工作记录表示例
4.2 居家药学服务
对于服用IM 的特殊患者,如行动不便或语言沟通困难的患者可以采取居家药学服务模式,药师走入社区居民家庭,为患者提供个性化的药学服务。对于合并使用多种药物或反复就诊的患者,药师可协助居家患者整理和制作当前的用药清单,了解居家患者用药的依从性,参照“4.1.4”部分提供IM 及其他合用药品的用药教育及咨询服务,并选择个性化的方式对居家患者进行科普宣教;指导有需要的患者整理家庭药箱,为居家患者进行效期药品管理、药品存放指导、药品回收等服务,明确IM 的储存条件(30 ℃以下保存),判断是否存在有潜在相互作用的药物并给出指导性建议,记录患者自我监测和异常情况处理结果。药师提供服务后,应请患者简要复述药师交代的事项,确保患者已准确理解。
药师提供IM 居家药学服务后,应及时记录居家药学服务相关内容。如药师评估认为患者需调整用药方案的,最终用药方案应由主诊医师确认并签字。若药师帮助居家患者整理和制作了用药清单,应当将整理后的用药清单原件或副本提供给患者参照执行。记录表格可参见《GIST患者居家药学服务内容记录表》[70](图5)。
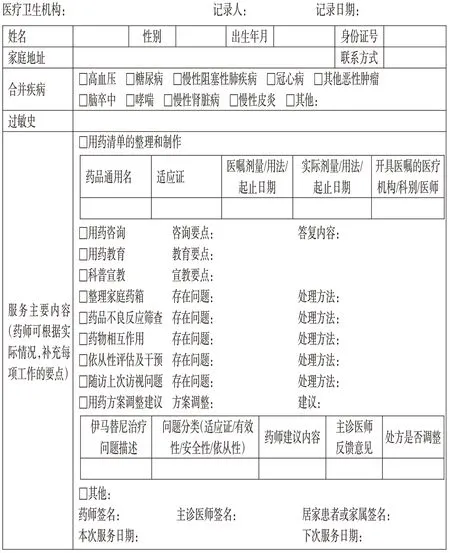
图5 GIST患者居家药学服务内容记录表示例
4.3 其他管理方式
为方便异地患者就医,降低患者的就医成本,患者可通过网络、电话、微信、手机APP 等线上途径进行IM用药咨询,药师可通过线上途径对服用IM的GIST患者进行用药指导与管理[74]。使用网络平台及电话沟通时需遵守医院及伦理委员会相关管理规定,注意患者信息及隐私安全。
4.4 IM不良反应管理
以足够剂量持续给药是取得良好疗效的关键。IM通常耐受性良好,然而其也可导致严重的不良反应,且不同患者在服用IM 后出现的药物不良反应也不尽相同。有研究显示,约30%的患者因IM 导致的严重不良反应而减少剂量,约17%的患者甚至因此停药,从而影响患者治疗效果[38]。因此对于需要长期服用IM的GIST患者,对不良反应进行适当的管理是必要的。下述不良反应分级依据为美国国家癌症研究所常见不良反应评价标准5.0版本。
4.4.1 水肿和体液潴留
IM相关的非血液学不良反应中最常见的是体液潴留。据统计,约70%服用IM 的患者可出现不同程度的水肿,主要发生在眶周和下肢,一般早晨较为明显,活动后减轻[75]。其发生发展的机制尚不明确,一般认为与IM的靶点之一血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)的抑制所引起的真皮间质液稳态失衡有关[76—77]。大多数水肿不需要治疗,但对于较严重的水肿,可限盐摄入或使用利尿剂来进行对症处理[78]。如出现严重的体液潴留,应停药,待恢复正常后根据体液潴留的严重程度调整剂量。
4.4.2 胃肠道反应
胃肠道反应是GIST 患者服用IM 后常见的不良反应。其中,恶心发生率约为52.4%,腹泻发生率约为44.9%,呕吐发生率约为12.9%[79]。IM 导致的恶心在服药后可持续数小时,在空腹服用IM时更常见,这可能由药物刺激胃肠道后引起神经兴奋,进而刺激呕吐中枢引起[79]。对于轻中度(1~2级)胃肠道反应,不需要减少药物剂量,但推荐IM 在饭后服用或与食物同服且饮食调整为清淡和易消化的食物[29,78]。如果出现较严重的胃肠道反应(3~4 级),可能需要减少药物剂量甚至暂时停药,当症状明显改善,可以继续维持原治疗方案[80]。
4.4.3 肌肉骨骼不适
此类不良反应较为常见,在接受IM治疗的GIST患者中发生率约为40%[75],通常不严重,表现为肌肉痉挛或疼痛、骨痛和关节痛等。这些表现可能很大程度上与药物影响骨骼和矿物质代谢有关。肌肉痉挛可以通过增加每日液体摄入和服用钙、镁补充剂等来缓解[80]。骨痛和关节痛可使用非甾体类抗炎药来减轻[78]。
4.4.4 皮疹
在接受每日400 mg IM治疗的GIST患者中,皮疹发生率约为35%(其中3~4级约占10%)[81],女性患者更为常见[82]。有报告显示,接受每日800 mg的患者皮疹发生率比接受每日400 mg的患者升高约11.6%[10],这提示IM引起的皮疹具有剂量依赖性,但其发生发展的机制尚不明确,目前认为其可能与超敏反应无关,而是由其药理作用引起的[79]。IM导致的皮疹通常发生在开始治疗的1周内,最常表现为红斑疹,前臂和躯干最突出[75]。轻中度皮疹患者可使用抗组胺药缓解症状,对于反复发作的较严重皮疹(3 级及以上)应减少IM 剂量甚至停药直到症状消退[79]。对于出现非常罕见的严重皮肤反应(如Stevens-Johnson 综合征)的患者,应暂时中断IM 治疗。在这些严重病例中,患者可接受口服类固醇治疗[82]。
4.4.5 血液毒性
IM 导致的血液毒性一般较轻,但也能引起较严重的贫血和中性粒细胞减少。据报道,约16.7%接受IM治疗的GIST 患者可出现3~4 级贫血[83]。对于2 级及以上的贫血,应对措施根据贫血的原因而有所不同,因为GIST患者可能会因术前慢性胃肠道出血而导致缺铁性贫血,或因术后维生素B12和叶酸吸收障碍而导致巨幼细胞性贫血。缺铁性贫血患者可口服硫酸亚铁,巨幼细胞性贫血患者可口服维生素B12和叶酸进行治疗[77]。中性粒细胞减少在接受IM治疗的GIST患者中较为常见,一般发生在治疗开始后的6周内,通常较轻,无需采取措施。对于3 级及以上中性粒细胞减少(发生率约为7%)的患者可给予粒细胞集落刺激因子进行治疗,同时暂停用药。而反复出现3级及以上中性粒细胞减少的患者则可能需减少IM 剂量[79]。在接受IM 治疗的GIST 患者中很少观察到血小板减少的发生,对于1~2级的血小板减少,可维持原治疗方案;而发生3级及以上血小板减少时可使用重组人促血小板生成素或白细胞介素11,同时暂停用药,尽量避免使用阿司匹林等可能增加出血风险的药物[79]。
4.4.6 乏力
乏力是IM 常见的不良反应,其发生可能与药物引起5-羟色胺失调、促炎细胞因子生成和神经肌肉功能退化有关。服用IM 的晚期GIST 患者乏力发生率约为34.7%(通常为1~2级),无需特殊处理;而对于乏力≥3级者应积极给予对症处理,同时进行适当锻炼如瑜伽,并联合物理治疗如推拿按摩、针灸等;但对于出现肿瘤骨转移、血小板减少、贫血、发热或活动性感染等的患者,应谨慎治疗,并辅以心理治疗、营养支持等;对于严重乏力的患者可适当予以精神兴奋类药物如哌甲酯、莫达非尼等药物治疗[84]。
4.4.7 肝毒性
IM 的肝毒性应引起足够重视,因为其可能导致肝功能衰竭甚至死亡[79]。约5.4%的GIST 患者在接受IM治疗后出现异常的转氨酶和胆红素升高[79],其中大部分患者转氨酶仅轻度升高,此类患者无需进行特殊治疗,但是应密切监测其肝功能。IM 所致肝毒性是可逆的,通常在用药治疗的前8周内出现,停止治疗1~4周后恢复正常。胆红素升高至正常值上限的3倍时,应中断IM治疗,直至指标恢复到正常值上限的1.5 倍以内。ALT和(或)AST 升高至正常值上限的5 倍时,应中断IM 治疗,直至恢复到正常值上限的2.5倍以内[8]。
4.4.8 心脏毒性
IM 所致的心脏不良反应并不常见,在GIST 的临床治疗中很少需要考虑,可能与IM 抑制非受体型酪氨酸激酶c-Abl相关[85]。据报道,接受IM治疗的GIST患者心力衰竭的发生率为0.5%~1.7%,通常见于65 岁以上有心脏相关危险因素的老年人[85]。当患者在治疗期间出现呼吸困难等症状时,可考虑进行心功能评估,仔细评估风险和获益,并对患者进行密切随访[75]。
5 附则
5.1 共识制定利益声明
共识专家和共识起草成员均要求填写利益声明表,所有作者均声明不存在利益冲突。本共识获中国药师协会立项批准。
5.2 共识更新计划
本共识计划在2~3年间更新版本。
《胃肠间质瘤伊马替尼个体化用药管理中国专家共识》工作组
编写组成员(按姓氏拼音排序)
陈万一(重庆大学附属肿瘤医院)
丁海樱(浙江省肿瘤医院)
董 梅(哈尔滨医科大学附属肿瘤医院)
董亚琳(西安交通大学第一附属医院)
方 罗(浙江省肿瘤医院)
封宇飞(北京大学人民医院)
高志冬(北京大学人民医院)
韩 勇(华中科技大学同济医学院附属协和医院)
何义富(安徽省肿瘤医院)
胡锦芳(南昌大学第一附属医院)
黄程辉(中南大学湘雅三医院)
黄 华(复旦大学附属肿瘤医院)
李 刚(江苏省肿瘤医院)
李国飞(中国医科大学附属盛京医院)
李国辉(国家癌症中心,国家肿瘤临床医学研究中心,中国医学科学院北京协和医学院肿瘤医院)
李岩峰(哈尔滨医科大学附属肿瘤医院)
栾家杰[皖南医学院第一附属医院(弋矶山医院)]
赖家骏(汕头大学医学院附属粤北人民医院)
揭志刚(南昌大学第一附属医院)
蒋微琴(浙江大学医学院附属第一医院)
贾 贝(国家癌症中心,国家肿瘤临床医学研究中心,中国医学科学院北京协和医学院肿瘤医院)
姜 帅(哈尔滨医科大学附属肿瘤医院)
寇有为(中国医科大学附属盛京医院)
黎军和(南昌大学第一附属医院)
刘继勇(复旦大学附属肿瘤医院)
楼 燕(浙江大学医学院附属第一医院)
马进安(中南大学湘雅二医院)
彭洪薇(南昌大学第一附属医院)
曲宏岩(哈尔滨医科大学附属肿瘤医院)
沙卫红(广东省人民医院)
孙 浩(重庆大学附属肿瘤医院)
孙学军(西安交通大学第一附属医院)
孙言才(安徽省肿瘤医院)
盛莉莉[皖南医学院第一附属医院(弋矶山医院)]
邰建东(吉林大学第一医院)
万相斌(河南省肿瘤医院)
王相峰(吉林大学第一医院乐群院区)
汪进国[皖南医学院第一附属医院(弋矶山医院)]
汪志凌(四川大学华西第二医院)
王成锋(国家癌症中心,国家肿瘤临床医学研究中心,中国医学科学院北京协和医学院肿瘤医院)
魏继福(江苏省肿瘤医院)
魏筱华(南昌大学第一附属医院)
肖洪涛(四川省肿瘤医院)
颜 苗(中南大学湘雅二医院)
燕 锦(四川省肿瘤医院)
杨春艳[皖南医学院第一附属医院(弋矶山医院)]
曾英彤(广东省人民医院)
张伶俐(四川大学华西第二医院)
张建伟(国家癌症中心,国家肿瘤临床医学研究中心,中国医学科学院北京协和医学院肿瘤医院)
张 李(天津医科大学肿瘤医院)
张 鹏(华中科技大学同济医学院附属协和医院)
张 洁(天津医科大学肿瘤医院)
张文周(河南省肿瘤医院)
肇丽梅(中国医科大学附属盛京医院)
郑锦坤(汕头大学医学院附属粤北人民医院)
左笑丛(中南大学湘雅三医院)
外审组成员(按姓氏拼音排序)
曹 舫(西安长安医院)
陈 琦(贵州省人民医院)
陈文刚(皖南医学院第二附属医院)
傅昌芳[中国科学技术大学附属第一医院(安徽省立医院)]
高 华(宁夏医科大学总医院)
黄 勇(皖南医学院第二附属医院)
刘丽娟(江西省肿瘤医院)
桑 冉(蚌埠医学院第一附属医院)
苏 方(蚌埠医学院第一附属医院)
谭诗生(贵州省人民医院)
王 磊(宁夏医科大学总医院)
王道荣(苏北人民医院)
杨建华(新疆医科大学第一附属医院)
赵 征(陕西省肿瘤医院)
张慧卿(江西省肿瘤医院)
张 华(新疆医科大学第一附属医院)
朱 华(苏北人民医院)
秘书组成员(按姓氏拼音排序)
伯贞艳(四川大学华西第二医院)
孔 滢(南昌大学第一附属医院)
柳 威(中南大学湘雅三医院)
乔涌起(国家癌症中心,国家肿瘤临床医学研究中心,中国医学科学院北京协和医学院肿瘤医院)
田 旭(吉林大学第一医院乐群院区)
张智瑞[皖南医学院第一附属医院(弋矶山医院)]
执笔者
魏筱华(南昌大学第一附属医院)
孔 滢(南昌大学第一附属医院)
刘 红(南昌大学第一附属医院)
江学辉(泉州市第一医院)
凯散尔·热西提(南昌大学药学院)
陈 旭(南昌大学药学院)
