秫米提取物对失眠小鼠睡眠的改善作用及机制研究 Δ
2024-02-28吕辰子赵彩蓉赵泓瑜李子昂孟祥龙张朔生山西中医药大学中药与食品工程学院山西晋中00619山西中医药大学中药炮制山西省重点实验室山西晋中00619东国大学韩医学院韩国庆州8066
王 娟 ,吕辰子 ,赵彩蓉 赵泓瑜 李子昂 韩 香 孟祥龙 张朔生 (1.山西中医药大学中药与食品工程学院,山西 晋中 00619;.山西中医药大学中药炮制山西省重点实验室,山西 晋中 00619;.东国大学韩医学院,韩国 庆州 8066)
失眠,又称睡眠障碍,主要表现为入睡困难或者难以维持睡眠状态,其不仅会影响人们学习记忆的正常功能,还容易导致免疫功能紊乱,诱发并增加神经炎症[1]。目前临床上常用苯二氮类或非苯二氮类化学药物治疗失眠,这类药物价格高、不良反应明显,长期使用易产生药物依赖性[2]。因此,开发具有疗效明确和安全性高的天然草本药物具有极大的现实意义。据报道,炎症因子是失眠的重要发病机制之一,磷脂酰肌醇3 激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路是体内调节细胞存活、凋亡及炎症的重要通路,其可通过调控核因子κB 亚基p65(nuclear factor-κB subunit p65,NF-κB p65)的表达,调节炎症因子水平,实现神经保护作用,从而延缓失眠的发生[3]。
秫米为禾本科植物粱Setariaitalica(L.)Beauv.或粟Setariaitalica(L.)Beauv.var.germanica(Mill.)Schrad.的黏性种子,味甘,性微寒,入肺、胃、大肠经,具有祛风除湿、和胃安神、解毒敛疮的功效[4]。秫米与半夏组成的半夏秫米汤被誉为治疗失眠的第一方,临床应用极为广泛[5]。现代药理研究表明,方中半夏水提物对小鼠有镇静催眠作用[6];而秫米作为一种天然草本药物,目前关于其镇静安神作用的研究鲜有报道。基于此,本研究拟以对氯苯丙氨酸(para-chlorophenylalanine,PCPA)诱导失眠小鼠模型,通过观察小鼠行为学变化和测定生化指标,围绕PI3K/Akt/NF-κB信号通路初步探究秫米提取物改善失眠的作用及可能机制,为秫米的进一步开发利用提供实证支持,也为中医药防治失眠提供实验依据。
1 材料
1.1 主要仪器
本研究所用仪器主要包括HC-2518 型高速离心机(安徽中科中佳科学仪器有限公司),OFT-100型大小鼠开场活动实验系统(成都泰盟科技有限公司),Synergy HTX型酶标仪(美国Bio-Tek公司),KZ-Ⅲ-F型研磨仪、SVE-2型垂直电泳仪(武汉赛维尔生物科技有限公司),DYY-6C型电泳仪电源(北京六一生物科技有限公司)等。
1.2 主要药品与试剂
秫米(批号220508)购自山西省农业科学院高寒区作物研究所,经山西中医药大学中药与食品工程学院张朔生教授鉴定为禾本科植物粱S.italica(L.)Beauv.或粟S.italica(L.) Beauv.var.germanica (Mill.) Schrad.的黏性种子。地西泮片(国药准字H10970219,批号20220701,每片含地西泮1.25 mg)购自济宁市安康制药有限责任公司;对照品葡萄糖、人参皂苷Rb1、没食子酸(批号分别为17042603、21101405、21012903,纯度均≥98%)均购自成都普菲德生物技术有限公司;PCPA(批号C13957194)购自上海麦克林生化科技有限公司;5-羟色胺(5-hydroxytryptamine,5-HT)、5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HTAA)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、白细胞介素2(interleukin-2,IL-2)、IL-6、B 细胞淋巴瘤2(B-cell lymphoma-2,Bcl-2)和Bcl-2 相关X 蛋白(Bcl-2-associated X protein,Bax)酶联免疫吸附检测(enzyme-linked immunosorbent assay,ELISA)试剂盒(批号均为202210)均购自上海泛柯实业有限公司;兔源NF-κB p65、磷酸化NFκB p65(p-NF-κB p65)、PI3K、磷酸化PI3K(p-PI3K)、Akt、磷酸化Akt(p-Akt)、β-肌动蛋白(β-actin)多克隆抗体(批号分别为BS1253、AP0124、BS3678、AP0854、BS1810、BS4006、AP0060)均购自武汉爱博泰克生物科技有限公司);辣根过氧化物酶(HRP)标记的山羊抗兔IgG 二抗(批号BA1054)购自武汉博士德生物工程有限公司。
1.3 动物
本研究所用动物为SPF 级雄性ICR 小鼠,共60 只,体重(20±2) g,由斯贝福(北京)生物技术有限公司提供,动物生产许可证号为SCXK(京)2019-0010,合格证号为10011230101930023。动物购入后,先在洁净环境中适应性饲养3 d,饲养环境温度为(23±1) ℃。饲养期间,给予普通饲料喂养,自由饮水,并保持垫料干燥、环境安静。本研究动物实验设计和实施方案通过了山西中医药大学伦理委员会审核和批准(编号为AWE202304295)。
2 方法
2.1 药物制备
(1)秫米提取物细粉:称取秫米50 g,加10 倍量(mL/g)蒸馏水浸泡15 min 后,加热回流提取30 min,过滤后加8倍量蒸馏水二次提取,合并上清液并浓缩至适宜浓度,冷冻干燥后收集细粉(得率45.3%),经紫外分光光度法[7—9]测得提取物中总皂苷、总多酚、总多糖含量分别为0.31%、0.08%、4.95%。将提取物干燥保存,备用。
(2)PCPA 溶液配制:精密称定 PCPA 1.0 g,溶于30 mL生理盐水中,再加入20 μL 聚山梨酯80促溶,涡旋混匀后得到PCPA混悬液。
(3)地西泮混悬液的制备:取地西泮1片,研成粉末,加入12.5 mL 生理盐水,超声(功率250 W,频率40 kHz)15 min,配制成质量浓度为0.1 mg/mL的混悬液。
2.2 动物分组、造模与给药
小鼠适应性喂养3 d 后,按随机数字表法分为空白组、模型组、阳性对照组(地西泮2.6 mg/kg,为成人临床等效剂量)和秫米提取物低、中、高剂量组(给药剂量分别为1.2、2.4、4.8 g/kg;按照《中华本草》中记载的秫米临床剂量并根据人和小鼠间体表面积折算的等效剂量为2.4 g/kg,以此作为中剂量),每组10只。除空白组外,其余各组小鼠均腹腔注射350 mg/kg PCPA混悬液,每天1次,持续3 d,以建立失眠小鼠模型;造模结束后,观察小鼠行为,当小鼠出现活动次数增加、易激惹、昼夜节律缺失、白天与夜晚活动不间断等行为则为造模成功[10]。造模成功后,空白组和模型组小鼠灌胃等体积生理盐水,各给药组小鼠灌胃相应药物,灌胃体积为0.01 mL/g,每天1 次,连续7 d。每天观察小鼠的精神活动状态、进食量、饮水量、对外界刺激的反应及体重变化等一般情况。
2.3 旷场行为学实验
末次给药60 min 后进行旷场行为学测试。将小鼠放置在反应箱正中央,采用小鼠的开场活动实验系统采集5 min 内小鼠的总运动距离、总静止时间、总运动时间、站立次数、修饰次数等活动轨迹。实验在安静、光线稳定的环境中进行。每只小鼠实验结束后,用75%乙醇擦拭方箱内壁及底面,防止留下气味及排泄物等。
2.4 标本采集与处理
旷场行为学实验之后,腹腔注射戊巴比妥钠(45 mg/kg)麻醉小鼠,腹主动脉取血约1 mL,室温下静置1 h后以4 000 r/min 离心15 min,分离血清,-80 ℃保存备用。小鼠取血后处死,剥离颅骨并分离海马,称取海马质量,加入9 倍体积预冷的磷酸盐缓冲液制备组织匀浆,并在4 ℃下以12 000 r/min离心15 min,取上清液于-80 ℃保存备用。
2.5 小鼠血清和海马组织中单胺类神经递质和炎症指标测定
取“2.4”项下血清,采用ELISA法测定血清中5-HT、BDNF、IL-2、IL-6、Bcl-2、Bax 的含量以及海马组织中5-HT、5-HTAA 的含量,并计算Bcl-2/Bax 比值。严格按照相应试剂盒说明书操作。
2.6 小鼠海马组织中PI3K/Akt/NF-κB 信号通路相关蛋白表达检测
采用Western blot 法进行测定。取冻存的海马组织样本30 mg,经蛋白提取、BCA 蛋白浓度定量及煮沸5 min 变性后,上样10 μg 蛋白进行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离(浓缩胶电压80 V、电泳时间20 min,分离胶电压120 V、电泳时间90 min),然后转移至硝酸纤维素(NC)膜(转膜电流300 mA,转膜时间120 min),以5%脱脂奶粉封闭2 h;加入PI3K、p-PI3K、Akt、p-Akt、NF-κB p65、p-NF-κB p65一抗(稀释比例均为1∶1 000)和β-actin 一抗(稀释比例为1∶2 000),4 ℃孵育过夜;TBST清洗4次后,加入HRP标记的羊抗兔IgG二抗(稀释比例为1∶2 000),室温孵育4 h;洗涤后暗室内采用ECL法检查,通过荧光化学发光凝胶成像系统检测目的条带,采用Image J 软件分析目的条带灰度值。以目的蛋白条带与内参蛋白条带灰度值的比值表示目的蛋白的表达水平,以p-NF-κB p65 与NFκB p65、p-PI3K与PI3K、p-Akt与Akt蛋白表达水平的比值分别表示NF-κB p65、PI3K、Akt蛋白的磷酸化水平。
2.7 统计学方法
采用SPSS 24软件对数据进行统计分析。符合正态分布的计量资料用±s表示,多组间比较采用单因素方差分析,组间两两比较使用LSD-t检验。检验水准α=0.05。
3 结果
3.1 秫米提取物对小鼠一般情况的影响
模型组小鼠白天活动增多,昼夜节律消失,精神亢奋,易激惹,毛发竖起且无光泽,体形消瘦;各给药组小鼠上述一般状态较模型组均明显改善。
3.2 秫米提取物对小鼠旷场实验行为学表现的影响
与空白组比较,模型组小鼠的总静止时间、站立次数及修饰次数均显著延长/增加(P<0.05),总运动距离、总运动时间均显著缩短(P<0.05);与模型组比较,阳性对照组和秫米提取物中、高剂量组小鼠的总运动时间均显著延长(P<0.01),总静止时间均显著缩短(P<0.01),并且秫米提取物各剂量组小鼠的站立次数及修饰次数均显著减少(P<0.05或P<0.01)。结果见表1。
表1 各组小鼠旷场实验行为学实验结果(±s,n=10)

表1 各组小鼠旷场实验行为学实验结果(±s,n=10)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05。
修饰次数4.80±0.84 7.20±0.84a 5.60±0.89 4.80±1.30c 4.60±0.55b 4.20±1.30b组别空白组模型组阳性对照组秫米提取物低剂量组秫米提取物中剂量组秫米提取物高剂量组总运动距离/mm 40 351.24±6 197.83 28 953.16±2 206.19a 35 827.18±2 494.41 29 372.82±1 346.61 34 533.60±2 166.02 35 607.24±4 662.43总静止时间/s 50.52±6.88 94.24±3.88a 73.56±7.42b 85.48±9.23 75.00±6.29b 74.02±6.83b总运动时间/s 245.10±6.65 198.78±12.40a 238.46±13.14b 214.52±15.74 232.82±9.61b 238.06±9.19b站立次数43.00±4.85 53.60±4.34a 49.80±3.27 38.00±4.74c 37.60±3.21b 34.40±6.11b
3.3 秫米提取物对小鼠血清中单胺类神经递质和炎症指标的影响
与空白组比较,模型组小鼠血清中5-HT、BDNF、Bcl-2 含量和Bcl-2/Bax 比值均显著降低(P<0.05),IL-6、IL-2 和Bax 含量均显著升高(P<0.05);与模型组比较,阳性对照组和秫米提取物高剂量组小鼠血清中上述指标水平均被显著逆转(P<0.05或P<0.01);秫米提取物中剂量组小鼠血清中5-HT、IL-2、Bax含量均被显著逆转(P<0.05或P<0.01)。结果见表2。
表2 各组小鼠血清中单胺类神经递质和炎症指标含量测定结果(±s,n=10)
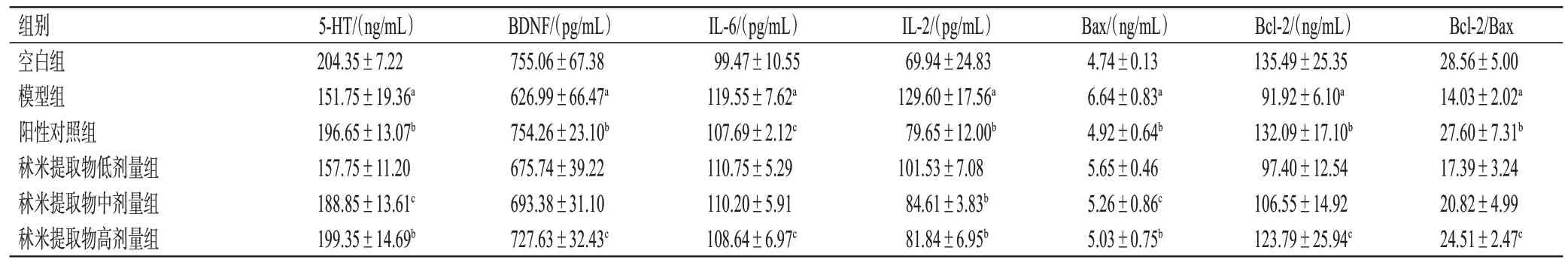
表2 各组小鼠血清中单胺类神经递质和炎症指标含量测定结果(±s,n=10)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05。
组别空白组模型组阳性对照组秫米提取物低剂量组秫米提取物中剂量组秫米提取物高剂量组Bcl-2/Bax 28.56±5.00 14.03±2.02a 27.60±7.31b 17.39±3.24 20.82±4.99 24.51±2.47c 5-HT/(ng/mL)204.35±7.22 151.75±19.36a 196.65±13.07b 157.75±11.20 188.85±13.61c 199.35±14.69b BDNF/(pg/mL)755.06±67.38 626.99±66.47a 754.26±23.10b 675.74±39.22 693.38±31.10 727.63±32.43c IL-6/(pg/mL)99.47±10.55 119.55±7.62a 107.69±2.12c 110.75±5.29 110.20±5.91 108.64±6.97c IL-2/(pg/mL)69.94±24.83 129.60±17.56a 79.65±12.00b 101.53±7.08 84.61±3.83b 81.84±6.95b Bax/(ng/mL)4.74±0.13 6.64±0.83a 4.92±0.64b 5.65±0.46 5.26±0.86c 5.03±0.75b Bcl-2/(ng/mL)135.49±25.35 91.92±6.10a 132.09±17.10b 97.40±12.54 106.55±14.92 123.79±25.94c
3.4 秫米提取物对小鼠海马组织中5-HT和5-HTAA含量的影响
与空白组比较,模型组小鼠海马组织中5-HT 和5-HTAA 含量均显著降低(P<0.05);与模型组比较,阳性对照组和秫米提取物高剂量组小鼠海马组织中5-HTAA含量显著升高(P<0.05)。结果见表3。
表3 各组小鼠海马组织中5-HT 和5-HTAA 含量测定结果(±s,n=10)
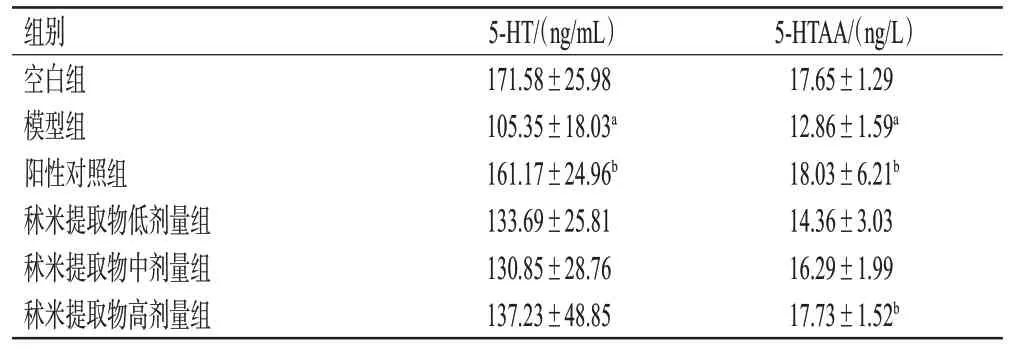
表3 各组小鼠海马组织中5-HT 和5-HTAA 含量测定结果(±s,n=10)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.05。
组别空白组模型组阳性对照组秫米提取物低剂量组秫米提取物中剂量组秫米提取物高剂量组5-HTAA/(ng/L)17.65±1.29 12.86±1.59a 18.03±6.21b 14.36±3.03 16.29±1.99 17.73±1.52b 5-HT/(ng/mL)171.58±25.98 105.35±18.03a 161.17±24.96b 133.69±25.81 130.85±28.76 137.23±48.85
3.5 秫米提取物对小鼠海马组织中PI3K/Akt/NF-κB信号通路相关蛋白表达的影响
与空白组比较,模型组小鼠海马组织中PI3K、Akt蛋白磷酸化水平均显著降低(P<0.05),NF-κB p65蛋白磷酸化水平均显著升高(P<0.05);与模型组比较,阳性对照组和秫米提取物低、高剂量组小鼠海马组织中PI3K蛋白磷酸化水平均显著升高(P<0.05或P<0.01),阳性对照组和秫米提取物高剂量组小鼠海马组织中Akt蛋白磷酸化水平均显著升高(P<0.05或P<0.01),秫米提取物中、高剂量组小鼠海马组织中NF-κB p65蛋白磷酸化水平均显著降低(P<0.05)。结果见图1、表4。
表4 各组小鼠海马组织中PI3K/Akt/NF-κB 信号通路相关蛋白的磷酸化水平测定结果(±s,n=10)
a:与空白组比较,P<0.05;b:与模型组比较,P<0.01;c:与模型组比较,P<0.05。
p-NF-κB p65/NF-κB p65 0.60±0.20 1.06±0.17a 0.83±0.15 0.76±0.15 0.69±0.08c 0.67±0.12c组别空白组模型组阳性对照组秫米提取物低剂量组秫米提取物中剂量组秫米提取物高剂量组p-PI3K/PI3K 0.74±0.11 0.46±0.09a 1.08±0.17b 0.72±0.10c 0.68±0.16 1.06±0.15b p-Akt/Akt 1.17±0.23 0.65±0.10a 1.03±0.20c 0.68±0.10 0.73±0.09 1.07±0.19b
4 讨论
PCPA是一种5-HT合成抑制剂,通过抑制色氨酸羟化酶阻滞5-HT的合成。随着大脑中5-HT的减少,会导致失眠、抑郁等病症发生[11]。因此,本研究采用腹腔注射PCPA 的方法来制备失眠小鼠模型,以探究秫米提取物对失眠小鼠的改善作用。地西泮是一种苯二氮类药物,通常被用作镇静药、抗焦虑药和肌肉松弛剂,故本研究选择地西泮作为阳性对照药。实验过程中笔者发现,小鼠在腹腔注射PCPA 3 d 后,出现了焦虑、烦躁、精神亢奋、体重增长缓慢等情况,而在秫米提取物干预下失眠小鼠的上述情况均有所改善。本研究发现,当小鼠处于失眠状态时,其运动路程明显缩短,探索能力下降;而经秫米提取物干预后,小鼠的总运动距离增加、总运动时间延长,总静止时间缩短,站立次数及修饰次数减少,这说明秫米提取物能影响失眠小鼠的自主活动,改善其失眠症状。
海马组织是大脑中重要的神经元区域,与记忆、情感和空间定向等功能密切关联,海马体积减小和神经元密度下降均与失眠相关,而神经炎症可以导致海马组织损伤和炎症反应[12]。5-HT 在海马组织中具有重要的生理和神经调节作用[13],5-HTAA 是5-HT 的主要代谢物。本研究结果显示,各给药组小鼠海马组织中5-HT 的含量均明显升高,这说明秫米提取物可促进小鼠体内5-HT的合成,改善失眠症状。
抗凋亡蛋白Bcl-2是一种环磷腺苷效应元件结合蛋白介导的蛋白质,有助于修复海马区神经元细胞;Bax为促凋亡蛋白,Bcl-2/Bax比值在细胞凋亡过程中有着重大意义[14]。BDNF 是一种神经营养因子,可抑制胱天蛋白酶3 活性并增加Bcl-2 的表达,保护神经细胞,防止细胞损伤[15]。本研究采用秫米提取物干预后,小鼠血清中Bcl-2/Bax比值和BDNF含量升高,提示秫米提取物可减缓小鼠神经元凋亡。
NF-κB 作为一种转录因子可以介导多种炎症反应和免疫反应,其过度活化会导致神经递质的改变和神经元的死亡,从而影响睡眠质量[16]。此外,一些炎症因子紊乱也会导致睡眠障碍,如IL-2、IL-6 等[17]。PI3K 是生长因子超家族信号转导过程中的重要分子,在多种生长因子的刺激下可被激活;Akt 可介导细胞生长、转化、分化等修复功能[18]。本研究结果表明,经秫米提取物干预后,小鼠血清中IL-6 和IL-2 水平降低,海马组织中Akt、PI3K蛋白磷酸化水平均升高,NF-κB p65蛋白磷酸化水平降低。该结果提示,秫米提取物可能通过调控PI3K/Akt/NF-κB信号通路,降低炎症因子水平,修复神经元细胞,进而改善小鼠失眠症状。
综上所述,秫米提取物可通过调控海马组织中PI3K/Akt/NF-κB信号通路相关蛋白的表达,减轻炎症反应,从而改善小鼠失眠症状。但本研究仅初步探究了秫米提取物调节炎症相关通路改善失眠症状,具体作用机制还需深入探索。
