头孢曲松及其杂质对斑马鱼肝脏的毒性
2024-02-27马媛媛崇小萌刘馨妍谢广云梁一帆姚尚辰张靖溥
张 锐,马媛媛,韩 莹,崇小萌,刘馨妍,谢广云,梁一帆,姚尚辰,,张靖溥,
(1.中国医学科学院/北京协和医学院医药生物技术研究所,北京 100050;2.中国食品药品检定研究院化学药品检定所抗生素室,北京102629;3.中国疾病预防控制中心职业卫生与中毒控制所,北京 100050)
模式生物斑马鱼因自身繁殖能力强、生殖周期短、胚胎易获得、已完成基因组测序及与人类基因的高度保守性等特点,广泛应用于药物筛选和安全性评价[1-2]。斑马鱼肝脏发育过程及肝功能均与人类高度相似,斑马鱼肝脏疾病模型已被广泛应用于人类肝毒性评价实验中[3-5]。
头孢菌素类是以冠头孢菌培养得到的天然头孢菌素C 作为原料,经半合成改造其侧链而得到的一类抗生素,属于β-内酰胺类抗生素[6]。头孢曲松是第三代头孢菌素类药物,对多种革兰氏阳性菌和革兰氏阴性菌具有强大的抗菌作用。头孢曲松偶见肝肾功能异常及血液系统改变,如中性粒细胞下降、血小板下降等,肌注部位可能有疼痛反应,偶见静脉炎[7]。由于其药物合成步骤繁杂,药物本身不稳定较容易产生杂质,而这些杂质与药物的毒性反应相关,容易使药效降低、抗菌活性减弱,甚至可能会对人体产生不良反应。药物自身带入以及降解形成的杂质的毒性、安全性等方面的研究是药品质量控制的重要依据[8]。
为了评估头孢曲松及其杂质暴露是否会产生肝脏毒性,本文以AB 品系野生型斑马鱼和转基因斑马鱼Tg(fabp10a:DsRed)作为实验动物,初步探讨头孢曲松及其杂质造成斑马鱼肝损伤的机制,为深入研究头孢曲松及其杂质造成人肝损伤的机制提供线索,并为药物监管和风险评估提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 样品头孢曲松(纯度83.9%)及其杂质A(纯度100%)、B(纯度100%)、C(纯度99.3%)、D(纯度100%)和E(纯度100%),均为白色粉末,且均由中国食品药品检定研究院提供,各受试物结构式见表1。油红O染色试剂购自美国Sigma-Aldrich公司;甲醇购自国药集团化学试剂有限公司。TRIzol 购自美国Invitrogen 公司;M-MLV反转录酶(M1708)购自美国Promega公司。
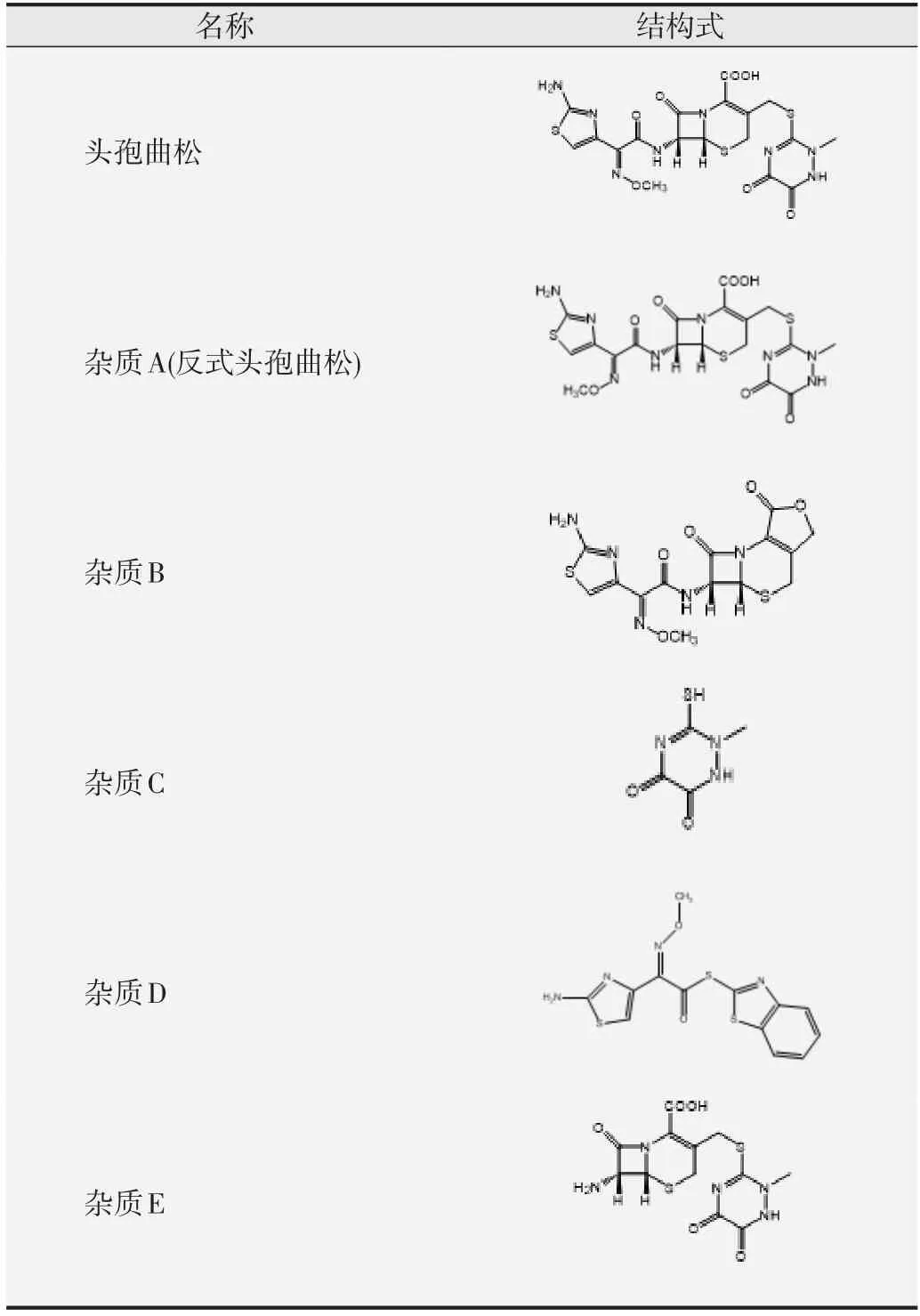
表1 头孢曲松及其杂质A、B、C、D、E的结构式
1.1.2 溶液的配制及浓度采用新鲜配制的斑马鱼饲养液(1 L纯水中加入0.3 g碳酸氢钠和0.2 g海水晶)为溶剂,头孢曲松及杂质A、B、C、D 每种物质均设置1、2、5 mmol/L 的3 个不同剂量组;杂质E 设置0.1、0.5、1 mmol/L的3个剂量组。所有受试物现用现配。
1.1.3 实验动物AB 品系(zebrafish,Danio rerio,AB strain)野生型和肝脏特异性荧光标记的Tg(fabp10a:DsRed)转基因斑马鱼严格按照以下条件饲养:温度为(28.5±1) ℃,饲养液电导率为480~550 μs/cm,光照14 h和黑暗10 h循环进行。挑选正常成鱼,按雌雄比1∶2的交配方式进行繁殖。收集受精后72 h的幼鱼,用于后续实验。
1.2 实验方法
实验分为对照组和受试物组,每组30枚幼鱼,受试物组用不同浓度头孢曲松或杂质溶液处理;在正常饲养液中发育的同批斑马鱼幼鱼为对照组。
1.2.1 野生型斑马鱼肝毒性实验选取野生型斑马鱼幼鱼,分别用头孢曲松及其杂质处理2 d 后,取受精后120 h 的幼鱼(每组至少30 枚),显微镜下活体观察幼鱼肝脏形态,计算肝脏的面积尺寸,并通过与对照组比对,用归一化的肝脏面积百分率判断头孢曲松及其杂质肝毒性。实验重复3次。
归一化的肝脏面积百分率=受试物组肝面积/对照组肝面积×100%
1.2.2 转基因斑马鱼肝毒性实验选取转基因斑马鱼幼鱼,分别用不同浓度的头孢曲松及其杂质处理2 d后,取受精后120 h 的幼鱼(每组至少30 枚),荧光显微镜下活体观察幼鱼肝脏荧光发光情况,记录幼鱼肝脏荧光强度及面积等数据,并通过与对照组比对,用归一化的肝脏面积百分率判断头孢曲松及其杂质肝毒性。实验重复3次。
1.2.3 斑马鱼整体油红O染色实验选取野生型斑马鱼幼鱼,用不同浓度的头孢曲松及其杂质分别处理2 d后,取受精后120 h的幼鱼(每组至少20枚)用PBS冲洗3次,转入4%多聚甲醛中,4 ℃下固定过夜;次日将斑马鱼样品从多聚甲醛中取出,于70%乙醇溶液中漂洗5 s 后放入新鲜配制的油红O 工作液(油红O储备液6 mL,加蒸馏水4 mL,混合,静置10~20 min,吸取上层液体)中染色5~10 min。用70%乙醇溶液洗去多余染液,PBS 冲洗1 遍,拍照。对幼鱼肝脏形态和脂肪含量变化进行观察,并通过与对照组比对判断头孢曲松及其杂质肝毒性情况。实验重复3次。
1.2.4 斑马鱼转录组测序及差异表达基因筛选头孢曲松杂质B、D和E不易获得且难溶于水,受试物量不足以进行转录组学测定,因此只对头孢曲松、杂质A及杂质C 进行转录组测序分析,测序浓度皆为5 mmol/L。取头孢曲松及其杂质A 和C 处理2 d 后的野生型斑马鱼幼鱼各100 枚,用PBS 清洗3 遍后置于含200 μL RNA later 试剂的EP 管中,随后置于-20 ℃冰箱备用。用TRIzol 试剂提取总RNA,作为mRNA 测序的建库起始样品。建库测序以及测序数据分析由上海美吉生物医药科技有限公司完成。
1.2.5 差异表达基因的KEGG富集分析得到差异表达基因后,为进一步了解差异表达基因的功能,阐述其在分子水平上的作用,利用KOBAS 3.0基于基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库进行信号通路富集分析,Bonferroni校正P<0.05。
1.3 统计学方法
采用GraphPad Prism 8.0.2 统计软件对数据进行分析。实验结果以表示,应用SPSS 26.0 进行统计学分析。采用单因素方差分析确定统计学差异,组间两两比较方差齐性时用LSD 法,方差不齐时用Dunnettt检验。P<0.05为差异有统计学意义。
2 结 果
2.1 头孢曲松及其杂质对野生型斑马鱼肝脏表型的影响
如图1 所示,与对照组相比,头孢曲松及其杂质诱导的野生型斑马鱼幼体肝毒性具有剂量-效应关系(r≥0.993,P<0.01)。正常对照组斑马鱼幼鱼肝组织结构清晰,呈浅红色或棕红色。经过不同浓度的受试物处理后,随着受试物浓度的增加,出现肝脏透明度下降、颜色变暗呈棕色或黑色,肝脏组织纹理无定形及面积改变等现象,显示头孢曲松及其杂质可导致肝脏变性。

图1 头孢曲松及其杂质对野生型斑马鱼肝脏表型的影响
头孢曲松及其杂质引起的肝毒性表型各不相同。与对照组相比,杂质B(r=0.999,P<0.01)、杂质D(r=0.993,P<0.01)和杂质E(r=0.994,P<0.01)引起斑马鱼肝脏面积随浓度降低而下降。1 和2 mmol/L 头孢曲松及其杂质A 和杂质C 均导致斑马鱼幼鱼肝脏面积增大,1 mmol/L 杂质C组与对照组间的差异具有统计学意义(P<0.01);而高浓度5 mmol/L 又会引起斑马鱼幼鱼肝脏区域减小(均为P<0.01),提示其高浓度下有可能诱发肝萎缩。归一化的肝脏面积百分率结果见图2。
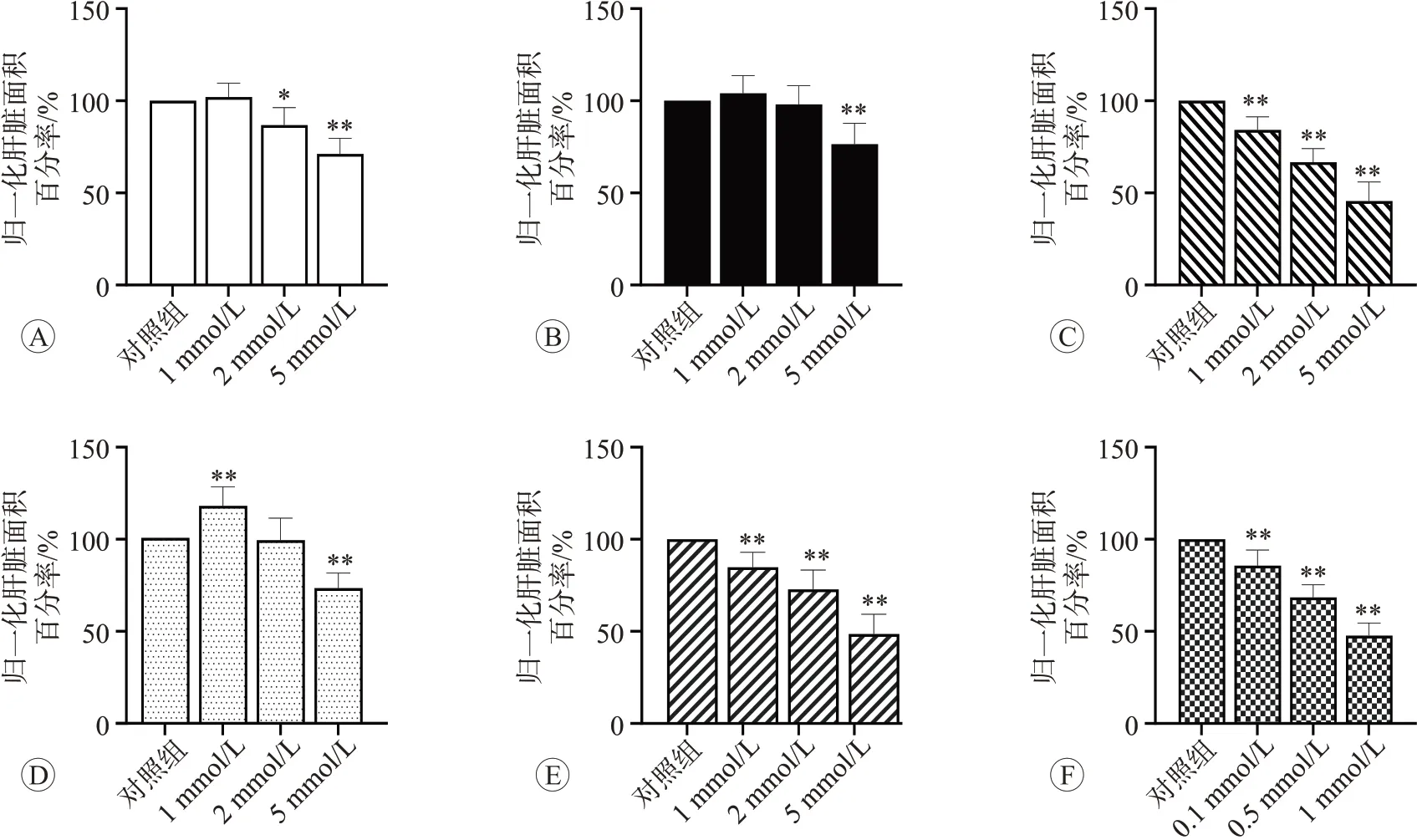
图2 头孢曲松及其杂质处理野生型斑马鱼后的归一化肝脏面积百分率分析
2.2 头孢曲松及其杂质对转基因斑马鱼肝脏发育的影响
如图3 所示,对照组斑马鱼幼鱼健康肝组织结构清晰,形态正常。与对照组比较,头孢曲松及其杂质均可诱导转基因斑马鱼幼体肝脏形态发生改变,其中1 和2 mmol/L 头孢曲松及杂质A 和C 均主要导致斑马鱼肝脏荧光区扩大或荧光强度增强,高浓度5 mmol/L组荧光面积减小,差异均具有统计学意义(P<0.05 或P<0.01),提示头孢曲松及杂质A和C有可能在高浓度下诱发肝萎缩。而杂质B、D和E均导致斑马鱼幼鱼荧光区减小或荧光强度减弱(P<0.05 或0.01)。归一化的肝脏面积百分率结果见图4。

图3 头孢曲松及其杂质对转基因斑马鱼肝脏表型的影响
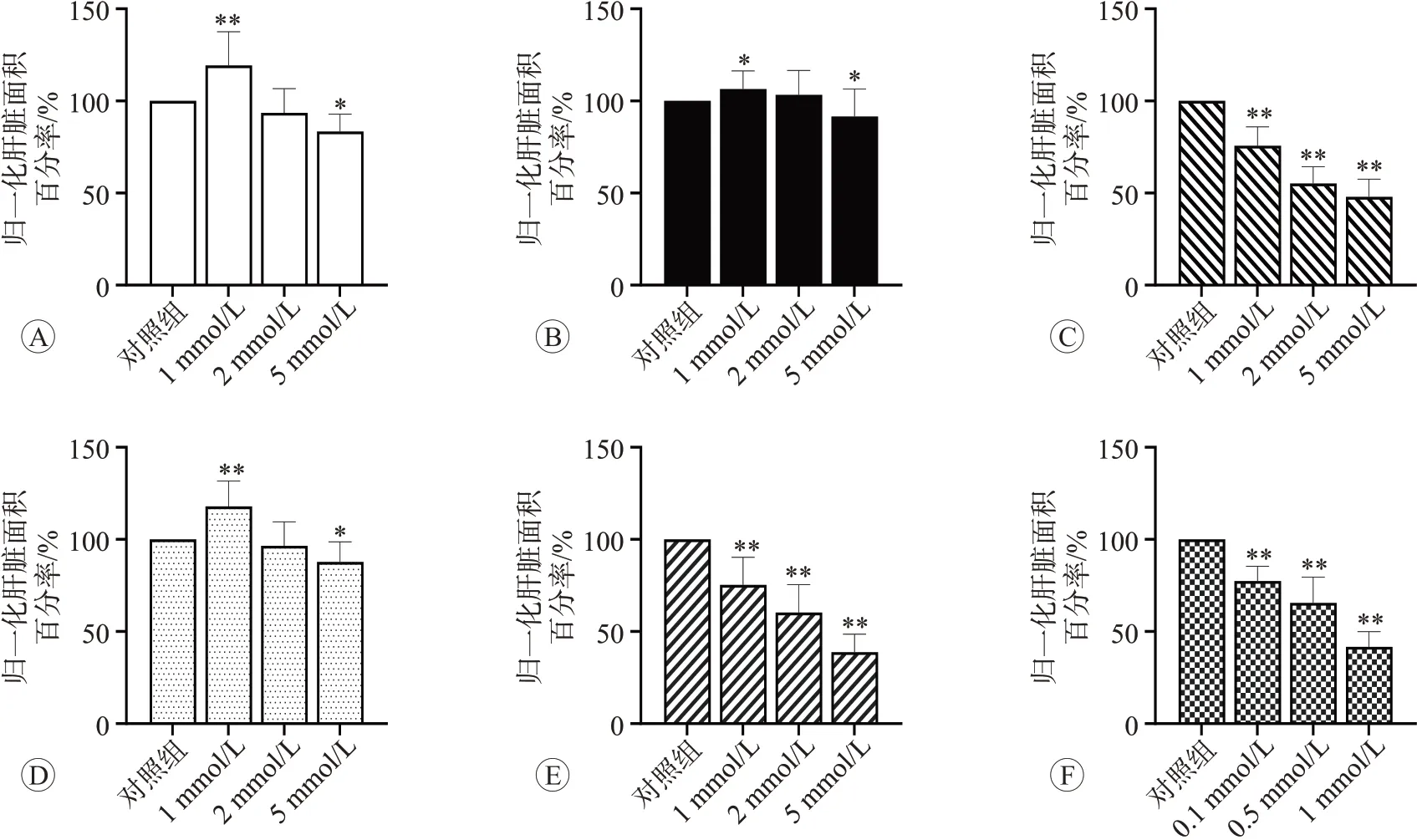
图4 头孢曲松及其杂质处理转基因斑马鱼后的归一化肝脏面积百分率分析
2.3 头孢曲松及其杂质对野生型斑马鱼幼鱼肝脂肪变性的影响
油红O 整体染色法检测野生型斑马鱼幼鱼肝脂肪变性情况如图5 所示。对照组斑马鱼幼鱼肝脏处无染色颜色或颜色较浅,即无脂肪堆积。与对照组相比,头孢曲松及其杂质A 和C 可导致幼鱼肝脏区域颜色随着受试物浓度的升高逐渐加深甚至高浓度组呈现黑色,杂质B、D和E处理组肝脏面积减小颜色变暗,脂肪主要堆积在卵黄囊处,且随给药浓度的增加现象越明显。
图5 头孢曲松及其杂质对斑马鱼肝脏脂肪含量的影响
2.4 测序及差异表达基因的筛选结果
测序结果如图6 所示,头孢曲松给药组共筛选出735 个差异表达基因,其中有553 个基因表达上调,182个基因表达下调;杂质A组共有237个差异表达基因,其中93 个上调,144 个下调;杂质C 组共有237个差异表达基因,其中有94 个上调,143 个下调。此结果表明在给予头孢曲松及其杂质A 和C 后,斑马鱼肝脏中基因的表达量发生了显著变化。
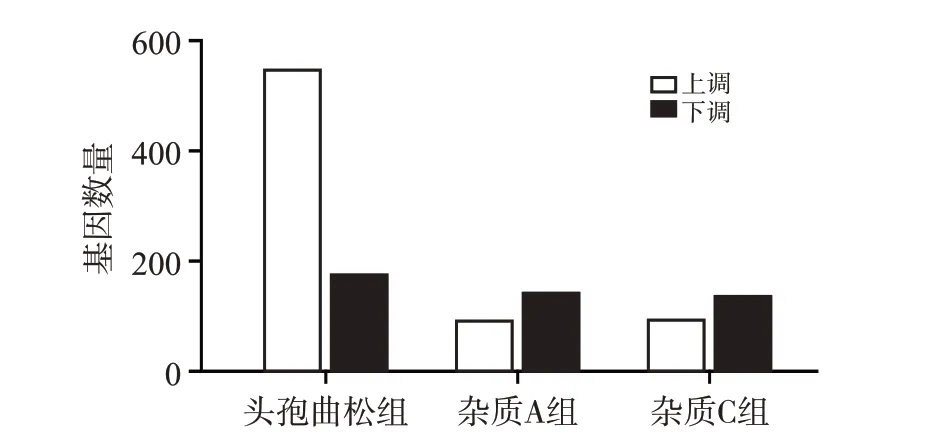
图6 头孢曲松及其杂质A和C处理后的差异表达基因数量
2.5 差异表达基因的KEGG富集分析
分别对头孢曲松及其杂质A 和C 处理组差异表达基因进行KEGG 通路分析,结果见图7。头孢曲松给药组主要富集到10条信号通路,包括代谢途径、类固醇激素生物合成、卟啉和叶绿素代谢葡萄糖酸盐的相互转化等相关通路。杂质A 组主要富集到3 条信号通路,包括代谢途径、色氨酸代谢和心肌收缩。头孢曲松杂质C 组主要富集到6 条信号通路,包括MAPK 信号通路、钙信号通路、核糖体等相关通路。
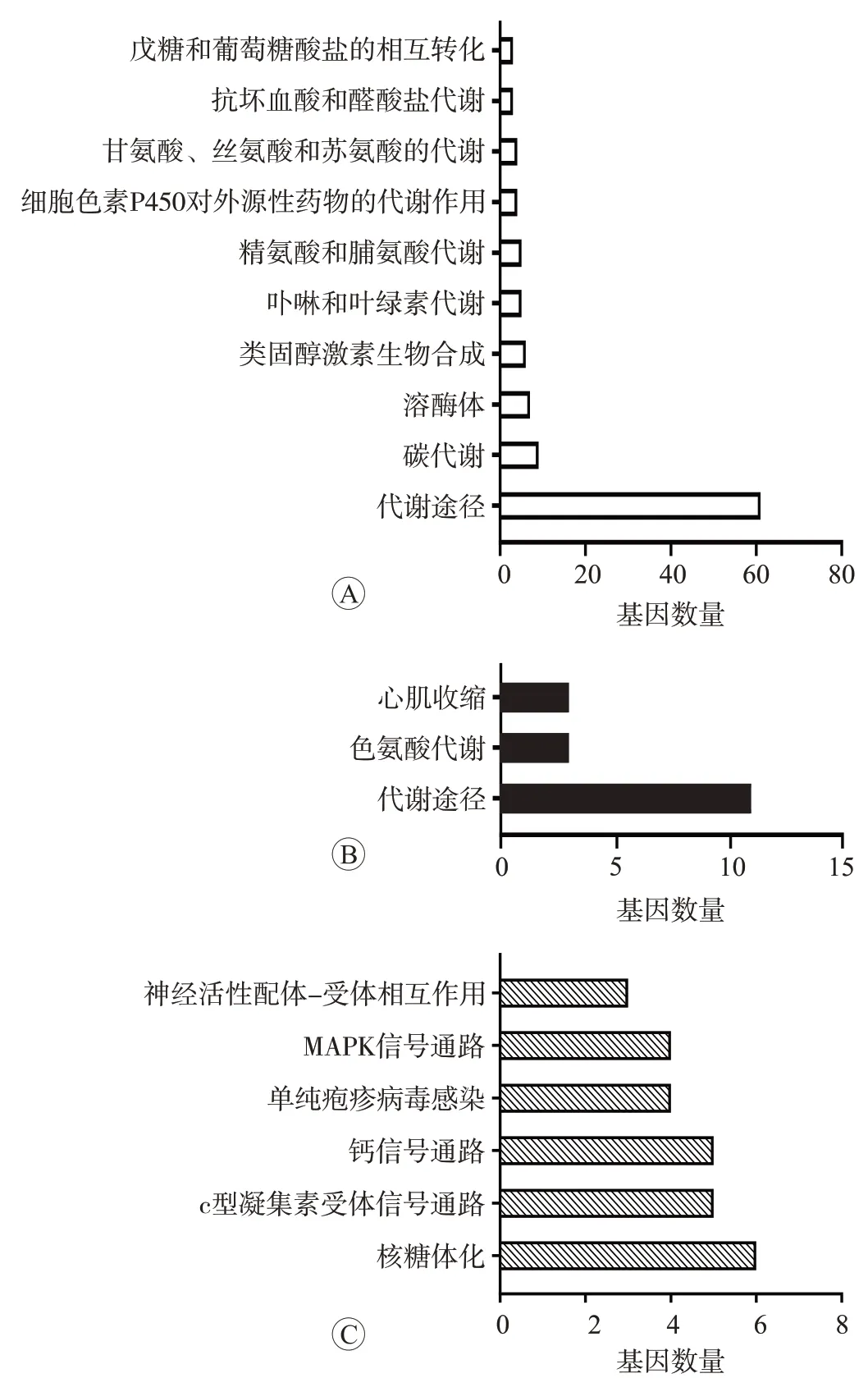
图7 头孢曲松及其杂质A和C处理组差异表达基因的KEGG富集通路直方图
3 讨 论
斑马鱼与哺乳动物具有相似的生理和功能,可作为筛选候选药物和化学品的毒性及安全性评估的体内模型[9-10]。斑马鱼同哺乳动物模型相比,具有与人类高度遗传保守性,可以用于筛选药物在组织中的靶向活性,提供有关化合物毒性等特性信息[11-12]。
头孢曲松属于第三代头孢菌素,是世界卫生组织基本药物标准清单中推荐的最安全有效的药物之一[13]。但由药物生产工艺或原料带入的杂质,或在贮存过程中产生的杂质等可影响药品的安全性和有效性[14-15]。因此,本文对头孢曲松及其杂质引起的肝毒性进行了初步研究。
结果显示,随着受试物浓度的增加野生型和转基因斑马鱼的肝脏毒性也增加,肝脏发黑现象逐渐严重,肝脏面积改变现象逐渐明显。头孢曲松及其杂质均可诱导转基因斑马鱼幼鱼肝脏形态发生改变,头孢曲松杂质B、D和E引起斑马鱼肝脏区域减小、荧光强度的减弱,肝脏位置颜色变暗,脂肪堆积于卵黄囊处。而1 和2 mmol/L 头孢曲松及其杂质A 和C 均导致斑马鱼幼鱼肝脏区域增大,荧光面积增大,肝脏区域颜色变暗;但高浓度5 mmol/L又会引起斑马鱼幼鱼肝脏区域减小,荧光面积减小,肝脏区域颜色呈黑色。这些现象提示头孢曲松及其杂质暴露可造成斑马鱼肝脏功能的变化,有可能诱发肝变性和肝萎缩。
转录组测序技术可捕捉不同组织的转录组动态变化,通过分析不同因素作用下的基因在RNA水平表达的差异,可将显著差异表达的基因与某些生物学功能联系起来,用于检测早期损伤标志物和分子调控机制的研究[16]。
因此本研究进一步提取头孢曲松及其杂质A 和C处理组斑马鱼幼鱼RNA进行高通量转录组测序,发现头孢曲松给药组有735 个基因的表达量发生变化,杂质A组共有237个差异表达基因,杂质C组共有237个差异表达基因。而分别对头孢曲松及其杂质A 和C 差异表达基因进行KEGG 通路分析发现,此3 种不同样品主要富集通路也存在差异。头孢曲松给药组主要富集到10条信号通路,包括代谢途径、类固醇激素生物合成、卟啉和叶绿素代谢葡萄糖酸盐的相互转化等相关通路;杂质A 组主要富集到3 条信号通路,包括代谢途径、色氨酸代谢和心肌收缩;杂质C 组主要富集到6 条信号通路,包括MAPK 信号通路、钙信号通路、核糖体等相关通路。
本研究利用模式生物斑马鱼模型初步评价头孢曲松及其杂质的肝毒性,结果表明头孢曲松及其杂质暴露可造成斑马鱼肝脏功能的变化,有可能诱发肝变性和肝萎缩,本实验结果为头孢曲松及其杂质的急性毒理学分析提供了基础数据。鉴于头孢曲松临床应用可能引起的肝损伤,本研究也为头孢曲松的药物监管和风险评估提供了参考。
