肝细胞核因子-1b在糜烂性毒剂2-氯乙基乙基硫醚诱导急性肺支气管上皮细胞损伤中的作用及其机制
2024-02-27孔德钦刘思佳刘建豪马丞飞赵昱舜周嘉恒师敏婕刘江正
孔德钦,刘思佳,2,刘建豪,2,马 耀,2,马丞飞,2,赵昱舜,2,周嘉恒,师敏婕,李 嘉,,刘江正,
(1.空军军医大学军事预防医学系军事毒理学与防化医学教研室/陕西省自由基生物学与医学重点实验室/教育部特殊作业环境危害评估与防治重点实验室,陕西 西安 710032;2.空军军医大学基础医学院学员二大队,陕西 西安 710032;3.空军军医大学航空航天医学系飞行人员康复与疗养教研室,陕西 西安 710032)
糜烂性毒剂作为一种经典的化学战剂,曾广泛应用于多次战争或恐怖袭击,导致了大量人员伤亡,对我国的化学安全构成了潜在的现实威胁。糜烂性毒剂经呼吸道或皮肤暴露后能够导致急性肺损伤,是导致伤员死亡和影响远期效应的最重要原因之一[1]。目前,糜烂性毒剂诱导急性肺损伤的中毒机制尚不明确,也缺乏有效的救治药物[2]。研究表明,糜烂性毒剂诱导急性肺损伤与过度活性氧(reactive oxygen species,ROS)聚集导致的氧化应激和线粒体功能障碍密切相关[3-4]。肝细胞核因子-1b(hepatocyte nuclear factor-1b,HNF-1b),亦称为HNF1β或TCF2,是一种在肝脏组织中大量表达的转录因子,属于含有同源域的超家族,在物种间高度保守[5]。HNF1-b的功能丧失或HNF-1b 等位基因截断可导致一种常染色体显性遗传疾病,称为青年5 型糖尿病(maturity-onset diabetes of the young type 5,MODY5)[6]。本课题组之前的研究表明,HNF-1b 在调节氧化应激和代谢过程中发挥了重要的作用[7],过表达HNF-1b能够显著减轻多氯联苯或双酚A诱导肝脏脂质代谢紊乱和肝损伤的发生和发展[8-9],其机制可能与抗氧化和保护线粒体功能相关[8]。除肝脏外,HNF-1b蛋白也被发现在其他器官和组织,包括肺、肠、胰腺、肾脏、生殖道和泌尿道中表达,被认为在上述器官的发育过程中发挥关键作用[5]。此前虽已证实HNF-1b在肺部上皮细胞中也有广泛表达,但其功能尚不明确[10]。本研究通过硫芥模拟剂2-氯乙基乙基硫醚(2-chloroethyl ethyl sulfide,CEES)构建糜烂性毒剂诱导体外肺支气管上皮损伤模型,检测CEES暴露后HNF-1b的变化;并通过慢病毒感染技术在人肺支气管上皮细胞系BEAS-2B细胞中过表达HNF-1b,探讨过表达HNF-1b 对CEES 诱导肺支气管上皮细胞损伤的调控作用及可能的机制。
1 材料与方法
1.1 主要试剂和仪器
2-氯乙基乙基硫醚(纯度99.5%)购自美国Sigma 公司;RPMI-1640 培养基和胎牛血清购自美国Gibco 公司;PBS、双抗溶液、0.25%胰酶、BCA 蛋白定量试剂盒购自北京索莱宝科技有限公司;CCK-8细胞活性检测试剂盒和凋亡检测试剂盒均购自南京恩晶生物有限公司;DCFH-DA、MitoSOX、JC-1荧光探针购自美国Thermo公司;DHE荧光探针购自上海碧云天生物技术有限公司;HNF-1b 抗体购自武汉爱博泰克生物科技有限公司,GAPDH抗体及二抗购自美国Bioworld公司;其他化学试剂均为分析纯以上级别。
Infinite M200 Pro全波段酶标仪购于瑞士Tecan公司;流式细胞仪为美国Beckman 公司产品;全自动高速冷冻离心机购于美国Sigma公司;CKX41S倒置显微镜和激光共聚焦显微镜购于日本奥林巴斯公司。
1.2 实验方法
1.2.1 细胞处理和分组人支气管上皮细胞系BEAS-2B 购自中国科学院上海细胞生物学研究所。BEAS-2B细胞接种于培养皿、6孔板或96孔板,使用含10%胎牛血清、100 IU/mL 青霉素和100 μg/mL 链霉素的RPMI-1640 培养基在CO2体积分数为5%的培养箱中培养。CEES 预先溶解于无水乙醇中制备成100 mmol/L的储备液,使用时稀释。细胞实验分为对照组和CEES 染毒组,其中对照组给予含1%(V/V)乙醇的无血清RPMI-1640培养基处理24 h,染毒组分别给予0.4、0.6、0.8、1.0 和1.2 mmol/L CEES 处理24 h;在分子功能实验中,将细胞分为4 组:溶剂对照组、CEES 组、HNF-1b 过表达组、HNF-1b 过表达+CEES组,CEES 的浓度为1 mmol/L,溶剂为1%(V/V)乙醇,处理时间为24 h,染毒结束后进行相应的检测。
1.2.2 CCK-8 试剂盒检测细胞活力采用试剂盒测定BEAS-2B 细胞活力。CEES 染毒结束后,向每孔中加入10 μL CCK-8,并将细胞在37 ℃条件下避光孵育1 h。通过全波段酶标仪检测450 nm 波长处吸光值,每组设10个复孔,取均值作为每组的吸光值,以对照组的吸光值为1,各组的细胞活力以其与对照组的相对值表示。
1.2.3 细胞大体形态观察将BEAS-2B细胞接种至6孔板,用不同浓度的CEES 处理24 h 后将细胞置于倒置显微镜下,在明场观察细胞大体形态的变化。
1.2.4 DCFH-DA 和DHE 检测细胞ROS 水平将BEAS-2B细胞接种至6孔板,按分组处理24 h后去除培养基,使用胰酶消化收集细胞沉淀,细胞内加入无血清培养基配制的终浓度为10 μmol/L的DCFH-DA或10 μg/mL的DHE探针工作液并重悬,在37 ℃孵箱内避光孵育30 min,去除探针,PBS 清洗1 次,用PBS重悬后用流式细胞仪检测,分别采用CytExpert软件收集检测数据,FlowJo软件对数据进行分析。
1.2.5 MitoSOX 检测线粒体ROS(mtROS)水平使用线粒体靶向的MitoSOX 荧光探针检测mtROS 含量。待BEAS-2B 细胞按分组处理24 h 后用胰酶消化收集细胞沉淀,加入无血清培养基配制的终浓度为5 μmol/L 的MitoSOX 探针,置于37 ℃孵箱内避光孵育20 min,后续操作同1.2.4。
1.2.6 Western blot 法检测HNF-1b 蛋白表达BEAS-2B 细胞处理结束后用4 ℃预冷的PBS 洗1 次,加入RIPA 裂解液在冰上裂解30 min,收集细胞裂解物,置于4 ℃高速离心机以12 000g离心20 min,收集上清即为细胞总蛋白。取少量蛋白,使用BCA法蛋白定量试剂盒进行蛋白浓度测定。其余蛋白样品加入5×上样缓冲液及二硫苏糖醇(dithiothreitol,DTT),100 ℃加热5 min 后用于Western blot 实验。取40 μg蛋白进行上样,电泳时初始电压设置为90 V,待蛋白到达分离胶时切换为120 V。在恒压20 V条件下使用PVDF 膜进行蛋白转印30 min,5%的脱脂奶粉封闭2 h,加入相应的HNF-1b 或GADPH 一抗,4 ℃摇床孵育16 h,TBST 洗膜3 次,加入1∶6 000 稀释的山羊抗兔二抗,摇床上孵育1 h,TBST 洗膜4 次,将条带置于凝胶成像系统进行显影并用Quantity One 软件进行拍照。
1.2.7 过表达HNF-1b 的BEAS-2B 细胞系的构建为了评价HNF-1b 在糜烂性毒剂诱导急性肺损伤中的作用及机制,我们构建了过表达HNF-1b 的BEAS-2B细胞系。首先用全基因合成的方式合成HNF-1b基因片段,并构建含有目的基因的重组质粒pCDH-CMVMCS-EF1-Puro-HNF1B,将质粒转染293lenti 细胞,产生高滴度的慢病毒。将BEAS-2B 细胞以5×104的密度接种于6孔板中,待细胞贴壁后加入10 μg/mL的凝聚胺(polybrene),同时以 感染复数(multiplicity of infection,MOI)为60 的滴度分别加入空载体对照病毒和HNF-1b 过表达的慢病毒。48 h 后换液,加入嘌呤霉素对有效感染的细胞进行筛选并扩增,从而构建稳定过表达HNF-1b的BEAS-2B细胞系。
1.2.8 Annexin V-FITC/PI双染法检测细胞凋亡使用Annexin V-FITC/PI 试剂盒经流式细胞仪检测细胞凋亡率。分别将正常细胞或者过表达细胞BEAS-2B接种在6 孔板,处理结束后用0.25%胰酶消化、离心、收集细胞,在细胞沉淀中加入200 μL 细胞凋亡检测工作液(缓冲液∶Annexin V-FITC∶PI=100∶1∶1),混匀后置于37 ℃孵箱中避光孵育30 min,PBS 洗1次,使用流式细胞仪检测细胞凋亡情况,通过CytExpert 软件收集数据,FlowJo 软件对数据进行分析。
1.2.9 JC-1 检测线粒体膜电位使用JC-1 染料检测线粒体膜电位(mitochondrial membrane potential,MMP)的变化。将BEAS-2B 细胞接种在共聚焦显微镜专用培养皿,待细胞处理结束后加入终浓度为2 μg/mL 的JC-1 工作液,置于37 ℃孵箱中避光孵育30 min,用PBS 洗3 次,使用共聚焦显微镜观察并拍照(红色荧光,EX/EM 为585/590 nm;绿色荧光,EX/EM为514/529 nm)。
1.3 统计学方法
2 结 果
2.1 CEES对BEAS-2B细胞活力水平的影响
不同浓度CEES 染毒24 h 后,CCK-8 法检测细胞活力,结果发现,与对照组比较,0.4 mmol/L CEES处理组BEAS-2B细胞活力升高(P<0.05),当CEES浓度超过0.6 mmol/L 时,细胞活力均显著降低(P<0.01),且具有剂量效应关系(r=-0.93,P<0.01)。上述结果提示糜烂性毒剂诱导肺上皮细胞损伤体外模型构建成功,见图1。

图1 不同剂量的CEES染毒后对BEAS-2B细胞活力的影响
2.2 CEES 染毒后对BEAS-2B 细胞形态和ROS 的影响
光学显微镜下发现,与对照组比较,0.6 mmol/L CEES 处理组细胞数量显著降低,上皮状细胞呈现纤维化表征,当CEES 浓度超过0.8 mmol/L 时,皱缩状的死细胞明显增多(图2)。

图2 不同剂量CEES染毒后的BEAS-2B细胞形态
氧化应激在糜烂性毒剂导致肺损伤中发挥了关键效应。基于DCF-DA 探针和MitoSOX 探针的流式细胞术分别检测细胞内总ROS 和线粒体ROS 水平,见图3。与对照组相比,0.6 mmol/L CEES 处理组总ROS(P<0.01)和线粒体ROS水平降低(P<0.05),而0.8 和1 mmol/L CEES 处理导致总ROS 和线粒体ROS 水平均显著升高(P<0.01)。上述结果提示CEES 能够诱导细胞氧化应激,同时引发线粒体氧化损伤。由于1 mmol/L CEES 处理组上述指标均显著,故后续实验用该浓度处理细胞。

图3 不同剂量CEES染毒后对BEAS-2B细胞ROS的影响
2.3 CEES 染毒对BEAS-2B 细胞HNF-1b 表达的影响
Western blot 检测BEAS-2B 细胞中HNF-1b 蛋白的表达,与对照组细胞相比,1 mmol/L CEES 染毒组HNF-1b 的蛋白水平显著下调(图4,P<0.01)。结果表明,HNF-1b 可能是糜烂性毒剂诱导急性肺损伤的重要靶分子。

图4 CEES染毒对BEAS-2B细胞HNF-1b表达的影响
2.4 过表达HNF-1b抑制CEES染毒导致的细胞损伤和凋亡
与对照组细胞相比,采用慢病毒转染过表达HNF-1b 的BEAS-2B 细胞系HNF-1b 的蛋白表达水平显著上调(图5A)。CCK-8 检测细胞活力结果表明,与正常对照组相比,过表达HNF-1b显著抑制了CEES导致的细胞活力降低(图5B,P<0.01)。细胞凋亡检测结果表明,过表达HNF-1b还明显拮抗了CEES导致的细胞凋亡发生(图6,P<0.01)。此结果表明,过表达HNF-1b显著减轻了CEES诱导的肺上皮细胞损伤。
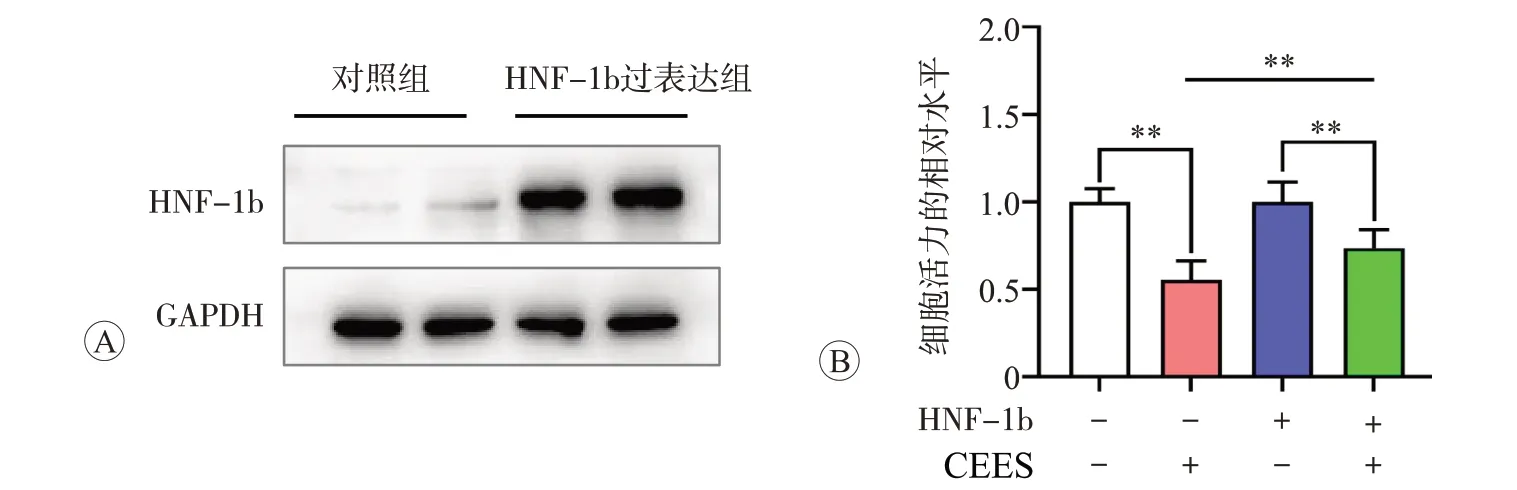
图5 过表达HNF-1b抑制CEES导致的细胞增殖活力

图6 过表达HNF-1b抑制CEES导致的细胞凋亡
2.5 过表达HNF-1b 可逆转CEES 诱导的BEAS-2B细胞ROS生成
氧化应激是糜烂性毒剂诱导急性肺损伤的重要机制之一。通过DHE 荧光探针检测,结果显示单独CEES 作用时,细胞内总ROS 水平较对照组明显升高(P<0.01);而过表达HNF-1b 可逆转CEES 染毒导致的BEAS-2B细胞内总ROS水平的升高(图7,P<0.01)。上述结果提示,过表达HNF-1b 可能通过抗氧化作用抑制CEES诱导肺上皮细胞损伤。
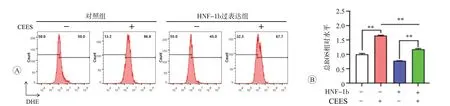
图7 过表达HNF-1b抑制CEES导致的细胞总ROS生成
2.6 过表达HNF-1b 逆转CEES 染毒导致的BEAS-2B细胞线粒体功能障碍
本研究检测了过表达HNF-1b 后线粒体损伤相关指标的变化,发现过表达HNF-1b显著抑制了CEES导致的线粒体ROS水平升高(图8,P<0.01),同时减轻了CEES 导致的MMP 水平降低(图9)。上述结果表明,HNF-1b 能够通过调控线粒体功能参与糜烂性毒剂CEES诱导的肺上皮细胞损伤过程。
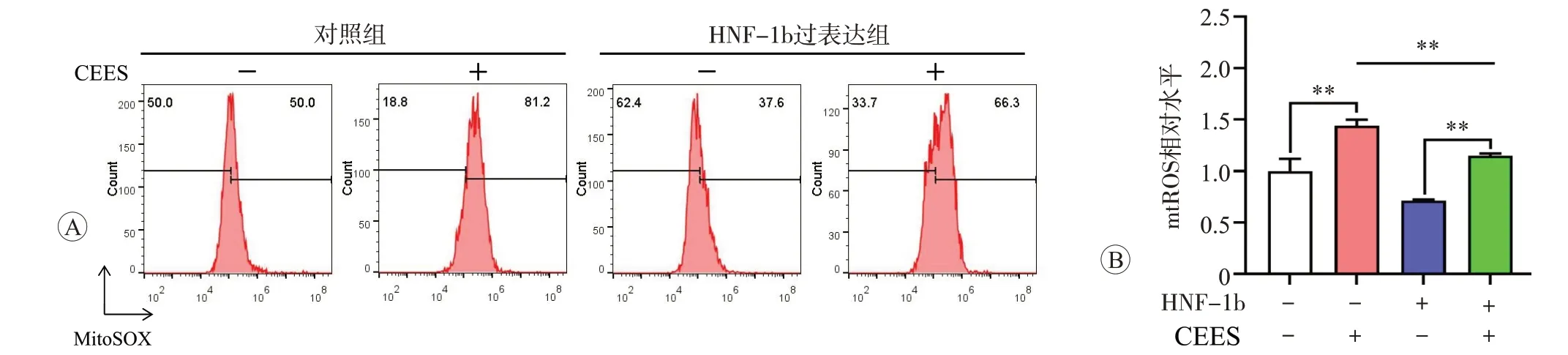
图8 过表达HNF-1b抑制CEES导致的mtROS生成

图9 过表达HNF-1b抑制CEES导致的线粒体膜电位受损
3 讨 论
糜烂性毒剂是一类能够直接损伤器官、组织和细胞,吸收后能导致全身中毒损伤的致死性化学战剂,曾在战争历史上被广泛使用,造成了众多的军事人员和平民中毒[11]。但其中毒和发病机制复杂,目前也缺乏有效的救治手段,需要研究新的中毒靶点和相关机制,以寻求新的干预靶标和救治思路[12]。此外,糜烂性毒剂导致的肺损伤如治疗不及时或不彻底,将会转变成慢性肺损伤,严重影响中毒伤员的预后和生活质量[13]。研究表明,过量ROS 生成导致的氧化应激被认为是糜烂性毒剂诱导急性肺损伤的关键致病因素之一,氧化应激还介导了炎症和凋亡的发生和发展[14]。使用抗氧化剂或抗氧化酶可在一定程度上减轻糜烂性毒剂诱导的器官损伤[15-16]。
本课题组以往的研究证实,HNF-1b 作为肝脏中大量表达的一种核转录因子,在调节脂肪合成、脂肪细胞分化、葡萄糖稳态和胰岛素抵抗中发挥了重要的调控作用,同时还能通过调控氧化酶的表达和炎症因子释放发挥氧化应激和炎症调节作用[10]。HNF-1b缺乏能够导致复杂和异质的临床表型,如肾脏和胰腺的发育异常、糖耐量异常等[17]。最新的研究发现,肺组织内也有HNF-1b 表达,目前其功能尚不明确[18]。过表达HNF-1b 可以通过抑制PI3K/Akt 磷酸化,显著抑制肺上皮细胞系A549 的恶性生物学行为[18],提示肺部HNF-1b 的表达对于呼吸系统可能具有其特殊的生物学功能。为了探索HNF-1b 在糜烂性毒剂导致急性肺损伤中的作用及调控机制,我们构建了CEES 染毒的BEAS-2B细胞模型,检测HNF-1b的表达改变对CEES诱导肺损伤的调控作用,以期为开发新的抗毒靶标和深入理解糜烂性毒剂中毒机制提供新思路。
在前期研究中,我们已证实,过表达HNF-1b慢病毒或使用化学单体齐墩果酸药理性激活HNF-1b能够通过上调抗氧化关键调控因子Nrf-2的表达和抑制NF-κB信号,进而抑制氧化应激损伤和炎症反应过度激活,表现出对环境污染物胁迫的保护作用[7]。本研究中,在CEES染毒BEAS-2B细胞后,HNF-1b蛋白的表达显著下调,结合HNF-1b对氧化应激和炎症反应的负向调控作用,我们推测HNF-1b的表达下调可能参与了CEES导致的急性肺损伤的发生和发展。后经慢病毒转染构建了过表达HNF-1b的肺支气管上皮细胞BEAS-2B细胞系,发现HNF-1b的蛋白表达水平显著上调,且过表达HNF-1b能够显著减轻CEES染毒所诱导的BEAS-2B细胞损伤,提高细胞活力,进一步证实了HNF-1b可能是拮抗糜烂性毒剂导致细胞损伤的保护性分子。
凋亡是一种受多种因素调节的程序性细胞死亡过程,文献已证实糜烂性毒剂染毒可以通过抑制VDR/Nrf2/Sirt3信号通路等诱发肺支气管上皮细胞的凋亡[19]。Kang等[18]报道HNF-1b通过调节细胞周期和凋亡途径参与了胚胎器官的发育过程。本文通过流式细胞术检测发现过表达HNF-1b可抑制CEES诱导的BEAS-2B细胞凋亡,提示上调HNF-1b 表达具有抗细胞凋亡的作用。上述结果表明,HNF-1b对糜烂性毒剂导致的肺上皮细胞发挥了保护作用,而CEES染毒导致的HNF-1b的抑制可能参与了肺上皮细胞的凋亡过程。
ROS 被认为是糜烂性毒剂诱导毒性的关键介质[20]。使用低分子量抗氧化剂或辅助因子、酶性抗氧化剂可以有效改善糜烂性毒剂中毒的损伤程度。糜烂性毒剂暴露后导致ROS 过量生成,介导脂质、蛋白和核酸发生氧化损伤[14]。目前,糜烂性毒剂导致氧化应激的机制尚不明确,可能涉及还原型谷胱甘肽(reduced glutathione,GSH)的耗竭[21]与抗氧化酶SOD的抑制[22]等。大量研究也证实,HNF-1b介导的氧化还原稳态调节可以抑制多氯联苯混合物诱导的氧化损伤[8],且多氯联苯[7]和双酚A[9]还能通过抑制HNF-1b促进氧化应激,提示HNF-1b 可能是一个新的氧化还原调控因子。在本研究中,我们发现HNF-1b 过表达能够逆转CEES 染毒诱导的细胞内ROS 水平和线粒体ROS水平升高,进而减轻氧化应激损伤。上述结果说明HNF-1b 作为一种保护性分子可能通过抗氧化而发挥拮抗糜烂性毒剂作用。另外,在本研究中还发现,0.4 mmol/L CEES 处理能够轻度提高细胞活力,0.6 mmol/L 时使总ROS 和线粒体ROS 水平轻微降低,这可能是由于毒物兴奋效应引起的,这是一种生物体对外界不利环境或者有毒物质产生的适应性保护反应,低水平的刺激作用会促进细胞活力增加,并通过激活Nrf2分子等增强细胞内防氧化能力,进而降低细胞内的ROS水平,从而使生物体更易于存活[23]。
糜烂性毒剂导致急性肺损伤的发病机制复杂,其中线粒体功能障碍备受关注[24]。越来越多的研究表明,氧化应激诱导的线粒体结构和功能异常参与了肺上皮细胞的死亡[24-25]。靶向线粒体的抗氧化剂能够显著减轻CEES诱导的细胞活力降低[24]。本课题组前期研究也证实,线粒体抗氧化剂MitoQ 能够有效减轻氮芥诱导的小鼠急性肝损伤[26]。Casemayou 等[27]报道,HNF-1b 的缺失导致肾小管细胞线粒体呼吸发生异常,提示HNF-1b 的下调可能参与了线粒体功能异常。为了进一步明确HNF-1b 对糜烂性毒剂诱导急性肺损伤的调控作用,我们通过JC-1 探针技术检测了MMP 水平。MMP 是线粒体活性的关键指标,它反映了电子运输和氧化磷酸化的过程,而氧化磷酸化是ATP产生的驱动力[28]。在本研究中,结果显示CEES暴露能够导致线粒体功能异常,表现为MMP 的显著降低,而过表达HNF-1b能够显著拮抗CEES对线粒体功能的损伤效应,提示线粒体功能调节可能参与了HNF-1b对糜烂性毒剂肺损伤的拮抗作用。
本研究通过构建糜烂性毒剂模拟物CEES 染毒体外细胞模型,证实CEES暴露后能够导致HNF-1b表达的显著下调,其可能是重要的干预靶标。过表达HNF-1b 能够显著减轻CEES 诱导的细胞损伤和凋亡,抑制线粒体功能障碍和氧化应激,靶向激活HNF-1b可能在糜烂性毒剂诱导急性肺损伤的临床救治中发挥重要作用。
