自噬在α粒子辐射诱发人支气管上皮细胞恶性转化中的作用
2024-02-27武云云王成芳曲功霖闫皓宇
杨 莉,邵 帅,武云云,王成芳,曲功霖,闫皓宇,苟 巧
(中国疾病预防控制中心辐射防护与核安全医学所,辐射防护与核应急重点实验室,北京 100088)
肺癌作为一种常见的恶性肿瘤,严重危害人类的身体健康。放射性氡及其子体是非吸烟者患肺癌的第一大危险因素[1]。氡的主要危害是短寿命子体衰变时不断发射出的高能α粒子,这些α粒子会滞留在人体的呼吸道表面,对局部细胞产生照射,从而诱发肺癌[2]。随着氡暴露与肺癌发生之间存在的密切关系被揭示,α粒子辐射致肺癌的分子机制研究越来越受到重视。
自噬是一种进化上古老且高度保守的分解代谢过程,主要通过各种细胞器形成自噬体并包裹细胞内待降解蛋白及受损细胞器与溶酶体融合成为自噬溶酶体,降解内容物,并将其循环利用或用于促进代谢途径的过程。自噬对肿瘤的发生、发展具有双重调节作用,既能抑制肿瘤的发生,减少细胞的DNA损伤和恶性增殖;亦能对肿瘤起保护作用,帮助肿瘤细胞在营养能量匮乏的环境下生存[3]。由于自噬在不同的生物学背景(癌症类型)下可以产生抑癌或致癌作用,目前自噬对癌症发生、发展的意义仍有争议。
迄今为止,国内外对α粒子辐射诱发肺癌分子机制的研究主要围绕癌基因过表达[4],抑癌基因突变或表达下调[5-6],DNA 损伤修复系统缺陷[7],氧化/抗氧化失衡[2,8]几方面进行,关于自噬在α粒子辐射诱发肺癌过程中的作用还未见报道。本研究利用永生化人支气管上皮细胞BEP2D、α粒子照射BEP2D后的第24代细胞RH24(具有一定的恶性表型)及其恶性转化细胞株BERP35T-1(具有明确的恶性表型),分析α粒子辐射诱发BEP2D细胞恶性转化中细胞自噬水平的变化;选择恶性程度最高的BERP35T-1细胞,分别用自噬抑制剂CQ 和自噬激活剂Rapa 抑制和促进该细胞自噬后,检测细胞的增殖、侵袭和迁移能力变化,旨在从自噬影响细胞恶性表型(增殖、侵袭和迁移能力)的角度,探讨α粒子辐射诱发人支气管上皮细胞恶性转化的机制。
1 材料与方法
1.1 试剂及主要仪器
胎牛血清、LHC-8 培养基购自美国Gibco 公司;LC3B、P62 抗体购自Abcam 公司;LC3A/B 抗体购自Cell Signaling 公司;β-actin抗体购自北京中杉金桥公司;GAPDH 抗体购自上海Abmart 公司;蛋白定量试剂盒、硝酸纤维素膜、浓缩电泳液及转膜液均购自北京普利莱公司;蛋白裂解液、发光检测试剂盒购自美国Thermo公司;牛血清蛋白、胰蛋白酶和二甲基亚砜(DMSO)购自美国Sigma 公司;CCK-8 试剂盒购自日本同仁公司;CQ 购自美国MCE 公司;Rapa 购自美国Abcam 公司;均用DMSO 助溶,作用细胞时对照组培养基中均含等体积DMSO。Transwell 小室购自美国Corning 公司。Primo Vert 倒置显微镜为德国蔡司公司产品,ChemiDoc XRS+发光检测成像系统为美国Bio-rad 公司产品,JEM-1400 Plus 透射电子显微镜为日本电子公司产品。
1.2 细胞来源和培养
BEP2D 细胞为经HPV-18 永生化的人支气管上皮细胞;RH24细胞为采用238PuO2沉积源α粒子1.5 Gy剂量照射BEP2D 细胞后的第24 代细胞,具有一定的恶性表型,但不能在裸鼠身上成瘤;BERP35T-1恶性转化细胞系是用238PuO2沉积源α粒子1.5 Gy 剂量照射BEP2D细胞,连续传35代后接种裸鼠,从成瘤细胞中克隆出来,具有明确的恶性表型,经病理专业人员鉴定为肺鳞癌细胞[9-11]。BEP2D、RH24、BERP35T-1 细胞均由原军事医学科学院二所四室周平坤和胡迎春老师惠赠。用LHC-8无血清培养基,在37 ℃、CO2体积分数为5%的条件下培养。BEP2D、RH24、BERP35T-1细胞每3 d更换1次培养基,每周传代1次。
1.3 Western blot 检测细胞内自噬相关蛋白LC3B和P62的表达
分别收获指数生长期的BEP2D、 RH24 和BERP35T-1 细胞,或用不同浓度自噬抑制剂CQ(0、40、60 μmol/L)及自噬激活剂Rapa(0、12.5、25 pmol/L)分别作用BERP35T-1 细胞48 h,用细胞裂解液裂解细胞,震荡5 min,于4 ℃、12 000 r/min离心10 min后,吸取上清液于-20 ℃保存,BCA法测定蛋白浓度,每个EP 管30 μg 蛋白,100 ℃变性5 min。配制不同浓度的分离胶和浓缩胶,各凝胶孔上样量保持一致;电压设置恒压60 V 电泳30 min,溴酚蓝进入分离胶后,调整电压至80 V 电泳90 min;转膜设置恒压110 V,20 min,分离分子质量20 ku 以下的蛋白,20 min结束后取出小分子量胶和膜,再继续转膜50 min,在冰水浴中进行转膜;在室温中用BSA封闭液封闭1 h;加入LC3B、P62、GAPDH 对应的一抗及BSA 封闭液在4 ℃中孵育过夜,用TTBS 洗膜3 次;在室温中用对应物种的二抗及BSA 封闭液孵育1 h,用TTBS 洗膜3 次,用发光显迹液在凝胶成像仪上显色。使用相应的内参(β-actin/GAPDH)作为对照,ImageJ软件进行灰度分析,计算LC3B和P62的相对表达水平。
1.4 透射电镜观察细胞内自噬小体的变化
使用0.25%的胰蛋白酶分别消化BEP2D、RH24和BERP35T-1 细胞5 min,使用含10% FBS 的培养基终止消化,1 200 r/min 离心5 min 后去除上清,加入2.5%的戊二酸磷酸盐缓冲液(pH为7.2~7.4)1 mL固定过夜。此后由北京大学医学部电镜平台进行制样,具体步骤为:使用0.1 mol/L 的PBS 缓冲液洗涤样品3 次,每次10 min;再用1% OsO4-PBS 固定1 h,用ddH2O洗3次,每次15 min;再用30%、50%、70%、95%丙酮进行梯度脱水,接着用100%乙醇脱水3 次,每次10 min;然后将样品以1∶1体积比转移进丙酮中浸透3 h;将标本放于包埋介质中,37 ℃加热24 h、48 ℃加热24 h、60 ℃加热24 h 聚合;然后将其切成50~70 nm 厚的薄片,用乙酸铀酰和碱性柠檬酸铅双染色15 min,最后使用透射电子显微镜观察细胞内自噬小体并拍照,根据其形态特征计数单位面积内自噬小体的数量。
1.5 CCK-8法检测细胞的增殖情况
将指数生长期的BERP35T-1细胞按1×104个/孔接种于96 孔板中,24 h 后,用不同浓度CQ(0、40、60 mmol/L)及Rapa(0、25 pmol/L)分别作用BERP35T-1 细胞48 h,每个浓度点设立6 个复孔。细胞用含有10%CCK-8 的LHC-8 培养基于96 孔板中37 ℃孵育2 h后,室温下振荡孵育5 s,用酶标仪测定450 nm波长下各孔的吸光度值D(450),计算细胞存活率。
细胞存活率=D(450)检测组/D(450)空白对照组×100%
1.6 Transwell实验检测细胞的侵袭能力
提前一天将基质胶从-20 ℃冰箱中取出放置于4 ℃冰箱解冻,将基质胶和Opti-MEM 无血清培养基以1∶8 混合稀释,向Transwell 小室中加入100 μL 的基质胶稀释液,置于培养箱中聚合1 h。BERP35T-1细胞经CQ(0、40、60 μmol/L)及Rapa(0、25 pmol/L)分别作用后,用0.25%胰蛋白酶消化5 min,再使用含10% FBS 的培养基终止消化,1 200 r/min 离心5 min去除上清,用细胞计数器计数细胞密度,加入Opti-MEM 稀释至3×105个/μL,取100 μL 细胞悬液加入Transwell 小室上室,下室加入600 μL 的LHC-8 培养基,放入37 ℃、CO2体积分数为5%的培养箱中培养48 h 后将小室放入无水甲醇中固定并透化30 min,ddH2O清洗3次后用Gimsa染液染色10 min,用棉签轻轻擦拭上室未穿过的细胞。在100 倍镜下每组随机选取3 个视野进行拍照,并用ImageJ 软件计数侵袭细胞数量。
1.7 划痕愈合实验检测细胞的迁移能力
将BERP35T-1细胞接种在细胞培养皿中,待细胞汇合度达90%~100%,用200 μL枪头垂直划痕。使用PBS 清洗脱落细胞,用CQ(0、40、60 μmol/L)作用0、12 h 和24 h 或用Rapa(0、25 pmol/L)作用0 和12 h,将细胞置于100 倍镜下于同一视野拍照记录划痕愈合状态,每组观察6 个视野,用ImageJ 软件计算不同浓度CQ 或Rapa 作用不同时间点的划痕宽度,并计算划痕闭合率。
划痕闭合率=(初始划痕宽度-当前划痕宽度)/初始划痕宽度×100%
1.8 统计学方法
2 结 果
2.1 BEP2D、RH24、BERP35T-1细胞的自噬水平
LC3B是LC3四种亚型中在肺组织中表达差异最为显著的蛋白[12],LC3B-I 在胞浆中产生,在ATG7 等作用下和磷脂酰乙醇胺结合成LC3B-II,LC3B-II在自噬体形成阶段被连接在自噬体外膜上,P62 作为自噬底物与LC3B-II 结合,在自噬溶酶体形成时P62 被降解[13],因此,可以利用LC3B-II 和LC3B-I 蛋白的比值及P62 蛋白的表达水平代表细胞的自噬水平[14-15]。Western blot法检测结果如图1所示,与BEP2D细胞相比,RH24 细胞及恶性转化的BERP35T-1 细胞内自噬标志物LC3B-II/I 的比值显著升高(P<0.01),其底物P62 的表达减弱(P<0.01)。且如图2 所示,用透射电镜观察也发现,与BEP2D 细胞相比,RH24 细胞及恶性转化的BERP35T-1细胞内单位面积自噬小体数量增加(P<0.01)。说明在α粒子辐射诱发BEP2D细胞恶性转化过程中,细胞自噬水平升高。

图1 Western blot法检测BEP2D、RH24、BERP35T-1细胞中自噬相关蛋白LC3B及P62的表达
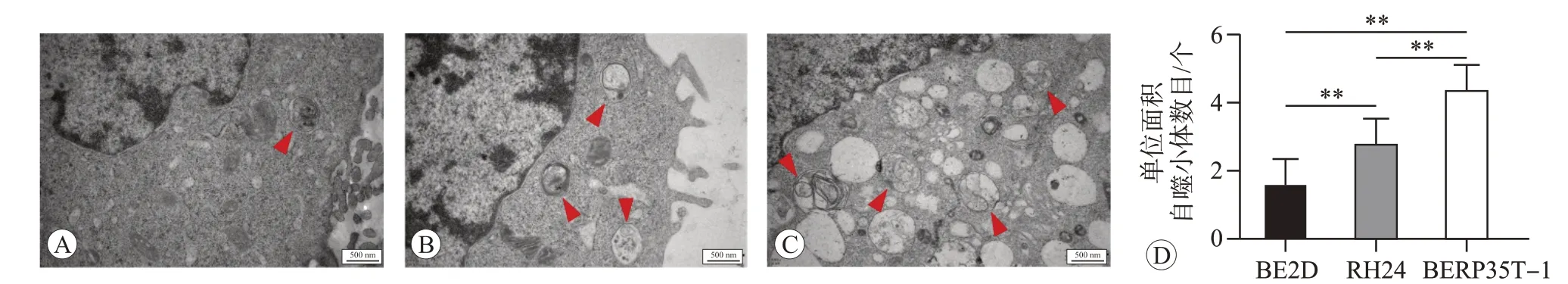
图2 透射电镜观察和分析BEP2D、RH24和BERP35T-1细胞中的自噬小体
2.2 自噬抑制剂CQ抑制BERP35T-1细胞自噬
CQ通过破坏溶酶体的酸性环境,阻止自噬小体和溶酶体融合,从而抑制自噬。在CQ的作用下,自噬体上的LC3B-II和自噬底物P62均不能被溶酶体降解,导致LC3B-II 和P62 蛋白的积累[16]。因此,CQ 抑制自噬的能力越强,LC3B-II 和P62 的蛋白水平越高,LC3B-II/I的比值也越高[17]。为确定CQ抑制自噬的合适浓度,将40 和60 μmol/L CQ 分别作用BERP35T-1 细胞48 h 后,经Western blot 检测LC3B、P62、GAPDH的表达水平。结果如图3所示,与对照组(0 μmol/L)相比,40和60 μmol/L CQ 作用48 h后BERP35T-1细胞内自噬标志物LC3B-II/I 水平明显升高(P<0.05),自噬相关蛋白P62的表达水平也相继升高(P<0.01),表明40和60 μmol/L CQ 均可显著抑制BERP35T-1 细胞自噬,所以后续实验采用40 和60 μmol/L CQ 作为抑制自噬的实验浓度。
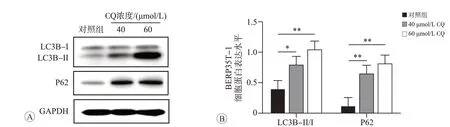
图3 不同浓度CQ作用48 h对BERP35T-1细胞自噬相关蛋白表达的影响
2.3 自噬抑制剂CQ 对BERP35T-1 细胞增殖能力的影响
将40和60 μmol/L CQ 作用BERP35T-1细胞48 h后,存活率检测结果如图4所示,与对照组(0 μmol/L)相比,40 和60 μmol/L CQ 处理48 h 组细胞存活率均显著降低,差异有统计学意义(P<0.01)。说明CQ 可通过抑制自噬降低BERP35T-1细胞的恶性增殖能力。

图4 不同浓度CQ作用48 h对BERP35T-1细胞增殖能力的影响
2.4 自噬抑制剂CQ 对BERP35T-1 细胞侵袭能力的影响
将40和60 μmol/L CQ 作用BERP35T-1细胞48 h后,用Transwell实验检测细胞的侵袭能力,结果如图5 所示,与对照组(0 μmol/L)相比,40 和60 μmol/L CQ 作用48 h 后BERP35T-1 细胞的侵袭细胞数量均明显减少(P<0.01)。说明CQ 可能通过抑制自噬降低BERP35T-1细胞的侵袭能力。
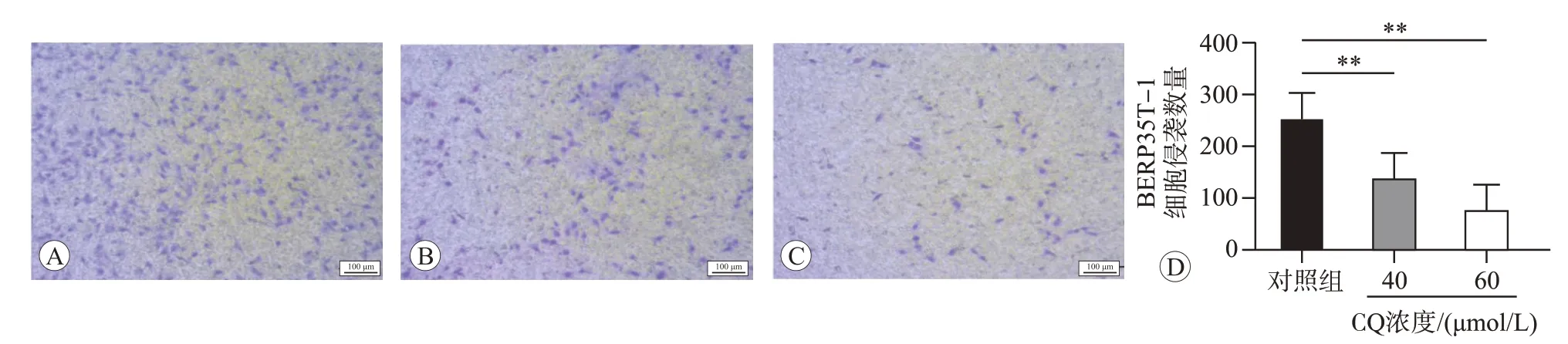
图5 不同浓度CQ作用48 h对BERP35T-1细胞侵袭能力的影响
2.5 自噬抑制剂CQ 对BERP35T-1 细胞迁移能力的影响
划痕实验检测细胞的划痕闭合率,结果如图6 所示,与对照组(0 μmol/L)相比,40和60 μmol/L CQ 作用12 和24 h 后,BERP35T-1 细胞的划痕闭合率均显著降低,且CQ 浓度越高,作用时间越长,降低越显著(P<0.05)。说明CQ可通过抑制自噬降低BERP35T-1细胞的迁移能力。
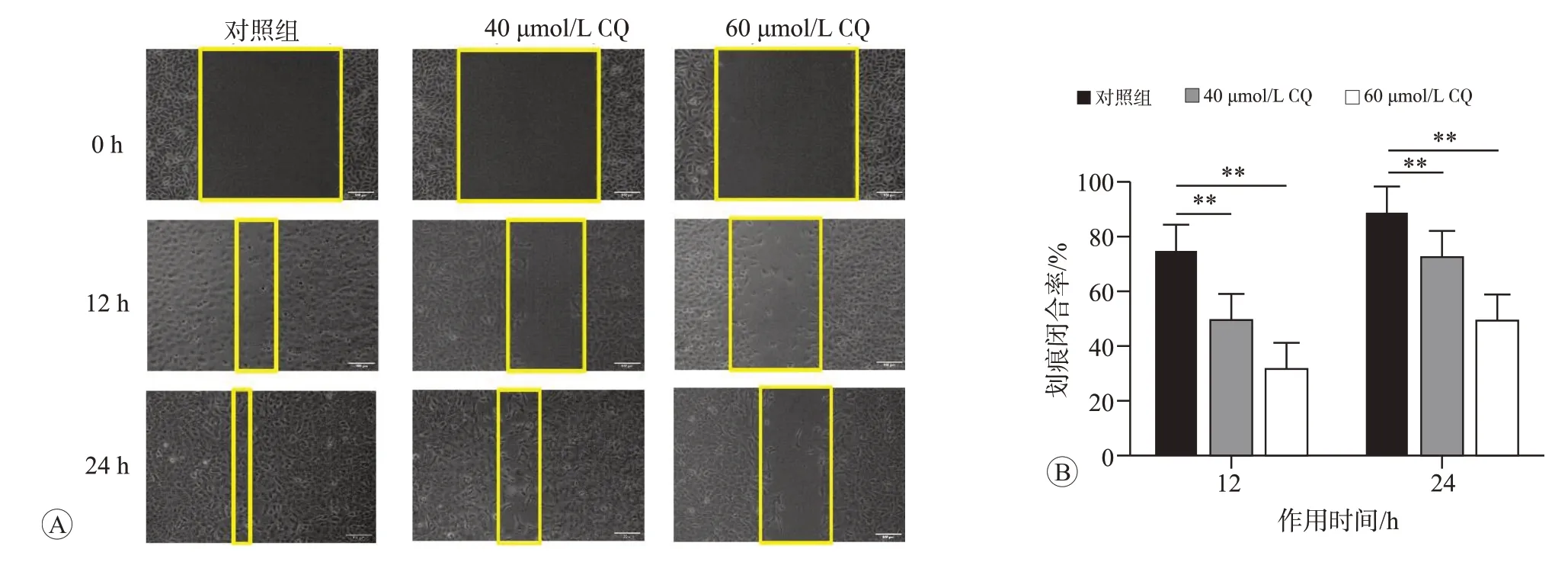
图6 不同浓度CQ作用12和24 h对BERP35T-1细胞迁移能力的影响
2.6 自噬激活剂Rapa促进BERP35T-1细胞自噬
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是自噬通路的上游蛋白,mTOR 可与不同的蛋白质相互作用形成两个不同的复合物,分别为mTORC1 和mTORC2,而Rapa 可以抑制mTORC1进而促进自噬[18]。为确定Rapa 激活自噬的合适浓度,将12.5和25 pmol/L的Rapa作用BERP35T-1细胞48 h后,经Western blot 检测LC3B、P62、GAPDH 的表达水平。结果如图7 所示,与对照组相比,12.5 pmol/L Rapa 对BERP35T-1细胞内LC3B-II/I 和P62蛋白表达水平的影响差异无统计学意义(P>0.05);25 pmol/L Rapa 处理组BERP35T-1 细胞内LC3B-II/I 水平明显升高(P<0.05),P62 水平降低(P<0.05),表明25 pmol/L Rapa 可以显著激活细胞自噬,因此后续实验采用25 pmol/L Rapa作为激活自噬的实验浓度。

图7 不同浓度Rapa作用48 h对BERP35T-1细胞自噬相关蛋白表达的影响
2.7 自噬激活剂Rapa 对BERP35T-1 细胞增殖能力的影响
将25 pmol/L Rapa 作用BERP35T-1 细胞48 h 后,用CCK-8 试剂盒检测细胞的存活率,结果如图8 所示,与对照组(0 mmol/L)相比,25 pmol/L Rapa处理组细胞存活率明显升高,差异有统计学意义(P<0.01)。说明Rapa 可通过促进自噬提高BERP35T-1 细胞的恶性增殖能力。
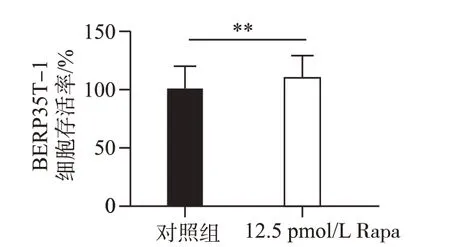
图8 25 pmol/L Rapa作用48 h对BERP35T-1细胞增殖能力的影响
2.8 自噬激活剂Rapa 对BERP35T-1 细胞侵袭能力的影响
将25 pmol/L Rapa 作用BERP35T-1 细胞48 h 后,用Transwell 实验检测细胞的侵袭能力,结果如图9所示,与对照组相比,25 pmol/L Rapa 作用后,BERP35T-1 细胞侵袭数量明显增加(P<0.01)。说明Rapa 可通过促进自噬从而提高BERP35T-1 细胞的侵袭能力。

图9 Rapa作用48 h对BERP35T-1细胞侵袭能力的影响
2.9 自噬激活剂Rapa 对BERP35T-1 细胞迁移能力的影响
划痕实验检测细胞的划痕闭合率,结果如图10所示,与对照组相比,25 pmol/L Rapa 作用12 h 后BERP35T-1 细胞划痕闭合率显著降低(P<0.01)。说明Rapa 可能通过促进自噬提高BERP35T-1 细胞的迁移能力。
3 讨 论
在多种类型的肿瘤细胞和肿瘤组织中,自噬水平升高。如在肝癌细胞和组织中自噬相关蛋白LC3B-II的表达显著增强[19];在肺腺癌细胞中,LC3B-II/I 的比值显著升高,且P62表达显著降低[20];王振波[21]通过免疫组织化学分析等方法研究表明,食管鳞癌中自噬相关蛋白LC3A的表达明显高于正常组织,且LC3A高表达与较差的患者总生存率相关,其低表达的患者放疗效果更显著;乔秋江[22]研究发现,LC3B-II/I 的比值和自噬小体数量与脑胶质瘤的病理分级呈正相关,与患者5年生存率呈负相关。本研究也发现,与BEP2D细胞相比,RH24 细胞及BERP35T-1 细胞内,LC3B-II/I蛋白比值升高,P62 表达降低,自噬体数量增加,说明在α粒子辐射诱发BEP2D 细胞恶性转化过程中,细胞自噬水平增高;此外,具有明确的恶性表型的BERP35T-1细胞自噬水平高于RH24细胞(具有一定的恶性表型),提示该过程中自噬水平与细胞恶性转化程度呈正相关。
已有研究表明,细胞自噬在多种肿瘤的发生、发展中具有重要作用。例如,Cai 等[23]发现,通过激活PTEN/AKT/FOXO3a/Atg7 轴可以诱导内源性自噬,进而导致非小细胞肺癌的发生。抑制自噬可使肿瘤细胞的恶性表型减弱。例如,胡剑翀[24]的研究表明,CQ以浓度和时间依赖的方式抑制肝细胞癌Hep3B细胞的增殖、侵袭和迁移,在抑制自噬的同时也阻碍了肿瘤细胞上皮-间质转化过程;Hamurcu 等[25]发现,沉默LC3和Beclin-1基因,从而抑制自噬,可显著抑制三阴性乳腺癌模型的细胞增殖、集落形成、迁移和侵袭,并诱导凋亡增加;在前列腺癌和黑色素瘤的小鼠模型中,敲除自噬相关基因ATG5或ATG7后肿瘤进展减缓[26]。本研究也发现,40 和60 mmol/L CQ 抑制细胞自噬后,BERP35T-1细胞的存活率、侵袭数和划痕闭合率均明显降低,说明抑制自噬可降低BERP35T-1细胞的增殖、侵袭和迁移能力。反之,促进自噬可增强肿瘤细胞的恶性表型。如Han 等[27]研究表明,乙酰辅酶A可通过增强自噬促进Snail蛋白的乙酰化,有助于KARS-LKB1 共突变的肺癌细胞的侵袭和迁移;RAS突变使自噬增加,增强了肿瘤的生长、存活以及恶性转化,与结肠癌、胰腺癌等恶性肿瘤的发展相关[28];糖原-相互作用蛋白1(GNIP1)作为支架蛋白,可通过不同结构域与Beclin 1和LC3B结合,促进自噬蛋白复合物的形成诱导自噬,从而增强肺腺癌细胞的增殖、侵袭和迁移能力[20]。本研究也发现,25 pmol/L Rapa促进细胞自噬后,BERP3T-1 细胞的存活率、侵袭数和划痕闭合率均显著增加,表明增强自噬可提高BERP35T-1细胞的增殖、侵袭和迁移能力。这些结果提示α粒子照射BEP2D 细胞后,细胞自噬水平的增高可能促进了细胞恶性转化。
综上所述,在α 粒子辐射诱发人支气管细胞BEP2D恶性转化过程中,细胞自噬增强,可能由此提高细胞增殖、侵袭和迁移的能力,从而促进细胞恶性转化。自噬抑制剂已被证明是许多体内抗肿瘤治疗的有用佐剂[29],目前,CQ在临床上主要用于慢性自身免疫性疾病以及人免疫缺陷病毒、严重急性呼吸综合征冠状病毒、非疟疾感染等疾病的治疗[30]。结合本研究结果推测,CQ作为自噬抑制剂在氡等α粒子放射源致肺癌的化学防治方面可能具有一定的应用前景。
