雷公藤甲素通过调控NLRP3通路抑制LPS诱导的BV2小胶质细胞炎性反应
2024-02-27穆秉桃李玉璐刘淇源孙肖乐胡芬琦曹佳蕾杨凤君李佩佩毕宇锦王泽涛张慧宇
穆秉桃,李玉璐,刘淇源,孙肖乐,胡芬琦,曹佳蕾,杨凤君,李佩佩,毕宇锦,王泽涛,张慧宇
(1.山西大同大学脑科学研究所/分子细胞免疫学大同市重点实验室,山西大同 037009;2.山西大同大学医学院,山西大同 037009;3.山西大同大学中医药健康服务学院,山西大同 037009)
诸多证据表明,神经炎症在神经退行性疾病的病理生理学机制中占据了中心地位。在神经退行性疾病脑组织中有许多炎症标记物,比如炎性细胞因子的增加,受损区域小胶质细胞激活等。其中研究小胶质细胞介导的炎症反应机制一直是焦点[1-2]。近年来研究发现,炎症小体活化在神经退行性疾病炎症反应中发挥关键作用。2019 年《Nature》上的新成果揭示:在阿尔茨海默病中,Aβ 沉积会激活NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎性小体[3];NLRP3 炎性小体可以驱动帕金森病的神经变性等[4]。提示抑制NLRP3 炎症小体活化可能成为治疗神经退行性疾病的有效靶点。
由于NLRP3炎症小体的激活主要存在于小胶质细胞,因此NLRP3 炎症小体就成为小胶质细胞介导的炎症反应的主要响应者。抑制其激活可能成为神经退行性疾病的一种有希望的治疗干预方法。
雷公藤甲素(Triptolide,TP)是二萜类化合物的一种,从雷公藤根部提取分离获得,以显著的抗炎、抗氧化和免疫抑制作用被广泛应用[5]。研究显示,TP对小胶质细胞炎症反应有显著的抑制作用[6],但是其机制尚不清楚。也有研究表明TP 可以抑制NLRP3 的活化[7],我们推测TP 抑制BV2 小胶质细胞炎性反应机制之一可能是通过调控NLRP3 通路。在本研究中,我们主要观察TP 对脂多糖(Lipopolysaccharide LPS)诱导BV2 细胞的影响,包括其激活状态、活性、炎性损伤和NLRP3 炎症小体表达,探究其对神经炎症的抑制机制。
1 材料和方法
1.1 材料
鼠源性BV2 小胶质细胞株,由军事医学研究院军事认知与脑科学研究所提供。TP(纯度≥98%)购自成都乐美天医药科技有限公司(货号:DL0034);山羊抗兔(ab150077)荧光二抗为美国Abcam 公司产品;谷氨酰胺、高糖DMEM 为美国Gibco 公司产品;兔抗NLRP3 抗体(批号af2155)、兔抗ASC 抗体(af6234)、兔抗caspase1(af1681)、一氧化氮检测试剂盒、RIPA 裂解液(P0013B)、LPS、牛血清蛋白及PMSF 均为上海碧云天公司产品;兔 抗IL-18 抗 体(57058S)、兔 抗GAPDH(5174S)、化学发光底物试剂(WBKLS0500)购自美国Milllipore 公司。
1.2 方法
1.2.1 细胞培养及实验处理
10 mL 培养平皿中加入5~6 mL 含有100 mL/L胎牛血清、100 U/mL 青霉素和100 mg/L 链霉素的高糖培养基,把BV2细胞悬液滴2~3滴到平皿中混匀。在5%CO2、37 ℃培养箱中进行常规培养,间隔1 d 换培养液,待细胞达80%丰度后用0.25 %的胰酶进行消化传代接种培养。达对数生长期细胞分成对照组、LPS模型组、LPS+TP 药物处理组三组。LPS模型组细胞采用1 mg/L LPS 作用24 h,LPS+TP 组细胞同时加入1 nmol/L TP[8]和1 mg/L LPS 作用24 h。镜下观察药物组细胞发生的形态变化并和对照组比较,拍照记录。
1.2.2 Griess 法测定上清液中的NO水平
在96 孔板中接种BV2 细胞,接种浓度50 个/μL,每孔100 μL 共设置5 个复孔,按照细胞分组药物对应处理24 h,吸取细胞上清液加入新的96 孔板中,每孔各50 μL 上清液和标准品,再各加50 μL 的Griess Reagent I和Ⅱ溶液,立即混匀后用酶标仪测定540 nm处吸光值,同时制作并绘制NaNO2标准曲线,用标准曲线公式计算NO 含量。
1.2.3 Western blot法检测
在6孔板中接种BV2细胞,接种浓度1 000个/μL,每孔2 000 μL,每组设置2 个复孔,依据细胞分组加入药物处理24 h,弃上清液留下贴壁细胞,PBS 轻柔清洗,加RIPA 裂解液冰上裂解细胞30 min,收集液体,行超微量分光光度计定量蛋白,并将各组蛋白含量调成一致。后续用10%SDS-PAGE 进行电泳分离蛋白,将蛋白转膜到PVDF膜,转膜条件为200 mA进行2 h,之后5%的脱脂牛奶封闭,4 ℃冰箱一抗[NLRP3、ASC、caspase1、IL-18 和GAPDH(1∶1000)]孵育过夜,次日室温下二抗[辣根过氧化物酶标记的山羊抗兔IgG(1∶3000)]孵育2 h,然后Bio-Rad 凝胶成像仪蛋白显影、观察并定量分析条带。
1.2.4 免疫荧光染色法
在24 孔板的底部放入灭菌玻璃小圆片,滴入100 μL 浓度为200 个/μL BV2 细胞液,30 min 后加入900 μL 细胞培养液,待细胞贴壁后依据分组加入药物作用24 h,弃上清后用4 %多聚甲醛固定细胞30 min,固定前后用PBS 轻柔清洗细胞。接着加入封闭液封闭细胞1 h(含1%的BSA 和0.3%的Triton X-100 的PBS 液),4 ℃冰箱一抗[NLRP3、ASC、caspase1、IL-18(1∶1000)]孵育过夜:,次日室温下避光二抗[Alex Fluor 594(红色)和488(绿色)标记的山羊抗兔IgG]孵育2 h,PBS 洗3 次,用DAPI 封固液封片,激光共聚焦显微镜下观察。
1.2.5 统计学方法
采用GraphPad Prism 5.0 软件对数据进行分析处理,实验重复三次,数据取平均值,计量资料用±s表示,组间比较采用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 TP对LPS 诱导BV2 细胞NO 释放量的影响
对NO 释放量的检测反映LPS 致炎作用,Griess法结果表明,对比对照组,模型组经LPS 作用后细胞释放出多量NO(P<0.01),LPS致炎明显;对比模型组,TP 组NO 的释放量明显较低(P<0.05),抗炎效果明显。

图1 TP对LPS致炎BV2 细胞NO 释放量的影响
2.2 TP对LPS诱导的BV2细胞形态的影响
图2结果显示,非激活状态的BV2小胶质细胞胞体较小而圆润、胞质清亮,细胞突起边缘清晰。LPS致炎性激活状态下的BV2 小胶质细胞胞体变大、触角延伸变粗变长,突起末端分支变多,呈现阿米巴样。TP 组细胞形态发生了逆转,阿米巴样小胶质细胞数量明显减少,细胞形态接近对照组。

图2 TP作用LPS 诱导的BV2 细胞形态变化
2.3 TP对LPS 诱导的BV2 细胞炎性小体表达的影响
图3~8显示了TP对LPS诱导的BV2细胞炎性小体表达的影响。与对照组比较,模型组LPS致小胶细胞炎症后,炎性小体成分NLRP3、ASC、caspase1表达增高,激活的炎性因子IL-18表达增高。与模型组比较,TP处理组NLRP3、ASC、caspase1和IL-18表达均降低,差异有统计学意义。

图3 NLRP3的免疫荧光染色检测及比较

图4 ASC的免疫荧光染色检测及比较
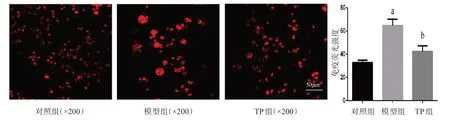
图5 caspase1的免疫荧光染色检测
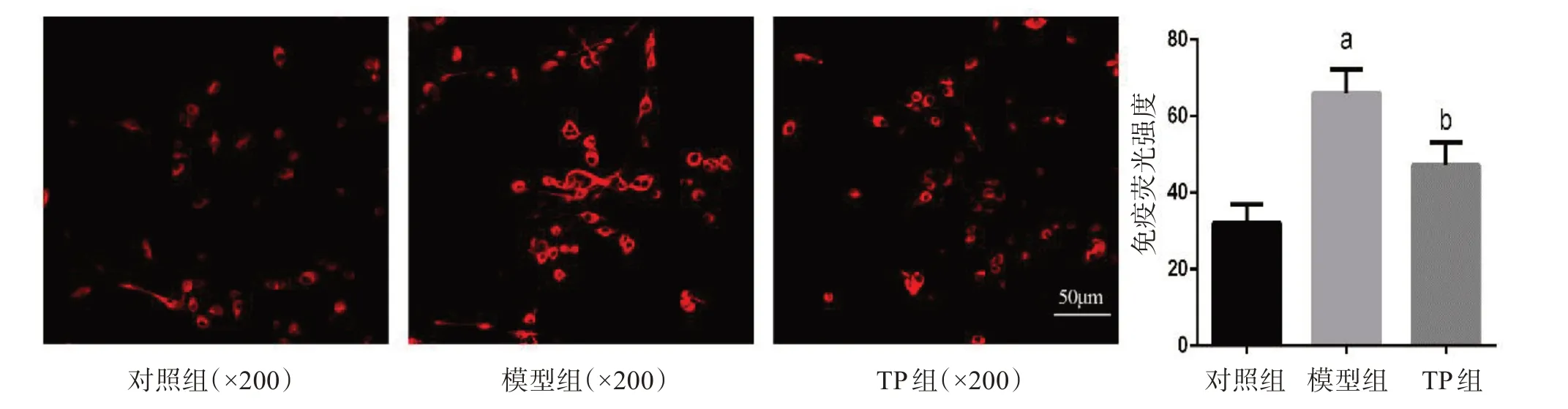
图6 IL-18的免疫荧光染色检测及比较
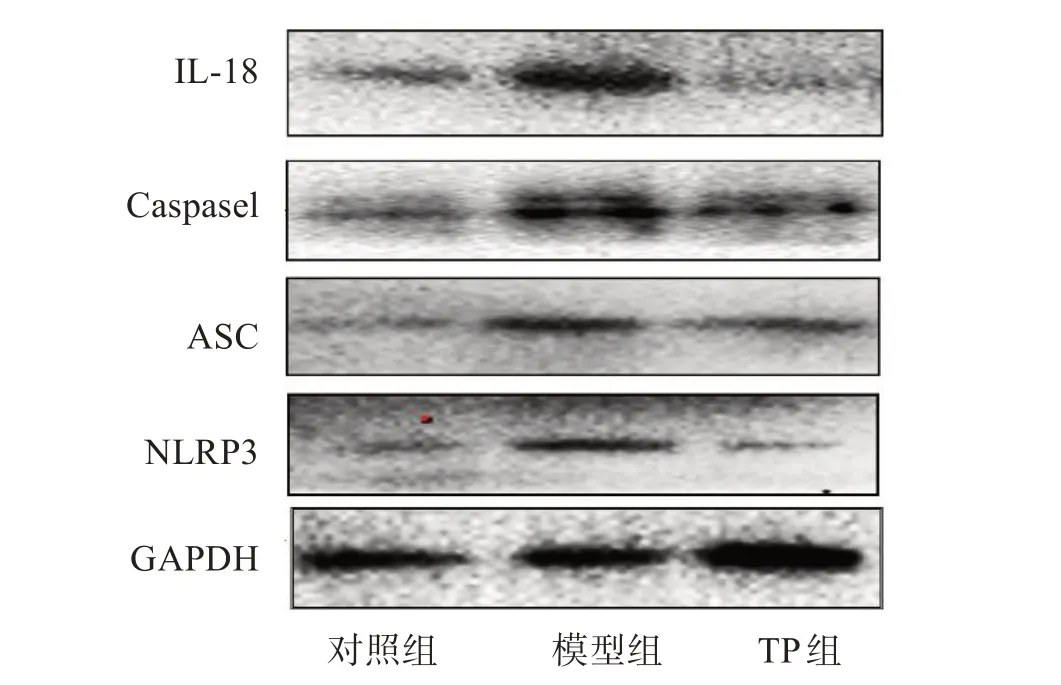
图7 NLRP3、ASC、caspase1和IL-18 蛋白免疫印迹条带图
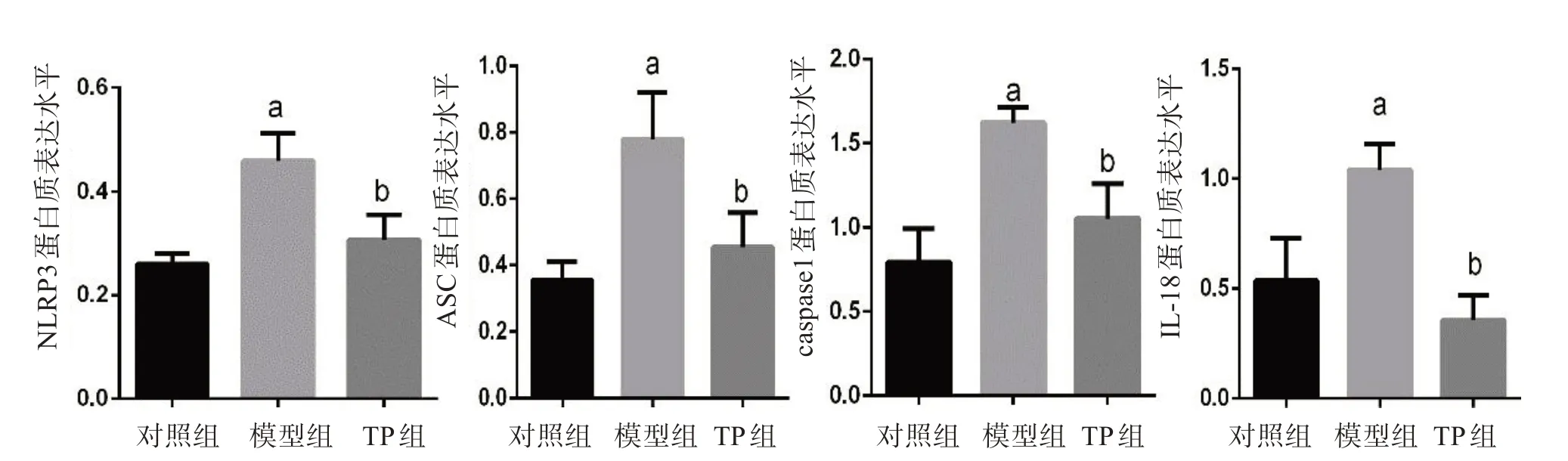
图8 NLRP3、ASC、caspase1和IL-18 蛋白表达水平比较
3 讨论
在近年的研究中,慢性炎症已成为神经退行性疾病的核心标志。而神经炎症主要是由常驻小胶质细胞群体驱动的[9]。由NLRP3、凋亡相关点状蛋白(Apoptosis-associated speck-like protein contain a CARD ASC)和半胱天冬酶-1 前体(pro-cysteinyl aspartate specific proteinase-1 Pro-caspase-1)组成的NLRP3炎性小体,促进前体Procaspase-1成熟为活性caspase-1,参与关键调节介质Gasdermin D(GSDMD)的切割,存在GSDMD 氨基末端的结构域又可以激活NLRP3 炎症小体引起系列炎症级联反应[10]。活性caspase-1还将白细胞介素(Interleukin-1β,IL-1β)和IL-18的前体裂解为活性物质,促进IL-18成熟并介导神经组织损伤的炎症反应。更多的研究已经明确了NLRP3炎症小体在神经退行性疾病中异常活化,NLRP3、caspase1上调,IL-18的表达增强。IL-18通过多种机制诱导神经细胞损伤,包括诱导NO产生,激活坏死和凋亡通路、调节突触可塑性和丝裂原激活蛋白激酶(mitogen activatedprotein kinase,MAPK)通路的影响元件,破坏细胞外基质和血脑屏障,加剧脑细胞水肿,最终导致细胞坏死[11]。本实验LPS诱导刺激BV2小胶质细胞炎症损伤,通过免疫荧光和wester blot法观察到,LPS使BV2细胞NLRP3炎症小体激活,NLRP3、ASC、caspase1表达增加(P<0.5),促IL-18炎症因子的成熟并诱导其大量表达(P<0.5),引发炎症级联反应。
最新报道显示,TP可以通过Nrf/HO-1通路抑制NLRP3炎症小体的免疫活化,预防细胞损伤[12]。本实验利用具有抗炎作用的TP作用于LPS诱导的炎性BV2细胞24 h后,免疫荧光和westerblot 显示炎性小体成分NLRP3、ASC、caspase1表达受到抑制,并且炎症因子IL-18的表达降低,和LPS组比较差异有统计学意义(P<0.5),说明中药雷公藤甲素的抗炎效果良好,对小胶质细胞炎性反应有抑制作用。
由上所知,LPS 诱导小胶质细胞激活,NLRP3炎性小体及致炎因子表达增高,致炎作用明显,TP干预后抑制了NLRP3 通路激活,有抑炎并保护神经细胞作用。靶向不同位点抑制小胶质细胞NLRP3炎症小体的激活可能成为干预神经退行性疾病的一种有希望的治疗策略。TP治疗有可能成为神经退行性疾病中抑制炎症反应的新思路。下一步实验中,我们将建立不同的细胞及动物模型进一步明确TP的神经保护作用及其它机制,为深入探讨神经退行性疾病的致病机制、寻找新靶点和筛选新的有效药物提供理论和实验依据。
